2.1 Introdução
Fibras alimentares são carboidratos (naturais e sintéticos) que resistem à digestão no intestino delgado humano e transmitem um benefício fisiológico à saúde [3,4]. A fibra adiciona volume à dieta, reduz a densidade de energia nos alimentos e pode melhorar o controle glicêmico e prevenir ou reduzir a constipação [3,5]. Em muitos países, um grande número de indivíduos não consome fibra alimentar suficiente para atingir os alvos recomendados [3,5]. Boas fontes de fibra alimentar incluem: grãos integrais, nozes e sementes, vegetais e frutas [3,5]. Uma maior ingestão de fibra alimentar tem sido associada a um menor risco de várias doenças crônicas, como doenças cardiovasculares e diabetes, e pode reduzir o risco de mortalidade por todas as causas [5–9]. Fibra alimentar pode ser incluída no painel de nutrição em rótulos de alimentos, e é normalmente listado como um subconjunto de carboidratos totais.

2.1.1 Tipos de fibra alimentar
Os alimentos contêm naturalmente uma mistura de fibras solúveis e insolúveis, e ambos os tipos têm importantes benefícios para a saúde no contexto de uma dieta rica em fibras [3,5]. Embora se tenha pensado que a solubilidade da fibra determinava seu efeito fisiológico, estudos recentes sugerem que outras propriedades, em especial a fermentabilidade e a viscosidade, são mais importantes, e os componentes das plantas (como os compostos antioxidantes) associados à fibra alimentar também podem contribuir para reduzir o risco da doença [5,13].
2.1.2 Efeitos benéficos das fibras alimentares
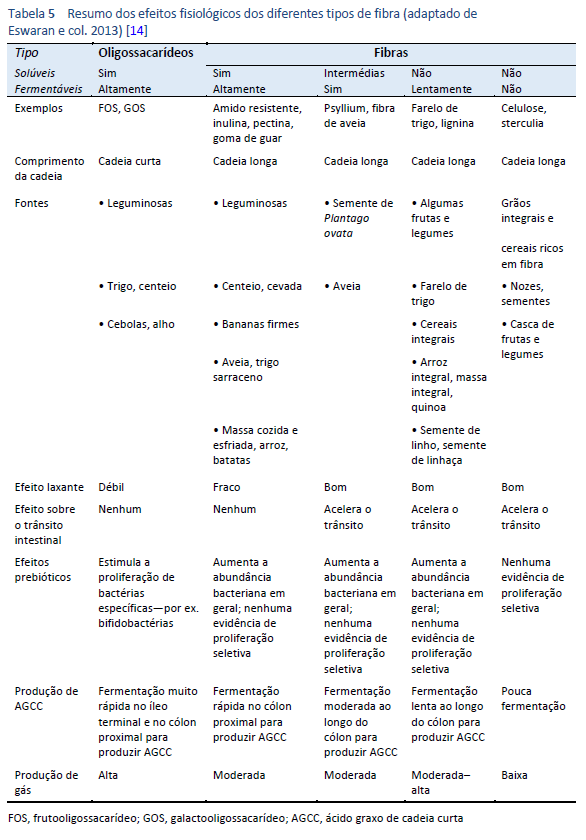
Para obter um resumo das características físicas e dos benefícios fisiológicos das fibras naturais, consulte a Tabela 5. São enumerados a seguir os efeitos fisiológicos benéficos de uma dieta rica em fibras com alimentos integrais em geral [12]:
- Redução do colesterol total e/ou das lipoproteínas de baixa densidade (LDL) no sangue
- Redução da glicose no sangue e/ou níveis de insulina pós-prandiais
- Aumento do volume das fezes e/ou diminuição do tempo de trânsito intestinal
- Aumento da produção de ácidos graxos de cadeia curta devido à fermentação da microbiota colônica
Além disso, os seguintes efeitos fisiológicos das fibras alimentares são considerados prováveis, mas requerem uma maior comprovação científica [12]:
- Redução da pressão arterial
- Maior saciedade
- Perda de peso/redução da obesidade
- Modulação positiva da microbiota colônica
2.1.3 Interação das fibras dietética e a microbiota intestinal
A fibra ingerida pode influenciar os perfis da microbiota fecal, causar alterações no complexo ambiente gastrointestinal e promover a proliferação de bactérias em geral e bactérias potencialmente benéficas em particular [14–16]. Os oligossacarídeos, incluindo frutooligossacarídeos e galactooligossacarídeos, inulina e possivelmente outras fibras solúveis, são, portanto, considerados prebióticos que podem estimular a proliferação preferencial de lactobacilos, bifidobactérias e outras bactérias saudáveis no cólon [3,14–16]. Acredita-se que a microbiota intestinal desempenha um papel crucial na saúde humana e na prevenção de doenças através de uma série de mecanismos, como a produção de ácidos graxos de cadeia curta (AGCC), que são importantes para manter a homeostase intestinal e a função imunológica ideal [3,14–16]. Alterações no microambiente intestinal têm sido associadas a muitas afecções comuns, como a síndrome do intestino irritável, obesidade, doenças cardiovasculares e asma [15,16]. A relação entre a microbiota intestinal, a fibra alimentar e sua incidência na saúde é uma área de crescente interesse, mas testes humanos bem controlados são necessários para confirmar os vínculos descritos e já observados em estudos animais e epidemiológicos. [15,16].
2.2 Papel da fibra alimentar nas afecções gastrointestinais
2.2.1 Constipação
- O aumento da fibra na dieta tem sido considerado um tratamento de primeira linha para a constipação [3,17,18].
- O aumento de líquidos na dieta tem sido considerado um tratamento de primeira linha para a constipação [3,17,18] mas a evidência disponível é contraditória.
- Melhoras na frequência e consistência do movimento intestinal podem ser observadas aumentando gradualmente a fibra alimentar (ou adicionando suplementos de fibra) a uma dose alvo de 20-30 g de fibra alimentar total e/ou suplementar por dia. A fibra deve ser introduzida gradualmente na dieta durante semanas, em vez de dias, para permitir que o organismo se ajuste [18,19].
- Acredita-se que a frequência das fezes melhore com a fibra solúvel, porque aumenta o volume e peso das fezes, e com a fibra insolúvel porque acelera o tempo de trânsito intestinal; para ambos, e especialmente para fibras insolúveis, faltam evidências de alta qualidade [14].
- A melhor evidência para a suplementação de fibra é para o psyllium no tratamento da constipação crônica [18].
- Em particular, falta evidência da eficácia da fibra para os subtipos individuais de constipação: metabólica, neurológica, relacionada à dieta, miogênica, relacionada à medicamentos e disfunção do assoalho pélvico [14].
- Pacientes com doenças obstrutivas do intestino devem evitar uma dieta rica em fibras.
- Demora no trânsito do cólon ou defecação dissinérgica pode estar presente quando os pacientes têm piora acentuada dos sintomas ligados à constipação com fibra [17,20,21].
Conclusão: uma dieta rica em fibras pode ter um efeito protetor e ser terapeuticamente útil no tratamento da constipação. É recomendado aumentar gradualmente a ingestão de fibra através da dieta e/ou suplementação para 20-30 g/dia com ingestão adequada de líquidos. Além disso, a suplementação de psyllium pode ser indicada no tratamento da constipação crônica. O papel da fibra em outras formas de constipação é limitado, e uma dieta rica em fibras pode exacerbar os sintomas em alguns indivíduos.
2.2.2 Síndrome do intestino irritável (SII)
- O efeito da fibra nos sintomas da SII é variável e específico para o tipo de fibra [14,22,23].
- Suplementos de fibras solúveis como linhaça, metilcelulose, goma de guar parcialmente hidrolisada e psyllium, demonstraram benefício terapêutico em vários ensaios clínicos, em particular em pacientes com SII com predomínio de constipação (SII-C) [3,14,22,23].
- Fibras altamente fermentáveis como oligossacarídeos, inulina e fibra de farelo de trigo (em virtude do seu conteúdo de oligossacarídeos) podem contribuir para o aumento da produção de gases, exacerbando assim os sintomas de inchaço, flatulência e desconforto gastrointestinal na SII [14,22,23].
- Reduzir a ingestão de fibras altamente fermentáveis, como parte de uma abordagem dietética com baixo teor do FODMAP (ver seção 3), é recomendada para o tratamento da SII; fornece alívio sintomático em quase 75% dos pacientes [14,22].
Conclusão: Fibras altamente fermentáveis, como oligossacarídeos e inulina, e também farelo de trigo podem exacerbar os sintomas da SII. A melhor evidência indica que reduzir a ingestão destas fibras fermentáveis como parte de uma abordagem dietética de baixo teor de FODMAP (ver seção 3) é eficaz para controlar os sintomas na maioria dos pacientes com SII. Por outro lado, os suplementos de fibras solúveis como psyllium, linhaça e metilcelulose podem ter um benefício terapêutico, particularmente na SII-C.
2.2.3 Doença intestinal inflamatória (DII)
- Falta evidência de um efeito terapêutico da fibra alimentar na DII. No entanto, devido aos potenciais efeitos antiinflamatórios e imunomoduladores da fibra, está justificado seguir pesquisando [24].
- A restrição da fibra alimentar na DII é desnecessária, exceto no caso de estenose intestinal significativa [24].
- Reduzir a ingestão de fibras altamente fermentáveis, como parte de uma abordagem dietética de baixo teor de FODMAP, pode ser útil no tratamento sintomático de pacientes com DII com SII concomitante (ver seção 3) [25,26].
Conclusão: Atualmente, não há suficiente evidência a favor do papel terapêutico da fibra alimentar na DII. Outros estudos de alta qualidade são, então, necessários. A ingestão de fibra alimentar não deve ser restrita em pacientes com DII, exceto no caso de obstrução intestinal. Pacientes com DII com SII concomitante podem melhorar reduzindo a ingestão de fibras altamente fermentáveis como parte de uma abordagem dietética de baixo teor de FODMAP.
2.2.4 Doença diverticular
- Maior ingestão de fibra alimentar pode estar associada a um risco reduzido de doença diverticular [27,28].
- Não está claro se uma dieta rica em fibras é benéfica em pacientes com diverticulose, pois sua patogênese é provavelmente multifatorial e complexa. Mais estudos são necessários para avaliar o papel da fibra na patogênese e no tratamento da doença diverticular [27,28].
- Alguns estudos de baixa qualidade sugeriram que a fibra pode melhorar os sintomas associados à diverticulose não complicada e diminuir o risco de diverticulite. No entanto, falta evidência de alta qualidade [27,28].
- Durante um episódio de diverticulite aguda, uma dieta pobre em fibras é frequentemente recomendada para reduzir ao mínimo a irritação intestinal [27,28]. No entanto, há evidência limitada que apoie essa estratégia.
Conclusão: O consumo de uma dieta rica em fibras pode proteger contra o desenvolvimento da doença diverticular e o risco de complicações (diverticulite) pode ser maior naqueles com dieta pobre em fibras. O uso a curto prazo de uma dieta pobre em fibras pode ser indicado no caso de diverticulite. No entanto, todas essas recomendações são apoiadas unicamente por evidência limitada e opiniões de especialistas.
2.2.5 Câncer colorretal
- A evidência de que a fibra diminui o risco de câncer colorretal é contraditória, e requer mais pesquisas [29].
- Uma análise de 2012 do “Estudo de Investigação Prospectiva Europeia sobre Câncer e Nutrição” (EPIC) mostrou uma relação inversa entre a fibra alimentar total e o risco de câncer colorretal, com resultados semelhantes para os cânceres de cólon e reto. De forma similar, fontes de fibras alimentares de cereais, frutas e vegetais foram associadas com um risco reduzido de câncer de cólon [30]. A fibra de cereais foi a única associada com um risco diminuído de câncer retal [30].
- Não há evidências de ensaios clínicos randomizados (ECRs) para sugerir que um maior consumo de fibra alimentar reduza a incidência ou a recorrência de pólipos adenomatosos em um período de 2 a 8 anos [31]. Ensaios de longo prazo e com níveis mais elevados de fibra alimentar são necessários para avaliar isso mais profundamente [31].
Conclusão: A evidência de estudos de coorte geralmente indica que uma dieta rica em fibras tem um efeito protetor contra o câncer colorretal; no entanto, não é certo se essa relação é de causa e efeito. Outros estudos de alta qualidade são necessários para elucidar a relação e identificar possíveis mecanismos de ação.
2.2.6 Indicações clínicas para uma dieta pobre em fibras
- A ingestão de alimentos pobres em fibras pode ajudar a diminuir a diarreia, os gases e o inchaço, diminuindo os movimentos intestinais e reduzindo a fermentação do cólon [32].
- O uso a curto prazo de uma dieta pobre em fibras (<10 g/dia) pode ser recomendado para fins de limpeza intestinal nos dias prévios aos procedimentos de diagnóstico, como colonoscopia, colonografia e cirurgia ginecológica laparoscópica. Em comparação com os regimes tradicionais de preparo intestinal (dieta líquida sem resíduos, com agentes catárticos), os estudos mostraram que uma dieta pobre em fibras pode ser melhor tolerada, ter menos efeitos colaterais e permitir uma redução na dosagem de agentes catárticos necessários sem comprometer a qualidade do preparo intestinal [32,33].
- Uma dieta pobre em fibras é frequentemente recomendada temporariamente após um surto de diverticulite, doença de Crohn ou colite ulcerativa, ou após cirurgia gastrointestinal. No entanto, são necessários mais estudos para esclarecer se isso tem algum benefício terapêutico [32]. Apesar disso, o uso a curto prazo apresenta pouco risco nutricional, especialmente se administrado sob a orientação de um dietista [32] e se a reintrodução da fibra ocorre no longo prazo.
- Os conselhos dietéticos para uma dieta pobre em fibras podem incluir: evitar nozes e sementes, usar pães e cereais mais refinados, reduzir a ingestão de frutas e vegetais sempre que possível e consumir frutas e verduras descascadas [32].
- Em alguns casos, a fibra não é o único fator da dieta a ser considerado quando uma dieta pobre em fibras é recomendada. Os conselhos dietéticos para pacientes com inchaço, dor e outros sintomas semelhantes aos da SII podem incluir: evitar alimentos condimentados, gordurosos, irritantes (como álcool e bebidas com cafeína) e alguns alimentos em particular que são pouco tolerados [19].
Conclusão: Há evidência limitada a favor do uso terapêutico de uma dieta pobre em fibras no contexto de doença gastrointestinal e cirurgia. No entanto, isso é comum na prática clínica, e o uso a curto prazo apresenta pouco risco nutricional. Uma dieta pobre em fibras pode ser útil quando se prepara o intestino para procedimentos diagnósticos e pode melhorar a satisfação e a adesão do paciente.
2.3 Ingestão de fibra e recomendações
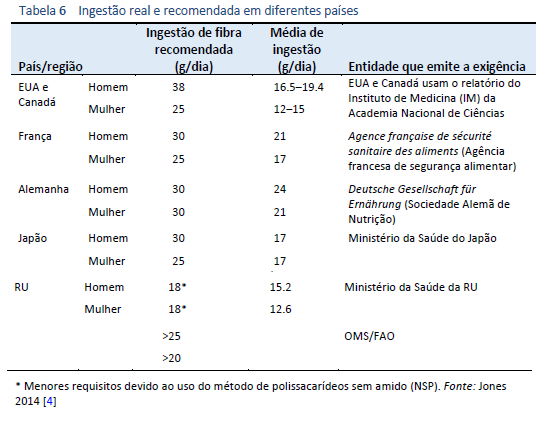
Os objetivos para a ingestão recomendada de fibra alimentar variam a nível mundial (Tabela 6). No entanto, as diretrizes geralmente recomendam uma ingestão >20 g/dia [4,5]. A ingestão real de fibra alimentar é inferior à recomendada em muitos países do mundo, mas é notavelmente maior em regiões nas quais predominam dietas com abundância de plantas, como a África subsaariana (Fig. 1) [3–5].
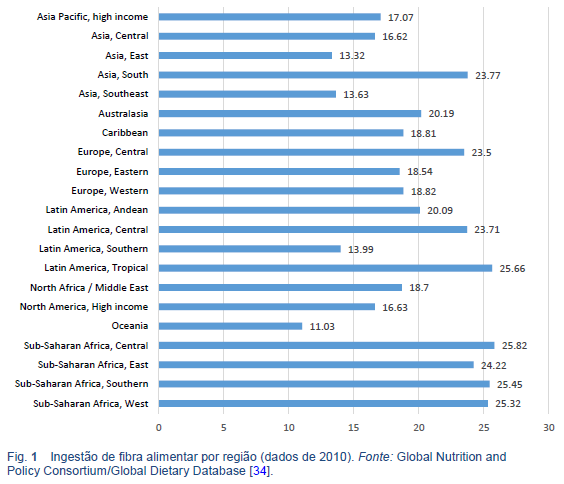
2.4 Tratamento para a “falta de fibra”
A ingestão adequada de fibra alimentar pode ser alcançada aumentando a variedade nos padrões alimentares diários [5]. Comer pelo menos 400 g ou cinco porções de frutas e vegetais por dia reduz o risco de doenças crônicas e ajuda a garantir uma ingestão diária adequada de fibras alimentares [11,35]. As mensagens de alimentação promovendo aumentar o consumo de alimentos ricos em fibras como grãos integrais, legumes, frutas e verduras devem ser amplamente apoiadas por profissionais da alimentação e nutrição [5,35].
Embora os consumidores também estejam recorrendo ao uso de suplementos de fibra e laxantes como fontes adicionais de fibras, o melhor conselho é consumir fibras nos alimentos. Poucos suplementos de fibras foram estudados quanto à eficácia fisiológica [5]. Aumentar a fibra na dieta muito rapidamente pode provocar sintomas como gases, inchaço e cólicas abdominais, por isso um aumento gradual na ingestão é sempre recomendado [5].
Boas fontes de fibra alimentar incluem: produtos integrais, frutas, legumes, feijões, ervilhas, nozes e sementes. Alimentos rotulados “ricos em fibras” geralmente contêm pelo menos 5 g de fibra por porção. Porém, os requisitos de rotulagem de alimentos variam entre os países [4,5].
Exemplos de alimentos comuns ricos em fibras [36]:
- ½ xícara de feijão vermelho cozido (6.5 g de fibra)
- ½ xícara de cereal de farelo de trigo (9.1 g de fibra)
- 1 xícara de abóbora, cozida (6.6 g de fibra)
- 1 laranja grande (7.2 g de fibra)
- 1 xícara de framboesas (8.0 g de fibra)
- 1 xícara de espaguete integral, cozido (5.9 g de fibra)
- 1 xícara de brócolis, fervidos (5.5 g de fibra)
Os consumidores têm interesse em aumentar o consumo de fibras, mas acham difícil e caro fazê-lo. A mudança na dieta requer alterações nos hábitos de longo prazo e é difícil de alcançar, apesar dos benefícios relatados. Manter a mudança na dieta requer motivação, habilidades comportamentais e um ambiente social e político favorável (Tabela 7) [5,37].
Muitos fatores e interações complexas influenciam a evolução e a forma dos padrões alimentares individuais ao longo do tempo: renda, preços dos alimentos (disponibilidade e acessibilidade dos alimentos saudáveis), preferências e crenças individuais, tradições culturais, bem como fatores geográficos, ambientais, sociais e econômicos [35].

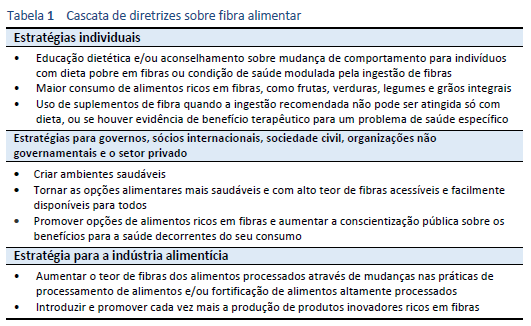
2.5 Diretrizes em cascata— fibra alimentar
Veja a seção 1.2 Cascatas, Tabela 1.
3.1 Introdução
3.1.1 O que é a dieta baixa em FODMAP?
A dieta baixa em FODMAP foi criada por pesquisadores da Universidade Monash em Melbourne, Austrália, para tratar pacientes com síndrome do intestino irritável (SII) [38–40]. Uma pesquisa mundial confirmou a eficácia da dieta no manejo dos sintomas da SII [41-45].
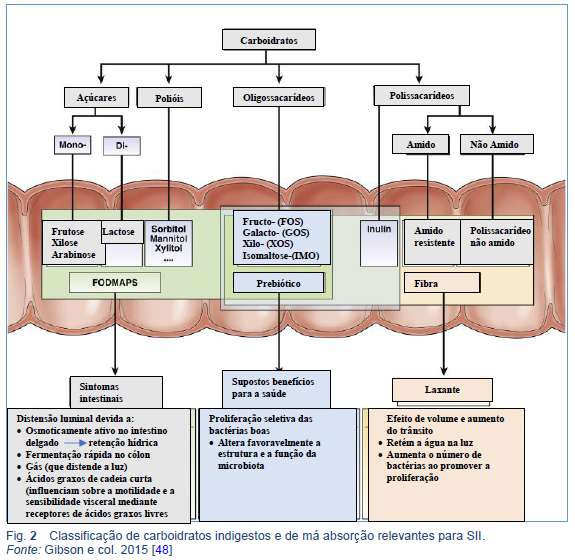
“FODMAP” é um acrônimo em inglês que significa: oligossacarídeos, dissacarídeos, monossacarídeos e polióis fermentáveis.
O acrônimo agrupa tipos específicos de carboidratos de cadeia curta que são lentamente absorvidos ou não digeridos no intestino delgado. Por causa de seu pequeno tamanho molecular, eles aumentam o conteúdo de água do intestino delgado através de um efeito osmótico e, por serem facilmente fermentados por bactérias, sua liberação no intestino grosso resulta na produção de gás [38,39,46]. Os FODMAPs podem assim distender (ou esticar) o intestino. Em pacientes com SII que são hipersensíveis a esse estiramento, os sintomas ocorrem, como dor/distensão abdominal, flatulência excessiva e alterações nos hábitos intestinais (constipação e/ou diarreia) [47]. A Figura 2 classifica carboidratos indigestos e de absorção lenta de acordo com suas propriedades funcionais [48].
A dieta baixa em FODMAP inclui a redução da ingestão alimentar dos cinco principais subgrupos de carboidratos:
- Frutose com excesso de glicose, por exemplo, mel, mango
- Lactose (quando a hipolactasia está presente) - por exemplo, leite, iogurte
- Polióis de açúcar (como sorbitol e manitol), por exemplo, abacate, cogumelos
- Frutanos, por exemplo, trigo, cebola, alho
- Galactooligossacarídeos (GOS), p. ex., Legumes, leite de soja
Os objetivos da dieta baixa em FODMAP são ajudar os pacientes a controlar seus sintomas e, posteriormente, identificar os desencadeadores alimentares específicos. Isso é feito através de uma redução inicial de todos os FODMAPs, seguida de novas provocações estratégicas. Os pacientes podem então seguir sua própria versão alterada da dieta. Não é sugerido seguir uma dieta estrita baixa em FODMAP por períodos prolongados.
O Departamento de Gastroenterologia da Universidade de Monash analisou o conteúdo de FODMAP de muitos alimentos e publicou os resultados em vários artigos de pesquisa [49–52]. A lista completa do conteúdo de FODMAP dos alimentos - classificado como baixo, moderado e alto - está disponível ao público por meio de um aplicativo para telefones inteligentes desenvolvido pela universidade [53].
3.1.2 Como implementar uma dieta baixa em FODMAP: reintrodução e problemas / limitações
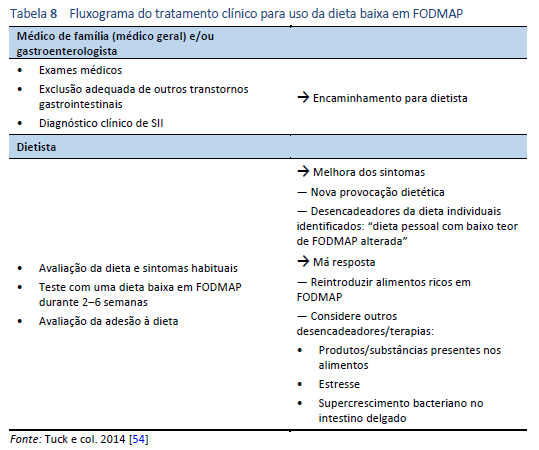
A dieta baixa em FODMAP é melhor implementada com a ajuda de um dietista experiente. A Tabela 8 apresenta uma visão geral do manejo clínico, incluindo o papel do médico de família (médico geral) ou gastroenterologista e do dietista. A dieta pode ser implementada em um processo de três etapas (Tabela 9).
Primeiro, os pacientes devem ser identificados como portadores de sintomas intestinais funcionais e devem ter outras condições, como doença celíaca, adequadamente excluídas antes alterar sua dieta. Isso é importante, já que as alterações dietéticas podem afetar a precisão de alguns testes como os da doença celíaca. Os pacientes devem então ser educados sobre formas de reduzir os alimentos ricos em FODMAP na dieta, geralmente por um período de 2-6 semanas [55]. O objetivo principal desta fase inicial é melhorar o controle dos sintomas. Os pacientes são instruídos por um dietista experiente sobre o conteúdo de FODMAP dos alimentos para garantir que eles entendam quais alimentos devem ser evitados e, principalmente, quais alimentos devem ser incluídos durante a fase inicial. Nenhum grupo alimentar inteiro deve ser excluído; pelo contrário, devem ser feitas alterações nos tipos de alimentos escolhidos em cada grupo de alimentos. Por exemplo, o consumo de maçãs, que têm um alto teor de FODMAP, pode ser alterado para a ingestão de laranjas, que têm um baixo teor de FODMAP. Isso é importante para manter a adequação nutricional [55]. Os pacientes devem entender os mecanismos dos FODMAPs e o efeito da dose para compreender o processo dietético.
A segunda fase é a fase de nova provocação; seu objetivo é identificar os alimentos desencadeadores específicos em cada indivíduo. É improvável que todos os alimentos ricos em FODMAP provoquem sintomas em todos os indivíduos, e os desafios estratégicos são, portanto, usados para identificar níveis de tolerância para cada subgrupo FODMAP [56]. A orientação de um dietista ajuda o paciente a testar cada subgrupo FODMAP, incluindo a resposta às diferentes doses, a frequência de consumo e o efeito aditivo de múltiplos alimentos ricos em FODMAP [56]. A tolerância individual aos FODMAPs varia muito. A tolerância de um indivíduo também pode variar dependendo de outros fatores, como os níveis de estresse.
A fase final é a fase de manutenção. O objetivo da fase de manutenção é que o paciente reintroduza o máximo de alimentos ricos em FODMAP na dieta conforme tolerado, mantendo um bom controle dos sintomas. Todos os alimentos que sejam bem tolerados devem ser reintroduzidos na dieta. Alimentos que são moderadamente tolerados podem ser reintroduzidos ocasionalmente, enquanto alimentos que são mal tolerados devem continuar sendo evitados [56]. A longo prazo, é recomendado aos pacientes seguir tentando de vez em quando fazer desafios com alimentos mal tolerados, a fim de reavaliar sua tolerância.

- Potenciais efeitos adversos da dieta baixa em FODMAP: qualquer alteração importante na ingestão nutricional acarreta riscos de efeitos indesejados, como redução da fibra alimentar ou risco aumentado de inadequação nutricional. O efeito da modificação dietética na qualidade de vida também deve ser considerado. Além disso, o que se come define em grande medida a microbiota gastrointestinal [59]. É possível, portanto, que a restrição de FODMAPs, incluindo frutanos prebióticos e galactooligossacarídeos, tenha efeitos marcantes na composição da microbiota [60].
Até o momento, existem poucos dados publicados sobre a adequação nutricional do consumo alimentar dos pacientes que seguem uma dieta baixa em FODMAP, a curto ou longo prazo, após a reintrodução de FODMAPs para determinar sua tolerância. No entanto, se presume que, com a orientação dietética apropriada, a dieta pode ser aplicada de forma nutricionalmente adequada. O efeito da dieta sobre a adequação nutricional quando autoimplementada não é conhecido [60]. Estudos realizados até hoje sugerem que a ingestão total de energia, carboidratos e cálcio pode ser reduzida no curto prazo, embora a ingestão de fibras não pareça estar alterada. Devido ao potencial da dieta em causar alterações na ingestão nutricional, o peso corporal e a ingestão alimentar devem ser monitorados durante todo o tratamento [60].
Uma dieta baixa em FODMAP pode melhorar ou piorar a qualidade de vida de um indivíduo; porém, a maioria dos dados sugere que a dieta baixa em FODMAP não produz uma deterioração na qualidade de vida e ela pode até melhorá-la [61]. Um estudo controlado por placebo publicado recentemente em pacientes com SII relatou que uma dieta baixa em FODMAP foi associada com alívio adequado dos sintomas e reduziu significativamente os escores de sintomas em comparação com um placebo [62].
Devido a esses potenciais efeitos prejudiciais da mudança na dieta, a adesão de longo prazo à dieta baixa em FODMAP é recomendada apenas para aqueles que apresentam sintomas graves e exigem restrição contínua para o controle dos sintomas. Um programa de reintrodução de alimentos ricos em FODMAP para identificar o limiar de tolerância do paciente é, portanto, encorajado.
3.2 Afecções gastrointestinais e dieta baixa em FODMAP
3.2.1 Indicações para uma dieta baixa em FODMAP
A maior parte da evidência existente sobre o uso da dieta baixa em FODMAP é para pacientes com SII. Como mencionado acima, é importante que os pacientes tenham recebido um diagnóstico clínico de SII, com exclusão de outras doenças, antes de implementar uma dieta baixa em FODMAP.
Há poucas evidências sobre o uso da dieta baixa em FODMAP em pacientes com doença inflamatória intestinal (DII) (doença de Crohn e colite ulcerativa) [26,63]. Em pacientes com DII, é comum ter sintomas do tipo SII. O uso da dieta baixa em FODMAP na DII é, portanto, dirigido a controlar os sintomas do tipo SII, ao invés da inflamação relacionada à doença em si. Isso também pode se aplicar a pacientes com doença celíaca.
O uso da dieta baixa em FODMAP está sendo investigado para outras afecções, como endometriose [64], cólica infantil [65], dispepsia funcional, fibromialgia [66], esclerodermia e síndrome da fadiga crônica. No entanto, a evidência para o uso da dieta nestas afecções é mínima e, portanto, não é recomendado por enquanto.
3.2.2 Dieta baixa em FODMAP, dispepsia funcional (DF) e SII
Existe considerável sobreposição de sintomas entre SII e dispepsia funcional (DF). A dispepsia funcional é caracterizada por sintomas de inchaço, arrotos, dor epigástrica e desconforto. Muitos pacientes experimentam DF e SII simultaneamente. Embora os dados sejam limitados pelo efeito da baixa dieta FODMAP especificamente para a DF, existem relatos que podem ser usados para controlar os sintomas [67]. São necessários mais dados para avaliar os efeitos da baixa dieta FODMAP em pacientes com DF.
3.3 Diretrizes em cascata—FODMAP
Veja a seção 1.2 Cascatas, Tabela 2.
4.1 Intolerância à lactose/ deficiência de lactase
4.1.1 Definição de termos
- Lactose: dissacarídeo comumente encontrado em produtos lácteos, com as maiores concentrações em leite e iogurte.
- Lactase: enzima da borda em escova necessária para quebrar a lactose (um dissacarídeo) nos monossacarídeos glicose e galactose.
- Deficiência de lactase: atividade da lactase na borda em escova que é marcadamente reduzida em relação à atividade observada em lactentes.
- Má absorção de lactose: ocorre quando uma quantidade substancial de lactose não é absorvida no intestino delgado.
- Intolerância à lactose: ocorre quando a má absorção de lactose induz sintomas gastrointestinais [68].
4.1.2 A intolerância à lactose em perspectiva: quando é relevante?
A expressão da lactase é regulada negativamente em aproximadamente 65-75% da população humana após o desmame. A má absorção de lactose é mais frequente nas populações da Ásia, América do Sul e África [69]. A persistência da lactase (produção continuada de lactase na vida adulta) é uma característica geneticamente determinada e ocorre mais frequentemente em populações da Europa e algumas da África, do Médio Oriente e do sul da Ásia [70].
A taxa de perda da atividade da lactase varia dependendo da etnia. Chineses e japoneses perdem 80-90% da atividade da lactase dentro dos 3-4 anos do desmame, em comparação com 7 anos após o desmame nos judeus e 18-20 anos após o desmame nos europeus do norte [71].
A intolerância secundária à lactose pode ser causada por danos no intestino delgado, como na doença celíaca não tratada ou na gastroenterite viral. A intolerância secundária à lactose é geralmente reversível uma vez que a condição primária tenha sido tratada [69].
A diferença da intolerância à lactose, a alergia ao leite de vaca é uma resposta inflamatória às proteínas do leite. Existem sintomas sobrepostos entre a intolerância à lactose e a alergia ao leite de vaca e, portanto, é possível um diagnóstico incorreto. A alergia à proteína do leite de vaca ocorre em 2-6% dos bebês e 0,1 a 0,5% dos adultos [72]. Além dos sintomas gastrointestinais, a alergia à proteína do leite de vaca pode causar sintomas cutâneos (eritema, prurido) e manifestações respiratórias (sibilos, falta de ar) e até anafilaxia [72]. Devido à semelhança de alguns sintomas, é importante que os profissionais de saúde estejam cientes das diferenças entre os dois. A alergia ao leite de vaca também pode ser induzida por produtos lácteos com um teor mínimo de lactose (como queijos duros).
4.1.3 Sintomas de intolerância à lactose
Os sintomas típicos de intolerância à lactose incluem dor abdominal, inchaço, flatulência, diarreia e borborigmo. Também pode provocar náuseas e vômitos, embora sejam menos frequentes [69].
Em pacientes com hipolactasia do tipo adulto comum, a quantidade de lactose ingerida necessária para produzir sintomas varia de 12 a 18 g ou 8 a 12 onças de leite. A ingestão de quantidades pequenas a moderadas de lactose geralmente produz inchaço, câimbras e flatulência, mas não diarreia. A ingestão de grandes quantidades de lactose, os tempos de esvaziamento gástrico e de trânsito intestinal mais rápidos contribuem para sintomas mais graves. Vários fatores determinam o aparecimento de sintomas de intolerância à lactose, como o conteúdo de lactose na dieta, tempo de trânsito intestinal, capacidade de fermentação do microbioma intestinal, hipersensibilidade visceral [73] e, talvez, fatores neuropsicológicos [74].

4.1.4 Como diagnosticar: em locais com recursos limitados e adequados
O diagnóstico de intolerância à lactose é baseado no autorrelato dos sintomas após a ingestão de lactose [54]. Determinar a dose de lactose que pessoas com intolerância à lactose podem tolerar é fundamental para determinar suas implicações para a saúde [68]. A presença de má absorção de lactose geralmente não está associada aos sintomas. É somente quando a má absorção de lactose induz sintomas que a “intolerância à lactose” pode ser diagnosticada.
- Teste respiratório de hidrogênio expirado com lactose. O teste do hidrogênio expirado com lactose é atualmente considerado a medida mais eficaz, não invasiva e confiável de má absorção de lactose [69]. O teste respiratório geralmente envolve o consumo de 25 g ou 50 g de lactose, seguido pela medição do hidrogênio e do metano no ar durante as próximas 3 a 4 horas. Embora as diretrizes diagnósticas variem, um aumento do hidrogênio expirado em 20 ppm (partes por milhão) acima do valor basal ou em metano em 10 ppm acima do valor basal sugere má absorção de lactose [69].
- Teste de “tolerância” à lactose [74]. Este é um exame de sangue para deficiência de lactase, e o termo tradicional “tolerância” não é apropriado. O paciente deve ingerir 50 g de lactose dissolvida em água. Amostras de sangue capilar são obtidas para analisar a concentração de glicose no plasma a -5, 0, 15, 30, 45 e 60 minutos. Quando há má absorção de lactose, a glicemia não aumenta após a ingestão de lactose; normalmente, a glicose plasmática deve aumentar no mínimo 1,4 mmol/l (25,2 mg/dl); se falhar, indica má absorção de lactose. A sensibilidade e especificidade do teste para a deficiência de lactase são altas (ambas> 90%).
- Teste genético [74]. O teste genético identifica polimorfismos de um único nucleotídeo associados à persistência/não persistência da lactase. Por exemplo, o genótipo CC se correlaciona com redução da hipolactasia, enquanto o genótipo TT se correlaciona com persistência da lactase. Nem todas as pessoas com o genótipo CC desenvolverão sintomas de má absorção de lactose. No entanto, as mutações relevantes dependem da etnia da população estudada.
- Biopsia intestinal. Uma biópsia jejunal pode ser usada para avaliar a atividade da lactase, mas é menos sensível e mais invasiva do que o teste respiratório com lactose. Este teste não é recomendado na prática clínica.
- Teste de provocação alimentar. A provocação com um alimento pode ser suficiente para identificar má absorção de lactose em muitos casos. O alimento utilizado deve ser relevante para as necessidades e preferências alimentares do indivíduo. Um exame padrão consiste em ingerir 1 xícara (250 ml) de leite desnatado* de una só vez, com monitoramento individual da resposta do sintoma. No entanto, isso deve ser adaptado ao indivíduo. Por exemplo, se uma pessoa em particular raramente consome essa quantidade de leite e prefere fazer o teste com 200 g de iogurte, deve usar então o iogurte de leite desnatado* [56].
* Uma vez que algumas pessoas são intolerantes à gordura láctea (triacilglicerol).
4.1.5 Como tratar
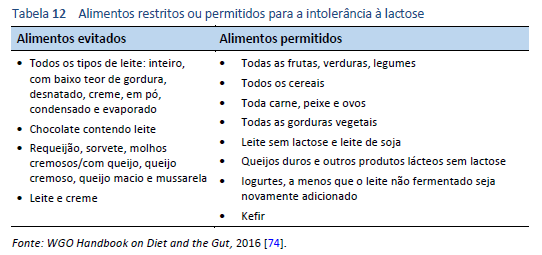
Existem duas maneiras principais de tratar a intolerância à lactose: evitando alimentos que contêm quantidades importantes de lactose (Tabela 12), ou usando β-galactosidase para hidrolisar o teor de lactose dos alimentos.
- Modificação dietética: redução de grandes quantidades de lactose. A maioria dos indivíduos com intolerância à lactose pode tolerar 12 a 15 g de lactose sem desencadear sintomas gastrointestinais [68]. Uma refeição média à base de lácteos contém aproximadamente 12 g de lactose [75], portanto, pequenas quantidades de lactose provavelmente sejam bem toleradas ainda naquelas pessoas com intolerância à lactose. A consideração da dosagem do consumo de lactose é fundamental para o manejo da intolerância à lactose. Produtos lácteos, como queijo duro, uma excelente fonte de cálcio, contêm <1 g de lactose e, portanto, devem ser incluídos na dieta daqueles com intolerância à lactose. A educação adequada é crucial para garantir a ingestão adequada de alimentos ricos em cálcio.
A redução da ingestão de grandes quantidades de lactose deve ser considerada. Isso pode ser feito reduzindo a ingestão de produtos ricos em lactose e/ou usando produtos sem lactose. Lácteos como o leite de vaca e o iogurte podem ser pré-incubados com β-galactosidase para hidrolisar o conteúdo de lactose. Há uma demanda crescente por produtos sem lactose em alguns países, resultando na disponibilidade de leite, iogurte, queijo, creme e sorvete sem lactose. No entanto, a necessidade de produtos como queijo e creme sem lactose é questionável, pois são produtos com um teor mínimo de lactose [54].
- Suplementação enzimática. Um tratamento alternativo para a intolerância à lactose é a suplementação com enzima lactase (β-galactosidase), que pode ser tomada por via oral junto com alimentos. Estudos mostraram que isso ajuda a reduzir o hidrogênio expirado e a obter uma melhora sintomática [76–78], embora doses mais altas de lactose, como 50 g, parecessem sobrecarregar a capacidade da enzima [77].
4.2 Intolerância à frutose
4.2.1 Definição de termos
- Frutose: monossacarídeo comumente encontrado em mel, manga, maçã, pera e xarope de milho rico em frutose.
- Excesso de frutose: frutose e glicose comumente coexistem nos alimentos; o excesso de frutose é definido como a presença de frutose que excede a glicose (também denominada “frutose livre”). A absorção do excesso de frutose depende de vias de absorção de baixa capacidade que parecem estar presentes ao longo do comprimento do intestino delgado. Nessa situação, é provável que as moléculas de frutose permaneçam no lúmen do intestino delgado por mais tempo e exerçam seus efeitos osmóticos em grande parte do seu comprimento, com ou sem “derramamento” no cólon (ou seja, má absorção de frutose) [46,54]. A frutose que atinge o intestino grosso está então disponível para fermentação colônica, criando subprodutos de hidrogênio e metano que podem ser medidos no ar expirado.
- Má absorção de frutose: absorção incompleta de uma determinada dose de frutose no intestino delgado, resultando em “derramamento” para o intestino grosso. A má absorção de frutose tem se demonstrado um fenômeno normal, ocorrendo em aproximadamente 35% dos indivíduos saudáveis [79].
- Intolerância à frutose: ocorre quando o consumo de frutose induz sintomas gastrointestinais.
4.2.2 Mecanismos propostos
- A frutose demonstrou ter um efeito osmótico que aumenta o conteúdo de água luminal no intestino delgado e provoca distensão (alongamento) da parede intestinal. Se isso estiver marcado, ou se houver hipersensibilidade visceral, pode provocar dor abdominal, inchaço e, às vezes, diarreia. Este efeito foi constatado ter ocorrido independentemente do grau de absorção de frutose no intestino delgado [46]. Não é, então, a presença de má absorção mas sim da hipersensibilidade visceral, como a observada em distúrbios gastrointestinais funcionais, o que provavelmente cause os sintomas após o consumo de frutose [47].
- O teste de hidrogênio expirado costumava ser uma ferramenta popular para decidir a terapia dietética; era pensado que os pacientes que tinham um teste de respiração negativo com frutose não requeriam restrição de frutose. No entanto, os sintomas podem aparecer independentemente da presença de má absorção com base na produção de hidrogênio ou metano na respiração, devido aos efeitos da frutose no intestino delgado. O teste de hidrogênio expirado não é mais recomendado para avaliar a absorção de frutose [80].
4.2.3 Ingestão de frutose
As estimativas do consumo de frutose sugerem que a ingestão total de frutose aumentou nos últimos anos, em grande parte devido ao aumento do uso de xaropes de milho ricos em frutose. Um estudo nos Estados Unidos que comparou a ingestão nos períodos 1977-1978 e 1999-2004 encontrou apenas um aumento de 1% no consumo de frutose como porcentagem da ingestão de energia, em comparação com um aumento de 41% na ingestão total de carboidratos [74,81], o que sugere que o aumento no consumo de frutose não é tão importante como pensado. Frutas e produtos elaborados com frutas foram a principal fonte de frutose na dieta em 1999-2004 [81].
4.2.4 Uso da modificação dietética
Os primeiros estudos que investigaram o efeito do excesso de frutose nos sintomas gastrointestinais se concentraram apenas na frutose ou na frutose em combinação com sorbitol. Porém, essas dietas com restrição de frutose foram mal descritas. Como o excesso de frutose é frequentemente consumido junto com outros carboidratos de cadeia curta que têm efeitos similares no intestino (isto é, FODMAPs), é o papel combinado desses carboidratos específicos na patogênese dos sintomas gastrointestinais, ao contrário de seus efeitos individualmente [49–51], o que provoca sintomas. O agrupamento desses carboidratos fermentáveis como parte da dieta de baixo FODMAP tem sido associado à melhora dos sintomas em até três quartos dos pacientes com distúrbios gastrointestinais funcionais. [40,41,44,82].
4.2.5 Recomendações
- A ingestão de frutose (com excesso de glicose) é alterada como um componente da dieta baixa em FODMAP. A redução de todos os FODMAPs da dieta, em vez de apenas frutose, tem um efeito mais benéfico na redução dos sintomas gastrointestinais.
- “Má absorção de frutose” não é um diagnóstico nem uma condição. Em vez disso, a frutose dietética pode desencadear sintomas gastrointestinais parecidos aos da SII, e seus efeitos devem ser considerados junto com os dos outros FODMAPs da dieta (ver seção 3).
- O valor clínico dos testes respiratórios para identificar a má absorção de frutose é limitado.
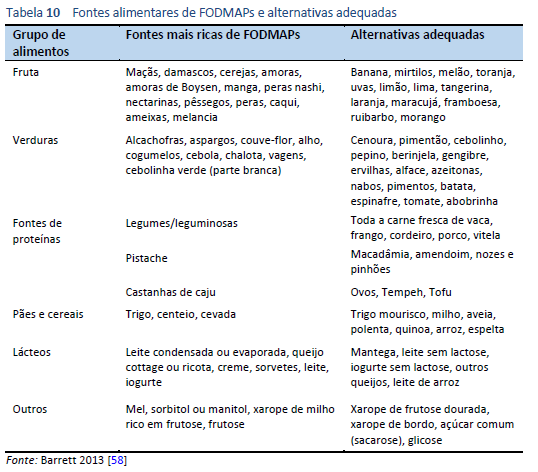
- Para os alimentos que devem ser evitados, consulte a tabela de composição do FODMAP (Tabela 10).
4.3 Deficiência de sacarase–isomaltase
A deficiência de sacarase-isomaltase (também conhecida como intolerância à sacarose) costuma se manifestar precocemente e pode resultar em má absorção de carboidratos, causando sintomas de diarreia, inchaço e dor abdominal, semelhantes aos sintomas da SII com predomínio de diarreia. A causa da deficiência de sacarase-isomaltase é a reduzida atividade de uma enzima conhecida como glicosidase no intestino delgado. A enzima está normalmente envolvida na digestão do amido e dos açúcares. Com a atividade reduzida da glicosidase, os carboidratos, particularmente a sacarose, se comportam então como FODMAPs, com aumento da atividade osmótica e da fermentação no intestino, o que pode provocar sintomas de SII [83]. A função da deficiência de sacarase-isomaltase na SII tardia não está bem estabelecida.
4.3.1 Deficiência congênita de sacarase–isomaltase
Na deficiência congênita de sacarase-isomaltase, as mutações no gene da sacarase-isomaltase (SI) levam a sintomas graves. Esta é uma condição rara. No entanto, estudos recentes identificaram múltiplas variações do gene SI com função reduzida. Cerca de 2-9% das pessoas de ascendência norte-americana e europeia podem ser afetadas, o que sugere que seja possivelmente uma condição subdiagnosticada [84]. No entanto, ainda não foi demonstrado se está patogenicamente envolvida com a indução de sintomas em pacientes com distúrbios gastrointestinais funcionais.
4.3.2 Deficiência secundária ou adquirida de sacarase–isomaltase
A deficiência de sacarase-isomaltase secundária ou adquirida também pode, teoricamente, ocorrer, mas geralmente é transitória. Estudos em animais mostraram que a atrofia das vilosidades, como a que ocorre na doença celíaca não tratada, pode resultar em deficiência de sacarase-isomaltase. Isso deve ser reversível com a cicatrização da atrofia vilosa [84].
4.3.3 Diagnóstico
Um diagnóstico de deficiência de sacarase-isomaltase pode ser estabelecido usando biópsias duodenais ou jejunais em crianças, para avaliar a atividade da sacarase, lactase, isomaltase e maltase [84]. No entanto, as amostras de biópsia devem ser imediatamente congeladas e, devido ao complexo processo de congelamento/descongelamento necessário para a análise da amostra, os resultados podem ser imprecisos [85]. Outros métodos de diagnóstico estão disponíveis, como o teste respiratório com sacarose, mas a realização de testes respiratórios com hidrogênio em crianças pequenas é problemática [85]. Mais recentemente, o sequenciamento genético se tornou disponível para identificar formas de deficiência congênita de sacarase-isomaltase [84], embora esses resultados devam ser considerados em combinação com o quadro clínico. Existem poucos dados sobre o valor de realizar tais testes em adultos.
4.3.4 Tratamento
Existe evidência limitada para o tratamento da deficiência de sacarase-isomaltase. As opções de tratamento incluem restrição dietética de açúcares e amido, embora isso tenha sido pouco estudado. Os pacientes começam com uma fase restritiva inicial, seguida de reintrodução gradual de açúcares para determinar a tolerância. No entanto, essas restrições dietéticas são difíceis e os pacientes muitas vezes não respeitam as indicações [85]. Uma alternativa à modificação dietética é a reposição enzimática com sacarosidase, que tem mostrado bom efeito em estudos com amostras pequenas [85,86]. No entanto, a suplementação enzimática é cara e pode não estar disponível em todo o mundo.
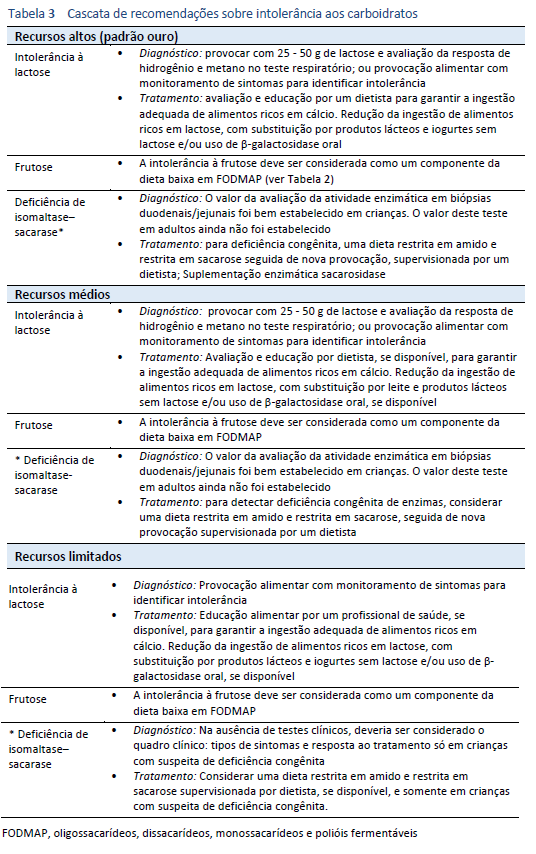
4.4 Diretrizes em cascata
Veja a seção 1.2 Cascatas, Tabela 3.
6.1 Apêndice

6.2 Organizações que publicam diretrizes pertinentes
https://journals.lww.com/jcge/Fulltext/2014/08000/Coping_With_Common_Gastrointestinal_Symptoms_in.4.aspx
http://www.worldgastroenterology.org/guidelines/global-guidelines/common-gi-symptoms
6.3 Referências
1. Bai JC, Ciacci C, Corazza GR, Fried M, Olano C, Rostami-Nejad M, et al. Celiac disease. World Gastroenterology Organisation global guidelines [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2016 [cited 2017 Jul 19]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/celiac-disease/celiac-disease-english
2. Bai JC, Ciacci C. World Gastroenterology Organisation global guidelines: celiac disease. February 2017. J Clin Gastroenterol. 2017;51(9):755–68.
3. Anderson JW, Baird P, Davis RH, Ferreri S, Knudtson M, Koraym A, et al. Health benefits of dietary fiber. Nutr Rev. 2009;67(4):188–205.
4. Jones JM. CODEX-aligned dietary fiber definitions help to bridge the “fiber gap.” Nutr J. 2014;13:34.
5. Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc. 2008;108(10):1716–31.
6. Kim Y, Je Y. Dietary fiber intake and total mortality: a meta-analysis of prospective cohort studies. Am J Epidemiol. 2014;180(6):565–73.
7. Threapleton DE, Greenwood DC, Evans CEL, Cleghorn CL, Nykjaer C, Woodhead C, et al. Dietary fibre intake and risk of cardiovascular disease: systematic review and meta-analysis. BMJ. 2013;347:f6879.
8. Yang Y, Zhao L-G, Wu Q-J, Ma X, Xiang Y-B. Association between dietary fiber and lower risk of all-cause mortality: a meta-analysis of cohort studies. Am J Epidemiol. 2015;181(2):83–91.
9. Yao B, Fang H, Xu W, Yan Y, Xu H, Liu Y, et al. Dietary fiber intake and risk of type 2 diabetes: a dose-response analysis of prospective studies. Eur J Epidemiol. 2014;29(2):79–88.
10. American Association of Cereal Chemists. The definition of dietary fiber. Report of the Dietary Fiber Definition Committee to the Board of Directors of the American Association Of Cereal Chemists. Submitted January 10, 2001. Cereal Foods World. 2001;46(3):112–26.
11. Livingston KA, Chung M, Sawicki CM, Lyle BJ, Wang DD, Roberts SB, et al. Development of a publicly available, comprehensive database of fiber and health outcomes: rationale and methods. PloS One. 2016;11(6):e0156961.
12. Howlett JF, Betteridge VA, Champ M, Craig SAS, Meheust A, Jones JM. The definition of dietary fiber – discussions at the Ninth Vahouny Fiber Symposium: building scientific agreement. Food Nutr Res [Internet]. 2010 [cited 2017 Jan 15];54. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2972185/
13. McRorie JW, McKeown NM. Understanding the physics of functional fibers in the gastrointestinal tract: an evidence-based approach to resolving enduring misconceptions about insoluble and soluble fiber. J Acad Nutr Diet. 2017;117(2):251–64.
14. Eswaran S, Muir J, Chey WD. Fiber and functional gastrointestinal disorders. Am J Gastroenterol. 2013;108(5):718–27.
15. Maslowski KM, Mackay CR. Diet, gut microbiota and immune responses. Nat Immunol. 2011;12(1):5–9.
16. Slavin J. Fiber and prebiotics: mechanisms and health benefits. Nutrients. 2013;5(4):1417–35.
17. Christodoulides S, Dimidi E, Fragkos KC, Farmer AD, Whelan K, Scott SM. Systematic review with meta-analysis: effect of fibre supplementation on chronic idiopathic constipation in adults. Aliment Pharmacol Ther. 2016;44(2):103–16.
18. Lindberg G, Hamid SS, Malfertheiner P, Thomsen OO, Fernandez LB, Garisch J, et al. World Gastroenterology Organisation global guideline: Constipation--a global perspective. J Clin Gastroenterol. 2011;45(6):483–7.
19. Hunt R, Quigley E, Abbas Z, Eliakim A, Emmanuel A, Goh K-L, et al. Coping with common gastrointestinal symptoms in the community: a global perspective on heartburn, constipation, bloating, and abdominal pain/discomfort May 2013. J Clin Gastroenterol. 2014;48(7):567–78.
20. Rao SSC, Patcharatrakul T. Diagnosis and treatment of dyssynergic defecation. J Neurogastroenterol Motil. 2016;22(3):423–35.
21. Suares NC, Ford AC. Systematic review: the effects of fibre in the management of chronic idiopathic constipation. Aliment Pharmacol Ther. 2011;33(8):895–901.
22. McKenzie YA, Bowyer RK, Leach H, Gulia P, Horobin J, O’Sullivan NA, et al. British Dietetic Association systematic review and evidence-based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):549–75.
23. Nagarajan N, Morden A, Bischof D, King EA, Kosztowski M, Wick EC, et al. The role of fiber supplementation in the treatment of irritable bowel syndrome: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2015 Sep;27(9):1002–10.
24. Wedlake L, Slack N, Andreyev HJN, Whelan K. Fiber in the treatment and maintenance of inflammatory bowel disease: a systematic review of randomized controlled trials. Inflamm Bowel Dis. 2014;20(3):576–86.
25. Gibson PR. Use of the low-FODMAP diet in inflammatory bowel disease. J Gastroenterol Hepatol. 2017;32 Suppl 1:40–2.
26. Gearry RB, Irving PM, Barrett JS, Nathan DM, Shepherd SJ, Gibson PR. Reduction of dietary poorly absorbed short-chain carbohydrates (FODMAPs) improves abdominal symptoms in patients with inflammatory bowel disease-a pilot study. J Crohns Colitis. 2009;3(1):8–14.
27. Böhm SK. Risk factors for diverticulosis, diverticulitis, diverticular perforation, and bleeding: a plea for more subtle history taking. Viszeralmedizin. 2015;31(2):84–94.
28. Carabotti M, Annibale B, Severi C, Lahner E. Role of fiber in symptomatic uncomplicated diverticular disease: a systematic review. Nutrients. 2017;9(2):161.
29. Asano T, McLeod RS. Dietary fibre for the prevention of colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2002;(2):CD003430.
30. Murphy N, Norat T, Ferrari P, Jenab M, Bueno-de-Mesquita B, Skeie G, et al. Dietary fibre intake and risks of cancers of the colon and rectum in the European prospective investigation into cancer and nutrition (EPIC). PloS One. 2012;7(6):e39361.
31. Yao Y, Suo T, Andersson R, Cao Y, Wang C, Lu J, et al. Dietary fibre for the prevention of recurrent colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2017 Jan 8;1:CD003430.
32. Vanhauwaert E, Matthys C, Verdonck L, Preter VD. Low-residue and low-fiber diets in gastrointestinal disease management. Adv Nutr. 2015;6(6):820–7.
33. Butt J, Bunn C, Paul E, Gibson P, Brown G. The White Diet is preferred, better tolerated, and non-inferior to a clear-fluid diet for bowel preparation: A randomized controlled trial. J Gastroenterol Hepatol. 2016 Feb;31(2):355–63.
34. Global Nutrition and Policy Consortium. Dietary intake of major foods by region, 1990 [Internet]. 2017 [cited 2017 Apr 22]. Available from: http://www.globaldietarydatabase.org/dietary-data-by-region.html
35. World Health Organization. Healthy diet [Internet]. WHO. 2017 [cited 2017 Jan 18]. Available from: http://www.who.int/mediacentre/factsheets/fs394/en/
36. United States Department of Agriculture. Agricultural Research Service. USDA food composition databases [Internet]. 2017 [cited 2017 Apr 21]. Available from: https://ndb.nal.usda.gov/ndb/nutrients/index
37. European Food Information Council (EUFIC). Why we eat what we eat: the barriers to dietary and lifestyle change [Internet]. 2004 [cited 2018 May 19]. Available from: http://www.eufic.org/en/healthy-living/article/why-we-eat-what-we-eat-the-barriers-to-dietary-and-lifestyle-change
38. Ong DK, Mitchell SB, Barrett JS, Shepherd SJ, Irving PM, Biesiekierski JR, et al. Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome. J Gastroenterol Hepatol. 2010;25(8):1366–73.
39. Barrett JS, Gearry RB, Muir JG, Irving PM, Rose R, Rosella O, et al. Dietary poorly absorbed, short-chain carbohydrates increase delivery of water and fermentable substrates to the proximal colon. Aliment Pharmacol Ther. 2010;31(8):874–82.
40. Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology. 2014;146(1):67-75.e5.
41. Eswaran SL, Chey WD, Han-Markey T, Ball S, Jackson K. A randomized controlled trial comparing the low FODMAP diet vs. modified NICE guidelines in US adults with IBS-D. Am J Gastroenterol. 2016;111(12):1824–32.
42. Staudacher HM, Lomer MCE, Anderson JL, Barrett JS, Muir JG, Irving PM, et al. Fermentable carbohydrate restriction reduces luminal bifidobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. J Nutr. 2012;142(8):1510–8.
43. McIntosh K, Reed DE, Schneider T, Dang F, Keshteli AH, De Palma G, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomised controlled trial. Gut. 2016;66(7):1241–51.
44. de Roest RH, Dobbs BR, Chapman BA, Batman B, O’Brien LA, Leeper JA, et al. The low FODMAP diet improves gastrointestinal symptoms in patients with irritable bowel syndrome: a prospective study. Int J Clin Pract. 2013;67(9):895–903.
45. Pedersen N, Vegh Z, Burisch J, Jensen L, Ankersen DV, Felding M, et al. Ehealth monitoring in irritable bowel syndrome patients treated with low fermentable oligo-, di-, mono-saccharides and polyols diet. World J Gastroenterol. 2014;20(21):6680–4.
46. Murray K, Wilkinson-Smith V, Hoad C, Costigan C, Cox E, Lam C, et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol. 2014;109(1):110–9.
47. Major G, Pritchard S, Murray K, Alappadan JP, Hoad CL, Marciani L, et al. Colon hypersensitivity to distension, rather than excessive gas production, produces carbohydrate-related symptoms in individuals with irritable bowel syndrome. Gastroenterology. 2017;152(1):124-133.e2.
48. Gibson PR, Varney J, Malakar S, Muir JG. Food components and irritable bowel syndrome. Gastroenterology. 2015;148(6):1158-1174.e4.
49. Muir JG, Shepherd SJ, Rosella O, Rose R, Barrett JS, Gibson PR. Fructan and free fructose content of common Australian vegetables and fruit. J Agric Food Chem. 2007;55(16):6619–27.
50. Muir JG, Rose R, Rosella O, Liels K, Barrett JS, Shepherd SJ, et al. Measurement of short-chain carbohydrates in common Australian vegetables and fruits by high-performance liquid chromatography (HPLC). J Agric Food Chem. 2009;57(2):554–65.
51. Biesiekierski JR, Rosella O, Rose R, Liels K, Barrett JS, Shepherd SJ, et al. Quantification of fructans, galacto-oligosacharides and other short-chain carbohydrates in processed grains and cereals. J Hum Nutr Diet. 2011;24(2):154–76.
52. Yao CK, Tan H-L, van Langenberg DR, Barrett JS, Rose R, Liels K, et al. Dietary sorbitol and mannitol: food content and distinct absorption patterns between healthy individuals and patients with irritable bowel syndrome. J Hum Nutr Diet. 2014;27 Suppl 2:263–75.
53. Monash University. Download the low FODMAP diet app for on-the-go IBS support [Internet]. 2017 [cited 2017 Apr 21]. Available from: http://www.med.monash.edu/cecs/gastro/fodmap/iphone-app.html
54. Tuck CJ, Muir JG, Barrett JS, Gibson PR. Fermentable oligosaccharides, disaccharides, monosaccharides and polyols: role in irritable bowel syndrome. Expert Rev Gastroenterol Hepatol. 2014;8(7):819–34.
55. Barrett JS. How to institute the low-FODMAP diet. J Gastroenterol Hepatol. 2017;32 Suppl 1:8–10.
56. Tuck C, Barrett J. Re-challenging FODMAPs: the low FODMAP diet phase two. J Gastroenterol Hepatol. 2017;32 Suppl 1:11–5.
57. McMeans AR, King KL, Chumpitazi BP. Low FODMAP dietary food lists are often discordant. Am J Gastroenterol. 2017;112(4):655–6.
58. Barrett JS. Extending our knowledge of fermentable, short-chain carbohydrates for managing gastrointestinal symptoms. Nutr Clin Pract. 2013;28(3):300–6.
59. Payne AN, Chassard C, Lacroix C. Gut microbial adaptation to dietary consumption of fructose, artificial sweeteners and sugar alcohols: implications for host-microbe interactions contributing to obesity. Obes Rev. 2012;13(9):799–809.
60. Staudacher HM. Nutritional, microbiological and psychosocial implications of the low FODMAP diet. J Gastroenterol Hepatol. 2017;32 Suppl 1:16–9.
61. Ostgaard H, Hausken T, Gundersen D, El-Salhy M. Diet and effects of diet management on quality of life and symptoms in patients with irritable bowel syndrome. Mol Med Rep. 2012;5(6):1382–90.
62. Staudacher HM, Lomer MCE, Farquharson FM, Louis P, Fava F, Franciosi E, et al. A diet low in FODMAPs reduces symptoms in patients with irritable bowel syndrome and a probiotic restores bifidobacterium species: a randomized controlled trial. Gastroenterology. 2017;153(4):936–47.
63. Prince AC, Myers CE, Joyce T, Irving P, Lomer M, Whelan K. Fermentable carbohydrate restriction (low FODMAP diet) in clinical practice improves functional gastrointestinal symptoms in patients with inflammatory bowel disease. Inflamm Bowel Dis. 2016;22(5):1129–36.
64. Moore JS, Gibson PR, Perry RE, Burgell RE. Endometriosis in patients with irritable bowel syndrome: specific symptomatic and demographic profile, and response to the low FODMAP diet. Aust N Z J Obstet Gynaecol. 2017;57(2):201–5.
65. Iacovou M, Mulcahy EC, Truby H, Barrett JS, Gibson PR, Muir JG. Reducing the maternal dietary intake of indigestible and slowly absorbed short-chain carbohydrates is associated with improved infantile colic: a proof-of-concept study. J Hum Nutr Diet. 2017;31(2):256–65.
66. Marum AP, Moreira C, Saraiva F, Tomas-Carus P, Sousa-Guerreiro C. A low fermentable oligo-di-mono saccharides and polyols (FODMAP) diet reduced pain and improved daily life in fibromyalgia patients. Scand J Pain. 2016;13:166–72.
67. Tan VP. The low-FODMAP diet in the management of functional dyspepsia in East and Southeast Asia. J Gastroenterol Hepatol. 2017;32 Suppl 1:46–52.
68. Shaukat A, Levitt MD, Taylor BC, MacDonald R, Shamliyan TA, Kane RL, et al. Systematic review: effective management strategies for lactose intolerance. Ann Intern Med. 2010;152(12):797–803.
69. Lomer MCE, Parkes GC, Sanderson JD. Review article: lactose intolerance in clinical practice – myths and realities. Aliment Pharmacol Ther. 2008;27(2):93–103.
70. Itan Y, Jones BL, Ingram CJ, Swallow DM, Thomas MG. A worldwide correlation of lactase persistence phenotype and genotypes. BMC Evol Biol. 2010;10:36.
71. Matthews SB, Waud JP, Roberts AG, Campbell AK. Systemic lactose intolerance: a new perspective on an old problem. Postgrad Med J. 2005;81(953):167–73.
72. Crittenden RG, Bennett LE. Cow’s milk allergy: a complex disorder. J Am Coll Nutr. 2005;24(6 Suppl):582S-91S.
73. Zhu Y, Zheng X, Cong Y, Chu H, Fried M, Dai N, et al. Bloating and distention in irritable bowel syndrome: the role of gas production and visceral sensation after lactose ingestion in a population with lactase deficiency. Am J Gastroenterol. 2013;108(9):1516–25.
74. World Gastroenterology Organisation. WGO handbook on diet and the gut. World Digestive Health Day WDHD — May 29, 2016 [Internet]. Makharia GK, Sanders DS, editors. Milwaukee, WI: World Gastroenterology Organisation and WGO Foundation; 2016 [cited 2017 Mar 24]. Available from: http://www.worldgastroenterology.org/UserFiles/file/WGOHandbookonDietandtheGut_2016_Final.pdf
75. O’Connell S, Walsh G. Physicochemical characteristics of commercial lactases relevant to their application in the alleviation of lactose intolerance. Appl Biochem Biotechnol. 2006;134(2):179–91.
76. Montalto M, Nucera G, Santoro L, Curigliano V, Vastola M, Covino M, et al. Effect of exogenous beta-galactosidase in patients with lactose malabsorption and intolerance: a crossover double-blind placebo-controlled study. Eur J Clin Nutr. 2005;59(4):489–93.
77. Lin MY, Dipalma JA, Martini MC, Gross CJ, Harlander SK, Savaiano DA. Comparative effects of exogenous lactase (beta-galactosidase) preparations on in vivo lactose digestion. Dig Dis Sci. 1993;38(11):2022–7.
78. Rosado JL, Solomons NW, Lisker R, Bourges H. Enzyme replacement therapy for primary adult lactase deficiency. Effective reduction of lactose malabsorption and milk intolerance by direct addition of beta-galactosidase to milk at mealtime. Gastroenterology. 1984;87(5):1072–82.
79. Barrett JS, Gibson PR. Fructose and lactose testing. Aust Fam Physician. 2012;41(5):293–6.
80. Yao CK, Tuck CJ, Barrett JS, Canale KE, Philpott HL, Gibson PR. Poor reproducibility of breath hydrogen testing: Implications for its application in functional bowel disorders. United Eur Gastroenterol J. 2017;5(2):284–92.
81. Marriott BP, Cole N, Lee E. National estimates of dietary fructose intake increased from 1977 to 2004 in the United States. J Nutr. 2009;139(6):1228S-1235S.
82. Staudacher HM, Whelan K, Irving PM, Lomer MCE. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. J Hum Nutr Diet. 2011;24(5):487–95.
83. Henström M, Diekmann L, Bonfiglio F, Hadizadeh F, Kuech E-M, von Köckritz-Blickwede M, et al. Functional variants in the sucrase–isomaltase gene associate with increased risk of irritable bowel syndrome. Gut. 2018;67:263–70.
84. Cohen SA. The clinical consequences of sucrase–isomaltase deficiency. Mol Cell Pediatr. 2016;3(1):5.
85. Puntis JWL, Zamvar V. Congenital sucrase-isomaltase deficiency: diagnostic challenges and response to enzyme replacement therapy. Arch Dis Child. 2015;100(9):869–71.
86. Harms H-K, Bertele-Harms R-M, Bruer-Kleis D. Enzyme-substitution therapy with the yeast Saccharomyces cerevisiae in congenital sucrase–isomaltase deficiency. N Engl J Med. 1987;316(21):1306–9.
87. Portincasa P, Bonfrate L, de Bari O, Lembo A, Ballou S. Irritable bowel syndrome and diet. Gastroenterol Rep. 2017;5(1):11–9.
88. Ford AC, Vandvik PO. Irritable bowel syndrome: dietary interventions. BMJ Clin Evid. 2015;2015:pii: 0410.
89. Bhat K, Harper A, Gorard DA. Perceived food and drug allergies in functional and organic gastrointestinal disorders. Aliment Pharmacol Ther. 2002;16(5):969–73.
90. Monsbakken KW, Vandvik PO, Farup PG. Perceived food intolerance in subjects with irritable bowel syndrome — etiology, prevalence and consequences. Eur J Clin Nutr. 2006;60(5):667–72.
91. Lacy BE. The science, evidence, and practice of dietary interventions in irritable bowel syndrome. Clin Gastroenterol Hepatol. 2015;13(11):1899–906.
92. Harvie RM, Chisholm AW, Bisanz JE, Burton JP, Herbison P, Schultz K, et al. Long-term irritable bowel syndrome symptom control with reintroduction of selected FODMAPs. World J Gastroenterol. 2017;23(25):4632–43.
93. World Gastroenterology Organisation. Global guidelines [Internet]. 2018 [cited 2018 May 19]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines
94. Quigley EMM, Fried M, Gwee K-A, Khalif I, Hungin APS, Lindberg G, et al. World Gastroenterology Organisation global guidelines. Irritable bowel syndrome: a global perspective. Update September 2015. J Clin Gastroenterol. 2016;50(9):704–13.
95. Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, et al. Non-celiac gluten sensitivity has narrowed the spectrum of irritable bowel syndrome: a double-blind randomized placebo-controlled trial. Nutrients. 2015;7(6):4542–54.
96. Eswaran S, Goel A, Chey WD. What role does wheat play in the symptoms of irritable bowel syndrome? Gastroenterol Hepatol. 2013;9(2):85–91.
97. Barmeyer C, Schumann M, Meyer T, Zielinski C, Zuberbier T, Siegmund B, et al. Long-term response to gluten-free diet as evidence for non-celiac wheat sensitivity in one third of patients with diarrhea-dominant and mixed-type irritable bowel syndrome. Int J Colorectal Dis. 2017;32(1):29–39.
98. Aziz I, Trott N, Briggs R, North JR, Hadjivassiliou M, Sanders DS. Efficacy of a gluten-free diet in subjects with irritable bowel syndrome–diarrhea unaware of their HLA-DQ2/8 genotype. Clin Gastroenterol Hepatol. 2016;14(5):696-703.e1.
99. Carroccio A, Mansueto P, Iacono G, Soresi M, D’Alcamo A, Cavataio F, et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol. 2012;107(12):1898–906.
100. Carroccio A, D’Alcamo A, Iacono G, Soresi M, Iacobucci R, Arini A, et al. Persistence of nonceliac wheat sensitivity, based on long-term follow-up. Gastroenterology. 2017;153(1):56-58.e3.
101. Skodje GI, Sarna VK, Minelle IH, Rolfsen KL, Muir JG, Gibson PR, et al. Fructan, rather than gluten, induces symptoms in patients with self-reported non-celiac gluten sensitivity. Gastroenterology. 2018;154(3):529-539.e2.
102. Gibson PR, Skodje GI, Lundin KEA. Non-coeliac gluten sensitivity. J Gastroenterol Hepatol. 2017;32 Suppl 1:86–9.
103. Molina-Infante J, Carroccio A. Suspected nonceliac gluten sensitivity confirmed in few patients after gluten challenge in double-blind, placebo-controlled trials. Clin Gastroenterol Hepatol. 2017;15(3):339–48.
104. Moayyedi P, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. The effect of dietary intervention on irritable bowel syndrome: a systematic review. Clin Transl Gastroenterol. 2015;6(8):e107.
105. World Health Organization. WHO guidelines on nutrition [Internet]. WHO. 2018 [cited 2017 Aug 19]. Available from: http://www.who.int/publications/guidelines/nutrition/en/
106. McClave SA, DiBaise JK, Mullin GE, Martindale RG. ACG clinical guideline: nutrition therapy in the adult hospitalized patient. Am J Gastroenterol. 2016;111(3):315–34.
107. Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014;63(8):1210–28.
108. National Institute for Health and Care Excellence (NICE). Diet, nutrition and obesity [Internet]. 2018 [cited 2018 May 19]. Available from: https://www.nice.org.uk/resources/lifestyle-and-wellbeing/diet--nutrition-and-obesity
109. North American Society for Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). Nutrition & obesity [Internet]. 2016 [cited 2018 May 19]. Available from: http://www.naspghan.org/content/55/en/Nutrition-and-Obesity