1. Introduction
La dysphagie peut se définir comme une difficulté dans les phases initiales de la déglutition (connue dans ce cas sous le nom de dysphagie oropharyngée) ou comme une sensation de gêne ou de blocage des aliments solides ou liquides lors de la déglutition pendant le passage de la bouche à l’estomac (on parle alors de dysphagie oesophagienne). La dysphagie est alors la « perception » d’un obstacle au passage normal du bol alimentaire. L’impaction alimentaire [1] constitue un symptôme spécifique qui peut survenir de façon intermittente chez ces patients.
La déglutition oropharyngée est un processus qui est réglé par un centre médullaire spécifique et dans l’œsophage moyen et distal par un réflexe autonome péristaltique qui est coordonné par le système nerveux entérique. Le tableau 1 énumère les mécanismes physiologiques qui interviennent dans les différentes phases.
Tableau 1 Mécanismes physiologiques des phases de la déglutition
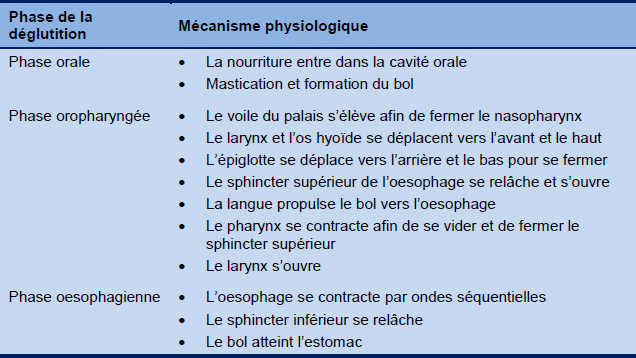
Le point important est de savoir si la dysphagie est oropharyngée ou oesophagienne. Cette distinction peut se faire avec confiance sur la base d’une anamnèse très précise qui fournit des éléments déterminants sur le type de dysphagie (oropharyngée vs. oesophagienne) dans près de 80–85% des cas [2]. Une localisation plus précise n’est pas fiable. Les éléments clés à considérer dans l’anamnèse (dont les points spécifiques sont discutés plus bas) sont:
- Localisation
- Types d’aliments et/ou liquides
- Progressive ou intermittente
- Durée des symptômes
Bien qu’elles puissent survenir souvent ensemble, il est tout autant important d’exclure l’odynophagie (déglutition douloureuse). Enfin, un diagnostic différentiel basé sur les symptômes devra exclure le globe pharyngé (sensation de « boule dans la gorge »), l’oppression thoracique, la dyspnée et la phagophobie (crainte d’avaler).
1.1 Causes de la dysphagie
Lorsqu’on entreprend d’établir l’étiologie de la dysphagie, il est utile de suivre la même classification que celle existant pour l’évaluation des symptômes, c’est-à-dire de faire une distinction entre les causes qui affectent essentiellement le pharynx et l’oesophage proximal (dysphagie oropharyngée ou “haute”) et les causes qui affectent surtout le corps de l’oesophage et la jonction oesophagogastrique (dysphagie oesophagienne ou « basse »). Cependant il est vrai que de nombreux troubles se chevauchent et qu’ils peuvent produire à la fois une dysphagie oropharyngéenne et oesophagienne. Une histoire naturelle détaillée de la maladie y compris des médicaments pris est très importante puisque les substances médicamenteuses peuvent être impliquées dans la pathogénèse de la dysphagie.
Dysphagie oropharyngée
Chez les patients jeunes, la dysphagie oropharyngée est le plus souvent causée par une maladie musculaire, des replis semi-lunaires ou des anneaux. Chez les patients plus âgés, la cause est d’ordinaire un trouble du système nerveux central, par exemple un accident vasculaire cérébral, une maladie de Parkinson et une démence. Le processus de vieillissement normal peut être à l’origine de troubles de la motilité oesophagienne (rarement symptomatiques [3]). Il est important de ne pas attribuer automatiquement une dysphagie au processus de vieillissement normal chez un patient âgé.
Généralement, il est utile de faire une distinction entre les problèmes mécaniques et les troubles de la motilité neuromusculaire, comme indiqué ci-dessous.
Causes mécaniques et obstructives:
- Infections (par exemple abcès rétropharyngiens)
- Thyromégalie
- Lymphadénopathie
- Diverticule de Zenker
- Maladies neuro-motrices (myosite, fibrose, barre au niveau du muscle crico- pharyngien)
- Oesophagite à éosinophiles
- Tumeurs malignes de la tête et du cou et leurs conséquences (par exemple, des strictures fibrotiques dures) des séquelles des interventions chirurgicales et/ou radiothérapeutiques sur ces tumeurs
- Ostéophytes cervicaux
- Tumeurs oropharyngées et néoplasmes (rare)
Troubles neuromusculaires:
- Maladies du système nerveux central telles que accident vasculaire cérébral, maladie de Parkinson, paralysie de nerf crânien ou bulbaire (par exemple sclérose en plaques, maladies neuro-motrices), sclérose latérale amyotrophique
- Troubles de la contraction musculaire tels myasthénie grave, dystrophie musculaire oculopharyngée, et autres
Entre 42 et 67% des patients présentent avec une dysphagie oropharyngée dans les trois jours suivant un accident vasculaire cérébral—ce qui rend l’AVC la cause principale de dysphagie. Parmi ces patients, 50% présentent une aspiration et un tiers développe une pneumonie nécessitant un traitement [4]. La sévérité de la dysphagie tend à être associée à la sévérité de l’AVC. Il est crucial d’effectuer un dépistage de la dysphagie chez les patients ayant subi un AVC afin de prévenir une issue défavorable en relation avec une aspiration et une nutrition/hydratations inadéquates [5].
Jusqu’à 50% des patients atteints de maladie de Parkinson manifestent des symptômes en rapport avec une dysphagie oropharygienne et jusqu’à 95% montrent des anomalies à la vidéooesophagographie [6,7]. Une dysphagie cliniquement significative peut se manifester précocément dans la maladie de Parkinson, mais elle est plus fréquente dans les stades tardifs.
Dysphagie oesophagienne
Tableau 2 Causes les plus fréquentes de dysphagie oesophagienne
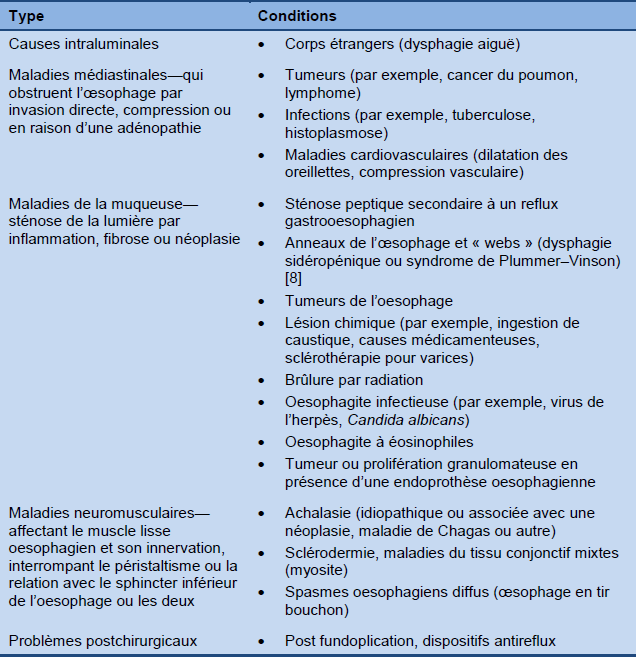
1.2 Algorithmes WGO—global guidelines
Algorithmes—une approche tenant compte des ressources à disposition
Pour les régions et les pays où toute la panoplie de tests diagnostiques et d’options thérapeutiques sont à disposition, il est possible de définir un traitement de choix (gold standard) pour le traitement de la dysphagie. Dans beaucoup de pays du monde les ressources nécessaires ne sont cependant pas disponibles. Les algorithmes diagnostiques et thérapeutiques de la WGO constituent une approche tenant compte des ressources à disposition.
Un algorithme représente un ensemble hiérarchique d’options diagnostiques, thérapeutiques et de gestion pour traiter le risque et la maladie, selon les ressources à disposition localement.
Autres guidelines à disposition
1.3 Charge que représente la dysphagie et épidémiologie
La dysphagie est un problème fréquent. Une personne sur 17 risque de développer une dysphagie au cours de sa vie. Une étude en 2011 au Royaume-Uni a montré une prévalence de 11% de la dysphagie dans la population générale [9]. Quarante à 70% des patients après AVC, 60–80% des patients avec une maladie neurodégénerative, jusqu’à 13% des adultes âgés de 65 ans et plus et plus de 51% des personnes âgées vivant en institution sont concernés [10,11], ainsi que 60–75% des patients qui subissent une radiothérapie pour un cancer de la tête et du cou.
Une résolution adoptée par le Congrès américain en 2008 [12] notait que:
- Jusqu’à 15 millions d’américains souffrent de dysphagie ; tous les américains de plus de 60 ans vont présenter une dysphagie à un moment donné.
- Il a été estimé par les Centers for Disease Control and Prevention que chaque année un diagnostic de dysphagie est posé chez un million de personnes aux Etats-Unis.
- Il a été estimé par l’Agency for Healthcare Research and Quality que chaque année 60'000 américains décèdent en raison de complications associées à une dysphagie.
- Les complications dues à la dysphagie augmentent les coûts de la santé en raison des hospitalisations, des soins aux urgences, des séjours prolongés en milieu hospitalier, de la nécessité de séjours en institution à long terme et du besoin d’un support respiratoire et nutritionnel coûteux.
- Le coût total de la dysphagie pour les systèmes de santé est supérieur à $1 milliards annuellement, y compris les coûts relatifs aux soins hospitaliers.
- La dysphagie est largement sous-estimée et n’est pas bien comprise par le public en général.
Les données épidémiologiques sont difficiles à établir globalement car la prévalence des maladies qui peuvent causer une dysphagie peut différer entre les différentes régions et continents. En conséquence, seules des approximations sont possibles globalement. Les taux de prévalence varient également selon l’âge des patients et l’on doit se souvenir que le spectre des pathologies associées à la dysphagie de l’enfant diffère de celui des adultes. Chez les patients les plus jeunes, la dysphagie implique souvent des traumatismes de la tête et du cou ou des cancers de la gorge ou de la bouche. Généralement la dysphagie se produit dans toutes les tranches d’âge, mais sa prévalence augmente avec l’âge.
La prévalence des tumeurs varie selon les différents pays. Par exemple, aux Etats- Unis et en Europe, l’adénocarcinome est le type de cancer de l’œsophage le plus fréquent, ce qui n’est pas le cas en Inde et en Chine où le cancer le plus fréquent est le carcinome épidermoïde. De même les sténoses corrosives de l’oesophage (chez les individus qui ont absorbé des produits corrosifs dans un but suicidaire) ou une tuberculose peuvent être des aspects importants dans un cadre non occidental.
Facteurs selon les différentes régions
- Amérique du Nord/Etats-Unis:
- Le taux de sténoses dues aux reflux ont eu tendance à diminuer aux Etats-Unis depuis que l’utilisation des inhibiteurs de la pompe à protons sont largement à disposition [13].
- L’oesophagite à éosinophiles est de plus en plus reconnue comme une cause majeure de dysphagie chez les enfants comme chez les adultes [13].
- Le cancer de l’oesophage tend à augmenter, même si le nombre absolu de personnes diagnostiquées avec un tel cancer aux Etats-Unis reste minime.
- Avec le vieillissement de la population aux Etats-Unis, certaines causes de dysphagie deviennent plus importantes que par le passé: par exemple, la compression par des ostéophytes cervicaux, les accidents vasculaires cérébraux et autres maladies neurologiques.
- L’usage courant des traitements ablatifs pour l’oesophage de Barrett (ablation par radiofréquences, ablation photodynamique et résection endoscopique de la muqueuse) peut très bien conduire à un nouveau sous-groupe de patients avec des sténoses causées par l’endothérapie.
- Europe/Occident:
- Alors que la dysphagie oesophagienne due à la maladie de reflux gastrooesophagien (GERD) et aux strictures peptiques tend à diminuer, les taux d’adénocarcinomes de l’œsophage et d’oesophagites à éosinophiles sont en augmentation [14–16].
- Asie [17,18]:
- Les causes les plus fréquentes de dysphagie oesophagienne sont le carcinome épidermoïde, l’achalasie et les sténoses post chirurgicales. La prévalence du GERD semble en augmentation, mais cette augmentation est toujours moins marquée en Asie que dans les pays occidentaux. La dysphagie post-AVC est assez courante en Asie et les améliorations apportées dans les systèmes de soins font graduellement reconnaître la nécessité d’un diagnostic et d’un traitement précoces.
- Amérique Latine:
- La maladie de Chagas est très courante dans certaines régions de l’Amérique Latine. Une achalasie et un mégaoesophage dûs à la maladie de Chagas peuvent se développer et conduire à une malnutrition. Certains aspects de l’achalasie de Chagas peuvent différer de ceux rencontrés dans l’achalasie idiopathique. La pression au niveau du sphincter oesophagien inférieur tend à être d’un niveau bas, apparemment parce que les mécanismes de contrôle stimulateurs et inhibitateurs sont endommagés. Tous les deux traitements tant médicaux que chirurgicaux sont cependant similaires [19].
- Afrique:
- En Afrique, le traitement de la dysphagie post-AVC n’est souvent pas optimal en raison de ressources insuffisantes ou d’une gestion inadéquate des ressources à disposition. Un manque de professionnels de la santé qualifiés et bien informés peut également expliquer un niveau de soins sous-optimal. Il existe également un manque d’unités médicales spécialisées dans les soins post-AVC et un manque de l’appareillage nécessaire—particulièrement des équipements d’imagerie radiologique moderne [20].
2. Diagnostic clinique
Une anamnèse détaillée comportant les éléments fondamentaux du diagnostic est importante et peut souvent permettre d’établir un diagnostic avec certitude. Il est important de déterminer soigneusement le lieu de perception des problèmes de déglutition: dysphagie oropharyngée vs. dysphagie oesophagienne.
2.1 Dysphagie oropharyngée
Anamnèse
La dysphagie oropharyngée peut aussi être appelée dysphagie “haute” en raison de sa localisation orale ou pharyngée. Les patients ont de la difficulté à initier la déglutition et ils identifient habituellement la région cervicale comme présentant un problème.
La dysphagie oropharyngée est fréquemment présente comme comorbidité chez les patients atteints de problèmes neurologiques et est associée à des effets négatifs sur la santé tels déshydratation, malnutrition, pneumonie et risque de mort. Ces problèmes de déglutition peuvent engendrer un degré d’anxiété accru et une peur, ce qui peut conduire ces patients à éviter la prise orale—ce qui peut engendrer une malnutrition, une dépression et un sentiment d’isolement.
Symptômes les plus fréquents:
- Difficulté à initier la déglutition, déglutitions à répétition
- Régurgitation nasale
- Toux
- Voix nasonnale
- Ecoulement de bave
- Diminution du réflexe de toux
- Suffocation (la pénétration laryngée et l’aspiration peuvent survenir sans suffocation ou toux concomitante)
- Dysarthrie et diplopie (peuvent accompagner une pathologie neurologique à l’origine de la dysphagie oropharyngée)
- Mauvaise haleine (halitose) chez les patients avec un gros diverticule de Zenker contenant une quantité importante de résidus ou chez les patients avec une achalasie avancée ou avec une obstruction prolongée accompagnée d’accumulation luminale de résidus en décomposition
- Pneumonies à répétition
Un diagnostic précis est possible en cas de pathologie neurologique précise accompagnant la dysphagie oropharyngée, comme par exemple:
- Hémiparésie consécutive à un AVC antérieur
- Ptose des paupières et fatigabilité faisant suspecter un myasthenia gravis
- Raideur, tremblements et dysautonomie faisant suspecter une maladie de Parkinson
- Autres pathologies neurologiques incluant la dystonie cervicale et la compression des nerfs crâniens, par exemple une hyperostose ou une malformation d’Arnold– Chiari (hernie du cervelet dans le trou occipital)
- Des déficits spécifiques des nerfs crâniens impliqués dans le processus de déglutition peuvent aussi aider à localiser l’origine du trouble orophagyngéen afin de poser un diagnostic
Evaluation
Les tests pour évaluer la dysphagie peuvent varier selon les caractéristiques du patient, la sévérité de la maladie et le niveau d’expertise à disposition. Tout patient souffrant d’un AVC devrait subir un dépistage de la dysphagie dans les 24 heures suivant l’accident et avant toute prise orale, car cela permet de diminuer le risque de complication résultant de la dysphagie par un facteur de 3. Les patients qui présentent une perte pondérale persistante et des infections pulmonaires à répétition devraient être évalués de toute urgence [21].
Un protocole d’évaluation de la déglutition au lit du malade a été développé par la American Speech-Language-Hearing Association (ASHA); un modèle est à disposition sur le site sous http://www.speakingofspeech.info/medical/BedsideSwallowingEval.pdf.
Cette méthode peu coûteuse qui peut être pratiquée au lit du malade permet une approche détaillée et structurée aux mécanismes de la dysphagie orgopharyngée et à sa prise en charge ; elle peut s’avérer utile dans les régions aux ressources limitées.
Les examens principaux pour évaluer une dysphagie oropharyngée sont:
- Radiocinéma ou vidéofluoroscopie (modified barium swallow)
- Ceci représente l’examen de choix pour évaluer la dysphagie orgopharyngée [22–24].
- La déglutition est enregistrée sur vidéo pendant la fluoroscopie, permettant ainsi de définir les mécanismes de la déglutition du patient.
- Ceci peut également aider à prédire le risque de pneumonie par aspiration [25].
- Les images de vidéofluoroscopic peuvent être visualisées à une vitesse réduite ou image par image, et peuvent également être envoyées par l’internet afin de faciliter leur interprétation dans les régions difficiles d’accès [26].
- Endoscopie haute
- L’endoscopie haute par voie nasale représente le traitement de choix pour l’évaluation des causes structurales de la dysphagie [22–24]—par exemple, des lésions dans l’oropharynx—et l’inspection de la présence de sécrétions ou d’aliments.
- L’endoscopie ne représente pas un moyen très sensible de détecter une déglutition anormale.
- Dans 20–40% des cas, il a été constaté que l’endoscopie n’a pas permis d’identifier une bronchoaspiration en raison de l’absence d’un réflexe de toux alors que celle-ci a été vérifiée au moyen d’une vidéofluoroscopie.
- Evaluation endoscopique de la déglutition (FEES, fiberoptic endoscopic evaluation of swallowing)
- La FEES est une approche endoscopique modifiée qui comprend la visualisation les structures laryngées et pharyngées au moyen d’un fibroscope transnasal flexible pendant l’administration de bols solides et liquides au patient.
- Manométrie pharyngooesophagienne à haute résolution
- Il s’agit d’une évaluation quantitative de la pression et du timing des contractions pharyngées et de la relaxation de l’œsophage supérieur.
- Elle peut être combinée avec le radiocinéma (fluororadioscopie) afin de permettre une meilleure appréciation du mouvement et des pressions impliqués dans la déglutition.
- Elle peut être utile chez des patients avec une dysphagie oropharyngée malgré un transit baryté conventionnel négatif.
- Elle peut être utile si une myotomie chirurgicale est envisagée.
- Manométrie à impédance automatisée (AIM) [27]
- Il s’agit d’une combinaison d’une manométrie à haute résolution et de l’impédance.
- Les variations du flux de pression émanant d’une analyse automatisée combinées avec des mesures de l’impédance peuvent fournir des informations diagnostiques précieuses.
- Ces mesures ont une valeur prédictive solide du risque d’aspiration quand elles sont combinées (SRI, swallow risk index).
- Test de déglutition avec de l’eau
- Ce test représente un test de dépistage de base, bon marché et potentiellement très utile en combinaison avec tous les éléments de l’anamnèse et l’examen physique.
- Lors de ce test, le patient doit boire 150 mL d’eau aussi rapidement que possible pendant que le médecin examinateur note la durée et le nombre de déglutitions nécessaires. La vitesse de déglutition et le volume moyen par déglutition peuvent être calculés à partir de ces données. Il a été estimé que ce test peut avoir une sensibilité prédictive de > 95% dans l’identification de la présence d’une dysphagie et peut être complété par un test avec des aliments qui consiste à mettre une petite quantité de pudding sur le dos de la langue [28].
L’algorithme proposé en Fig. 1 donne une liste de tests plus sophistiqués et de procédures nécessaires pour établir un diagnostic et proposer des traitements spécifiques.
Fig. 1 Evaluation et traitement de la dysphagie oropharyngée
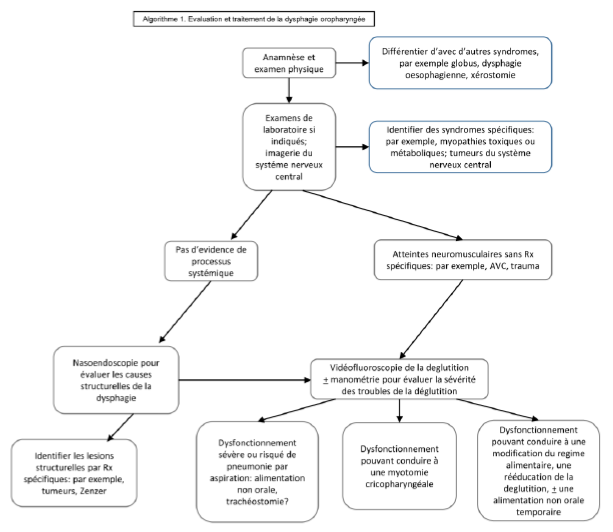
2.2 Dysphagie oesophagienne
Diagnostic différentiel
Les affections le plus fréquemment associées à une dysphagie oesophagienne sont:
- Sténose peptique—est présente chez jusqu’à 10% des patients souffrant de maladie de reflux gastro-oesophagien (GERD) [29,30], mais l’incidence diminue en relation avec l’utilisation des inhibiteurs de la pompe à protons
- Néoplasie oesophagienne—y compris une néoplasie du cardia et une pseudoachalasie
- Membranes (webs), anneaux (rings)
- Achalasie, y compris d’autres troubles de la motilité oesophagienne primaire et secondaire
- Sclérodermie
- Troubles spastiques de la motilité
- Dysphagie fonctionnelle
- Lésion post-radiothérapie (post-actinique)
Causes rares:
- Oesophagite lymphocytaire
- Anomalies cardiovasculaires
- Atteinte oesophagienne par la maladie de Crohn
- Lésion caustique
Anamnèse
La dysphagie oesophagienne peut aussi porter le nom de dysphagie « basse » en raison de sa localisation probable au niveau de l’œsophage distal—bien qu’on puisse noter que certains patients atteints de dysphagie oesophagienne, telle que l’achalasie, peuvent décrire des symptômes localisés dans la région cervicale, mimant une dysphagie orgopharyngéale.
- Les dysphagies qui surviennent aussi bien avec les solides que les liquides impliquent souvent un problème de motilité oesophagienne. Cette suspicion se renforce quand les dysphagies intermittentes aux solides et aux liquides sont associées avec une douleur thoracique.
- Les dysphagies qui surviennent uniquement avec des solides mais jamais avec des liquides suggèrent la possibilité d’une obstruction mécanique avec sténose luminale de diamètre de < 15 mm. Si elles sont progressives, il faut envisager une sténose peptique ou un carcinome. De plus il faut noter que les patients atteints de sténoses peptiques ont une longue anamnèse de brûlures rétro-sternales et de reflux, mais pas de perte de poids. Inversement, les patients atteints de cancer de l’œsophage tendent à être plus âgés avec des pertes de poids marquées.
- En cas de dysphagie intermittente avec impaction alimentaire, tout particulièrement chez les hommes jeunes, il faut suspecter une oesophagite à éosinophiles.
L’examen clinique des patients atteints de dysphagie oesophagienne offre d’habitude un intérêt limité ; cependant une lymphadénopathie cervicale/supraclaviculaire peut être palpable chez les malades ayant un cancer de l’œsophage. En outre, quelques patients atteints de sclérodermie avec des sténoses peptiques secondaires peuvent présenter le syndrome CREST (calcinose, maladie de Raynaud, dysmotilité oesophagienne, sclérodactylie, télangiectasie).
L’halitose est un symptôme non spécifique qui peut suggérer une achalasie avancée ou une obstruction prolongée avec accumulation de résidus se décomposant lentement dans la lumière de l’oesophage.
L’anamnèse constitue la pierre angulaire de l’évaluation et doit être considérée en premier lieu. La question la plus importante en ce qui concerne la dysphagie oesophagienne est d’exclure une tumeur maligne. L’anamnèse du patient peut donner des indices. Le caractère malin est vraisemblable en cas de:
- Durée courte – <4 mois
- Progression de la maladie
- Dysphagie plus marquée pour les solides que les liquides
- Perte de poids
Par contre une achalasie est plus vraisemblable dans les cas suivants:
- Dysphagie concernant aussi bien les solides que les liquides. Une dysphagie pour les liquides devrait faire suspecter ce diagnostic.
- Il existe une régurgitation passive nocturne de mucus ou d’aliments.
- Problème existant depuis plusieurs mois ou années.
- Le patient fait des manœuvres supplémentaires afin de faire passer la nourriture, tels que boire ou changer de position.
Il faut suspecter la présence d’une oesophagite à éosinophiles si:
- Il existe une dysphagie intermittente associée à des impactions alimentaires occasionnelles.
Evaluation
Les examens initiaux à effectuer dépendent de l’anamnèse. Il est nécessaire que les patients soient rapidement orientés vers un spécialiste car la plupart des patients devront subir un examen par endoscopie. L’algorithme détaillé dans Fig. 2 montre le processus décisionnel afin de décider quel est l’examen initial à effectuer : endoscopie vs transit baryté.
- Evaluation par endoscopie:
- Le vidéo-endoscope (les endoscopes à fibres optiques ont généralement été remplacés par des endoscopes électroniques ou vidéo-endoscopes) est passé par la bouche jusqu’à dans l’estomac permettant une visualisation détaillée du tractus gastrointestinal supérieur.
- Un examen par vidéo-endoscope à haute résolution, si à disposition, permet de détecter des changements subtils tels les îlots blanchâtres typiques d’une oesophagite à éosinophiles.
- Le passage de l’endoscope dans la cavité gastrique est très important pour exclure une pseudoachalasie due à une tumeur de la jonction oesogastrique.
- L’endoscopie permet d’effectuer des biopsies et de pratiquer des manœuvres à but thérapeutique.
- L’endosonographie (EUS) peut se révéler utile dans certains cas d’obstruction.
- Transit baryté:
- Le transit baryté effectué chez un patient en position couchée ou debout peut souligner les irrégularités de la lumière de l’œsophage et identifier la plupart des cas d’obstruction, par membranes et anneaux.
- L’examen de l’oropharynx et de l’œsophage pendant la déglutition représente le test initial le plus utile chez les patients avec une anamnèse ou des signes cliniques faisant suspecter une lésion de l’œsophage proximal. Quand il est effectué par un expert, cet examen peut s’avérer être plus sensible et plus sûr qu’une endoscopie haute.
- Le transit baryté peut également être utile pour détecter une achalasie et des spasmes oesophagiens diffus, bien que la manométrie représente l’examen le plus sûr dans le diagnostic de ces pathologies.
- Il peut être également utile d’inclure une pastille de barium pour identifier de petites sténoses. Un transit baryté peut également se révéler utile chez les patients dysphagiques avec une endoscopie négative si cette pastille de Garcia est utilisée.
- Une évaluation radiographique approfondie [31] est utile si on suspecte la présence d’un trouble mécanique subtil malgré une endoscopie supérieure négative.
- Un transit baryté minuté peut s’avérer très utile afin d’évaluer une achalasie avant et après traitement.
- Manométrie oesophagienne:
- Cette méthode de diagnostic est basée sur l’enregistrement de la pression dans la lumière de l’œsophage en utilisant des techniques à base de capteurs de pression ou de perfusion.
- La manométrie est indiquée quand on suspecte une cause oesophagienne à la dysphagie après un transit baryté et une endoscopie sans particularités et après un traitement anti-reflux approprié et lorsque la guérison de l’œsophage est prouvée endoscopiquement.
- Les trois causes principales de dysphagie qui peuvent être diagnostiquées par manométrie oesophagienne sont l’achalasie, la sclérodermie et les spasmes oesophagiens.
- Manométrie oesophagienne à haute résolution (HRM) avec mesure simultanée des pressions sur tout l’oesophage:
- Cet examen est utilisé afin d’évaluer les troubles de la motilité oesophagienne.
- Elle est basée sur des enregistrements simultanés de la pression avec jusqu’à 36 capteurs distribués le long de l’œsophage et radialement afin de permettre des mesures à l’intérieur des sphincters et dans le corps de l’œsophage, avec une présentation des résultats en trois dimensions (EPT).
- L’algorithme diagnostic de la classification de Chicago permet une catégorisation hiérarchique des troubles de la motilité oesophagienne. La classification de Chicago a permis de clarifier les diagnostics d’achalasie et de spasmes de l’œsophage distal.
- Transit oesophagien isotopique:
- Le patient avale un liquide radioactif (par exemple de l’eau marquée au technetium-99m ou un aliment également marqué) et l’on mesure la radioactivité au niveau de l’oesophage.
- Les patients avec des troubles de la motilité oesophagienne ont typiquement une clearance de l’isotope radioactif plus lente dans l’oesophage. Des troubles de la motilité devraient donc être suspectés chez les patients avec une endoscopie négative combinée avec un temps de transit oesophagien anormal.
- Quand les examens barytés et une manométrie oesophagienne à haute résolution sont utilisés il n’existe que peu de motif à effectuer une scintigraphie oesophagienne.
Fig. 2 Evaluation et traitement de la dysphagie oesophagienne
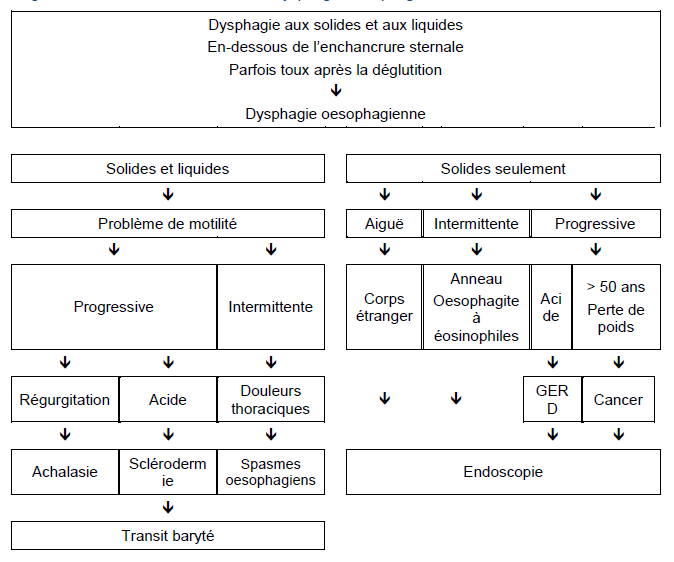
2.3 Algorithmes diagnostiques
Les tableaux 3 et 4 fournissent des options diagnostiques pour les situations où les ressources sont limitées, en quantités moyennes ou permettent l’utilisation des techniques de pointe.
Tableau 3 Algorithme: options diagnostiques pour la dysphagie oropharyngée

CT, computed tomography; PET, positron-emission tomography.
Tableau 4 Algorithme: options diagnostiques pour la dysphagie oesophagienne

CT, computed tomography; PET, positron-emission tomography.
3. Options thérapeutiques
3.1 Dysphagie oropharyngée
Le but du traitement est d’améliorer le passage des solides et des liquides et d’empêcher la broncho-aspiration. La cause de la dysphagie représente un élément important pour le choix de l’approche thérapeutique.
Tableau 5 Dysphagie oropharyngée : causes et options thérapeutiques
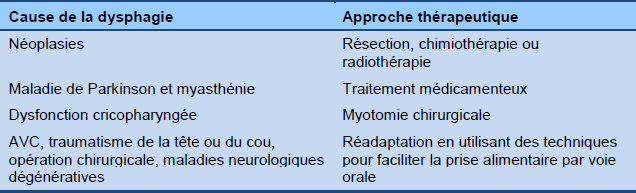
La prise en charge des complications est d’une importance primordiale. A ce propos, l’identification du risque d’aspiration est un élément fondamental lorsqu’on considère les options thérapeutiques. Pour les patients sous réadaptation active post AVC, le traitement de la dysphagie devrait être poussé aux limites de la tolérabilité. Des mesures simples peuvent se révéler très utiles—par exemple, mise en place d’un dentier en cas de problèmes dentaires, modification de la consistance des liquides [32] et des aliments [33] ou modification du volume du bol alimentaire.
- Rééducation de la déglutition:
- Proposer les modifications posturales, nutritionnelles et comportementales appropriées.
- Des manœuvres relativement simples permettent de diminuer la dysphagie oropharyngée pendant la déglutition.
- Entraînement spécifique à la déglutition par un spécialiste des troubles de la déglutition.
- Différentes techniques de traitement ont été développées afin d’améliorer les troubles de la déglutition, par exemple les exercices de renforcement et le biofeedback.
- Modifications nutritionnelles et du régime alimentaire:
- Une nourriture plus molle, éventuellement en combinaison avec des mesures posturales, peut se révéler utile.
- L’alimentation orale est la meilleure solution à chaque fois que cela est possible. Modifier la consistance des aliments afin d’épaissir les liquides et rendre les aliments plus mous peut faire une grande différence [34].
- On doit apporter un soin tout particulier à surveiller les besoins en liquides et les besoins nutritionnels (risques de déshydratation).
- L’addition d’acide citrique aux aliments améliore les réflexes de déglutition peut-être par stimulation gustatoire et stimulation du nerf trijumeau par l’acide [35].
- Un traitement adjuvant avec un inhibiteur de l’enzyme de conversion de l’angiotensine pour faciliter le réflexe de toux peut aussi se montrer utile [36].
- Support nutritionnel alternatif:
- En présence d’un fort risque de broncho-aspiration ou quand l’alimentation par voie orale ne suffit pas, on peut envisager l’introduction sous contrôle radiologique d’une fine sonde souple pour nourrir le malade.
- L’alimentation par gastrostomie après AVC réduit la mortalité et améliore l’état de nutrition du patient en comparaison à l’alimentation par voie nasogastrique.
- La gastrostomie percutanée par voie endoscopique consiste à passer un tube dans l’estomac par voie percutanée sous surveillance endoscopique, ce qui est d’ordinaire préférable, si cela est possible, à une gastrostomie chirurgicale.
- La probabilité que ces tubes destinés à l’alimentation puissent être retirés est plus faible chez les patients âgés, chez ceux qui ont eu un AVC bilatéral ou une aspiration durant la vidéofluoroscopie initiale [37].
- Une alimentation par sonde jéjunale devrait être utilisée dans un contexte de problème aigu et une gastrostomie percutanée ou par une jéjunostomie dans un contexte de problème chronique.
- Des traitements chirurgicaux destinés à supprimer les causes spastiques de la dysphagie telles que la myotomie cricopharyngée ont été couronnés de succès dans 60% des cas, mais leur utilisation reste controversée [38]. D’un autre côté, la chirurgie « à ciel ouvert » et la myotomie endoscopique chez les patients avec un diverticule de Zenker sont des moyens thérapeutiques reconnus.
3.2 Dysphagie oesophagienne
Une dysphagie aiguë nécessite une évaluation rapide et une intervention immédiate. Chez les adultes, la cause la plus fréquente est l’impaction alimentaire. Une composante mécanique sous-jacente peut également exister. On observe une amélioration rapide après le retrait du bol alimentaire impacté. Il faut faire attention à éviter une perforation lorsque l’on pousse vers le bas le corps étranger.
Le tableau 6 fournit une liste d’options thérapeutiques à considérer en présence d’une dysphagie oesophagienne.
Tableau 6 Dysphagie oesophagienne : options thérapeutiques
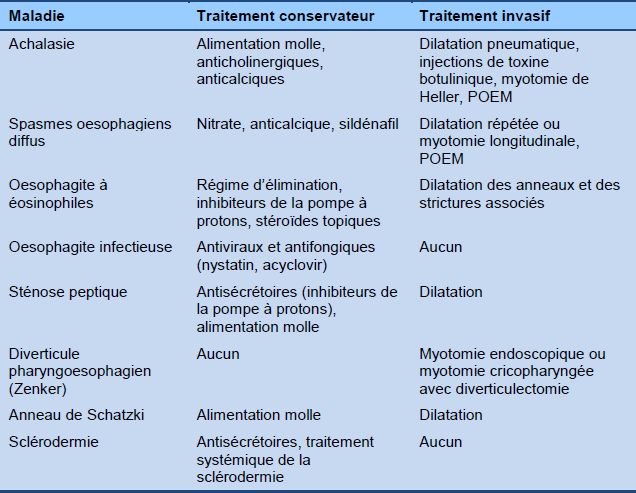
POEM, myotomie perorale endoscopique.
Sténoses peptiques oesophagiennes
Les sténoses peptiques sont habituellement le résultat d’un reflux gastro oesophagien (GERD), mais elles peuvent également être causées par des médicaments. Le diagnostic différentiel doit exclure:
- Les sténoses caustiques après ingestion de produits chimiques caustiques
- Les sténoses provoquées par des médicaments
- Les sténoses post opératoires
- Les sténoses fongiques
- L’oesophagite à éosinophiles
Après confirmation par endoscopie, une dilatation progressive [39,40] par une bougie de Savary représente le traitement de choix. La dilatation par ballonnet est une alternative, mais comporte davantage de risques.
- Un traitement anti reflux agressif avec inhibiteurs de la pompe à protons tels oméprazole 20 mg 2x/jour ou équivalent ou une fundoplication améliorent la dysphagie et diminuent le besoin de recourir à d’autres dilatations chez des patients souffrant de sténoses oeosphagiennes peptiques. Certains patients peuvent nécessiter des doses plus élevées d’inhibiteurs de la pompe à protons.
- Chez les patients dont la dysphagie persiste ou récidive après traitement initial par dilatation ou thérapie anti reflux, la cicatrisation de l’oesophagite de reflux doit être confirmée endoscopiquement avant de répéter la dilatation.
- Lorsque la cicatrisation de l’oesophagite de reflux est obtenue, le besoins d’autres dilatations est déterminé empiriquement.
- On peut apprendre aux patients qui ne ressentent qu’un soulagement de courte durée de leur dysphagie après dilatation la technique de l’auto-dilatation (self- bougienage).
- Dans les sténoses réfractaires, on peut injecter des stéroïdes dans la lésion avant dilatation et pratiquer une incision électrochirurgicale par endoscopie.
- Rarement les vraies sténoses réfractaires peuvent exiger une résection de l’œsophage suivie d’une plastie reconstructive.
- Exceptionnellement une prothèse endoluminale [41] peut être indiquée chez les patients avec une sténose bénigne. Le risque de perforation est d’environ 0.5% et il existe un taux élevé de risque de migration de l’endoprothèse dans ces conditions.
- La chirurgie est généralement indiquée en cas de perforation franche, mais des méthodes endoscopiques de fermeture de la perforation sont en train d’être développées.
Traitement des anneaux de la muqueuse de l’œsophage inférieur (y compris les anneaux de Schatzki)
- Le traitement par dilatation des anneaux de la muqueuse de l’œsophage inférieur implique le passage d’une seule bougie large (45–60 Fr) ou une dilatation par ballonnet (18–20 mm) pour rupturer (plutôt que pour seulement dilater) les anneaux.
- Après une dilatation importante, toute oesophagite de reflux associée est traitée agressivement par des inhibiteurs de la pompe à protons à dose élevée.
- Le besoin de dilatations ultérieures est déterminé empiriquement. Cependant la rechute est possible et les patients doivent être informés qu’ils pourraient avoir besoin d’autres dilatations dans le futur. Des biopsies de la muqueuse oesophagienne devraient être faites dans de tels cas afin d’évaluer l’éventuelle présence d’une oesophagite à éosinophiles.
- Une manométrie oesophagienne est recommandée chez les patients dont la dysphagie persiste ou récidive rapidement en dépit d’une dilatation appropriée ou d’un traitement anti reflux.
- Pour les patients qui ont des troubles de la motilité susceptibles d’être traités, comme l’achalasie, le traitement sera dirigé avant tout contre les troubles de la motilité.
- Si on ne trouve aucun trouble de la motilité susceptible d’être traité, on répétera l’endoscopie pour confirmer la cicatrisation de l’oesophagite et la rupture de l’anneau.
- Chez les patients chez qui l’anneau persiste, on essaiera une autre tentative de dilatation.
- Les anneaux réfractaires à toute dilatation par ballonnets standards et bougies peuvent répondre à une incision électrochirurgicale par voie endoscopique et à une résection chirurgicale. Ces traitements ne devraient concerner que rarement les patients ayant des anneaux de la muqueuse de l’œsophage inférieur et seulement après exclusion de toutes les autres causes de dysphagie.
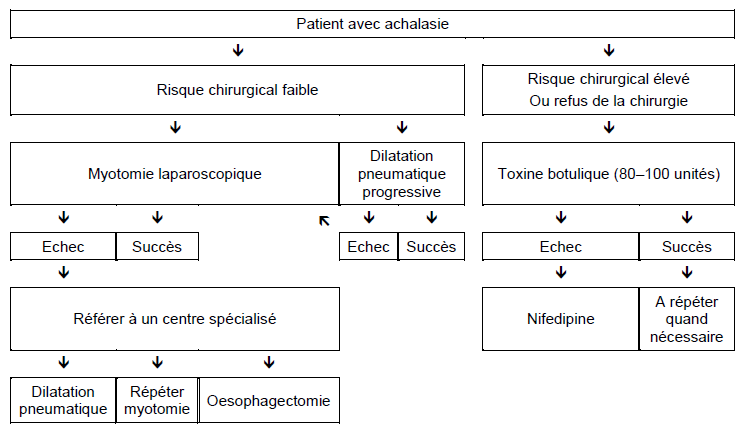
Achalasie
- Une éventuelle pseudoachalasie (âge avancé, perte de poids rapide et sévère) ou une maladie de Chagas devraient être exclues.
- Le traitement de l’achalasie dépend largement du risque chirurgical.
- Un traitement médical avec des nitrates ou des anticalciques est souvent inefficace ou mal toléré.
- Des injections de toxine botulique peuvent représenter le traitement initial chez les patients qui représentent un mauvais risque chirurgical, ou si le médecin juge que les médicaments et la dilatation pneumatique risquent d’être mal tolérés. L’injection de toxine botulique apparaît être une procédure sûre qui peut entraîner une rémission clinique d’au moins six mois pour à peu près les deux tiers des patients souffrant d’achalasie. Cependant, la plupart des patients auront besoin d’injections répétées pour maintenir la rémission. Les résultats à long terme de ce traitement ont été décevants et beaucoup de chirurgiens considèrent que le geste chirurgical est rendu plus difficile par les cicatrices qui peuvent résulter des injections.
- Quand ces traitements ont échoué, le médecin et le patient doivent décider si les bénéfices potentiels de la dilatation pneumatique ou de la myotomie dépassent les risques substantiels de ces procédures chez les patients âgés ou handicapés.
- Chez ceux pour lesquels l’acte chirurgical est une option, la plupart des gastroentérologues commencent avec une dilatation pneumatique par endoscopie et optent pour une myotomie laparoscopique de type Heller lorsque deux ou trois dilatations pneumatiques avec des ballonnets de 30 mm, 35 mm et 40mm ont échoué. Quelques gastroentérologues préfèrent opter directement pour la chirurgie sans un essai préliminaire de dilatation pneumatique ou limitent le diamètre des dilatations pneumatiques à 30–35 mm.
- La myotomie perorale endoscopique (POEM) est en train de faire son apparition comme alternative à la dilatation pneumatique ou à la myotomie de type Heller.
- En cas d’échec de ces traitements, tout particulièrement chez les patients avec une décompensation de l’œsophage, une oesophagectomie peut se discuter.
- Une gastrostomie pour permettre l’alimentation peut représenter une alternative à une dilatation pneumatique ou à une myotomie, mais beaucoup de patients qui n’ont pas d’atteinte neurologique trouvent que la vie avec une gastrostomie est intolérable.
Fig. 3 Options thérapeutiques chez les patients avec une achalasie
Oesophagite à éosinophiles
- L’oesophagite à éosinophiles est une inflammation de l’œsophage d’origine allergique [42].
- Le diagnostic est basé sur l’examen histologique de biopsies de la muqueuse de l’œsophage supérieur et inférieur après un traitement initial avec des inhibiteurs de la pompe à protons pendant 6–8 semaines. Environ un tiers des patients chez qui on suspecte une oesophagite à éosinophiles parviennent à une rémission avec un traitement avec des inhibiteurs de la pompe à protons [43].
- L’identification de l’allergène alimentaire ou aérien peut servir à diriger les conseils diététiques.
- Au cas où aucun allergène spécifique ne peut être identifié, un régime d’élimination des 6 allergènes alimentaires les plus fréquemment rencontrés pourrait être tenté.
- Les stéroïdes topiques et les antagonistes des leucotrienes sont les médicaments le plus souvent recommandés pour le traitement de l’oesophagite à éosinophiles [44,45].
- La dilatation de l’œsophage chez les patients avec des sténoses et des anneaux associés est sûre (le taux de perforation est de moins de 1%) et efficace (avec une amélioration de la dysphagie pendant jusqu’à 1–2 ans dans plus de 90% de cas) [46,47].
3.3 Algorithmes thérapeutiques
Les tableaux 7–9 montrent les options thérapeutiques pour les régions aux ressources limitées, aux ressources moyennes et aux ressources importantes.
Tableau 7 Algorithme : options thérapeutiques pour la dysphagie oropharyngée

Tableau 8 Algorithme: options thérapeutiques pour la dysphagie oesophagienne

IPP, inhibiteur de la pompe à protons.
Tableau 9 Algorithme: options thérapeutiques pour l’achalasie

4. Références
Références générales
Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
Liste de références
- Ginsberg GG. Food bolus impaction. Gastroenterol Hepatol 2007;3:85–6.
- Hila A, Castell D. Upper gastrointestinal disorders. In: Hazzard W, Blass J, Halter J, Ouslander J, Tinetti ME, editors. Principles of geriatric medicine and gerontology. 5th ed. New York: McGraw-Hill Professional; 2003: 613–40.
- Shamburek RD, Farrar JT. Disorders of the digestive system in the elderly. N Engl J Med 1990;322:438–43.
- Hinchey JA, Shephard T, Furie K, Smith D, Wang D, Tonn S, et al. Formal dysphagia screening protocols prevent pneumonia. Stroke J Cereb Circ 2005;36:1972–6.
- Donovan NJ, Daniels SK, Edmiaston J, Weinhardt J, Summers D, Mitchell PH, et al. Dysphagia screening: state of the art: invitational conference proceeding from the State-of-the-Art Nursing Symposium, International Stroke Conference 2012. Stroke J Cereb Circ 2013;44:e24–31.
- Kalf JG, de Swart BJM, Bloem BR, Munneke M. Prevalence of oropharyngeal dysphagia in Parkinson’s disease: a meta-analysis. Parkinsonism Relat Disord 2012;18:311–5.
- Nicaretta DH, Rosso AL, Mattos JP de, Maliska C, Costa MMB. Dysphagia and sialorrhea: the relationship to Parkinson’s disease. Arq Gastroenterol 2013;50:42–9.
- Atmatzidis K, Papaziogas B, Pavlidis T, Mirelis C, Papaziogas T. Plummer–Vinson syndrome. Dis Esophagus 2003;16:154–7.
- Holland G, Jayasekeran V, Pendleton N, Horan M, Jones M, Hamdy S. Prevalence and symptom profiling of oropharyngeal dysphagia in a community dwelling of an elderly population: a selfreporting questionnaire survey. Dis Esophagus 2011;24:476–80.
- Turley R, Cohen S. Impact of voice and swallowing problems in the elderly. Otolaryngol Head Neck Surg 2009;140:33–6.
- Lin LC, Wu SC, Chen HS, Wang TG, Chen MY. Prevalence of impaired swallowing in institutionalized older people in Taiwan. J Am Geriatr Soc 2002;50:1118–23.
- United States. Congress. House. Resolution expressing the sense of the Congress that a National Dysphagia Awareness Month should be established. 110th Congress. 2nd session. H. Con. Res. 195 (2008). Washington, DC: United States Government Printing Office, 2008. Available at: http://thomas.loc.gov/cgi-bin/query/z?c110:H.CON.RES.195:.
- Kidambi T, Toto E, Ho N, Taft T, Hirano I. Temporal trends in the relative prevalence of dysphagia etiologies from 1999–2009. World J Gastroenterol 2012;18:4335–41.
- Rutegård M, Lagergren P, Nordenstedt H, Lagergren J. Oesophageal adenocarcinoma: the new epidemic in men? Maturitas 2011;69:244–8.
- Ronkainen J, Talley NJ, Aro P, Storskrubb T, Johansson SE, Lind T, et al. Prevalence of oesophageal eosinophils and eosinophilic oesophagitis in adults: the population-based Kalixanda study. Gut 2007;56:615–20.
- Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen M, et al. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol 2011;128:1349–50.
- Zhang HZ, Jin GF, Shen HB. Epidemiologic differences in esophageal cancer between Asian and Western populations. Chin J Cancer 2012;31:281–6.
- Ronkainen J, Agréus L. Epidemiology of reflux symptoms and GORD. Best Pract Res Clin Gastroenterol 2013;27:325–37.
- Matsuda NM, Miller SM, Evora PRB. The chronic gastrointestinal manifestations of Chagas disease. Clinics (São Paulo, Brazil) 2009;64:1219–24.
- Blackwell Z, Littlejohns P. A review of the management of dysphagia: a South African perspective. J Neurosci Nurs 2010;42:61–70.
- National Stroke Foundation. Clinical guidelines for stroke management 2010. Melbourne: National Stroke Foundation, 2010: 78–95.
- Scharitzer M, Pokieser P, Schober E, Schima W, Eisenhuber E, Stadler A, et al. Morphological findings in dynamic swallowing studies of symptomatic patients. Eur Radiol 2002;12:1139–44.
- Barkhausen J, Goyen M, von Winterfeld F, Lauenstein T, Arweiler-Harbeck D, Debatin JF. Visualization of swallowing using real-time TrueFISP MR fluoroscopy. Eur Radiol 2002;12:129–33.
- Ramsey DJC, Smithard DG, Kalra L. Early assessments of dysphagia and aspiration risk in acute stroke patients. Stroke J Cereb Circ 2003;34:1252–7.
- Pikus L, Levine MS, Yang YX, Rubesin SE, Katzka DA, Laufer I, et al. Videofluoroscopic studies of swallowing dysfunction and the relative risk of pneumonia. AJR Am J Roentgenol 2003;180:1613–6.
- Perlman AL, Witthawaskul W. Real-time remote telefluoroscopic assessment of patients with dysphagia. Dysphagia 2002;17:162–7.
- Omari TI, Dejaeger E, van Beckevoort D, Goeleven A, Davidson GP, Dent J, et al. A method to objectively assess swallow function in adults with suspected aspiration. Gastroenterology 2011;140:1454–63.
- Chang YC, Chen SY, Lui LT, Wang TG, Wang TC, Hsiao TY, et al. Dysphagia in patients with nasopharyngeal cancer after radiation therapy: a videofluoroscopic swallowing study. Dysphagia 2003;18:135–43.
- Katz PO, Knuff TE, Benjamin SB, Castell DO. Abnormal esophageal pressures in reflux esophagitis: cause or effect? Am J Gastroenterol 1986;81:744–6.
- Spechler SJ. AGA technical review on treatment of patients with dysphagia caused by benign disorders of the distal esophagus. Gastroenterology 1999;117:233–54.
- Ott DJ. Radiographic techniques and efficacy in evaluating esophageal dysphagia. Dysphagia 1990;5:192–203.
- Cichero J, Nicholson T, Dodrill P. Liquid barium is not representative of infant formula: characterisation of rheological and material properties. Dysphagia 2011;26:264–71.
- Gisel E. Interventions and outcomes for children with dysphagia. Dev Disabil Res Rev 2008;14:165–73.
- Wilkinson TJ, Thomas K, MacGregor S, Tillard G, Wyles C, Sainsbury R. Tolerance of early diet textures as indicators of recovery from dysphagia after stroke. Dysphagia 2002;17:227–32.
- Pelletier CA, Lawless HT. Effect of citric acid and citric acid-sucrose mixtures on swallowing in neurogenic oropharyngeal dysphagia. Dysphagia 2003;18:231–41.
- Marik PE, Kaplan D. Aspiration pneumonia and dysphagia in the elderly. Chest 2003;124:328–36.
- Ickenstein GW, Kelly PJ, Furie KL, Ambrosi D, Rallis N, Goldstein R, et al. Predictors of feeding gastrostomy tube removal in stroke patients with dysphagia. J Stroke Cerebrovasc Dis 2003;12:169–74.
- Gervais M, Dorion D. Quality of life following surgical treatment of oculopharyngeal syndrome. J Otolaryngol 2003;32:1–5.
- Mann NS. Single dilation of symptomatic Schatzki ring with a large dilator is safe and effective. Am J Gastroenterol 2001;96:3448–9.
- Dumon JF, Meric B, Sivak MV, Fleischer D. A new method of esophageal dilation using Savary-Gilliard bougies. Gastrointest Endosc 1985;31:379–82.
- Pouderoux P, Verdier E, Courtial P, Bapin C, Deixonne B, Balmès JL. Relapsing cardial stenosis after laparoscopic nissen treated by esophageal stenting. Dysphagia 2003;18:218–22.
- Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:1066–78.
- Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
- Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
- Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
- Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
- Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
















