1. Introdução
A disfagia pode ser descrita como a dificuldade de iniciar a deglutição (geralmente denominada disfagia orofaríngea) ou a sensação de que alimentos sólidos e/ou líquidos estão retidos na transição da boca para o estômago (geralmente denominada disfagia esofágica). Disfagia, portanto, é a percepção de que há impossibilidade de passagem normal do material deglutido. Estes pacientes podem apresentar um sintoma especial intermitente: a impactação alimentar [1].
A deglutição orofaríngea é um processo controlado pelo centro de deglutição na medula oblonga e pelo esôfago médio e distal por um reflexo peristáltico praticamente autônomo e coordenado pelo sistema nervoso entérico. A Tabela 1 ilustra os mecanismos fisiológicos envolvidos nas fases da deglutição.
Tabela 1 Mecanismos fisiológicos envolvidos na deglutição, por fase

É fundamental determinar se a disfagia é orofaríngea ou esofágica. Essa decisão deve ser feita com segurança e baseada em anamnese cuidadosa, que permite a classificação adequada do tipo de disfagia (orofaríngea vs. esofágica) em cerca de 80-85% dos casos [2]. Não é possível fazer uma localização mais precisa de modo seguro. A seguir, os pontos chave a considerar na história clínica:
- Localização
- Tipos de alimentos e/ou líquidos
- Progressivo ou intermitente
- Duração dos sintomas
Apesar da frequente ocorrência simultânea, é importante excluir a odinofagia (deglutição dolorosa). Finalmente, o diagnóstico diferencial baseado em sintomas deve excluir o globus faríngeo (sensação de "bola na garganta"), pressão torácica, dispneia e fagofobia (medo de engolir).
1.1 Causas de disfagia
No estabelecimento do diagnóstico etiológico da disfagia, é útil seguir a mesma classificação adotada para a avaliação dos sintomas, ou seja, distinguir entre as causas que afetam principalmente a faringe e o esôfago proximal (disfagia orofaríngea ou "alta"), e as causas que afetam principalmente o corpo esofágico e a junção esofagogástrica (disfagia esofágica ou "baixa"). No entanto, muitas desordens se sobrepõem e podem produzir disfagia tanto orofaríngea quanto esofágica. É muito importante fazer uma anamnese detalhada, incluindo as medicações em uso, pois podem estar envolvidas na patogênese da disfagia.
Disfagia orofaríngea
Em pacientes jovens, a disfagia orofaríngea é mais frequentemente causada por doenças musculares inflamatórias, teias e anéis. Em pacientes mais velhos, é geralmente causada por doenças do sistema nervoso central, como acidente vascular cerebral, doença de Parkinson e demência. O envelhecimento normal pode provocar anomalias moderadas da motilidade esofagiana (raramente sintomáticas [3]). No paciente adulto, a disfagia não deve ser atribuída automaticamente ao processo normal de envelhecimento.
Geralmente é útil fazer uma diferenciação entre distúrbios mecânicos e de motilidade neuromuscular, como mostrada a seguir:
Causas mecânicas e obstrutivas:
- Infecções (ex. Abscessos retrofaríngeos)
- Tiromegalia
- Linfadenopatia
- Divertículo de Zenker
- Redução na complacência muscular (miosite, fibrose, barra cricofaríngea)
- Esofagite eosinófila
- Neoplasias de cabeça e pescoço e consequências (ex. Estenoses fibróticas duras) de intervenções cirúrgicas e/ou radioterapêuticas nesses tumores
- Osteófitos cervicais
- Neoplasias e malignidades orofaríngeas (raro).
Distúrbios neuromusculares:
- Doenças do sistema nervoso central como acidentes cerebrovasculares, doença de Parkinson, paralisia de nervo craniano ou bulbar (ex.: esclerose múltipla, doença do neurônio motor), esclerose lateral amiotrófica
- Distúrbios contráteis como como miastenia grave, distrofia muscular oculofaríngea, e outras
Nos primeiros 3 dias após o AVC, 42-67% dos pacientes apresenta disfagia orofaríngea, tornando o acidente vascular cerebral a principal causa de disfagia. Destes pacientes, 50% são aspirados e um terço desenvolve pneumonia que requer tratamento [4]. A intensidade da disfagia tende a estar diretamente relacionada à do AVC. Em pacientes com AVC, é fundamental fazer exames a fim de excluir disfagia para evitar eventos adversos decorrentes da aspiração e nutrição/hidratação inadequadas [5].
Até 50% dos pacientes com Parkinson manifestam alguns sintomas consistentes com disfagia orofaríngea e até 95% apresentam videoesofagografia anormal [6,7]. Pode ocorrer disfagia clinicamente significativa e de forma precoce na doença de Parkinson, mas é mais comum em fases posteriores.
Disfagia esofágica
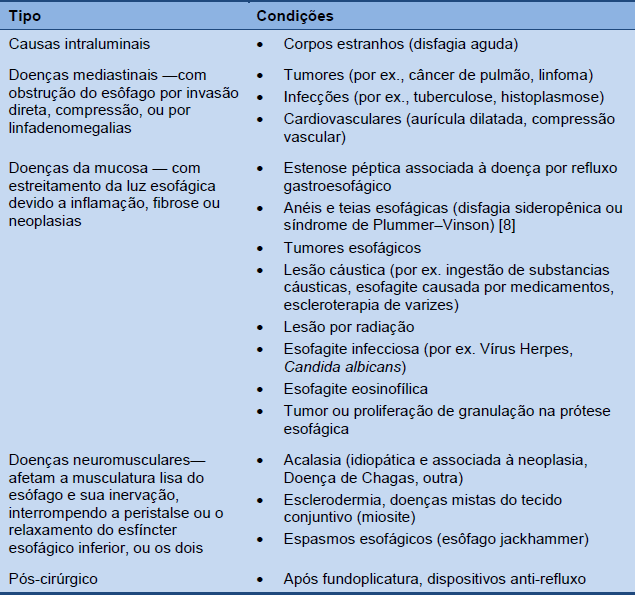
Tabela 2 Causas mais comuns de disfagia esofágica
1.2 Cascatas da WGO — diretrizes mundiais
Cascatas— abordagem segundo a disponibilidade de recursos
Uma abordagem padrão ouro só é viável se todas as opções de tratamento médico e testes diagnósticos estiverem disponíveis. Esses recursos para diagnose e manipulação da disfagia podem não estar suficientemente disponíveis em todos os países. As Diretrizes da Organização Mundial de Gastroenterologia (WGO) oferecem uma abordagem sensível aos recursos em forma de cascatas de diagnose e tratamento.
Uma cascata da WGO é um grupo hierárquico de diagnóstico, opções terapêuticas e de manipulação para administrar o risco e a doença, classificado de acordo com os recursos disponíveis.
Outras diretrizes disponíveis para o público
1.3 Carga da doença e epidemiologia
A disfagia é um problema frequente. Uma em cada grupo de 17 pessoas apresenta alguma forma de disfagia durante sua vida. Um estudo realizado no Reino Unido em 2011 descreve uma taxa de prevalência de disfagia de 11% na comunidade em geral [9]. A condição afeta 40–70% dos pacientes com AVC, 60–80% dos pacientes com doenças neurodegenerativas, até 13% dos adultos de 65 anos e > 51% dos pacientes idosos institucionalizados [10,11], bem como 60–75% dos pacientes submetidos a radioterapia por câncer de cabeça ou pescoço.
A carga desta doença está claramente descrita na resolução do congresso dos EUA em 2008 [12], onde se salienta que:
- A disfagia afeta 15 milhões de americanos; todos os americanos maiores de 60 vão apresentar disfagia em algum momento.
- O Centro de Controle de Prevenção de Doenças estima que cerca de 1 milhão de pessoas são diagnosticadas com disfagia, a cada ano, nos Estados Unidos.
- A Agência de Pesquisa e Qualidade em Serviços de Saúde (Agency for Healthcare Research and Quality) estima que anualmente morrem 60.000 americanos por complicações de disfagia.
- As complicações da disfagia aumentam os custos de saúde como resultado de readmissões hospitalares, atendimentos de urgência, estadias hospitalares prolongadas, necessidade de internação em instituições de cuidados a longo prazo, e necessidade de suporte respiratório e nutricional dispendiosos.
- O custo anual do sistema de saúde para a disfagia, incluindo os gastos com hospitais, é superior a US$ 1 bilhão.
- A disfagia é uma patologia muito subestimada e mal-entendida em geral.
É difícil fornecer dados epidemiológicos a nível mundial, pois a prevalência da maioria das doenças que causam disfagia tende a diferir entre as diferentes regiões e continentes. Portanto, só podem ser feitas aproximações em escala global. As taxas de prevalência variam dependendo da idade dos pacientes, e deve ser lembrado que o tipo de patologia que leva à disfagia em pediatria difere daquele das patologias dos grupos de maior idade. Em pacientes mais jovens, a disfagia está frequentemente relacionada a lesões de cabeça e pescoço por acidentes, ou câncer de boca e garganta. A disfagia ocorre em todas as faixas etárias, mas sua prevalência aumenta com a idade.
A prevalência de tumores difere entre os países. Por exemplo, enquanto nos Estados Unidos e na Europa o adenocarcinoma é o tipo mais frequente de câncer esofágico, na Índia e na China a patologia mais frequente é o carcinoma de células escamosas. Também, estenoses cáusticas do esôfago (ingestão de agentes corrosivos com intenção suicida) e tuberculose podem ser importantes em sociedades não ocidentais.
Notas regionais
- América do Norte/EUA:
- As taxas de estenose por refluxo têm diminuído nos Estados Unidos a partir da aparição e ampla difusão dos inibidores da bomba de prótons [13].
- A esofagite eosinofílica é cada vez mais reconhecida como uma importante causa de disfagia tanto em crianças quanto em adultos [13].
- Apesar dos números absolutos de pacientes diagnosticados com câncer esofágico nos Estados Unidos serem baixos, a incidência deste tipo de câncer está aumentando.
- Com o crescimento da população de pacientes idosos nos Estados Unidos, a compressão pelos osteófitos cervicais, os acidentes cerebrovasculares e outros distúrbios neurológicos estão se tornando mais importantes como causas de disfagia do que no passado.
- É provável que o uso difundido de tratamentos ablativos para esôfago de Barrett (ablação por radiofrequência, terapia fotodinâmica e ressecção endoscópica da mucosa) conduza a um novo grupo de pacientes com estenose causada por endoterapia.
- Europa/Países de ocidente:
- Apesar da doença por refluxo gastroesofágico (DRGE) e as estenoses pépticas terem diminuído como causas de disfagia esofágica, o adenocarcinoma de esôfago e a esofagite eosinofílica estão aumentando [14–16].
- Ásia [17,18]:
- O carcinoma espinocelular esofágico, a acalasia, e a estenose pós-operatória são causas comuns de disfagia de origem esofágico. A prevalência da DRGE parece estar aumentando, mas comparado com os países de ocidente, a DRGE segue sendo prevalente na Ásia. A disfagia pós-AVC é bastante comum na Ásia, e graças às melhorias na atenção à saúde, está gradualmente sendo reconhecida e tratada cada vez mais cedo.
- América Latina:
- A doença de Chagas tem uma alta prevalência em diferentes partes da América Latina. Pode causar acalasia e megaesôfago chagásico que levam à desnutrição. Acalasia chagásica e acalasia idiopática possuem características diferentes. A pressão do esfíncter esofágico inferior tende a estar na faixa baixa, aparentemente por dano nos mecanismos de controle tanto excitatórios como inibitórios. Apesar das diferenças, os tratamentos médicos e cirúrgicos são similares [19].
- África:
- Na África, o tratamento da disfagia pós AVC pode não ser o melhor devido à falta de recursos ou má administração dos recursos disponíveis. A falta de professionais da saúde com boa formação pode contribuir para que os serviços não sejam o ideal. Existe também falta de unidades de atenção em indivíduos com AVC e a correspondente instrumentação— particularmente as instalações de imaginologia necessárias para aplicar o padrão ouro, o esofagograma de bário modificado [20].
2. Diagnóstico clínico
Uma boa anamnese que cubra os principais elementos diagnósticos é útil e ajuda frequentemente a estabelecer um diagnóstico com segurança. É importante estabelecer cuidadosamente a localização da sensação de distúrbio da deglutição para determinar se é disfagia orofaríngea ou esofágica.
2.1 Disfagia orofaríngea
Antecedentes clínicos
A disfagia orofaríngea também pode ser denominada disfagia "alta", e se refere ao compromisso oral ou faríngeo. Os pacientes têm dificuldade de iniciar a deglutição, e geralmente identificam a área cervical como a origem do problema.
Nos pacientes neurológicos, a disfagia orofaríngea é uma afecção comórbida altamente prevalente e com consequências adversas à saúde como desidratação, desnutrição, pneumonia, inclusive a morte. Os distúrbios da deglutição podem causar ansiedade e medo, que pode levar os pacientes a evitar a ingestão oral— provocando assim desnutrição, depressão e isolamento.
Sintomas frequentemente associados:
- Dificuldade em iniciar a deglutição, deglutição repetitiva
- Regurgitação nasal
- Tosse
- Fala anasalada
- Baba
- Redução no reflexo de tosse
- Engasgo (n.b.: a penetração e aspiração laríngeas podem ocorrer sem engasgo com sufocação/tosse concomitantes)
- Disartria e diplopia (podem acompanhar patologias neurológicas que causam disfagia orofaríngea)
- Halitose em pacientes com divertículo de Zenker contendo resíduos alimentares ou em pacientes com acalasia severa e obstrução crônica, com acúmulo de resíduos em decomposição na luz esofágica
- Pneumonias recorrentes
Há uma série de afecções neurológicas definidas acompanhando a disfagia orofaríngea e que permitem fazer um diagnóstico preciso:
- Hemiparesia pós AVC
- Ptose palpebral e fatigabilidade/fraqueza sugerindo miastenia grave
- Rigidez, tremor e disautonomia sugerindo doença de Parkinson
- Outras doenças neurológicas incluindo distonia cervical e compressão dos nervos cranianos, como hiperostose ou malformação de Arnold–Chiari (herniação do encéfalo posterior/ herniação de estruturas da base do cérebro posterior)
- Déficits específicos dos nervos cranianos envolvidos na deglutição também podem ajudar a identificar a origem do distúrbio orofaríngeo, e estabelecer um diagnóstico.
Testes
Diferentes testes podem ser considerados para avaliação da disfagia, dependendo das características do paciente, da severidade da doença e dos recursos disponíveis. Nas primeiras 24 horas após um AVC não deve ser iniciada dieta antes do paciente ser avaliado em busca de disfagia, pois um diagnóstico oportuno reduz três vezes o risco de complicações decorrentes da disfagia. Os pacientes com emagrecimento persistente e infecções torácicas recorrentes devem ser estudados de urgência [21].
A ASHA (American Speech-Language-Hearing Association) desenvolveu um teste de cabeceira para avaliação da deglutição; o modelo está disponível em http://www.speakingofspeech.info/medical/BedsideSwallowingEval.pdf. Esta ferramenta acessível oferece uma abordagem detalhada e estruturada dos mecanismos da disfagia orofaríngea e seu manejo, além de ser útil em regiões com recursos disponíveis limitados.
A seguir são apresentados os principais testes para avaliar a disfagia orofaríngea:
- Videofluoroscopia da deglutição ou “deglutograma de bário modificado”
- É considerado o padrão ouro para avaliar a disfagia orofaríngea [22–24].
- Durante a fluoroscopia a deglutição é registrada em vídeo, obtendo detalhes dos mecanismos de deglutição do paciente.
- Também pode ajudar a predizer o risco de pneumonia aspirativa [25].
- As técnicas videofluoroscópicas permitem reduzir a velocidade de observação, mostrar quadro por quadro e ser transmitidas pela internet, facilitando a leitura interpretativa em áreas remotas [26].
- Endoscopia alta
- A nasoendoscopia é considerada padrão ouro para avaliação das causas estruturais de disfagia [22–24] — por ex. lesões de orofaringe— e inspeção das secreções ou partículas de alimentos.
- Não é um método sensível para detectar uma função de deglutição anormal.
- Quando comparada à videofluoroscopia não chega a identificar a aspiração em 20–40% dos casos, devido a ausência do reflexo de tosse
- Videoendoscopia da deglutição (FEES, por sua sigla em inglês)
- A FEES é uma técnica endoscópica modificada que consiste em visualizar as estruturas laríngeas e faríngeas através de um endoscópio flexível transnasal enquanto o paciente recebe bolos alimentares e líquidos.
- Manometria faringoesofágica de alta resolução
- Consiste na avaliação quantitativa da pressão e sincronização da contração da faringe e do relaxamento do esfíncter esofágico superior.
- Pode ser utilizada com videofluoroscopia para avaliar melhor o movimento e pressões envolvidas.
- Pode ter um certo valor nos pacientes com disfagia orofaríngea apesar de estudo com bário convencional negativo.
- Pode ser útil quando a miotomia está sendo considerada.
- Manometria de alta resolução com impedância (MAR) [27]
- Consiste na combinação de impedância e manometria de alta resolução.
- As variáveis pressão/fluxo decorrentes da análise automática de medições combinadas de manometria e impedância oferecem informação valiosa para o diagnóstico.
- Quando combinadas para pontuação do índice de risco de deglutição (SRI) estas medições são um forte preditor de aspiração.
- Teste da deglutição cronometrada de água
- Teste de rastreamento básico e de preço acessível que pode ser útil se considerado junto com a história clínica e o exame físico.
- Consiste na ingestão de um copo de 150 ml de agua pelo paciente o mais rápido possível, enquanto o examinador registra o tempo que ele demora e a quantidade de deglutições. A partir destes dados é possível calcular a velocidade e o volume médio por deglutição. O teste tem sensibilidade preditiva > 95% para identificar a presença de disfagia, e pode ser complementado por um teste de deglutição de alimentos colocando uma pequena quantidade de pudim no dorso da língua [28].
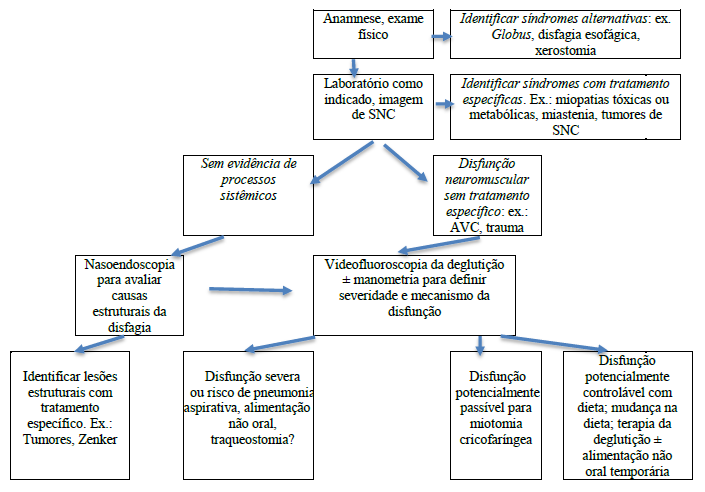
O algoritmo que aparece na Fig. 1 indica os testes e procedimentos mais sofisticados necessários na investigação diagnóstica em busca de terapias específicas.
Fig. 1 Avaliação e manejo da disfagia orofaríngea
2.2 Disfagia esofágica
Diagnóstico diferencial
As condições mais comuns associadas à disfagia esofágica são:
- Estenose péptica — ocorre em 10% dos pacientes com DRGE [29,30], mas a incidência diminui com o uso de inibidores da bomba de prótons
- Neoplasia de esôfago — inclui neoplasia de cárdia e pseudoacalasia
- Teias e anéis esofágicos
- Acalasia, que inclui outros distúrbios primários e secundários da motilidade esofágica
- Esclerodermia
- Distúrbios da motilidade espástica
- Disfagia funcional
- Lesão por radiação
Causas infrequentes:
- Esofagite linfocítica
- Anomalias cardiovasculares
- Envolvimento esofágico da doença de Crohn
- Lesão cáustica
História clínica
A disfagia esofágica também pode ser denominada disfagia "baixa", referindo-se a uma provável localização no esôfago distal, — mas deve-se destacar que pacientes com disfagia esofágica tais como acalasia, podem localizar disfagia na região cervical, como se fosse disfagia orofaríngea.
- A disfagia que ocorre igual para sólidos e líquidos geralmente reflete dismotilidade esofágica. Esta suspeita é reforçada quando a disfagia intermitente para sólidos e líquidos estiver acompanhada de dor torácica.
- A disfagia que ocorre somente para sólidos, mas nunca para líquidos, sugere a possibilidade de obstrução mecânica, com estenose luminal para diâmetro < 15 mm. Se a disfagia é progressiva, deve-se considerar especialmente a hipótese de estenose péptica ou carcinoma. Vale a pena salientar que os pacientes com estenose péptica costumam ter sintomas de longa data como pirose e regurgitação, mas sem perda de peso. Pelo contrário, os pacientes com câncer esofágico tendem a ser mais velhos, do sexo masculino, com emagrecimento acentuado.
- Em caso de disfagia intermitente com impactação alimentar, especialmente em homens jovens, deve-se suspeitar esofagite eosinofílica.
O exame físico de pacientes com disfagia esofágica geralmente tem um valor limitado, mas os pacientes com câncer esofágico podem apresentar linfadenopatia cervical/supraclavicular palpável. Alguns pacientes com esclerodermia e estenose péptica secundária também podem apresentar síndrome CREST – por suas siglas em inglês - (calcinose, doença de Raynaud, dismotilidade esofágica, esclerodactilia e telangiectasia).
A halitose é um sinal muito inespecífico que pode sugerir acalasia avançada ou obstrução de longa data, com lento acúmulo de resíduos em decomposição no esôfago.
A história clínica é a base da avaliação e deve ser considerada em primeiro lugar. Uma grande preocupação com a disfagia esofágica é excluir a neoplasia maligna. A história do paciente pode fornecer algumas pistas. A neoplasia maligna é provável se observar:
- Duração curta – menos de 4 meses
- Avanço da doença
- Disfagia mais para sólidos do que para líquidos
- Perda de peso
Acalasia é mais provável se:
- A disfagia é tanto para sólidos quanto para líquidos. A disfagia para líquidos sugere fortemente o diagnóstico.
- Há regurgitação noturna passiva de mucus ou alimentos.
- O problema existe há vários meses ou anos.
- O paciente adota outras medidas para facilitar a passagem dos alimentos, como beber líquido ou mudar a posição do corpo.
Esofagite eosinofílica é mais provável se houver:
- Disfagia intermitente associada a impactação alimentar ocasional.
Testes
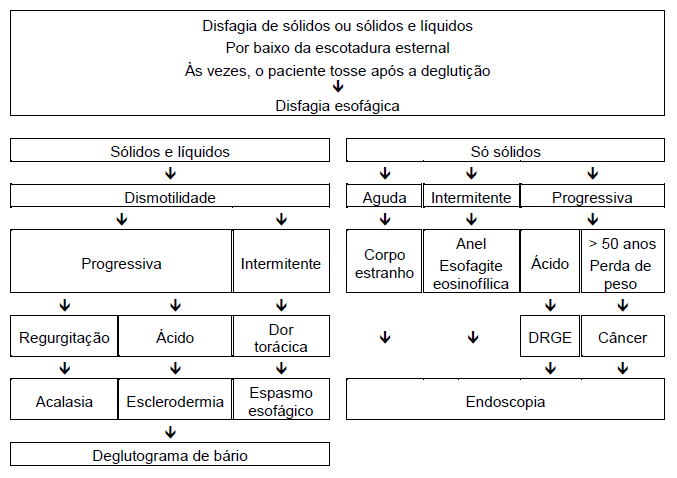
A história clínica constitui a base do teste inicial. Os pacientes geralmente devem ser prontamente encaminhados à endoscopia precoce. O algoritmo na Fig. 2 resume o processo de tomada de decisão sobre qual deve ser empregado como teste inicial, se a endoscopia ou o esofagograma baritado.
- Avaliação endoscópica:
- A endoscopia usa um videoendoscópio (a maior parte dos fibroscópios foram substituídos por endoscópios eletrônicos ou videoendoscópios) introduzido pela boca até o estômago, que observa de forma detalhada o trato gastrointestinal
- Se disponível, a videoendoscopia de alta resolução pode ser usada para detectar mudanças sutis, como as típicas placas esbranquiçadas da esofagite eosinofílica.
- É muito importante introduzir o endoscópio na cavidade gástrica para excluir uma pseudoacalasia por tumor da junção esofagogástrica.
- A endoscopia permite obter amostras de tecido e realizar intervenções terapêuticas.
- A ultrassonografia endoscópica (UE) é útil em alguns casos de obstrução do trato de saída.
- Esofagograma contrastado baritado (deglutograma de bário):
- O esofagograma baritado, realizado com o paciente em posição supina e em bipedestação, pode mostrar irregularidades na luz esofágica e identificar a maioria dos casos de obstrução, teias e anéis.
- O exame com bário da orofaringe e esôfago durante a deglutição é o teste inicial mais útil nos pacientes com antecedentes ou características clínicas que sugerem uma lesão do esôfago proximal. Em mãos experientes, pode chegar a ser mais sensível e seguro do que a endoscopia alta.
- Também pode ajudar a detectar acalasia e espasmo esofágico difuso, apesar dessas condições serem diagnosticadas de maneira mais definitiva pela manometria.
- Pode ser útil incluir um tablete de bário para identificar as estenoses sutis. O teste também pode ajudar em pacientes disfágicos com endoscopia negativa se adicionar o tablete.
- Se houver suspeita de obstrução mecânica sutil apesar da endoscopia alta ser negativa, pode ser útil fazer uma avaliação radiográfica de coluna total [31].
- O esofagograma baritado cronometrado é muito útil na avaliação de acalasia antes e depois do tratamento.
- Manometria esofágica:
- Este método diagnóstico é baseado no registro da pressão da luz esofágica usando técnicas de estado sólido ou de perfusão.
- A manometria está indicada quando se suspeita de causa esofágica de disfagia após esofagograma de bário e endoscopia inconclusivas e tratamento anti-refluxo adequado, se confirmada a cicatrização da esofagite endoscopicamente.
- As três principais causas de disfagia que podem ser diagnosticadas usando manometria esofágica são acalasia, esclerodermia e espasmo esofágico.
- Manometria esofágica de alta resolução (MAR) com topografia da pressão esofágica (TPE):
- Comumente utilizada na avaliação dos distúrbios da motilidade esofágica.
- Instrumento baseado no registro simultâneo da pressão através de cateteres com 36 sensores longitudinais e radiais que permitem a leitura da pressão nos esfíncteres e corpo esofágico, e que utiliza um formato de diagramação tridimensional para descrever os resultados do exame (TPE).
- O esquema algorítmico diagnóstico da Classificação de Chicago (CC) oferece uma categorização hierárquica dos distúrbios da motilidade esofágica. A CC tem esclarecido o diagnóstico de acalasia e de espasmo esofágico distal.
- Cintilografia estudo do trânsito esofágico com radionuclídeos:
- O paciente ingere um líquido radiomarcado (por exemplo, água misturada com coloide de enxofre tecnécio Tc 99m ou alimento radiomarcado) para medir a radiatividade no interior do esôfago.
- Pacientes com distúrbios da motilidade esofágica têm depuração lentificada do radiofármaco do esôfago. Portanto, deve-se suspeitar anomalias da motilidade em pacientes com endoscopia negativa e duração do trânsito anormal.
- A cintilografia esofágica oferece pouca informação adicional quando usados testes com bário ou impedância MAR.
Fig. 2 Avaliação e manejo da disfagia esofágica
2.3 Cascatas diagnósticas
As Tabelas 3 e 4 oferecem opções diagnósticas alternativas para situações com recursos limitados, recursos médios, ou “de última geração”.
Tabela 3 Cascata: opções diagnósticas para disfagia orofaríngea

TC, tomografia computadorizada; PET, tomografia de emissão de pósitrons.
Tabela 4 Cascata: opções diagnósticas para disfagia esofágica

TC, tomografia computadorizada; PET, tomografia de emissão de pósitrons.
3. Opções de tratamento
3.1 Disfagia orofaríngea
O objetivo do tratamento é melhorar a passagem de alimentos e bebidas e evitar a aspiração. A causa da disfagia é um fator importante na escolha da abordagem.
Tabela 5 Disfagia orofaríngea: causas e abordagem do tratamento

O manejo das complicações é de crucial importância. Nesse sentido, é fundamental identificar o risco de aspiração quando se discute as opções de tratamento. O tratamento da disfagia em pacientes com AVC recebendo reabilitação ativa deve ser oferecido na medida do tolerado. Os remédios simples podem ser importantes — por ex.: uso de prótese dentária para solucionar seus problemas de dentes, modificações na textura dos líquidos [32] e alimentos [33], ou alteração do volume do bolo alimentar.
- Reabilitação e reeducação da deglutição:
- São sugeridas modificações na postura, nutrição e comportamento.
- Manobras relativamente simples durante a deglutição podem reduzir a disfagia orofaríngea.
- Treinamento da deglutição com especialista em distúrbios da deglutição.
- Várias técnicas de terapia da deglutição foram desenvolvidas para melhorar as alterações da deglutição. Incluem exercícios de fortalecimento e biofeedback.
- Modificações nutricionais e dietéticas:
- Alimentos moles, possivelmente combinados com medidas de correção postural, melhoram os resultados.
- Sempre que possível, a alimentação oral é a melhor opção. Modificar a consistência dos alimentos (espessar os líquidos) e oferecer alimentos moles pode fazer uma grande diferença [34].
- Deve-se ter cuidado de controlar as necessidades nutricionais e de líquidos (considerando o risco de desidratação).
- A adição de ácido cítrico nos alimentos melhora os reflexos da deglutição, possivelmente devido ao aumento a estimulação gustativa e trigeminal [35].
- O tratamento adjuvante com inibidor da enzima conversora da angiotensina para facilitar o reflexo da tosse também pode ser útil [36].
- Apoio nutricional alternativo:
- Se houver alto risco de aspiração, ou se a ingestão oral for insuficiente para manter um estado nutricional adequado, deve-se considerar a introdução de uma sonda de alimentação macia e tolerável guiada radiologicamente.
- A alimentação por gastrostomia após AVC reduz a taxa de mortalidade e melhora o estado nutricional em comparação com a sonda nasogástrica.
- A gastrostomia endoscópica percutânea consiste em introduzir uma sonda de gastrostomia no estômago por via abdominal percutânea guiada pelo endoscopista e, se disponível, preferir geralmente a gastrostomia cirúrgica.
- A probabilidade de perda por remoção da sonda de alimentação é menor em pacientes idosos com AVC bilateral, ou cuja video-fluoroscopia inicial mostrou aspiração [37].
- A alimentação por sonda jejunal deve ser utilizada em pacientes críticos, deixando a alimentação por gastrostomia percutânea ou sonda de jejunostomia para as patologias crónicas.
- Os tratamentos cirúrgicos dirigidos a aliviar as causas espásticas da disfagia, como a miotomia cricofaríngea, têm dado bons resultados em até 60% dos casos, mas seu uso segue sendo controverso [38]. Por outro lado, a cirurgia aberta e a miotomia endoscópica nos pacientes com divertículo de Zenker estão bem consolidadas.
3.2 Disfagia esofágica
A disfagia aguda requer avaliação e intervenção imediatas. A impactação alimentar é a causa mais comum nos adultos. Pode haver um componente subjacente de obstrução mecânica. Após remoção do bolo alimentar impactado, observa-se melhora imediata. Deve-se ter cuidado para evitar perfuração ao tentar puxar o corpo estranho para baixo.
A Tabela 6 fornece uma lista de opções para o manejo da disfagia esofágica.
Tabela 6 Opções de manejo da disfagia esofágica
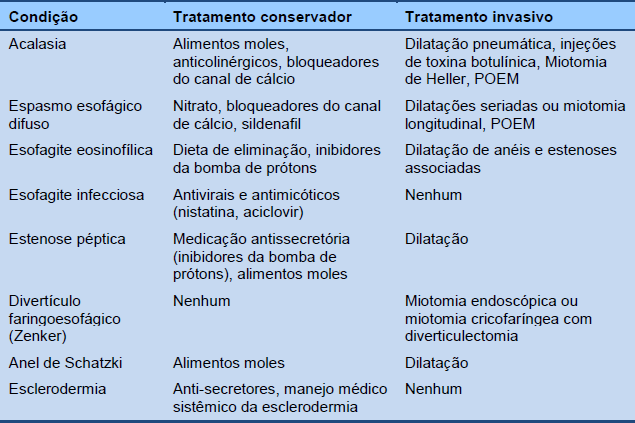
POEM, (pelas siglas em inglês) miotomia endoscópica peroral
Estenoses esofágicas pépticas
A estenose péptica é geralmente o resultado de doença do refluxo gastroesofágico (DRGE), mas também pode ser causada por medicação. O diagnóstico diferencial deve excluir:
- Estenose cáustica após ingestão de substâncias ou produtos químicos corrosivos
- Estenose induzida por drogas
- Estenose pós-operatória
- Estenose fúngica
- Esofagite eosinofílica
Após confirmada a estenose por via endoscópica, a dilatação progressiva [39,40] com vela de Savary constitui o tratamento escolhido. A dilatação com balão seria uma alternativa, mas pode chegar a ser mais arriscado.
- O tratamento anti-refluxo agressivo com inibidores da bomba de prótons — como omeprazol 20 mg 2 vezes por dia ou equivalente — ou fundoplicatura melhora a disfagia e reduz a necessidade de dilatações subsequentes em pacientes com estenose esofágicas pépticas. Alguns pacientes podem precisar de doses mais altas.
- Em pacientes com persistência ou recidiva da disfagia após tratamento inicial com dilatação e tratamento anti-refluxo, a cicatrização da esofagite de refluxo deve ser confirmada por endoscopia antes de repetir a dilatação.
- Assim que estiver curada a esofagite por refluxo, a necessidade de mais dilatações subsequentes será avaliada empiricamente.
- Pacientes que apresentam alivio passageiro da disfagia após a dilatação podem ser ensinados à técnica da autodilatação com vela.
- Para a estenose refratária, as opções terapêuticas incluem a injeção intralesional de corticoides antes da dilatação, e a incisão eletrocirúrgica endoscópica.
- Em raras ocasiões, a estenose verdadeiramente refratária pode requerer ressecção e reconstrução do esôfago.
- Excepcionalmente pode ser indicado fazer uma prótese endoluminal em pacientes com estenoses benignas [41]. O risco de perfuração é de cerca de 0,5% e nessas condições existe um alto índice de migração da prótese.
- A cirurgia é geralmente indicada se houver perfuração franca, mas métodos endoscópicos para fechamento das feridas estão sendo desenvolvidos.
Tratamento dos anéis mucosos do esôfago inferior (incluindo anel de Schatzki)
- A terapia de dilatação dos anéis mucosos do esôfago inferior consiste em passar uma única vela grande (45–60 Fr) ou fazer uma dilatação com balão (18–20 mm) para fraturar os anéis (e não simplesmente estirá-los).
- Após uma dilatação abrupta, toda esofagite por refluxo associada é tratada agressivamente com altas doses de inibidores da bomba de prótons.
- A necessidade de dilatações subsequentes é determinada empiricamente. No entanto, a recidiva da disfagia é possível, e os pacientes devem saber que provavelmente seja necessária uma nova dilatação. Nesses casos a mucosa esofágica deve ser biopsiada para avaliar possível esofagite eosinofílica.
- A manometria esofágica é recomendada em pacientes com persistência ou recidiva precoce da disfagia apesar da dilatação e terapia anti-refluxo adequadas.
- Em pacientes com distúrbio da motilidade tratável como acalasia, a terapia está dirigida à dismotilidade.
- Se não for encontrado distúrbio de motilidade tratável, repetir a endoscopia para confirmar se houve cura da esofagite e rompimento do anel.
- Em pacientes com anéis persistentes é justificado fazer outra tentativa de dilatação.
- Em pacientes com anéis refratários que não responderam à dilatação com velas e balões normais, podem ser tentados incisão eletrocirúrgica endoscópica e exérese cirúrgica. Estes tratamentos são raramente necessários em pacientes com anéis de mucosa do esôfago inferior, e somente após ter excluído outras causas de disfagia.
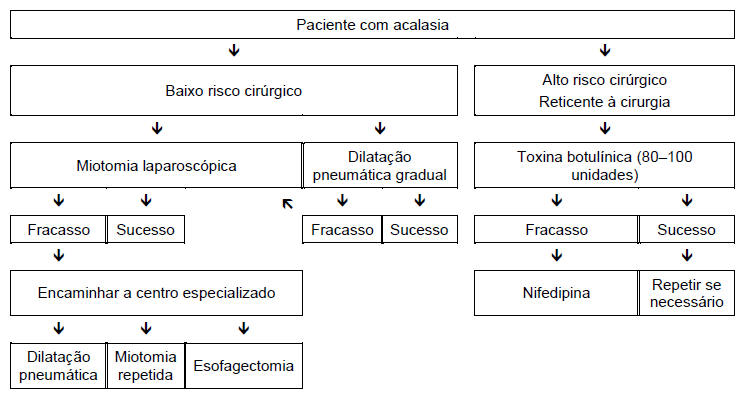
Acalasia
- A possibilidade de pseudoacalasia deve ser excluída (idade avançada, emagrecimento rápido e severo) ou doença de Chagas.
- O manejo da acalasia depende principalmente do risco cirúrgico.
- O tratamento médico com nitratos ou bloqueadores do canal de cálcio é frequentemente ineficaz ou mal tolerado.
- A injeção de toxina botulínica é indicada como tratamento inicial em pacientes com risco cirúrgico, se o médico considerar que a dilatação por velas e a medicação são mal toleradas. A injeção de toxina botulínica parece ser um procedimento seguro que pode induzir remissão clínica durante pelo menos 6 meses em cerca de 2/3 dos pacientes com acalasia. No entanto, a maioria dos pacientes precisa repetir as injeções para manter a remissão. Os resultados a longo prazo deste tratamento têm sido decepcionantes, e alguns cirurgiões sentem que a cirurgia se torna mais difícil devido às cicatrizes que podem provocar as injeções.
- Quando houver insucesso destes tratamentos, médico e paciente devem decidir se os benefícios potenciais da dilatação pneumática ou da miotomia superam os riscos substanciais que esses procedimentos podem constituir em pacientes idosos ou enfraquecidos.
- Em pacientes com opção de cirurgia, a maioria dos gastroenterologistas começa com dilatação pneumática endoscópica e optam por miotomia laparoscópica tipo Heller quando não respondem a duas ou três dilatações pneumáticas graduais (com balões de 30 mm, 35 mm e 40 mm). Alguns gastroenterologistas preferem optar diretamente pela cirurgia sem teste prévio de dilatação pneumática, ou limitam o diâmetro dos dilatadores pneumáticos que utilizam a 30–35 mm.
- A miotomia endoscópica peroral (POEM) está surgindo como alternativa tanto para dilatação pneumática quanto para miotomia de Heller.
- Se estes tratamentos falharem, especialmente em pacientes em fase descompensada, pode ser requerida esofagectomia.
- A gastrostomia para alimentação é uma alternativa à dilatação pneumática ou miotomia, mas muitos pacientes sem dano neurológico consideram que a vida com uma gastrostomia é inaceitável.
Fig. 3 Opções de manejo nos pacientes com acalasia
Esofagite eosinofílica
- A esofagite eosinofílica é uma inflamação do esôfago provocada por alérgeno [42].
- O diagnóstico se baseia no exame histológico de biopsias da mucosa do esôfago superior e inferior após tratamento inicial com inibidores da bomba de prótons durante 6–8 semanas. Aproximadamente 1/3 dos pacientes com suspeita de esofagite eosinofílica alcançam a remissão após tratamento inicial com inibidores da bomba de prótons [43].
- A identificação do alérgeno alimentar ou do aeroalérgeno é importante para a orientação dietética.
- Se não for identificado nenhum alérgeno específic,o pode-se tentar a dieta de exclusão dos seis alimentos.
- As recomendações normativas para tratamento farmacológico da esofagite eosinofílica incluem corticoides tópicos e antagonistas de leucotrienos [44,45].
- A dilatação esofágica dos pacientes com estenoses e anéis associados é segura (com taxa de perfurações verdadeiras menor de 1%) e eficaz (a disfagia melhora em 1–2 anos em mais de 90% dos casos) [46,47].
3.3 Cascatas de manejo
As Tabelas 7–9 apresentam as opções de manejo alternativas para situações com recursos limitados, recursos médios, ou recursos de “última geração”.
Tabela 7 Cascata: opções de manejo da disfagia orofaríngea

Tabela 8 Cascata: opções de manejo da disfagia esofágica

IBP, inibidor da bomba de prótons.
Tabela 9 Cascata: opções de manejo da acalasia

4. Referências
Referências gerais
Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
Lista de referências
- Ginsberg GG. Food bolus impaction. Gastroenterol Hepatol 2007;3:85–6.
- Hila A, Castell D. Upper gastrointestinal disorders. In: Hazzard W, Blass J, Halter J, Ouslander J, Tinetti ME, editors. Principles of geriatric medicine and gerontology. 5th ed. New York: McGraw-Hill Professional; 2003: 613–40.
- Shamburek RD, Farrar JT. Disorders of the digestive system in the elderly. N Engl J Med 1990;322:438–43.
- Hinchey JA, Shephard T, Furie K, Smith D, Wang D, Tonn S, et al. Formal dysphagia screening protocols prevent pneumonia. Stroke J Cereb Circ 2005;36:1972–6.
- Donovan NJ, Daniels SK, Edmiaston J, Weinhardt J, Summers D, Mitchell PH, et al. Dysphagia screening: state of the art: invitational conference proceeding from the State-of-the-Art Nursing Symposium, International Stroke Conference 2012. Stroke J Cereb Circ 2013;44:e24–31.
- Kalf JG, de Swart BJM, Bloem BR, Munneke M. Prevalence of oropharyngeal dysphagia in Parkinson’s disease: a meta-analysis. Parkinsonism Relat Disord 2012;18:311–5.
- Nicaretta DH, Rosso AL, Mattos JP de, Maliska C, Costa MMB. Dysphagia and sialorrhea: the relationship to Parkinson’s disease. Arq Gastroenterol 2013;50:42–9.
- Atmatzidis K, Papaziogas B, Pavlidis T, Mirelis C, Papaziogas T. Plummer–Vinson syndrome. Dis Esophagus 2003;16:154–7.
- Holland G, Jayasekeran V, Pendleton N, Horan M, Jones M, Hamdy S. Prevalence and symptom profiling of oropharyngeal dysphagia in a community dwelling of an elderly population: a selfreporting questionnaire survey. Dis Esophagus 2011;24:476–80.
- Turley R, Cohen S. Impact of voice and swallowing problems in the elderly. Otolaryngol Head Neck Surg 2009;140:33–6.
- Lin LC, Wu SC, Chen HS, Wang TG, Chen MY. Prevalence of impaired swallowing in institutionalized older people in Taiwan. J Am Geriatr Soc 2002;50:1118–23.
- United States. Congress. House. Resolution expressing the sense of the Congress that a National Dysphagia Awareness Month should be established. 110th Congress. 2nd session. H. Con. Res. 195 (2008). Washington, DC: United States Government Printing Office, 2008. Available at: http://thomas.loc.gov/cgi-bin/query/z?c110:H.CON.RES.195:.
- Kidambi T, Toto E, Ho N, Taft T, Hirano I. Temporal trends in the relative prevalence of dysphagia etiologies from 1999–2009. World J Gastroenterol 2012;18:4335–41.
- Rutegård M, Lagergren P, Nordenstedt H, Lagergren J. Oesophageal adenocarcinoma: the new epidemic in men? Maturitas 2011;69:244–8.
- Ronkainen J, Talley NJ, Aro P, Storskrubb T, Johansson SE, Lind T, et al. Prevalence of oesophageal eosinophils and eosinophilic oesophagitis in adults: the population-based Kalixanda study. Gut 2007;56:615–20.
- Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen M, et al. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol 2011;128:1349–50.
- Zhang HZ, Jin GF, Shen HB. Epidemiologic differences in esophageal cancer between Asian and Western populations. Chin J Cancer 2012;31:281–6.
- Ronkainen J, Agréus L. Epidemiology of reflux symptoms and GORD. Best Pract Res Clin Gastroenterol 2013;27:325–37.
- Matsuda NM, Miller SM, Evora PRB. The chronic gastrointestinal manifestations of Chagas disease. Clinics (São Paulo, Brazil) 2009;64:1219–24.
- Blackwell Z, Littlejohns P. A review of the management of dysphagia: a South African perspective. J Neurosci Nurs 2010;42:61–70.
- National Stroke Foundation. Clinical guidelines for stroke management 2010. Melbourne: National Stroke Foundation, 2010: 78–95.
- Scharitzer M, Pokieser P, Schober E, Schima W, Eisenhuber E, Stadler A, et al. Morphological findings in dynamic swallowing studies of symptomatic patients. Eur Radiol 2002;12:1139–44.
- Barkhausen J, Goyen M, von Winterfeld F, Lauenstein T, Arweiler-Harbeck D, Debatin JF. Visualization of swallowing using real-time TrueFISP MR fluoroscopy. Eur Radiol 2002;12:129–33.
- Ramsey DJC, Smithard DG, Kalra L. Early assessments of dysphagia and aspiration risk in acute stroke patients. Stroke J Cereb Circ 2003;34:1252–7.
- Pikus L, Levine MS, Yang YX, Rubesin SE, Katzka DA, Laufer I, et al. Videofluoroscopic studies of swallowing dysfunction and the relative risk of pneumonia. AJR Am J Roentgenol 2003;180:1613–6.
- Perlman AL, Witthawaskul W. Real-time remote telefluoroscopic assessment of patients with dysphagia. Dysphagia 2002;17:162–7.
- Omari TI, Dejaeger E, van Beckevoort D, Goeleven A, Davidson GP, Dent J, et al. A method to objectively assess swallow function in adults with suspected aspiration. Gastroenterology 2011;140:1454–63.
- Chang YC, Chen SY, Lui LT, Wang TG, Wang TC, Hsiao TY, et al. Dysphagia in patients with nasopharyngeal cancer after radiation therapy: a videofluoroscopic swallowing study. Dysphagia 2003;18:135–43.
- Katz PO, Knuff TE, Benjamin SB, Castell DO. Abnormal esophageal pressures in reflux esophagitis: cause or effect? Am J Gastroenterol 1986;81:744–6.
- Spechler SJ. AGA technical review on treatment of patients with dysphagia caused by benign disorders of the distal esophagus. Gastroenterology 1999;117:233–54.
- Ott DJ. Radiographic techniques and efficacy in evaluating esophageal dysphagia. Dysphagia 1990;5:192–203.
- Cichero J, Nicholson T, Dodrill P. Liquid barium is not representative of infant formula: characterisation of rheological and material properties. Dysphagia 2011;26:264–71.
- Gisel E. Interventions and outcomes for children with dysphagia. Dev Disabil Res Rev 2008;14:165–73.
- Wilkinson TJ, Thomas K, MacGregor S, Tillard G, Wyles C, Sainsbury R. Tolerance of early diet textures as indicators of recovery from dysphagia after stroke. Dysphagia 2002;17:227–32.
- Pelletier CA, Lawless HT. Effect of citric acid and citric acid-sucrose mixtures on swallowing in neurogenic oropharyngeal dysphagia. Dysphagia 2003;18:231–41.
- Marik PE, Kaplan D. Aspiration pneumonia and dysphagia in the elderly. Chest 2003;124:328–36.
- Ickenstein GW, Kelly PJ, Furie KL, Ambrosi D, Rallis N, Goldstein R, et al. Predictors of feeding gastrostomy tube removal in stroke patients with dysphagia. J Stroke Cerebrovasc Dis 2003;12:169–74.
- Gervais M, Dorion D. Quality of life following surgical treatment of oculopharyngeal syndrome. J Otolaryngol 2003;32:1–5.
- Mann NS. Single dilation of symptomatic Schatzki ring with a large dilator is safe and effective. Am J Gastroenterol 2001;96:3448–9.
- Dumon JF, Meric B, Sivak MV, Fleischer D. A new method of esophageal dilation using Savary-Gilliard bougies. Gastrointest Endosc 1985;31:379–82.
- Pouderoux P, Verdier E, Courtial P, Bapin C, Deixonne B, Balmès JL. Relapsing cardial stenosis after laparoscopic nissen treated by esophageal stenting. Dysphagia 2003;18:218–22.
- Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:1066–78.
- Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
- Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
- Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
- Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
- Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
















