A presente diretriz é a segunda publicada pela WGO para complementar os temas do Dia Mundial da Saúde Digestiva (DMSD). Seu objetivo é orientar os profissionais da saúde no melhor manejo da doença do refluxo gastroesofágico (DRGE) com um documento conciso de recomendações baseadas nas últimas evidências, resultantes de um processo mundial de consenso de especialistas, centrado na melhore prática atual.
1.1 Cascatas para o diagnóstico e tratamento da DRGE
As diretrizes da WGO têm por objetivo destacar as opções de manejo apropriadas, sensíveis ao contexto e aos recursos disponíveis em cada área geográfica, sejam consideradas "em desenvolvimento", "semidesenvolvidas" ou "desenvolvidas."
- Existe a preocupação com as diretrizes dos países desenvolvidos, pois ao privilegiar os estudos de alta tecnologia e vigilância do esôfago de Barrett (EB), por exemplo, podem desviar a pesquisa e os recursos clínicos de problemas mais urgentes dos países em desenvolvimento e semidesenvolvidos.
- Porém, alguém poderia argumentar que nos países desenvolvidos existem problemas semelhantes e que a ênfase excessiva nas complicações ou "associações da DRGE propostas" (como no Consenso de Montreal [1]) está conduzindo a estudos e uso de recursos de forma inadequada nas regiões desenvolvidas.
- Também, é importante insistir aos seguros médicos e às entidades financiadoras que uma terapia apropriada e eficaz é tanto terapêutica como diagnóstica, e que realizar estudos obrigatórios (como, por exemplo, esofagogastroduodenoscopia) para indicar terapia com inibidores da bomba de prótons (IBP) não é centrado no paciente e, ainda mais importante, talvez não seja rentável.
- As Cascatas de WGO são, portanto, sensíveis ao contexto, e o contexto não é definido necessariamente apenas pela disponibilidade de recursos.
Uma abordagem padronizada global exigiria que a epidemiologia da DRGE e os sintomas tipo refluxo sejam comparáveis no mundo inteiro, e que os testes diagnósticos e todas as opções de tratamento médicas estejam normalmente disponíveis. Mas, nem a epidemiologia da doença, nem a disponibilidade de recursos para o diagnóstico e tratamento da DRGE, são suficientemente uniformes mundialmente como para apoiar a indicação de uma única abordagem padrão ouro.
A DRGE é uma afecção particularmente indicada para a abordagem em cascata da WGO, e esta diretriz mundial da WGO inclui uma série de cascatas com opções sensíveis aos contextos e aos recursos para o diagnóstico e manejo da DRGE. As Cascatas da WGO pretendem servir como complemento “global” -não substituição- das regras “padrão ouro” elaboradas por grupos regionais e sociedades nacionais.
Cascatas da WGO: conjunto hierárquico de opções diagnósticas, terapêuticas e de manejo para lidar com risco e patologia, qualificadas segundo os recursos disponíveis.
A DRGE é hoje amplamente prevalente ao redor do mundo, e com evidência clara de prevalência crescente em muitos países em desenvolvimento. As recomendações de práticas devem ser sensíveis ao contexto, visando otimizar a atenção, levando em conta os recursos locais e a disponibilidade de sistemas de apoio à assistência médica. A expressão da doença é considerada semelhante em todas as regiões, com azia e regurgitação como sintomas principais. Para o manejo inicial, o paciente pode comprar medicamento de venda livre para aliviar a azia ou consultar um farmacêutico. Quando os pacientes percebem que seus sintomas tendem a se agravar, podem consultar o doutor; segundo as circunstâncias do paciente e estrutura do sistema local de assistência médica, os pacientes podem procurar conselho nos serviços de atenção primária ou consultar um gastroenterologista ou cirurgião, diretamente ou por indicação. A abordagem em cascata da WGO tem por fim otimizar o uso dos recursos disponíveis de assistência médica para pacientes individuais, em função de sua localização e acesso a fornecedores de cuidados médicos diversos.
- Nesta diretriz, as cascatas são enumeradas nas seções 3.5 “Cascatas para o diagnóstico da DRGE” e 4.6 “Cascatas para o tratamento da DRGE”.
- A Seção 5.2 do Apêndice apresenta uma lista das diretrizes “padrão ouro” selecionadas.
1.2 Definição e descrição da DRGE
1. A doença do refluxo gastroesofágico (DRGE) é uma afecção decorrente do fluxo retrógrado de conteúdo gástrico para o esôfago, orofaringe e/ou vias respiratórias que provoca sintomas incômodos, lesões ou complicações suficientes para prejudicar a qualidade de vida de seus portadores.
2. Os sintomas induzidos pelo refluxo, a esofagite erosiva e as complicações a longo prazo [2] podem ter efeitos muito nocivos nas atividades diárias, produtividade laboral, sono e qualidade de vida. A definição da DRGE de Montreal estabelece que são considerados "sintomas incômodos" aqueles sintomas moderados a severos que aparecem uma ou mais vezes por semana.
3. A DRGE pode ser classificada pela presença ou ausência de erosões; os sintomas de DRGE sem erosões, após exame endoscópico, constituem doença do refluxo não erosiva (DRNE), enquanto os sintomas de DRGE com erosões constituem esofagite erosiva (EE) [3]. Cabe igualmente salientar que pode ocorrer EE na ausência de sintomas [4].
4. A DRNE é "uma subcategoria da DRGE caracterizada por sintomas relacionados com refluxo na ausência tanto de erosões da mucosa esofágica na endoscopia convencional como de terapia supressora de ácido recente". Esta definição foi qualificada na base de um componente patobiológico e diagnóstico [5], estabelecendo que "evidência a favor deste diagnóstico inclui capacidade de reação face à supressão do ácido, monitorização por 24 horas do pH positivo (associação positiva dos sintomas) ou identificação de novos achados endoscópicos, morfológicos ou fisiológicos." A DRNE é, sem dúvida, a forma mais comum de DRGE a nível mundial [5].
5. O termo "esôfago de Barrett” (EB) se refere à presença endoscópica, confirmada histologicamente, de um revestimento colunar do esôfago. Atualmente é considerada a única complicação identificável da DRGE que apresenta potencial maligno.
6. As síndromes extraesofágicas associadas a DRGE se subdividem em associações estabelecidas (tosse, laringite, asma, erosões dentárias) e associações propostas (faringite, sinusite, fibrose idiopática pulmonar, otite média) [6].
A frequência e severidade dos sintomas relacionados com o refluxo podem variar de forma contínua. Há indivíduos que apresentam sintomas de refluxo ocasionais moderados que não incomodam e não preenchem os critérios para um diagnóstico da DRGE; nestes casos, os sintomas devem ser tratados com terapias intermitentes de baixa intensidade e mudanças no estilo de vida conforme o requerido.
- Os sintomas de refluxo da DRNE podem ser tão severos quanto os dos pacientes com dano da mucosa confirmado por endoscopia [7].
- O aparecimento de sintomas de refluxo, embora moderados, duas ou mais vezes por semana está associado a uma diminuição da qualidade de vida do paciente [8]. Portanto, os sintomas de refluxo são considerados incômodos quando apresentados duas ou mais vezes por semana [1].
- O aparecimento de sintomas infrequentes moderados ou severos menos de duas vezes por semana pode ser, no entanto, suficiente para afetar a qualidade de vida e compatível com diagnóstico da DRGE [8].
1.3 Epidemiologia da DRGE
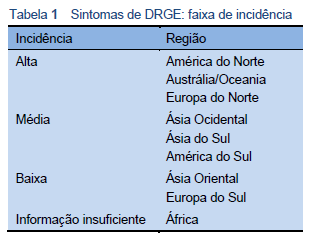
A DRGE é uma doença mundial e a evidência sugere que sua prevalência está aumentando. As estimativas de prevalência mostram uma variação geográfica considerável, mas hoje elas são constantemente inferiores a 10% apenas no leste da Ásia [9]. A alta prevalência da DRGE e, portanto, de sintomas incômodos, tem consequências sociais importantes que afetam negativamente a produtividade laboral [10] e muitos aspectos da qualidade de vida dos pacientes [11,12].
Ainda faltam estudos epidemiológicos sólidos para os países desenvolvidos, como o Japão, bem como para muitas economias emergentes como Rússia, Índia e o continente africano. Também há poucos dados sobre a prevalência da DRGE em populações pediátricas, sua incidência [9] (Tabela 1), história natural e causas.
A maioria dos estudos epidemiológicos sobre a doença está baseada nos sintomas [4]. Um diagnóstico com base nos sintomas pode gerar dados epidemiológicos sobre prevalência de sintomas do refluxo gastroesofágico (SRGE) provavelmente pouco confiáveis. Isto é, em parte, porque a descrição e nomenclatura dos sintomas de refluxo variam entre as regiões e, em parte, porque a descrição dos sintomas gastrointestinais altos (sintomas "dispépticos") pode ser similar ainda quando os pacientes sofrem patologias gastrointestinais altas muito diversas, como doença por úlcera péptica, dispepsia não ulcerosa, dismotilidade ou DRGE [13]. Contudo, vale a pena considerar a prevalência dos sintomas "dispépticos" no mundo inteiro, visto que esses dados afetam a probabilidade pré-teste de os sintomas gastrointestinais altos serem atribuíveis ao refluxo gastroesofágico.
3.1 Considerações diagnósticas
A presença de sintomas de azia e/ou regurgitação duas ou mais vezes por semana sugere DRGE [47]. Os critérios clínicos, endoscópicos e de pHmetria fornecem uma caracterização abrangente da doença, embora geralmente não sejam requeridos estudos para estabelecer um diagnóstico da DRGE - com a ressalva de que a probabilidade de ter DRGE no pré-teste varia marcadamente entre as regiões geográficas. (Consulte também a seção 1.2, Definição e descrição da DRGE).
A avaliação inicial deve documentar a presença, severidade e frequência da azia, a regurgitação (ácida ou de qualquer tipo) e os sinais de alerta; também devem ser buscados sintomas atípicos esofágicos, pulmonares, otorrinolaringológicos e bucais. Pode ser útil avaliar fatores precipitantes como refeições, dieta (gordura), atividades (agachar) e posição decúbido; também os fatores que aliviam a sintomatologia (bicarbonato, antiácidos, leite, medicamentos de venda livre).
Nesse sentido, é importante excluir outros diagnósticos gastrointestinais, em particular o câncer gastrointestinal alto e a doença ulcerosa, especialmente nas áreas de prevalência. Também é importante considerar outros diagnósticos não gastrointestinais, especialmente a cardiopatia isquêmica.
As ferramentas do questionário de diagnóstico para DRGE (questionários de doença do refluxo, RDQs) foram desenvolvidas para estudos epidemiológicos. Porém, os RDQ não tiveram bons resultados no estudo Diamond [32]. De fato, o diagnóstico feito por um médico -médico de família ou gastroenterologista- mostrou melhor sensibilidade e especificidade para o diagnóstico da DRGE do que o RDQ. Os questionários costumam ser difíceis de usar na prática clínica. Uma cuidadosa anamnese constitui a base do diagnóstico sintomático, a esofagogastroduodenoscopia (EGD) é reservada para identificar ou excluir lesões estruturais importantes em casos selecionados.
Uma avaliação da “probabilidade pré-teste” local, baseada na região, pode prover alguma orientação sobre as opções e a sequência de testes necessários para o diagnóstico, visto o baixo valor preditivo da maioria dos sintomas.
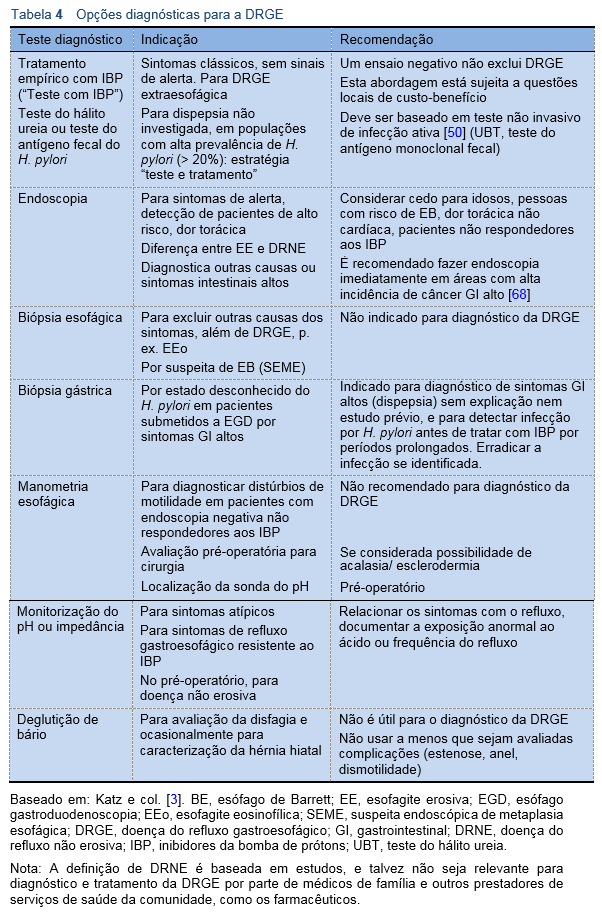
Tratamento com IBP como apoio ao diagnóstico
- “Ensaio com IBP.” O uso de terapia empírica a curto prazo (1-2 semanas) com doses altas de IBP não é mais recomendado para determinar se os sintomas do paciente estão ligados ou não ao ácido [32], pois não é um teste sensível nem específico. Contudo, isto é bastante comum na prática.
- Para avaliar a resposta ao tratamento em pacientes com DRGE é exigido um ciclo formal de terapia com IBP de duração adequada (geralmente 8 semanas).
- Os episódios de refluxo ligeiramente ácidos podem constituir uma proporção significativa de todos os episódios de refluxo. Se for o caso, esses pacientes podem não responder bem ao tratamento com IBP (20-40% dos pacientes com DRGE não respondem de maneira satisfatória) [34]. Além disso, até 5% dos episódios de refluxo podem consistir em refluxo genuinamente alcalino.
- Em um subconjunto de pacientes não respondedores aos IBP, os sintomas de refluxo podem estar ligados à azia funcional, e não à DRGE [34]. Cabe ainda considerar diagnósticos alternativos como: doença de úlcera péptica, neoplasia alta gastrointestinal, dispepsia funcional, esofagite eosinofílica e acalasia da cárdia.
- Em casos refratários ao tratamento com IBP, pode ser considerada a monitorização ambulatorial do pH/impedância esofágica durante 24 horas para ajudar a caracterizar os sintomas; o paciente não deve estar recebendo IBP [48].
-- Se houver falha total do tratamento com IBP, deve ser suspenso pelo menos 1 semana antes de fazer monitorização do pH de 24 h (se necessário, pode usar antiácido de resgate) para avaliar a persistência do refluxo ácido.
-- Se os sintomas do refluxo refratário responderam parcialmente, realizar monitorização do pH de 24 h (com ou sem monitorização da impedância esofágica) e seguir administrando IBP, para avaliar a persistência do refluxo ácido apesar do tratamento.
-- Ocasionalmente, pode ser necessária monitorização do pH de 24 h, com monitorização da impedância esofágica, com e sem tratamento com IBP [49].
Infecção por Helicobacter pylori [50]
Em muitos países com alta prevalência de H. pylori, úlcera péptica e câncer seguem sendo mais frequentes do que DRGE e causam mais morbidade e mortalidade [51].
- Nesse quadro, a abordagem para o diagnóstico e tratamento dos sintomas do intestino alto deve integrar a avaliação dos riscos de H. pylori, e a consciência da possível superposição e dificuldade para discriminar entre sintomas de DRGE, úlcera péptica e sintomas funcionais, com decisão sobre os méritos relativos da abordagem teste/tratamento em comparação com a esofagogastroduodenoscopia (EGD) para detectar H. pylori e doenças associadas antes de iniciar a terapia empírica antirrefluxo.
- Embora estudos epidemiológicos demonstrem associação negativa entre a prevalência da infecção por H. pylori e a presença e severidade da DRGE, isto não prova causalidade. Infecção por H. pylori deve ser buscada e, se indicado, deve ser administrada terapia de erradicação conforme as diretrizes internacionais, nacionais ou locais.
- A diminuição da prevalência de H. pylori observada em alguns países está relacionada com a melhoria das condições socioeconômicas. Melhorias dos níveis de higiene e saneamento reduzem a probabilidade de transmissão de H. pylori (e outras doenças infecciosas). O aumento do nível socioeconômico está intimamente associado a uma prevalência crescente de obesidade, ocupações sedentárias e alteração dos hábitos alimentares, o que pode favorecer o refluxo. Então, embora haja uma correlação inversa entre H. pylori e prevalência e severidade da DRGE, isto bem pode refletir diferentes efeitos de um ou vários fatores nas duas condições, e não uma relação causal entre H. pylori e DRGE.
- Estudos fisiológicos com monitorização do pH mostraram que a exposição anormal ao ácido esofágico, marca distintiva do refluxo esofágico, não está influenciada pela presença ou ausência de infecção por H. pylori.
- Na maioria dos pacientes, a presença ou não de H. pylori não tem efeito sobre a severidade dos sintomas, recorrência ou eficácia do tratamento da DRGE. A erradicação do H. pylori não exacerba a DRGE preexistente nem afeta a eficácia do tratamento [52]. De fato, em pacientes com dispepsia não estudada positiva para H. pylori, foi achado que a terapia de erradicação está ligada à menor prevalência de sintomas tipo refluxo (36%) do que ao tratamento de controle (49%) [53].
- Um subgrupo de pacientes infetados com cepas de H. pylori mais proinflamatórias (fatores de virulência vacA e cagA) pode ser menos propenso a ter esofagite severa ou EB. Isto pode ser porque muitas vezes a infecção produz gastrite severa do corpo do estômago com atrofia, causando menor produção de ácido. Estes pacientes, no entanto, têm maior risco de desenvolver câncer gástrico ou úlcera. A terapia de erradicação nestes pacientes tem o potencial para reduzir o risco de neoplasia gástrica.
IBP e H. pylori
A relação entre terapia com IBP e progressão da gastrite e atrofia do corpo gástrico em pacientes com infecção gástrica por H. pylori foi claramente estabelecida a partir das primeiras observações de Kuipers e col. [54]. Os IBP estão associados à piora do grau histológico da gastrite nos pacientes infetados por H. pylori, acompanhado de uma maior prevalência de atrofia da mucosa gástrica e metaplasia intestinal [55], que aparece antes, e com maior frequência, do que em pacientes infetados com H. pylori que não recebem IBP. Este risco de atrofia da mucosa gástrica e metaplasia intestinal não é observado quando os IBP são utilizados em pacientes não infetados ou naqueles nos quais foi erradicado o H. pylori antes de usar os IBP a longo prazo. Como é sabido que atrofia da mucosa gástrica e metaplasia intestinal são os principais fatores de risco para desenvolver adenocarcinoma gástrico, a maioria das diretrizes de especialistas recomendam fazer testes e tratar o H. pylori a longo prazo antes de administrar o IBP, especialmente em pacientes jovens.
Endoscopia (EGD)
A EGD é geralmente indicada para sintomas gastrointestinais altos de início recente, quase sem limite de idade, em regiões onde está disponível e asequível e onde há alta frequência de doença ulcerosa e grande preocupação pela possibilidade de neoplasias, como na maior parte da Ásia [56]. As cascatas apresentadas a seguir visam solucionar a escassa disponibilidade de endoscopia em áreas com menos recursos, sugerindo o tratamento empírico para erradicar o H. pylori como estratégia de primeira linha.
- Se a EGD é realizada em regiões com baixa prevalência da DRGE, a maioria dos pacientes com DRGE vão ter DRNE; nessas circunstâncias, a sensibilidade da EGD para o diagnóstico da DRGE será baixa, e o resultado principal será então excluir outros diagnósticos da via digestiva alta.
- A endoscopia é recomendada particularmente para pacientes com sinais de alerta sugestivos de DRGE com complicações, ou de outras doenças gastrointestinais altas como disfagia, hemorragia, odinofagia ou perda de peso.
- Pacientes com disfagia devem ser estudados para detectar possíveis complicações ou algum distúrbio de motilidade subjacente, acalasia, estenose, patologia do anel, esofagite eosinofílica ou neoplasia maligna [38].
- Em vários países asiáticos a preferência pela EGD é impulsionada pelo risco de neoplasia em idade precoce e pela disponibilidade de endoscopia a “preço razoável e acesso direto”, uma abordagem “primeiro a endoscopia”.
Outros estudos
Estudos adicionais, além da EGD, são raramente necessários; eles têm, também, precisão variável e muitas vezes não estão disponíveis.
- Estudos relevantes adicionais incluem radiologia, gammagrafia, manometria e monitorização prolongada do pH esofágico, com ou sem monitorização da impedância esofágica.
- O pH esofágico ou monitorização do pH-impedância durante 24 horas (ou 48-72 horas com cápsula de pH esofágico de Bravo) podem ser utilizados para quantificar a exposição esofágica ao ácido e avaliar a associação temporal entre azia e episódios de refluxo, utilizando como medida a probabilidade de associação sintomática (PAS) [57].
- Em geral, os estudos esofágicos são indicados ou realizados por especialistas após a consulta; eles raramente são requeridos, com exceção de pacientes específicos com sintomas recalcitrantes ou atípicos. Inclusive no mundo desenvolvido, o acesso à monitorização do pH, monitorização da impedância, manometria e gammagrafia é frequentemente muito limitado.
3.2 Anamnese e exame físico do paciente
Os objetivos da avaliação do paciente incluem a valorização dos sintomas e fatores de risco para diagnóstico da DRGE e a predição das sequelas a longo prazo. Nesse sentido, é importante considerar a epidemiologia regional da doença gastrointestinal alta e a probabilidade de DRGE pré-teste em relação com outras condições. Por exemplo, na Ásia, o EB não é frequente, portanto, não é um risco importante para adenocarcinoma esofágico, que é por si só pouco comum. A prevalência de úlcera péptica e câncer gástrico são os principais motivos para indicar endoscopia na Ásia onde, a diferença de Ocidente, o adenocarcinoma esofágico é menos comum. É provável que a prevalência crescente dos cânceres da união gastroesofágica no Ocidente esteja também relacionada com a DRGE, apesar destes cânceres serem ainda pouco frequentes. Por outro lado, o câncer escamoso é mais comum em outras partes do mundo (com maior prevalência no Irã, por exemplo), e está relacionado com fatores diferentes ao refluxo. A consideração de todos estes fatores deve guiar a sequência e escolha dos testes diagnósticos.
Características do histórico pessoal e familiar
As características a seguir podem ajudar a diagnosticar e avaliar a severidade da DRGE:
- Fatores predisponentes e fatores de risco (ver acima), inclusive história familiar.
- Duração dos sintomas.
- Sintomas diurnos, inclusive hora do dia e relação com as refeições.
- Sintomas noturnos, inclusive impacto no sono, efeitos da posição decúbito, refeições abundantes e tarde da noite.
- Tratamentos e remédios experimentados, inclusive resposta sintomática à terapia; melhoria dos sintomas com medicamentos que reduzem a quantidade de ácido, como os antiácidos, favorece o diagnóstico da DRGE.
- Disfagia periódica ou impactação do bolo alimentício podem sugerir lesão esofágica vinculada ao refluxo, estenose ou neoplasia maligna, bem como esofagite eosinofílica ou dismotilidade esofágica [58].
História medicamentosa: pergunte sobre medicamentos que possam contribuir para os sintomas da via digestiva alta (não forçosamente DRGE)
- Aspirina/medicamentos antiinflamatórios não esteroideos (AINE), ferro, potássio, quinidina, tetraciclina, bisfosfonatos
- Zidovudina, agentes anticolinérgicos, antagonistas alfa-adrenérgicos, barbitúricos
- Agonistas β2-adrenérgicos, bloqueadores dos canais de cálcio, benzodiazepinas, dopamina
- Estrógenos, analgésicos narcóticos, nitratos, progesterona, prostaglandinas, teofilina
- Antidepressivos tricíclicos, quimioterapia
História dietética
- Em alguns pacientes, inchaço ou constipação podem estar associados a maior risco de DRGE ou SRGE [59].
- Vários estudos sugerem que parar de fumar e adotar algumas medidas físicas pode ser benéfico para o paciente, como também alterar o tamanho das porções e horário das refeições, mas há evidência limitada sobre a prevenção de evitar o álcool e certos ingredientes da dieta, como bebidas gasosas, cafeína, gorduras e comidas picantes, chocolate e hortelã [60].
- Nas pessoas com sobrepeso, a perda de peso pode estar acompanhada de uma melhoria da DRGE ou SRGE [61].
- Os carboidratos fermentáveis podem aumentar a tendência ao refluxo [62].
Avaliação física: geralmente não há sinais físicos de DRGE
- Circunferência da cintura, peso e IMC são fatores de risco relevantes.
- Raramente é possível observar presença de estigmas periféricos de esclerodermia.
- Avaliação e inspeção para excluir outros problemas de saúde como asma, doença cardiaca e câncer:
-- Anemia, perda de peso
-- Orofaringe: úlceras, candidiase, lesões, tumores, erosões dentárias linguais, cáries
-- Pescoço: gânglios, tumores
-- Pulmões: chiados, estertores crepitantes
-- Ouvidos: perda de audição, derrames no ouvido médio (a evidência não apoia o refluxo gastroesofágico como causa de otite média)
-- Abdômen: tumores, dor esquisita
-- Sinais (locais ou sistêmicos) de neoplasia, se anamnese e exame físico forem suspeitos
3.3 Testes para diagnóstico da DRGE
Um diagnóstico presuntivo de DRGE pode ser estabelecido na presença de sintomas típicos: azia e regurgitação. Na gravidez, a DRGE pode ser diagnosticada de forma confiável apenas com base nos sintomas.
Se os sintomas dominantes ou mais incômodos são atípicos para DRGE, se deve considerar outros diagnósticos como as doenças relacionadas com H. pylori e os sintomas induzidos por AINEs. Em regiões onde há uma alta prevalência de infecção por H. pylori, uma estratégia inicial de teste e tratamento de H. pylori, ou uma endoscopia se possível, devem ser consideradas.
Os exames radiológicos rara vez resultam necessários. Monitorização do pH esofágico ou impedância-pH e manometria esofágica podem ser realizados de forma segura, mas raramente são necessárias. Sintomas de refluxo intratável ou complicações da DRGE podem ser avaliadas de forma segura com EGD [24,25].
- Na presença de sintomas típicos de DRGE não é necessário endoscopia digestiva alta (EGD), apesar do achado de erosões esofágicas ou lesões da mucosa [41] ter alta especificidade para o diagnóstico da DRGE. A endoscopia é recomendada na presença de sintomas de alerta e para avaliar pacientes com maior risco de complicações ou outros diagnósticos [41]. As características endoscópicas da doença do refluxo foram definidas pelos grupos de consenso de Genval, Montreal e Vevey e na classificação de DRGE de Los Ángeles [1,5,41,63].
Dados recentes indicam que é razoável fazer endoscopia para identificar EB em certos grupos de alto risco [64]; homens brancos maiores de 50 anos com sobrepeso e sintomas crônicos de DRGE têm maior risco de adenocarcinoma esofágico.
- É possível obter biópsias endoscópicas de esófago, estômago ou duodeno. As biópsias esofágicas distais não são recomendadas para diagnóstico da DRGE [65] e apenas devem ser feitas para avaliar a probabilidade de complicações [66] ou de esofagite eosinofílica. Biópsias do esófago distal e médio devem ser feitas se há suspeita de esofagite eosinofílica com base na história do paciente ou achados endoscópicos [58]. Além disso, devem ser realizadas biópsias esofágicas nos quatro quadrantes se o aspecto endoscópico for compatível com EB, com suspeita endoscópica de metaplasia esofágica (SEME) [34], ou se houver anomalias visíveis compatíveis com neoplasia ou infecção. As biópsias gástricas estão indicadas para diagnóstico da infecção por H. pylori, atrofia, metaplasia intestinal ou displasia, inclusive na presença de esofagite erosiva. É preciso levar em conta que as biópsias podem dar falso negativas para H. pylori se os pacientes estiverem tomando ou tenham tomado recentemente IBP ou antibióticos. Não há nenhuma razão para fazer biópsias duodenais rotineiras em pacientes com sintomas típicos de DRGE.
- O Teste do hálito ureia (UBT, C13 ou C14) ou o teste do antígeno fecal do H. pylori são recomendados como testes não invasivos para infecção ativa do H. pylori, como base da estratégia “teste e tratamento” para H. pylori em áreas onde a prevalência de H. pylori é maior de 20% [50]. O teste do H. pylori não confirma nem exclui um diagnóstico da DRGE, mas segundo a abordagem de Cascatas, o diagnóstico de sintomas digestivos altos deve ser guiado pela prevalência local da doença e os fatores econômicos.
- A sorologia é insuficiente para o diagnóstico da infecção ativa por H. pylori, mas em áreas de alta prevalência, se o paciente não tomou antibióticos recentemente, a sorologia terá valor preditivo positivo razoavelmente alto, se validado localmente. A sorologia do H. pylori pode ser um guia em pacientes tratados com IBP, o que pode conduzir a falsos negativos de infecção ativa (UBT, teste do antígeno fecal do H. pylori, histologia, cultura ou teste rápido de ureasa).
- A manometria esofágica é recomendada para avaliação pré-operatória, antes da cirurgia antirrefluxo ou para pacientes com sintomas persistentes apesar de tratamento adequado e endoscopia normal, para excluir acalasia ou outros distúrbios de motilidade [3]. A manometria esofágica não está indicada de rotina para diagnóstico da DRGE.
- A pHmetria e a impedância do esófago ambulatoriais podem ajudar a avaliar os pacientes refratários ao tratamento com IBP, e nos quais o possível diagnóstico da DRGE está em análise. A monitorização ambulatorial do refluxo com pHmetria é o único teste que pode avaliar a associação de sintomas do refluxo [48]. A monitorização da impedância-pH esofágica pode ser útil para avaliar a doença do refluxo, tanto ácido como não ácido, em pacientes com sintomas de refluxo persistentes que responderam mal à terapia padrão [34], mas as medidas de associação entre sintomas não foram validadas para a monitorização da impedância-pH. A monitorização do pH esofágico está indicada antes de considerar a cirurgia antirrefluxo para DRGE, usualmente em pacientes sem tratamento, para confirmar que os sintomas estão ligados ao refluxo.
- A radiografia baritada (deglutição) não deve ser feita para diagnosticar DRGE [67]. Pode sim ser apropriada em pacientes com sintomas de disfagia, para avaliar anomalias estruturais (p. ex., hérnia hiatal, malrotação) ou distúrbios de motilidade (p. ex., acalasia).
3.4 Diagnóstico diferencial
- Doença de úlcera péptica
- Neoplasia maligna do intestino alto
- Azia funcional: diferenciar DRNE e azia funcional com base na resposta clínica à supressão terapéutica do ácido, monitorização do pH ou da impedância-pH.
- Anel de Schatzki, estenose: membrana esofágica
- Acalasia da cárdia
- Distúrbios de motilidade do corpo esofágico: esclerodermia; espasmo esofágico difuso
- Esofagite eosinofílica
- Infecção: Cândida, herpes simples, etc.
- “Esofagite da pílula”
- Doença cardíaca: doença cardíaca isquêmica, doença pericárdica
- Divertículo esofágico
- Outra patologia do tórax
3.5 Cascatas para o diagnóstico da DRGE

Notas:
* Os sinais de alerta justificam a realização de EGD em todas as regiões.
** Prevalência de H. pylori:
Baixa: <30% a nível nacional, população de baixo risco, erradicação confirmada.
Alto: ≥ 30% a nível nacional, pacientes idosos, região de alto risco (por exemplo, populações originárias da América do Norte), grupos étnicos de alto risco (imigrantes da Europa oriental, América do Sul, África, subcontinente índio, Ásia).
- Para EGD, realizar biópsia esofágica em regiões de recursos abundantes ou biópsia para pacientes de regiões de “recursos médios”, se os sintomas sugerem esofagite eosinofílica.
- Para avaliar EGD, considerar somente se há alta prevalência de EB na população local e recursos abundantes.
- Para a maioria dos propósitos, EGD não vai alterar o manejo, na ausência de sinais de alerta ou acesso a cirurgia antirrefluxo.
- Não há indicações para a série gastrointestinal alta no estudo dos sintomas gastrointestinais altos de rotina (dispepsia não investigada).
4.1 Princípios de manejo
Princípios gerais
Embora a severidade e frequência dos sintomas variam muito entre os pacientes com DRGE, os sintomas de refluxo (SRGE) ocasionais não preenchem os critérios para um diagnóstico da DRGE e são controlados com tratamentos intermitentes de baixo nível e ajustes no estilo de vida, se necessário. Os sintomas mais frequentes ou severos interferem em grande medida na qualidade de vida dos pacientes e justificam um tratamento que seja suficiente para normalizá-la.
Em geral, o tratamento da DRGE segue uma abordagem passo a passo tanto respeito das terapias como dos profissionais da saúde que as indicam ou fornecem.
Princípios básicos
Os princípios básicos do tratamento da DRGE incluem intervenções no estilo de vida, redução da acidez luminal esofágica através tanto da neutralização ácida local como da supressão da secreção de ácido gástrico com tratamento médico; ou, em raras ocasiões, com cirurgia antirrefluxo. Os objetivos principais do tratamento são aliviar os sintomas, melhorar a qualidade de vida relacionada com a saúde do paciente, curar a esofagite, evitar a recorrência dos sintomas e prevenir ou tratar as complicações ligadas à DRGE da forma mais rentável.
4.2 Terapia passo a passo
A pirose infrequente, menos de duas vezes por semana, irá responder talvez ao autocuidado com antiácido ou alginato-antiácido, administrado uma vez por semana ou com menos frequência. É muito improvável que estes medicamentos tenham efeitos nocivos. As combinações de alginato-antiácido são úteis e são superiores aos antiácidos isolados [69]. Neste grupo de pacientes, em particular, pode ser útil evitar alimentos ou eventos que ativem os sintomas e as refeições muito abundantes pela noite. A perda de peso naqueles que têm sobrepeso também pode reduzir a frequência dos sintomas.
Os pacientes com sintomas mais frequentes devem ser avaliados para indicar um tratamento a longo prazo. Em pacientes com diagnóstico da DRGE, apresentando sintomas incômodos duas ou mais vezes por semana, justifica indicar uma terapia empírica com inibidor ácido (IBP ou, se indisponível, H2RA). Também podem ser utilizados antiácidos/alginatos se IBP ou H2RA estiverem indisponíveis, ou para alívio imediato dos sintomas em pacientes que tomam medicamentos supressores de ácido.
Se os medicamentos de venda livre ou os ajustes no estilo de vida falharem, os pacientes muitas vezes consultam primeiro o farmacêutico ou o médico de atenção primária. A definição de fracasso depende em grande medida do tratamento que está a ser experimentado. Por um lado, pode falhar porque o paciente na verdade não tem DRGE; por outro lado, é possível que ele seja inadequado para enfrentar a severidade da DRGE. Nesse caso, pode haver resposta parcial à terapia, e o manejo posterior será guiado segundo a disponibilidade e otimização de terapias mais potentes. Esses passos posteriores podem requerer encaminhamento para a atenção secundária se o tratamento inicial falhar [70]. A abordagem do refluxo deve focalizar a melhor prática clínica, sendo prioridade o tratamento dos sintomas.
- É aconselhável escolher a dose eficaz mais baixa dos medicamentos prescritos: a dose capaz de prover um alívio aceitável dos sintomas. Isto pode variar de nenhum medicamento até tratamento a curto prazo com IBP uma vez por dia. Na prática, é comum iniciar a terapia de IBP na dose padrão; metade da dose de IBP controla os sintomas em poucos pacientes, embora alguns deles possam “descer” com sucesso para doses mais baixas depois do controle inicial na dose padrão.
- Em certos pacientes com sintomas moderados ou DRNE diagnosticado por endoscopia, o tratamento com IBP intermitente dirigido pelo próprio paciente (“terapia sob demanda”), resulta uma estratégia útil. Permite reduzir a quantidade de comprimidos que toma o paciente, reduz os custos e permite ao paciente manejar seus sintomas. Contudo, se não alcançar o controle dos sintomas e a qualidade de vida segue sendo deficiente, será preciso passar à terapia diária.
- A nível de atenção primária, podem ser prescritos IBP ou combinação de alginato-antiácido e terapia supressora de ácido a critério do médico; a terapia combinada pode ser mais benéfica do que a terapia supressiva de ácido isoladamente [70].
- Para melhor controle dos sintomas, os pacientes devem ser informados sobre como usar corretamente a terapia com IBP; o tratamento ótimo pode ser definido como a administração do IBP 30-60 minutos antes do café da manhã e, no caso de dosagem duas vezes por dia, 30-60 minutos antes da última refeição também [71].
- Os pacientes com falha no tratamento com IBP em doses completas, com ou sem terapias adjuvantes, podem melhorar provando a terapia intensiva de IBP duas vezes por dia.
- O tratamento com IBP duas vezes por dia pode não funcionar em alguns pacientes, seja porque os sintomas não são causados pelo refluxo ácido e deve considerar um diagnóstico alternativo, ou porque o grau de supressão de ácido não é suficiente para controlar os sintomas. No caso destes pacientes “refratários ao IBP” deve ser considerado encaminhamento para a atenção secundária.
- Os antiácidos de venda livre mostram resultados decepcionantes em pacientes com esofagite erosiva.
Cuidado pessoal
- No paciente obeso ou com sobrepeso, a perda de peso controlada constitui uma parte importante do tratamento a longo prazo da DRGE e não deve ser ignorada como intervenção terapêutica, pois pode reduzir a frequência e intensidade dos sintomas e diminuir o grau de EE, se estiver presente.
- Estilo de vida: porções pequenas, evitar jantar tarde, evitar fatores desencadeantes, uso de um dispositivo de posicionamento para dormir (travesseiro) [72].
- Os medicamentos de venda livre (antiácidos ou alginato-antiácidos) oferecem o mais rápido alívio dos sintomas, mas geralmente transitório, e podem ser tomados conforme exigido.
- Características alertantes: ver seção 2.4.
Opções para a automedicação assistida por farmacêutico
- Orientar os pacientes na seleção do medicamento de venda livre confirmando o diagnóstico, encaminhar os pacientes com sintomas de alerta para o médico e educar os pacientes sobre o uso apropriado de seu medicamento de venda livre, que, em algumas jurisdições, pode incluir IBP [73].
N.B.: a disponibilidade de opções de tratamento varia segundo os países.
- Antiácidos: recomendado para alívio a curto prazo ou intermitente:
-- Os antiácidos simples neutralizam o ácido gástrico; incluem sais de sódio, cálcio, magnésio e alumínio.
-- Agentes que contêm alginato: incluem ácido algínico com pequenas doses de antiácidos: efeitos de proteção mínimos.
- Antagonistas do receptor de Histamina H2 (H2RA): recomendados para curto e médio prazo
-- Medicamentos de venda livre fáceis de conseguir
-- Cimetidina, ranitidina, famotidina, nizatidina
-- Ação mais prolongada que os antiácidos
-- Taquifilaxia
- IBPs de venda livre:
-- Os pacientes que consultam em farmácias por sintomas frequentes de refluxo podem beneficiar do tratamento com IBP de venda livre
-- Esomeprazol, lansoprazol, omeprazol, pantoprazol, rabeprazol, cuja disponibilidade sem receita pode diferir em cada país: consultar o sitio web da Associação da Indústria Europeia de Automedicação (http://www.aesgp.eu/facts-figures/otc-ingredients/)
-- Outros IBP sem receita podem estar disponíveis em outras jurisdições.
- Sinais de alerta: ver seção 2.4.
-- Verificar as interações medicamentosas.
Autotratamento sem estudos deve ser evitado diante das seguintes condições [74–77]:
- Sintomas de azia ou regurgitação que:
-- Duração > 3 meses com azia gástrica severa ou noturna
-- Continúam após 2 semanas de tratamento com H2RA ou IBP de venda livre
-- Aparecem quando o paciente está recebendo H2RA ou IBP prescritos
- Azia gástrica ou regurgitação de início recente aos 45-55 anos – em pacientes mais jovens em várias regiões asiáticas
- Disfagia ou odinofagia
- Sintomas ou sinais de hemorragia gastrointestinal: hematêmese e melena, anemia por deficiência de ferro
- Sintomas ou sinais de laringite: rouquidão, chiado, tosse ou falta de ar
- Perda de peso inexplicada
- Náuseas, vômitos e/ou diarreia contínuos
- Sintomas sugestivos de dor no peito de tipo cardíaco: irradiação para o ombro, braço, pescoço ou mandíbula, dificuldade para respirar, sudorese
- Em mulheres grávidas ou mães amamentando
- Crianças <12 anos para antiácidos/H2RA, ou <18 anos para IBP.
Ação de seguimento
- Os objetivos do autotratamento são que o paciente fique livre dos sintomas e que recupere uma qualidade de vida ótima com a terapia de melhor custo-benefício.
- Se não alcançar um alívio satisfatório e completo dos sintomas, recomendar aos pacientes que consultem um profissional da saúde para uma avaliação diagnóstica.
- Uso excessivo de IBP: as pessoas que precisam supressão sustentada do ácido gástrico devem ter indicação adequada para uso prolongado de IBP; a necessidade de administração a longo prazo de IBP deve ser reavaliada de forma regular. Defendemos a prescrição responsável de IBP, que deve ser baseada em uma boa avaliação e bom diagnóstico e, se o tratamento não funcionar, o medicamento deve ser suspenso. É recomendado documentar o tratamento adequadamente.
Opções para médicos de família
- Reforçar as mudanças no estilo de vida
- Aprovar medicamentos de venda livre (antiácidos, alginatos, H2RA), se necessário
- Prescrição de H2RA
- IBP atualmente disponíveis: doses padrão diárias que surgem de estudos do coração em EE (nem todos os IBP estão disponíveis em todos os países, e a dose padrão de IBP pode diferir em certos países):
— Omeprazol (20 mg)
— Rabeprazol (20 mg)
— Lansoprazol (30 mg)
— Pantoprazol (40 mg)
— Esomeprazol (40 mg)
— Dexlansoprazol (60 mg)
- Medicamentos procinéticos:
— Podem diminuir o refluxo gastroesofágico, mas são poucos os procinéticos disponíveis para uso clínico e sua eficácia nos ensaios clínicos foi, no mínimo, modesta. Não recomendado.
— Metoclopramida deve ser evitada por causa dos efeitos adversos.
— Domperidona mostra poucos benefícios e não é recomendado por problemas de segurança ligados à prolongação do intervalo QTc na eletrocardiografia.
— Mosapride: disponibilidade e eficácia limitadas.
- Sinais de alerta: ver seção 2.4.
— Verificar as interações dos medicamentos
— Excluir/tratar outras condições que possam estar contribuindo (constipação, medicamentos que agravam a sintomatologia).
Opções para especialistas (atenção secundária: gastroenterologista, cirurgião)
Para atender às necessidades dos pacientes, deve ser levada em conta a totalidade dos sintomas. Os sintomas adicionais, com ou sem pirose, podem responder de forma diferente ao tratamento.
- A regurgitação e a azia podem não responder ao tratamento.
- A interrupção dos IBP pode provocar um rebote dos sintomas a curto prazo em uma minoria dos pacientes [78,79].
- O fracasso do tratamento com IBP [80,81] pode estar relacionado com:
— Diagnóstico incorreto: pode ser confundido com azia funcional.
— Descumprimento: os pacientes com DRGE podem não cumprir as indicações de administração do IBP, e isto pode conduzir ao fracasso do tratamento [82].
— Tempo de dosagem incorreto: a maioria dos IBP são mais efetivos se tomados 30 a 60 minutos antes da refeição.
— Dosagem inadequada.
— Baixa biodisponibilidade do fármaco (metabolizadores rápidos).
— Refluxo duodenogastroesofágico, refluxo noturno, refluxo ligeiramente ácido, refluxo ácido residual.
— Esvaziamento gástrico tardio/prolongado, obstrução de saída gástrica.
— Hipersensibilidade esofágica.
— Esofagite eosinofílica.
— Comorbidade psicológica.
- Os H2RAs são efetivos para suprimir o ácido a curto prazo, mas a taquifilaxia limita os benefícios a longo prazo.
- Existe pouca evidência que apoie o uso de procinéticos (cisaprida, domperidona, tegaserod, mosaprida) isolados ou em combinação com supressão ácida. Os efeitos adversos severos têm levado à retirada destes agentes do mercado em muitas jurisdições, e acontece taquifilaxia. Não podem ser recomendados.
- Possíveis consequências ou efeitos adversos da supressão ácida [83]: a maioria são baseados em análises retrospectivas de populações heterogéneas e, portanto, mostram associações que podem não ser causais.
— Dor de cabeça e diarreia acontecem em taxas pouco diferentes às observadas com placebo.
— Infecções gastrointestinais [84]: o uso de IBPs aumenta pouco o risco de gastroenterite bacteriana e está associado a um maior risco de infecção por Clostridium difficile.
— Infecções das vias respiratórias: os relatórios que descrevem um moderado aumento de pneumonia adquirida na comunidade pelo uso de IBP reconhecem a heterogeneidade dos resultados do estudo, a ausência de uma base fisiopatológica clara e a possibilidade de fatores de confusão não ponderados.
— Nível baixo de vitamina B12 sérica: não é clinicamente significativo.
— Hipomagnesemia: muito rara, mas documentada com estudos de reexposição.
— Câncer: evidência não indica que o uso de IBP aumente por si mesmo o risco.
— Osteoporose, fraturas - não provável.
- Sinais de alerta (ver seção 2.4):
— Verificar as interações medicamentosas.
— Excluir/tratar outras patologias que possam estar contribuindo (constipação, medicamentos que exacerbam os sintomas).
— Decidir sobre a necessidade de realizar mais estudos, medicamentos “não aprovados” (off label) e cirurgia.
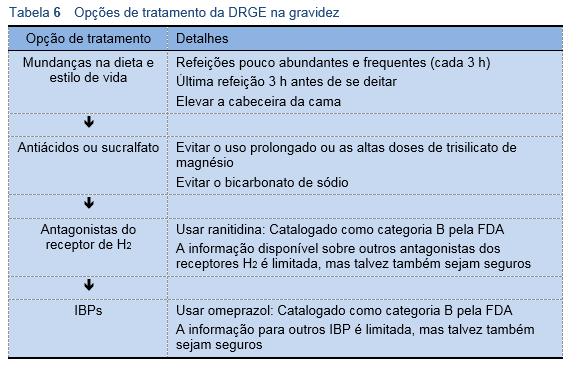
4.3 Tratamento da DRGE na gravidez
4.4 Intervenções cirúrgicas
A intervenção cirúrgica (em geral, fundoplicatura) em pacientes com DRGE é pouco indicada, mas pode ser considerada se houver hérnia hiatal grande que cause sintomas de refluxo ligados ao volume e se há evidência de aspiração ou disfunção da cárdia. Outras indicações podem incluir a falta de cumprimento do tratamento médico, efeitos secundários associados ao tratamento médico, esofagite refratária ao tratamento médico ou sintomas persistentes documentados como causados por DRGE refratária. [3].
- Não há evidência a favor da cirurgia antirrefluxo como a única indicação para tratar o EB ou evitar a evolução para um adenocarcinoma precoce.
- Antes de considerar a cirurgia antirrefluxo, os pacientes devem ser informados sobre o risco que envolve o uso prolongado de IBP depois da cirurgia [85,86].
- Antes de decidir a cirurgia antirrefluxo, é preciso verificar o cumprimento do paciente com a administração dos IBP e otimizar o tratamento médico [85].
Por definição, a resposta à supressão ácida (ou neutralização) nos pacientes com azia gástrica funcional está ausente ou é mínima no melhor dos casos, e os pacientes correm o risco de ser encaminhados para cirurgia por sua DRGE. Portanto, todos os pacientes com sintomas de DRGE encaminhados para cirurgia devem ser submetidos a monitorazição do pH de 24 horas para excluir azia gástrica funcional [87]. Também devem ser submetidos a manometria esofágica, gole de bário e EGD para excluir outros diagnósticos diferenciais.
As técnicas endoscópicas cirúrgicas antirrefluxo foram desenvolvidas a partir de finais dos 90, mas a maioria não prosperou devido a que seu sucesso foi limitado [88]. Ainda faltam dados dos resultados a longo prazo para algumas técnicas e procedimentos novos, e estas terapias só devem ser oferecidas no contexto de ensaios clínicos.
4.5 Manejo das complicações da DRGE
Apesar do prognóstico dos pacientes com DRGE ser bom, e 90% alcançar um bom controle dos sintomas com tratamento ótimo, pode haver complicações, incluindo hemorragia, EB, estenose, ulceração e malignidade.

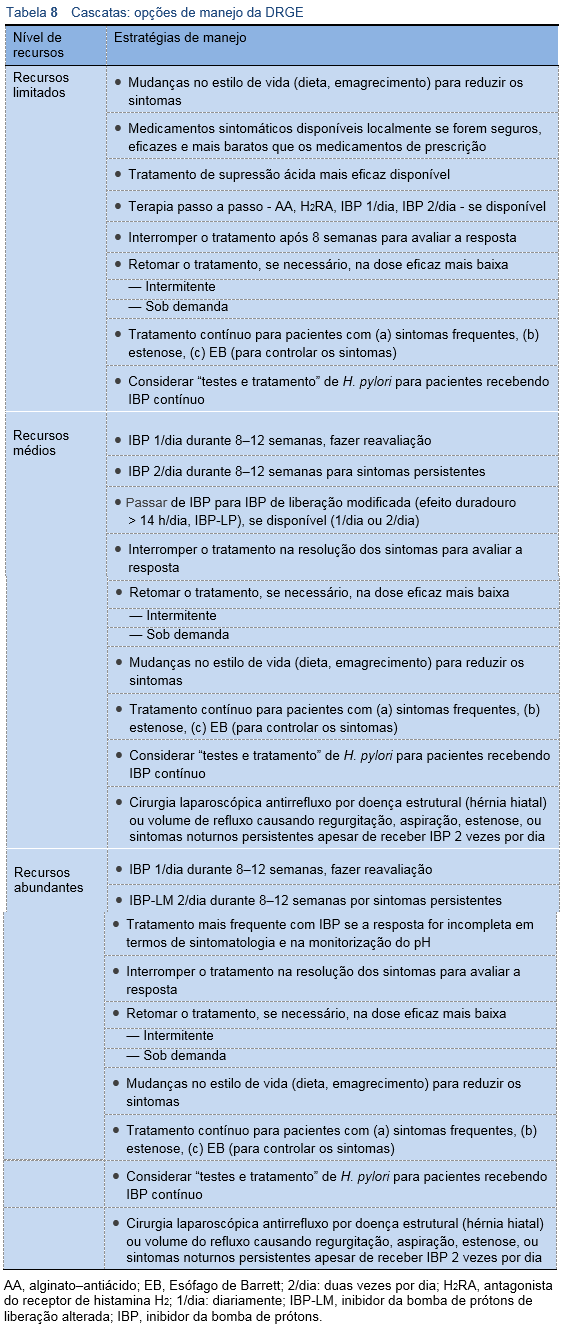
4.6 Cascatas para manejo da DRGE
Para fornecer uma orientação correta em áreas com poucos recursos e evitar estudos diagnósticos desnecessários, é básico contar com uma avaliação diagnóstica completa da história do paciente e seu exame físico (ver seções 3.1 e 3.2), incluindo quando acontecem os sintomas (durante o dia ou pela noite, sua relação com as refeições) e sua resposta (nenhuma, parcial ou completa) aos antiácidos, H2RA ou IBP.
A cascata da Tabela 8 supõe que não existem sinais de alerta e outras causas não gastrointestinais dos sintomas, que, se indicado, foi buscada e erradicada a infecção por H. pylori e que foi excluído o uso de AINEs como causa dos sintomas.
5.2 Diretrizes padrão ouro para a DRGE
2013 American College of Gastroenterology guidelines for diagnosis and management:
Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol 2013;108:308–28; quiz 329. doi: 10.1038/ajg.2012.444. PMID: 23419381. National Guideline Clearinghouse NGC 009639.
2012 American College of Physicians Clinical Guidelines Committee best practice advice:
Shaheen NJ, Weinberg DS, Denberg TD, Chou R, Qaseem A, Shekelle P; Clinical Guidelines Committee of the American College of Physicians. Upper endoscopy for gastroesophageal reflux disease: best practice advice from the clinical guidelines committee of the American College of Physicians. Ann Intern Med 2012;157:808–16. doi: 10.7326/0003-4819-157-11-201212040-00008. PubMed PMID: 23208168
2011 American Gastroenterological Association medical position statement on the management of Barrett’s esophagus:
American Gastroenterological Association, Spechler SJ, Sharma P, Souza RF, Inadomi JM, Shaheen NJ. American Gastroenterological Association medical position statement on the management of Barrett’s esophagus. Gastroenterology 2011;140:1084–91. doi: 10.1053/j.gastro.2011.01.030. PubMed PMID: 21376940. National Guideline Clearinghouse NGC 008565.
2010 Brazilian GERD group consensus guidelines:
Moraes-Filho JP, Navarro-Rodriguez T, Barbuti R, Eisig J, Chinzon D, Bernardo W; Brazilian Gerd Consensus Group. Guidelines for the diagnosis and management of gastroesophageal reflux disease: an evidence-based consensus. Arq Gastroenterol 2010;47:99–115. PubMed PMID: 20520983.
2008 Asia–Pacific consensus update:
Fock KM, Talley NJ, Fass R, Goh KL, Katelaris P, Hunt R, et al. Asia–Pacific consensus on the management of gastroesophageal reflux disease: update. J Gastroenterol Hepatol 2008;23:8–22. doi: 10.1111/j.1440-1746.2007.05249.x. Erratum in: J Gastroenterol Hepatol 2008;23:504. PubMed PMID: 18171339.
2007 American Society for Gastrointestinal Endoscopy — role of endoscopy in the management of GERD:
Standards of Practice Committee, Lichtenstein DR, Cash BD, Davila R, Baron TH, Adler DG, et al. Role of endoscopy in the management of GERD. Gastrointest Endosc 2007;66:219–24. doi: 10.1016/j.gie.2007.05.027. PubMed PMID: 17643692.
2006 American Gastroenterological Association Institute medical position statement on endoscopic therapy in gastroesophageal reflux disease:
Falk GW, Fennerty MB, Rothstein RI. AGA Institute medical position statement on the use of endoscopic therapy for gastroesophageal reflux disease. Gastroenterology 2006;131:1313–4. PubMed PMID: 17030198.
2005 Canadian Association of Gastroenterology GERD Consensus Group, 2004 update:
Armstrong D, Marshall JK, Chiba N, Enns R, Fallone CA, Fass R, et al. Canadian Consensus Conference on the management of gastroesophageal reflux disease in adults — update 2004. Can J Gastroenterol 2005;19:15–35. PubMed PMID: 15685294.
2002 Gastroenterological Society of Australia guidelines for clinicians:
Katelaris P, Holloway R, Talley N, Gotley D, Williams S, Dent J, et al. Gastro-oesophageal reflux disease in adults: guidelines for clinicians. J Gastroenterol Hepatol 2002;17:825–33. doi: 10.1046/j.1440-1746.2002.02839.x. PubMed PMID: 12164956.
5.3 Classificação de esofagite erosiva de Los Ángeles

5.4 Critérios de Praga para o esófago de Barrett
Os critérios de Praga para EB oferecem um sistema consensuado de classificação endoscópica que foi submetido a uma extensa validação interna e externa por parte de endoscopistas experimentados. Os critérios de Praga fornecem um sistema simples para avaliar a extensão do esófago de Barrett, com base no comprimento do esófago distal que ocupa o epitélio de Barrett circunferencialmente (C) e o máximo (M) em relação à união gastroesofágica, que se caracteriza pelos extremos proximais das pregas da mucosa gástrica e/ou “pinça” do esfíncter esofágico inferior. Foi demonstrado que diferentes endoscopistas identificaram e mediram estes critérios com fiabilidade. A localização dos pontos de referência gastroesofágicos é esencial para a classificação, e podem ser identificados e localizados de forma confiável por diferentes endoscopistas. O sistema de classificação padronizada melhora a capacidade dos médicos para medir a eficácia dos tratamentos do EB em pacientes individuais e melhora a classificação dos pacientes com EB nos ensaios clínicos [89,90].
5.5 Dados epidemiológicos regionais sobre DRGE
Epidemiologia da DRGE no Japão
Michio Hongo
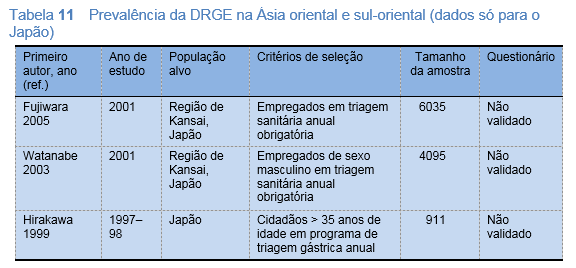
- Fujiwara Y, Higuchi K, Watanabe Y, Shiba M, Watanabe T, Tominaga K, et al. Prevalence of gastroesophageal reflux disease and gastroesophageal reflux disease symptoms in Japan. J Gastroenterol Hepatol 2005;20:26–9.
Prevalência do refluxo gastroesofágico e sintomas da doença do refluxo gastroesofágico no Japão.
Dos 6035 pacientes elegíveis, 2662 (44,1%) informaram ter azia gástrica e/ou regurgitação ácida no decorrer do ano anterior: 124 (2,1%) diariamente, 275 (4,6%) duas vezes por semana, 773 (12,8%) duas vezes por mês, e 1490 (24,7%) menos de duas vezes por mês. 399 (6,6%) pacientes foram diagnosticados com DRGE, e não houve relação entre prevalência da DRGE e sexo ou idade.
- Fujimoto K. Review article: prevalence and epidemiology of gastro-oesophageal reflux disease in Japan. Aliment Pharmacol Ther 2004;20 Suppl 8:5–8. Artigo de revisão: prevalência e epidemiologia da doença do refluxo gastroesofágico no Japão.
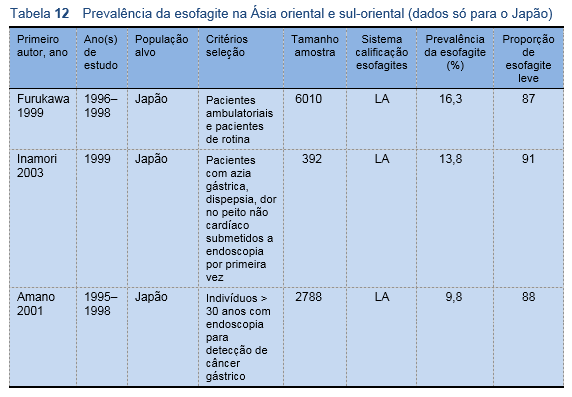
Os estudos endoscópicos mostram que a prevalência geral da esofagite por refluxo na população adulta no Japão se encontra na faixa de 14-16%.
- Fujimoto K, Iwakiri R, Okamoto K, Oda K, Tanaka A, Tsunada S, et al. Characteristics of gastroesophageal reflux disease in Japan: increased prevalence in elderly women. J Gastroenterol 2003;38 Suppl 15:3–6.
Características da doença do refluxo gastroesofágico no Japão: aumento da prevalência em mulheres idosas.
As percentagens de cada motivo de consulta em relação à totalidade dos pacientes foram os seguintes: azia, 27,0%; disfagia, 16,9%; odinofagia, 19,2%; regurgitação ácida, 7,1%. As percentagens de cada grau foram as seguintes: grau A: 9,6%; grau B: 4,6%; e grau C + D: 2,0%.
- Wong BC, Kinoshita Y. Systematic review on epidemiology of gastroesophageal reflux disease in Asia. Clin Gastroenterol Hepatol 2006;4:398–407.
Revisão sistemática da epidemiologia da doença do refluxo gastroesofágico na Ásia.
A prevalência da DRGE comunicada na população do leste da Ásia variou de 2,5% a 6,7% para alguns sintomas semanais de azia e/ou regurgitação ácida, e pode estar aumentando. Nos estudos de casos, a prevalência da esofagite por refluxo variou de 3,4% a 16,3%.
- Fujiwara Y, Arakawa T. Epidemiology and clinical characteristics of GERD in the Japanese population. J Gastroenterol 2009;44:518–34. Epidemiologia e características clínicas da DRGE na população japonesa.
- Yamagishi H, Koike T, Ohara S, Kobayashi S, Ariizumi K, Abe Y, et al. Prevalence of gastroesophageal reflux symptoms in a large unselected general population in Japan. World J Gastroenterol 2008;14:1358–64.
Prevalência de sintomas de refluxo gastroesofágico em grande população geral não selecionada no Japão. A prevalência dos sintomas típicos da DRGE (azia gástrica) foi alta - cerca de 20% da população japonesa - e a frequência foi especialmente elevada nas mulheres de 60-89 anos de idade.
- Kinoshita Y, Adachi K, Hongo M, Haruma K. Systematic review of the epidemiology of gastroesophageal reflux disease in Japan. J Gastroenterol 2011;46:1092–103. Revisão sistemática da epidemiologia da doença do refluxo gastroesofágico no Japão.
Sete estudos informaram que a prevalência de, no mínimo, sintomas semanais foi de 6,5-9,5%, valor próximo ao relatado nas populações ocidentais (10-20%).
Epidemiologia da DRGE na Índia
Shobna Bhatia
Há vários estudos da Índia que informam a prevalência de sintomas semanais de DRGE, mostrando que varia entre 7,6% e 19%.

- Bhatia SJ, Reddy DN, Ghoshal UC, Jayanthi V, Abraham P, Choudhuri G, et al. Epidemiology and symptom profile of gastroesophageal reflux in the Indian population: report of the Indian Society of Gastroenterology Task Force. Indian J Gastroenterol 2011;30:118–27.
- Sharma PK, Ahuja V, Madan K, Gupta S, Raizada A, Sharma MP. Prevalence, severity, and risk factors of symptomatic gastroesophageal reflux disease among employees of a large hospital in Northern India. Indian J Gastroenterol 2011;30:128–34.
- Kumar S, Sharma S, Norboo T, Dolma D, Norboo A, Stobdan T, et al. Population based study to assess prevalence and risk factors of gastroesophageal reflux disease in a high altitude area. Indian J Gastroenterol 2011;30:135–43.
- Chowdhury SD, George G, Ramakrishna K, Balamurugan R, Mechenro J, Ramakrishna BS. Prevalence and associations of gastro esophageal reflux disease: a community study in south India [abstract]. Gastroenterology 2015;148:S-403–4.
Epidemiologia da DRGE no Brasil
Joachim Moraes-Filho
A prevalência da azia gástrica (11,9%) é relativamente alta na população urbana no Brasil, embora mais baixa que os valores informados em outros países. Azia e DRGE têm maior prevalência entre as mulheres, e ambas estão relacionadas com a alimentação, alimentos gordurosos e picantes; a DRGE é mais frequente em pessoas maiores de 35 anos.
- Moraes-Filho JP, Chinzon D, Eisig JN, Hashimoto CL, Zaterka S. Prevalence of heartburn and gastroesophageal reflux disease in the urban Brazilian population. Arq Gastroenterol 2005;42:122–7.
Epidemiologia da DRGE em Asan-si, Coreia
Young-Seok Cho
A prevalência da DRGE entre a população da cidade de Asan-si na Coreia foi de 3,5%. Azia gástrica e regurgitação ácida são associadas significativamente à dor no peito, disfagia, sensação de nó na garganta, rouquidão e asma.
- Cho YS, Choi MG, Jeong JJ, Chung WC, Lee IS, Kim SW, et al. Prevalence and clinical spectrum of gastroesophageal reflux: a population-based study in Asan-si, Korea. Am J Gastroenterol 2005;100:747–53.
Epidemiologia da DRGE na Argentina
Graciela Salis
Na Argentina, os sintomas típicos de refluxo gastroesofágico são altamente prevalentes a nível nacional (a prevalência de sintomas frequentes de refluxo foi 23,0% (IC 95%, 20,1 a 25,9) e a prevalência da DRGE foi 11,9% (IC 95%, 9,6 a 14,1). Os sintomas frequentes de refluxo gastroesofágico são associados significativamente à disfagia, sensação de nó na garganta e dor no peito de origem não cardíaco.
- Chiocca JC, Olmos JA, Salis GB, Soifer LO, Higa R, Marcolongo M, et al. Prevalence, clinical spectrum and atypical symptoms of gastro-oesophageal reflux in Argentina: a nationwide population-based study. Aliment Pharmacol Ther 2005;22:331–42.
Epidemiologia da DRGE GERD na Rússia
Leonid Lazebnik
O ensaio MEGRE baseado na população foi realizado em seis cidades da Rússia utilizando uma metodologia reconhecida internacionalmente, e mostrou que a prevalência da DRGE é de 13,3%. A maioria dos pacientes prestam pouca atenção aos sintomas; não procurou conselho médico e não recebeu, portanto, nenhum tratamento adequado. Azia gástrica aconteceu em 47,5% dos pacientes que responderam: frequentemente em 9% e rara vez em 38,5%. A regurgitação aconteceu em 42,9% dos pacientes: com frequência em 7,6%, rara vez em 35,3%.
- Lazebnik LB, Masharova AA, Bordin DS, Vasil’ev IuV, Tkachenko EI, Abdulkhakov RA, et al. [Results of a multicenter trial “Epidemiology of Gastroesophageal Reflux Disease in Russia” (MEGRE)]. Ter Arkh 2011;83:45–50. [Artigo em russo.]
1. Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, Global Consensus Group. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006;101:1900–20; quiz 1943.
2. Moayyedi P, Talley NJ. Gastro-oesophageal reflux disease. Lancet 2006;367:2086–100.
3. Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol 2013;108:308–28; quiz 329.
4. Dent J, Becher A, Sung J, Zou D, Agréus L, Bazzoli F. Systematic review: patterns of reflux-induced symptoms and esophageal endoscopic findings in large-scale surveys. Clin Gastroenterol Hepatol 2012;10:863–73.e3.
5. Modlin IM, Hunt RH, Malfertheiner P, Moayyedi P, Quigley EM, Tytgat GNJ, et al. Diagnosis and management of non-erosive reflux disease—the Vevey NERD Consensus Group. Digestion 2009;80:74–88.
6. Hunt R, Quigley E, Abbas Z, Eliakim A, Emmanuel A, Goh KL, et al. Coping with common gastrointestinal symptoms in the community: a global perspective on heartburn, constipation, bloating, and abdominal pain/discomfort, May 2013. J Clin Gastroenterol 2014;48:567–78.
7. Modlin IM, Moss SF. Symptom evaluation in gastroesophageal reflux disease. J Clin Gastroenterol 2008;42:558–63.
8. Dent J, Armstrong D, Delaney B, Moayyedi P, Talley NJ, Vakil N. Symptom evaluation in reflux disease: workshop background, processes, terminology, recommendations, and discussion outputs. Gut 2004;53 Suppl 4:iv1–24.
9. El-Serag HB, Sweet S, Winchester CC, Dent J. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2014;63:871–80.
10. Henke CJ, Levin TR, Henning JM, Potter LP. Work loss costs due to peptic ulcer disease and gastroesophageal reflux disease in a health maintenance organization. Am J Gastroenterol 2000;95:788–92.
11. Liker H, Hungin P, Wiklund I. Managing gastroesophageal reflux disease in primary care: the patient perspective. J Am Board Fam Pract 2005;18:393–400.
12. Revicki DA, Wood M, Maton PN, Sorensen S. The impact of gastroesophageal reflux disease on health-related quality of life. Am J Med 1998;104:252–8.
13. Veldhuyzen van Zanten SJ, Flook N, Chiba N, Armstrong D, Barkun A, Bradette M, et al. An evidence-based approach to the management of uninvestigated dyspepsia in the era of Helicobacter pylori. Canadian Dyspepsia Working Group. CMAJ 2000;162(12 Suppl):S3–23.
14. El-Serag H. The association between obesity and GERD: a review of the epidemiological evidence. Dig Dis Sci 2008;53:2307–12.
15. Goh KL. Changing epidemiology of gastroesophageal reflux disease in the Asian-Pacific region: an overview. J Gastroenterol Hepatol 2004;19 Suppl 3:S22–5.
16. El-Serag HB, Satia JA, Rabeneck L. Dietary intake and the risk of gastro-oesophageal reflux disease: a cross sectional study in volunteers. Gut 2005;54:11–7.
17. Fass R, Quan SF, O’Connor GT, Ervin A, Iber C. Predictors of heartburn during sleep in a large prospective cohort study. Chest 2005;127:1658–66.
18. DiBaise JK. A randomized, double-blind comparison of two different coffee-roasting processes on development of heartburn and dyspepsia in coffee-sensitive individuals. Dig Dis Sci 2003;48:652–6.
19. Akiyama T, Inamori M, Iida H, Mawatari H, Endo H, Hosono K, et al. Alcohol consumption is associated with an increased risk of erosive esophagitis and Barrett’s epithelium in Japanese men. BMC Gastroenterol 2008;8:58.
20. Gunasekaran TS, Dahlberg M, Ramesh P, Namachivayam G. Prevalence and associated features of gastroesophageal reflux symptoms in a Caucasian-predominant adolescent school population. Dig Dis Sci 2008;53:2373–9.
21. Eslick GD, Talley NJ. Gastroesophageal reflux disease (GERD): risk factors, and impact on quality of life—a population-based study. J Clin Gastroenterol 2009;43:111–7.
22. Nilsson M, Johnsen R, Ye W, Hveem K, Lagergren J. Lifestyle related risk factors in the aetiology of gastro-oesophageal reflux. Gut 2004;53:1730–5.
23. Moraes-Filho JPP, Navarro-Rodriguez T, Eisig JN, Barbuti RC, Chinzon D, Quigley EMM. Comorbidities are frequent in patients with gastroesophageal reflux disease in a tertiary health care hospital. Clin São Paulo Braz 2009;64:785–90.
24. Keller J, Frederking D, Layer P. The spectrum and treatment of gastrointestinal disorders during pregnancy. Nat Clin Pract Gastroenterol Hepatol 2008;5:430–43.
25. Richter JE. Review article: the management of heartburn in pregnancy. Aliment Pharmacol Ther 2005;22:749–57.
26. Marrero JM, Goggin PM, de Caestecker JS, Pearce JM, Maxwell JD. Determinants of pregnancy heartburn. Br J Obstet Gynaecol 1992;99:731–4.
27. Habr F, Raker C, Lin CL, Zouein E, Bourjeily G. Predictors of gastroesophageal reflux symptoms in pregnant women screened for sleep disordered breathing: a secondary analysis. Clin Res Hepatol Gastroenterol 2013;37:93–9.
28. Nazer D, Thomas R, Tolia V. Ethnicity and gender related differences in extended intraesophageal pH monitoring parameters in infants: a retrospective study. BMC Pediatr 2005;5:24.
29. Yamaguchi T, Sugimoto T, Yamada H, Kanzawa M, Yano S, Yamauchi M, et al. The presence and severity of vertebral fractures is associated with the presence of esophageal hiatal hernia in postmenopausal women. Osteoporos Int USA 2002;13:331–6.
30. Watanabe A, Iwakiri R, Yamaguchi D, Higuchi T, Tsuruoka N, Miyahara K, et al. Risk factors for resistance to proton pump inhibitor maintenance therapy for reflux esophagitis in Japanese women over 60 years. Digestion 2012;86:323–8.
31. Akiyama T, Inamori M, Akimoto K, Iida H, Mawatari H, Endo H, et al. Gender differences in the age-stratified prevalence of erosive esophagitis and Barrett’s epithelium in Japan. Hepatogastroenterology 2009;56:144–8.
32. Dent J, Vakil N, Jones R, Bytzer P, Schöning U, Halling K, et al. Accuracy of the diagnosis of GORD by questionnaire, physicians and a trial of proton pump inhibitor treatment: the Diamond Study. Gut 2010;59:714–21.
33. Thomson ABR, Barkun AN, Armstrong D, Chiba N, White RJ, Daniels S, et al. The prevalence of clinically significant endoscopic findings in primary care patients with uninvestigated dyspepsia: the Canadian Adult Dyspepsia Empiric Treatment — Prompt Endoscopy (CADET-PE) study. Aliment Pharmacol Ther 2003;17:1481–91.
34. Boeckxstaens GE, Smout A. Systematic review: role of acid, weakly acidic and weakly alkaline reflux in gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2010;32:334–43.
35. Atkins D, Briss PA, Eccles M, Flottorp S, Guyatt GH, Harbour RT, et al. Systems for grading the quality of evidence and the strength of recommendations II: pilot study of a new system. BMC Health Serv Res 2005;5:25.
36. Bruley des Varannes S, Cestari R, Usova L, Triantafyllou K, Alvarez Sanchez A, Keim S, et al. Classification of adults suffering from typical gastroesophageal reflux disease symptoms: contribution of latent class analysis in a European observational study. BMC Gastroenterol 2014;14:112.
37. DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey LM, editors. Pharmacotherapy: a pathophysiologic approach. 9th ed. New York: McGraw-Hill; 2014.
38. Vakil NB, Traxler B, Levine D. Dysphagia in patients with erosive esophagitis: prevalence, severity, and response to proton pump inhibitor treatment. Clin Gastroenterol Hepatol 2004;2:665–8.
39. Malfertheiner P, Nocon M, Vieth M, Stolte M, Jaspersen D, Koelz HR, et al. Evolution of gastro-oesophageal reflux disease over 5 years under routine medical care—the ProGERD study. Aliment Pharmacol Ther 2012;35:154–64.
40. Corley DA, Kubo A. Body mass index and gastroesophageal reflux disease: a systematic review and meta-analysis. Am J Gastroenterol 2006;101:2619–28.
41. Lundell LR, Dent J, Bennett JR, Blum AL, Armstrong D, Galmiche JP, et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut 1999;45:172–80.
42. Navarro-Rodriguez T, Fass R. Functional heartburn, nonerosive reflux disease, and reflux esophagitis are all distinct conditions—a debate: pro. Curr Treat Options Gastroenterol 2007;10:294–304.
43. Ronkainen J, Talley NJ, Storskrubb T, Johansson SE, Lind T, Vieth M, et al. Erosive esophagitis is a risk factor for Barrett’s esophagus: a community-based endoscopic follow-up study. Am J Gastroenterol 2011;106:1946–52.
44. Kuipers EJ. Barrett esophagus and life expectancy: implications for screening? Gastroenterol Hepatol 2011;7:689–91.
45. Lagergren J, Bergström R, Nyrén O. Association between body mass and adenocarcinoma of the esophagus and gastric cardia. Ann Intern Med 1999;130:883–90.
46. Malagelada J, Bazzoli F, Boeckxstaens G, De Looze D, Fried M, Kahrilas P, et al. World Gastroenterology Organisation Global Guidelines. Dysphagia [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2014 [accessed 2015 Dec 8]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/dysphagia/dysphagia-english.
47. Moraes-Filho J, Cecconello I, Gama-Rodrigues J, Castro L, Henry MA, Meneghelli UG, et al. Brazilian consensus on gastroesophageal reflux disease: proposals for assessment, classification, and management. Am J Gastroenterol 2002;97:241–8.
48. Hirano I, Richter JE, Practice Parameters Committee of the American College of Gastroenterology. ACG practice guidelines: esophageal reflux testing. Am J Gastroenterol 2007;102:668–85.
49. Hemmink GJM, Bredenoord AJ, Weusten BLAM, Monkelbaan JF, Timmer R, Smout AJPM. Esophageal pH-impedance monitoring in patients with therapy-resistant reflux symptoms: “on” or “off” proton pump inhibitor? Am J Gastroenterol 2008;103:2446–53.
50. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon ATR, Bazzoli F, et al. Management of Helicobacter pylori infection—the Maastricht IV/ Florence Consensus Report. Gut 2012;61:646–64.
51. Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015;64:1353–67.
52. Yaghoobi M, Farrokhyar F, Yuan Y, Hunt RH. Is there an increased risk of GERD after Helicobacter pylori eradication? A meta-analysis. Am J Gastroenterol 2010;105:1007–13; quiz 1006, 1014.
53. Chiba N, Van Zanten SJOV, Sinclair P, Ferguson RA, Escobedo S, Grace E. Treating Helicobacter pylori infection in primary care patients with uninvestigated dyspepsia: the Canadian adult dyspepsia empiric treatment—Helicobacter pylori positive (CADET-Hp) randomised controlled trial. BMJ 2002;324:1012–6.
54. Kuipers EJ, Lundell L, Klinkenberg-Knol EC, Havu N, Festen HP, Liedman B, et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication. N Engl J Med 1996;334:1018–22.
55. Lundell L, Vieth M, Gibson F, Nagy P, Kahrilas PJ. Systematic review: the effects of long-term proton pump inhibitor use on serum gastrin levels and gastric histology. Aliment Pharmacol Ther 2015;42:649–63.
56. Chen SL, Gwee KA, Lee JS, Miwa H, Suzuki H, Guo P, et al. Systematic review with meta-analysis: prompt endoscopy as the initial management strategy for uninvestigated dyspepsia in Asia. Aliment Pharmacol Ther 2015;41:239–52.
57. Chander B, Hanley-Williams N, Deng Y, Sheth A. 24 Versus 48-hour bravo pH monitoring. J Clin Gastroenterol 2012;46:197–200.
58. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011;128:3–20.e6; quiz 21–2.
59. Zimmerman J, Hershcovici T. Bowel symptoms in nonerosive gastroesophageal reflux disease: nature, prevalence, and relation to acid reflux. J Clin Gastroenterol 2008;42:261–5.
60. Festi D, Scaioli E, Baldi F, Vestito A, Pasqui F, Di Biase AR, et al. Body weight, lifestyle, dietary habits and gastroesophageal reflux disease. World J Gastroenterol 2009;15:1690–701.
61. de Bortoli N, Guidi G, Martinucci I, Savarino E, Imam H, Bertani L, et al. Voluntary and controlled weight loss can reduce symptoms and proton pump inhibitor use and dosage in patients with gastroesophageal reflux disease: a comparative study. Dis Esophagus 2014 Dec 17 [Epub ahead of print].
62. Piche T, des Varannes SB, Sacher-Huvelin S, Holst JJ, Cuber JC, Galmiche JP. Colonic fermentation influences lower esophageal sphincter function in gastroesophageal reflux disease. Gastroenterology 2003;124:894–902.
63. [No authors listed.] An evidence-based appraisal of reflux disease management—the Genval Workshop Report. Gut 1999;44 Suppl 2:S1–16.
64. Becher A, Dent J. Systematic review: ageing and gastro-oesophageal reflux disease symptoms, oesophageal function and reflux oesophagitis. Aliment Pharmacol Ther 2011;33:442–54.
65. Knuff TE, Benjamin SB, Worsham GF, Hancock JE, Castell DO. Histologic evaluation of chronic gastroesophageal reflux. An evaluation of biopsy methods and diagnostic criteria. Dig Dis Sci 1984;29:194–201.
66. Johnsson F, Joelsson B, Gudmundsson K, Greiff L. Symptoms and endoscopic findings in the diagnosis of gastroesophageal reflux disease. Scand J Gastroenterol 1987;22:714–8.
67. Johnston BT, Troshinsky MB, Castell JA, Castell DO. Comparison of barium radiology with esophageal pH monitoring in the diagnosis of gastroesophageal reflux disease. Am J Gastroenterol 1996;91:1181–5.
68. Peng S, Xiong LS, Xiao YL, Lin JK, Wang AJ, Zhang N, et al. Prompt upper endoscopy is an appropriate initial management in uninvestigated chinese patients with typical reflux symptoms. Am J Gastroenterol 2010;105:1947–52.
69. Wang C, Hunt RH. Medical management of gastroesophageal reflux disease. Gastroenterol Clin North Am 2008;37:879–99, ix.
70. Tytgat GN, McColl K, Tack J, Holtmann G, Hunt RH, Malfertheiner P, et al. New algorithm for the treatment of gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2008;27:249–56.
71. Sheikh I, Waghray A, Waghray N, Dong C, Wolfe MM. Consumer use of over-the-counter proton pump inhibitors in patients with gastroesophageal reflux disease. Am J Gastroenterol 2014;109:789–94.
72. Person E, Rife C, Freeman J, Clark A, Castell DO. A novel sleep positioning device reduces gastroesophageal reflux: a randomized controlled trial. J Clin Gastroenterol 2015;49:655–9.
73. Boardman HF, Heeley G. The role of the pharmacist in the selection and use of over-the-counter proton-pump inhibitors. Int J Clin Pharm 2015;37:709–16.
74. Berardi RR, American Pharmacists Association, editors. Handbook of nonprescription drugs: an interactive approach to self-care. 16th ed. Washington, DC: American Pharmacists Association; 2009.
75. Weijenborg PW, Cremonini F, Smout AJPM, Bredenoord AJ. PPI therapy is equally effective in well-defined non-erosive reflux disease and in reflux esophagitis: a meta-analysis. Neurogastroenterol Motil 2012;24:747–57, e350.
76. Bell NJ, Burget D, Howden CW, Wilkinson J, Hunt RH. Appropriate acid suppression for the management of gastro-oesophageal reflux disease. Digestion 1992;51 Suppl 1:59–67.
77. Hunt RH. Importance of pH control in the management of GERD. Arch Intern Med 1999;159:649–57.
78. Howden CW, Kahrilas PJ. Editorial: just how “difficult” is it to withdraw PPI treatment? Am J Gastroenterol 2010;105:1538–40.
79. Niv Y. Gradual cessation of proton pump inhibitor (PPI) treatment may prevent rebound acid secretion, measured by the alkaline tide method, in dyspepsia and reflux patients. Med Hypotheses 2011;77:451–2.
80. Fass R, Sifrim D. Management of heartburn not responding to proton pump inhibitors. Gut 2009;58:295–309.
81. Richter JE. The patient with refractory gastroesophageal reflux disease. Dis Esophagus 2006;19:443–7.
82. Dal-Paz K, Moraes-Filho JP, Navarro-Rodriguez T, Eisig JN, Barbuti R, Quigley EMM. Low levels of adherence with proton pump inhibitor therapy contribute to therapeutic failure in gastroesophageal reflux disease. Dis Esophagus 2012;25:107–13.
83. Sheen E, Triadafilopoulos G. Adverse effects of long-term proton pump inhibitor therapy. Dig Dis Sci 2011;56:931–50.
84. Leonard J, Marshall JK, Moayyedi P. Systematic review of the risk of enteric infection in patients taking acid suppression. Am J Gastroenterol 2007;102:2047–56; quiz 2057.
85. Lødrup A, Pottegård A, Hallas J, Bytzer P. Use of proton pump inhibitors after antireflux surgery: a nationwide register-based follow-up study. Gut 2014;63:1544–9.
86. Madan A, Minocha A. Despite high satisfaction, majority of gastro-oesophageal reflux disease patients continue to use proton pump inhibitors after antireflux surgery. Aliment Pharmacol Ther 2006;23:601–5.
87. Thomas V, Rangan K, Kumar S. Occurrence of functional heartburn in patients with symptoms of gastroesophageal reflux disease (GERD) not responding to proton pump inhibitors (PPI) [abstract] 2011;106(Suppl 2):S25.
88. Fuchs KH, Babic B, Breithaupt W, Dallemagne B, Fingerhut A, Furnee E, et al. EAES recommendations for the management of gastroesophageal reflux disease. Surg Endosc 2014;28:1753–73.
89. Alvarez Herrero L, Curvers WL, van Vilsteren FGI, Wolfsen H, Ragunath K, Wong Kee Song LM, et al. Validation of the Prague C&M classification of Barrett’s esophagus in clinical practice. Endoscopy 2013;45:876–82.
90. Sharma P, Dent J, Armstrong D, Bergman JJGHM, Gossner L, Hoshihara Y, et al. The development and validation of an endoscopic grading system for Barrett’s esophagus: the Prague C & M criteria. Gastroenterology 2006;131:1392–9.

















