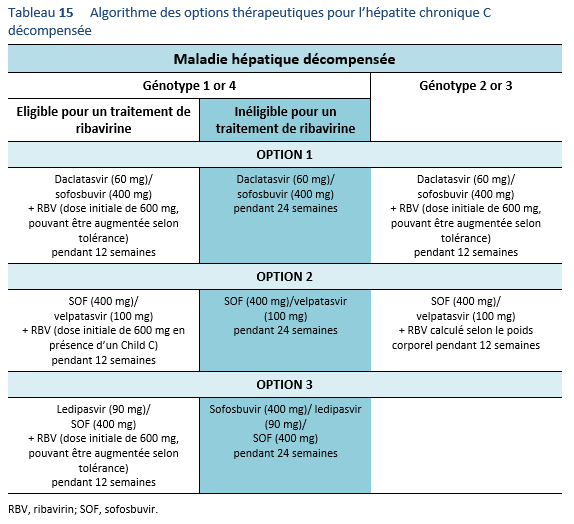
5.1 Buts du traitement
Le but du traitement de l’infection par le VHC est de limiter les complications liées au virus. Ce but est atteint lorsqu’on éradique le virus afin d’atteindre une réponse virale soutenue (RVS ; sustained viral response : SVR). Les patients chez lesquels on a obtenu une RVS/SVR sont ainsi libérés du virus et les risques d’une réactivation du virus sont négligeables. Une amélioration de la nécrose, de l’inflammation, de la fibrose hépatiques et une diminution du risque de développer un cancer hépatocellulaire ont été démontrés chez les patients avec une RVS/SVR.
Il n’est pas nécessaire d’instaurer un traitement antiviral chez les patients chez qui une infection VHC aiguë s’est résolue sans traitement. Suivant les données, entre 15% et 50% des patients guérissent spontanément.
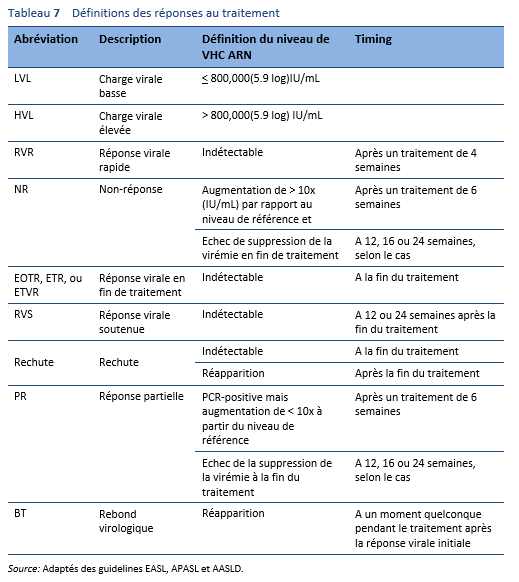
5.2 Principes du traitement
Il a été démontré que le traitement et la guérison de l’hépatite C préviennent le risque de complication à long terme et que le traitement représente la méthode de prise en charge principale d’une infection chronique par hépatite C.
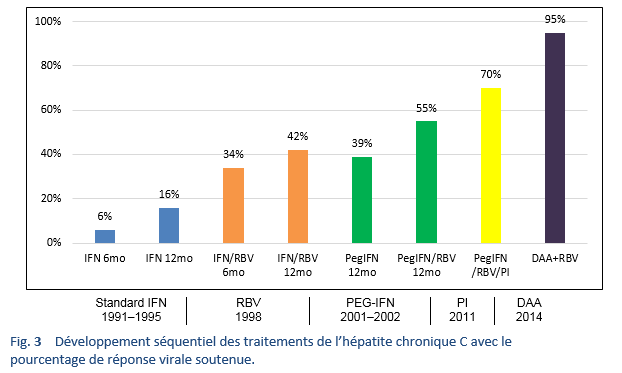
Les génotypes non 1 du VHC sont les plus fréquents dans les pays à forte densité de population de l’Asie du Sud, de l’Extrême-Orient, d’Afrique et du Moyen-Orient. Avant l’ère de l’interféron pegylé (PEG-IFN), une monothérapie conventionnelle d’IFN ou une thérapie combinée conventionnelle d’IFN/RBV représentaient le traitement de base pour le traitement du VHC dans la plupart des pays du monde. A partir de 2002, PEG-IFN/RBV a été introduit. Les études-clés sur le traitement par PEG-IFN/RBV ont montré une RVS de 40–45% chez les patients avec le génotype 1, jusqu’à 80% chez ceux avec le génotype 2 et de seulement 50% chez ceux avec le génotype 3a. Chez des patients traités pour une hépatite C chronique, 50–60% se sont révélés être non répondeurs ou rechuteurs [35]. De plus, ces traitements nécessitaient des injections d’IFN/RBV pendant 24–48 semaines, ce qui représentait un taux de toxicité considérable et trop de patients étaient inaptes à un traitement par IFN ou étaient réticents à l’idée d’effectuer un tel traitement en raison des effets secondaires indésirables. Il était donc nécessaire de trouver un régime de traitement idéal par des médicaments oraux en dose journalière unique avec une thérapie de courte durée et des effets secondaires minimes, qui seraient efficaces pour tous les génotypes et qui comporteraient un taux de RVS élevé (> 95%), indépendamment du stade de la fibrose hépatique, d’une non-réponse antérieure à un traitement d’IFN/RBV, du sexe, de la race ou de l’âge [39].
A partir de 2011, les antiviraux à action direct (DAA) ont été introduits et représentent actuellement le traitement standard.
Le sofosbuvir (SOF), aisément à disposition dans les pays en voie de développement, est pris sous forme d’un comprimé de 400 mg une fois par jour. Le dosage du PEG-IFN-a2a devrait être de 180 µg une fois par semaine. Le dosage du PEG-IFN alfa-2b devrait se baser sur le poids du patient (1.5 µg/kg par semaine). Le dosage de ribavirine devrait également se baser sur le poids du patient (par exemple, 1000 mg < 75 kg et 1200 mg > 75 kg.)
Le coût des nouveaux DAA était au début très élevé et des efforts ont été entrepris afin de négocier un prix favorable pour les pays à ressources limitées, ce qui a conduit à une diversité dans les prix dans les différentes régions du monde. Par exemple, un seul emballage de sofosbuvir coûtait $28’000 aux Etats-Unis, donc environ $84’000 pour un traitement de 3 mois, tandis qu’un produit générique coûtait $300 au Pakistan et en Inde (donc $1'800 pour un traitement de 6 mois).
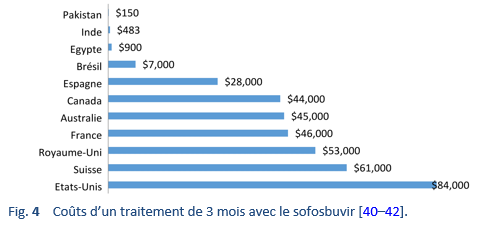
Le fabricant du Sofosbuvir, Gilead Sciences, Inc., a volontairement conclu des accords d’octroi de licence avec plusieurs autres fabricants afin de diffuser les versions locales de médicaments génériques dans certains pays à ressources limitées ou moyennes et les prix des médicaments ont ainsi encore diminué dans ces pays. Cependant, ces accords d’exploitation sous licences ne sont pas à disposition dans plusieurs pays à ressources moyennes où l’hépatite C représente un lourd fardeau de maladie, tels la Chine, le Brésil, l’Argentine, l’Iran et la Turquie. Les versions génériques des DAA sont relativement bon marché et représentent un traitement alternatif efficace. Dans une étude sur 448 patients, Freeman et al. font état d’une RVS4 d’environ 94% avec l’utilisation des DAA génériques [43].
Les options de traitement discutées dans ce guideline sont à interpréter selon les services de santé et les ressources financières à disposition et sont basées sur quelques données empiriques venant d’experts et de sociétés médicales régionaux, sans pour autant s’écarter des pratiques médicales basées sur les preuves. Ceci a été fait dans le but de rendre le traitement de l’hépatite C applicable mondialement et réalisable pratiquement, permettant ainsi à tous les médecins de mettre à jour leurs connaissances et de conférer ainsi un maximum de bénéfice aux patients souffrant d’une hépatite C partout dans le monde.
Les guidelines ne sont pas des règles fixes, mais représentent un processus dynamique et en perpétuel changement, afin d’aider les médecins à donner un traitement approprié à leurs patients et en tenant compte des approches individualisées là où c’est nécessaire. Il est toujours nécessaire d’améliorer et de mettre à jour les guidelines lorsque de nouvelles études fournissent de nouvelles preuves.
5.3 Qui traiter?
L’infection par le virus de l’hépatite C peut guérir avec un traitement antiviral ; en raison de la nature asymptomatique de la maladie, beaucoup de patients ignorent cependant qu’ils sont infectés et même pour ceux chez lesquels un diagnostic a été posé, l’accès au traitement reste problématique dans beaucoup de régions [5].
Un plaidoyer publié par l’Organisation mondiale de la santé (World Health Organization) définit l’objectif d’éliminer les hépatites B et C d’ici 2030 [44]. Tous les patients souffrant d’une infection VHC chronique devraient ainsi recevoir un traitement, sauf ceux avec une espérance de vie réduite en raison de comorbidités sévères. Les patients à haut risque de développer des complications hépatiques devraient être traités immédiatement.
Les patients à haut risque de développer des complications hépatiques sont:
- Les patients avec une fibrose avancée stade métavir ≥ F2
- Les patients avec une cirrhose décompensée qui sont dans l’attente d’une transplantation hépatique
- Les patients ayant subi une greffe hépatique
Les patients avec des complications extra hépatiques sévères telles une vasculite, une cryoglobulinémie à l’origine de dommages aux organes cibles ou un syndrome glomérulonéphrétique/néphrotique à l’origine d’une protéinurie importante.
5.4 Prédicteurs d’une réponse au traitement
Les recommandations concernant le traitement optimal pour une infection par l’hépatite C continuent à évoluer, mais sont quand-même influencées par quelques facteurs bien connus pouvant compromettre une RVS dans certains cas:
- Le génotype du virus de l’hépatite C
- Les traitements anti-VHC antérieurs
- Une maladie hépatique compensée vs décompensée
- Les interactions entre médicaments
- Une maladie rénale chronique
- Transplantation d’organe solide
Les facteurs suivants sont prédictifs d’une réponse moins favorable à un traitement avec des combinaisons d’antiviraux à action directe (DAA):
- Traitement antérieur avec des antiviraux à action directe
- Cirrhose hépatique (Child–Pugh B et C)
- Mauvaise compliance au traitement
5.5 Evaluation avant le traitement
Il est indispensable de pratiquer les tests et les évaluations suivants avant d’entreprendre un traitement par des antiviraux à action directe (DAA):
- Une anamnèse détaillée et un examen clinique sont indispensables, y compris une anamnèse d’autres éventuelles maladies hépatiques et d’autres conditions pouvant avoir un effet néfaste sur le foie, tels une infection par le virus de l’hépatite B, un alcoolisme, une maladie auto-immune, une maladie hépatique métabolique ou la prise de médicaments potentiellement hépatotoxiques. Ceux-ci devraient être pris en considération et les mesures appropriées prises afin de réduire les risques potentiels.
- D’autres évaluations devraient être envisagées (cardiopulmonaire, psychiatrique) ainsi qu’une évaluation du risque de non compliance. Les mesures appropriées devraient être prises afin de réduire les risques potentiels.
- Une évaluation de la prise de médicaments actuelle ou antérieure et de la compliance lors de traitements antérieurs. Les interactions importantes potentielles entre médicaments devraient également être prises en considération.
- Le degré de fibrose hépatique devrait être évalué par des mesures non invasives:
— Les études ont démontré que le FibroScan représente une alternative fiable à la ponction-biopsie du foie et que le degré de fibrose peut être facilement quantifié et avec certitude chez >95% des patients [45]. En ce qui concerne l’élastographie transitoire, l’interprétation de celle-ci devrait comporter un intervalle interquartile/des valeurs médianes de < 30% et des ALT sériques de < 5 × la limite supérieure de la norme. Il ne devrait pas y avoir une consommation excessive d’alcool et il faut également tenir compte de l’IMC du patient. En présence d’un indexe de masse corporel (IMC) de >30 kg/m2, l’utilisation de sondes extra-larges doit être envisagée.
— Dans les régions à ressources limitées et dans les endroits où le FibroScan n’est pas disponible, des scores tels le « fibrosis 4 index (FIB4) », index du rapport AST sur thrombocytes (APRI), et l'imagerie par impulsion de force de radiation acoustique (ARFI) peuvent être utilisés. Un score APRI ≥ 2 peut s’utiliser afin de prédire la présence d’une cirrhose. A son point limite, le score ARFI a une sensibilité de 48% mais une spécificité de 94% pour prédire une cirrhose. Il peut également être utilisé afin de prédire la présence d’une fibrose importante (stades 2–4). Si on utilise une valeur seuil limite de 1.5, sa sensibilité est de 37% et sa spécificité est de 95% pour une fibrose importante [46,47].
— Une ponction-biopsie hépatique ne devrait être considérée que si il existe une possibilité d’étiologie additionnelle.
- Une détermination quantitative du VHC-ARN sérique en utilisant un dosage sensitif par PCR en temps réel avec un seuil inférieur de détection de ≤ 15 IU/mL.
- Génotype du VHC.
- Chez les patients avec une cirrhose connue ou suspectée, le score de Child–Turcotte–Pugh et le score MELD (« Model for End-Stage Liver Disease » devraient être calculés.
5.5.1 Recommandations en ce qui concerne la surveillance avant le traitement
1. Dans les 12 semaines avant de commencer un traitement, il faudrait effectuer une formule sanguine complète (FSC), des tests de la fonction hépatique, une albumine sérique, l’INR, un taux de filtration glomérulaire et un dosage de la TSH (si un traitement par IFN est envisagé).
2. Une PCR quantitative ainsi qu’un génotypage devraient être effectués avant de commencer tout traitement.
3. Les femmes en âge de procréer devraient subir un test de grossesse urinaire avant de commencer un traitement. Tous les nouveaux traitements oraux, avec ou sans ribavirine, sont actuellement contre-indiquées pendant la grossesse ou pendant l’allaitement en raison du manque de données de sécurité adéquates chez les humains ; des mesures de contraception adéquates sont toujours systématiquement à recommander chez les femmes en âge de procréer [48].
4. Pour les traitements contenant de la ribavirine, l’âge du patient et toute comorbidité cardiovasculaire en raison d’une anémie secondaire devraient être prise en compte.
5.6 Evaluation pendant le traitement
Evaluations recommandées chez les patients pendant le traitement pour VHC:
1. Insister sur la nécessité d’une compliance au traitement, soit lors des consultations ou par téléphone. Interroger le patient concernant d’éventuels effets secondaires et renseigner le patient sur les éventuelles interactions potentielles entre médicaments. Se référer à ce sujet au très utile “HEP Drug Interaction Checker” de l’université de Liverpool (http://www.hep-druginteractions.org) [49].
2. Après 4 semaines de traitement, effectuer les examens suivants : FSC, créatinine sérique, taux de filitraton clomérulaire (GFR) et tests hépatiques. La FSC peut être effectuée plus souvent chez les patients sous traitement de ribavirine si ceci est indiqué cliniquement.
3. Doser la TSH à 12 semaines chez les patients sous traitement d’interféron.
4. PCR quantitative à la fin du traitement et à 12 semaines après la fin du traitement.
5.6.1 Quand arrêter le traitement en raison des effets secondaires
- En présence d’une augmentation de 10x ou davantage des ALT après 4 semaines de traitement.
- En présence d’une augmentation de moins <10 x des ALT mais en présence d’un des facteurs suivants :
— Apparition de symptômes (nausées, vomissements, faiblesse)
— Ictère
— Augmentation de la bilirubine, des phosphatases alcalines (ALP) ou l’INR
- En présence d’une augmentation de moins de 10x des ALT et si le patient est asymptomatique, mesurer de nouveau des ALT à 6 semaines et si ceci reste élevé de façon durable, penser à arrêter le traitement.
5.7 Evaluation post-traitement
5.7.1 Chez les patients non-répondeurs au traitement
1. Tests hépatiques, FSC, INR tous les 6–12 mois afin d’évaluer la progression de la maladie (patients avec F4).
2. Surveillance de l’apparition du carcinome hépato-cellulaire (CHC) chez les patients avec une fibrose avancée (métavir F3/F4) par ultrasonographie tous les 6 mois.
3. Surveillance endoscopique afin de détecter d’éventuelles varices oesophagiennes chez les patients cirrhotiques.
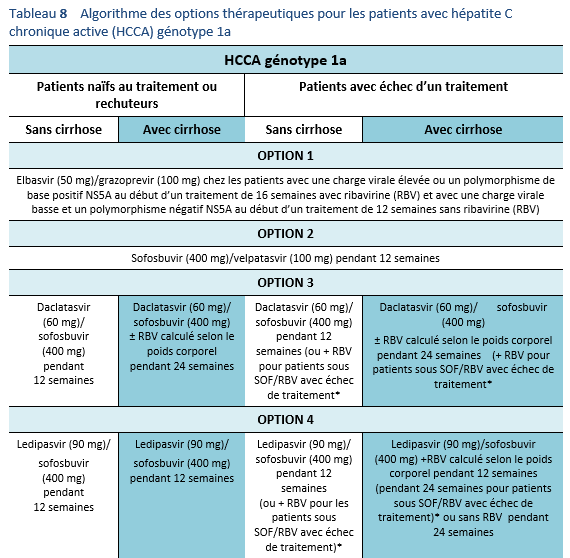
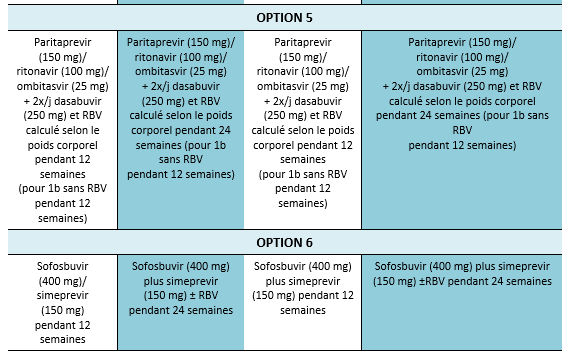
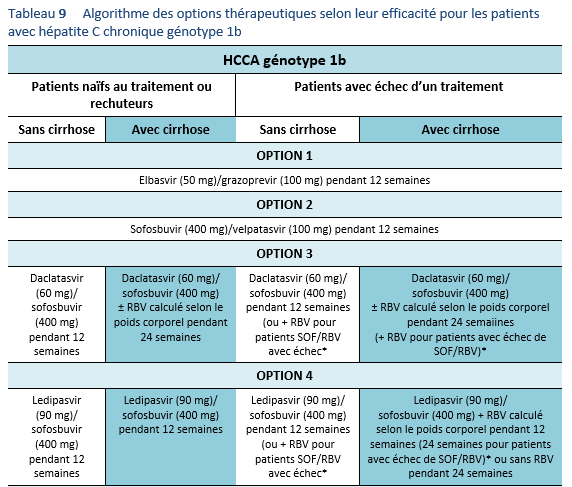
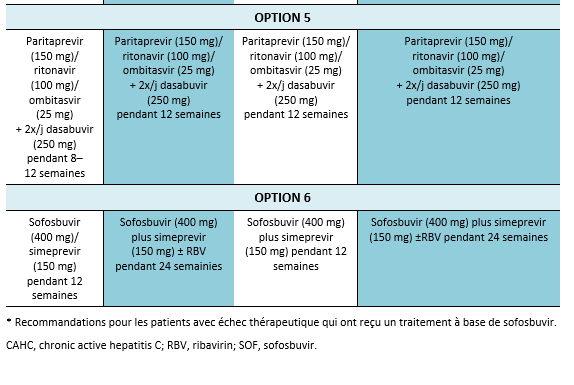
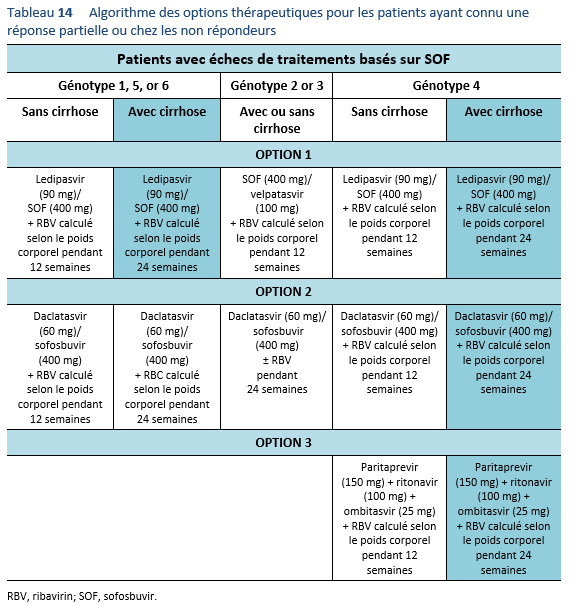
4. Considérer l’éventualité d’un nouveau traitement au cas où un traitement alternatif efficace serait à disposition. Actuellement, une évaluation avant traitement est nécessaire afin de détecter une éventuelle mutation et afin de pouvoir choisir le schéma de traitement optimal. Les guidelines à disposition actuellement recommandent d’effectuer une évaluation des mutations de NS5A chez les patients ayant subi un échec de traitement aux Direct Acting Antivirals (DAA/AAD, notamment avant de penser à effectuer un traitement d’elbasvir/grazoprevir chez les patients avec un génotype 1a.
5.7.2 Chez les patients avec réponse virologique soutenue (sustained viral response : SVR/RVS)
1. Chez les patients avec une fibrose F0–F2, les mêmes recommandations s’appliquent comme s’il n’y a jamais eu d’infection VHC.
2. Chez les patients avec une fibrose F3–F4, il est recommandé d’effectuer une surveillance par ultrason 2 x par année à la recherche d’un éventuel CHC.
3. Surveillance endoscopique de base chez les patients cirrhotiques ; s’il existe des varices il est recommandé de les traiter et de les surveiller de façon standard.
4. Si les tests hépatiques restent anormaux malgré la présence d’une RVS, d’autres origines de la maladie hépatique devraient être recherchées.
5.8 Traitement avec des agents oraux et sans interféron pour l’hépatite C chronique depuis 2014
- Les Direct Acting Antivirals (DAA/AAD de la deuxième génération ont été approuvés par les autorités américains (FDA) en décembre 2013 et en janvier 2014 pour le traitement de l’hépatite C chronique génotype 1, qui est le génotype le plus répandu et qui est reconnu comme étant difficile à traiter. Le premier DAA/AAD a été le sofosbuvir (SOF), qui est un inhibiteur de la polymérase NS5B. L’étude ELECTRON a été la première à évaluer SOF/RBV et une RVS a été observée chez 84% des 25 patients naïfs au traitement après 24 semaines de traitement (RVS 24) [50,51]. Dans une étude ultérieure avec un traitement de sofosbuvir et RBV pendant 24 semaines chez 60 patients avec un génotype 1 et naïfs au traitement avec également des facteurs pronostiques défavorables (ethnicité afro-américaine, génotypes du gène de l’interleukine 28B et charge viral de >800,000 IU/mL), le taux de RVS (SVR 24) était de 68% [51].
- Dans l’étude ELECTRON, des patients avec un génotype 2 et 3 sans cirrhose ont reçu SOF/RBV et le taux de RVS était de 100% (RVS 24) [52]. Dans l’étude FISSION, 499 patients naïfs au traitement ont reçu SOF/RBV pendant 12 semaines et le taux de RVS 12 était de 97% chez les patients avec VHC génotype 2. Chez les patients avec le génotype 3, le taux de RVS 12 n’était que de 56% [53]. L’étude POSITRON a également rapporté les taux de RVS 24 après 24 semaines de traitement de 61% pour le génotype 3 et de 93% pour le génotype 2 [54]. Des résultats semblables ont également été rapportés par l’étude FUSSION, avec des taux de RVS de 62% chez les patients avec le génotype 3.
- Par la suite, plusieurs médicaments administrés de manière séparée ou dans des combinaisons à dose fixe ont été approuvés par la FDA, notamment le daclatasvir, 3D Regimen, paritaprevir + dasabuvir/ombitasvir + ritonavir (Viekira pak).
- Une des thérapies combinées pour tous les génotypes les plus récentes (connue sous le nom Epclusa) qui ont été approuvées par la FDA comporte sofosbuvir + velpatasvir [55]. Dans une étude de phase 3, Feld et al. ont administré cette combinaison pendant 12 semaines et rapportaient un taux de RVS 12 chez 99% des patients avec des génotypes 1, 2, 4, 5 et 6 [56]. L’étude ASTRAL-3 a rapporté une RVS 12 chez 95% de patients avec un génotype 3 patients traités par sofosbuvir + velpatasvir pendant 12 semaines [57]. Dans une autre étude, Curry et al. ont administré cette combinaison chez les patients décompensés, avec un taux de RVS de 83% chez les patients l’ayant pris pendant 12 semaines, 86% chez ceux l’ayant pris pendant 24 semaines et de 94% chez les patients l’ayant pris avec de la ribavirine pendant 12 semaines [58].
- Le Zepatier est une autre combinaison pour tous les génotypes comportant des AAD qui a été approuvée en 2016 et qui associe 100 mg de grazoprevir et 50 mg d’elbasvir. L’étude C-SWIFT a étudié une combinaison de Zepatier et sofosbuvir et a rapporté un taux d’efficacité de >90% chez les patients avec un génotype 1 l’ayant pris pendant 8 semaines et pendant 12 semaines chez les patients avec un génotype 3 [59].
5.9 Traitement des populations spécifiques
5.9.1 Traitement de l’hépatite C aiguë
L’hépatite C aiguë est difficile à diagnostiquer chez les patients asymptomatiques, d’autant plus quand la date exacte de la contamination par le virus n’est pas connue. Deux questions doivent être prise en considération chez les patients avec une hépatite C aiguë : tout d’abord la question de quand il faut initier un traitement et deuxièmement quel traitement utiliser et pendant combien de temps.
Dans une méta-analyse de 16 études, il a été constaté que le résultat était meilleur chez les patients qui ont bénéficié d'un traitement à un stade précoce que chez les patients qui ont été mis sous observation dans l’attente d’une éventuelle clairance spontanée. Dans une autre étude, une RVS de 85–100% a été obtenue avec un traitement précoce et des doses plus élevées d’interféron conventionnel à une dose de 5–10 millions d’unités/jour pendant 12 semaines. Le PEG-IFN à une dose de 1.2–1.3 mg/kg par semaine a également été étudié en raison de son schéma posologique commode, mais son coût était plus élevé [60–65].
L’étude de Deterding et al. a montré qu’un traitement tardif s’est montré aussi efficace qu’un traitement précoce. De plus, effectuer un traitement tardif permet de réduire la possibilité d’un traitement inutile chez les patients pouvant éliminer le virus de façon spontanée sans traitement ; une surveillance étroite est cependant souhaitable dans de tels cas [66].
Vu que les nouveaux AAD sont plus efficaces et plus sûrs, l’argument en faveur d’un traitement précoce est devenu plus faible relativement parlant. Les nouvelles recommandations sont ainsi énumérées ci-dessous.
- Contrôle régulier du VHC ARN pendant au moins 6 mois afin de pouvoir détecter une éventuelle clairance spontanée.
- Conseils chez les patients avec une infection par le VHC aiguë afin d’éviter la prise de tout médicament hépatotoxique (par exemple, acétaminophène) et l’alcool. Il est également nécessaire que ces patients prennent des mesures de précaution afin de réduire le risque de transmettre la maladie à d’autres personnes.
- La mise en place d’un traitement précoce ne peut être envisagée que dans des circonstances bien précises—par exemple, chez les individus à risque de transmettre la maladie à d’autres (tels que les toxicomanes i.v. ou les chirurgiens), chez les patients qui souffrent déjà d’une maladie hépatique avancée pour une autre raison et chez ceux qui risquent d’être perdus de vue. Même chez ces groupes de patients précis, Il serait souhaitable d’attendre pendant 12–16 semaines avant de commencer un traitement.
- Si nécessaire, un traitement pour une infection à VHC aiguë avec des AAD peut être administré aux mêmes doses que pour une maladie chronique.
- Le taux d’infectivité étant très bas, il n’est pas nécessaire d’instaurer un traitement prophylactique en cas de blessures par piqûres.
5.9.2 Traitement de l’infection par le VHC chez les enfants
Les avis divergent quant au traitement de hépatite C chez les enfants. L’évolution naturelle de l’infection par le virus de l’hépatite C est plutôt lente et le traitement peut ainsi être reporté jusqu’à l’adolescence. Il faut cependant admettre que les adolescents et les jeunes adultes sont peut-être davantage insouciants et de ce fait moins compliants en ce qui concerne un éventuel traitement.
Chez les enfants, la AASLD ne recommande que l’interféron plus ribavirine et le PEG-IFN est également considéré comme étant plus efficace que l’interféron conventionnel [67]. Le peginterféron alfa-2b est administré à un dosage de 60 µg/m2/semaine, tandis que le peginterféron alfa-2a est administré à un dosage de 180 µg/1.73 m2/semaine associé à la ribavirine à un dosage de 15 mg/kg/jour. Cette combinaison est administrée pendant 48 semaines chez les patients avec un génotype 1 ou 4 et pendant 24 semaines chez ceux avec un génotype 2 ou 3.
La réponse au traitement par IFN/RBV chez les enfants avec une infection par le virus de l’hépatite C est de 36–57% de RVS pour le génotype 1, de 84–100% pour les génotypes 2 et 3, et de 50–80% pour le génotype 4. Chez les enfants, le profil d’effets secondaires indésirables comprend des symptômes pseudo-grippaux, de la fièvre, de la leucopénie, des maux de tête, des douleurs abdominales, une perte d’appétit, des diarrhées et des troubles psychiatriques [68–72].
En raison des effets secondaires indésirables et du pourcentage bas de RVS, en particulier chez les enfants avec un génotype 1, un traitement par AAD peut être considéré. Il existe actuellement deux études de phase 2 en cours, sponsorisées par Gilead Sciences, et qui évaluent l’efficacité et la sécurité du ledipasvir et du sofosbuvir pour le génotype 1 et du sofosbuvir et de la RBV pour les génotypes 2 et 3, respectivement. L’excellente efficacité des nouveaux AAD chez les adultes a incité les chercheurs à évaluer leur efficacité chez les adolescents. Les paramètres pharmacocinétiques et le profil de sécurité du sofosbuvir et du ledipasvir/sofosbuvir ont été évalués chez les enfants dans le groupe d’âge 12–17 années et des résultats comparables à ceux cités plus haut ont également été rapportés chez ces patients [73]. Avant que l’usage des AAD soit approuvé chez les enfants d’autres études plus approfondies sont nécessaires.
Il est à noter:
- D’autres groupes de patients particuliers avec une hépatite C chronique—par exemple, ceux avec une insuffisance rénale, ceux avec une coinfection VHC/VIH et VHB, et ceux ayant reçu une greffe d’organe, etc. sont traités dans des centres spécialisées pour les maladies du foie ; les recommandations concernant leur traitement peuvent être trouvées dans d’autres guidelines internationaux (voir Tableau 1).
- Le traitement de l’hépatite C évolue rapidement en raison du développement rapide des AAD et il est recommandé de se référer au guidelines de l’AASLD, de l’EASL et de l’APASL.
5.10 Les génériques locaux et les DAA de marque déposée: sont-ils efficaces?
Maintenat que de nouveaux médicaments et de nouveaux AAD ont été approuvés, il y a de grands espoirs actuellement que ces médicaments vont permettre un traitement efficace, sûr et pas cher de l’hépatite C. Malgré le fait qu’il existe une très grande variation entre les prix des médicaments génériques dans le monde entier, Hill et al. ont souligné en 2013 que les coûts réels de production des AAD sont très bas—par exemple, un traitement de 12 semaines de sofosbuvir coûte environ $101 et un traitement de 12 semaines de daclatasvir coûte $20 [74].
Il existe plusieurs fabricants de génériques actuellement et la vive concurrence entre eux devrait permettre de nouvelles diminutions du prix des AAD. Des pays à faible revenu tels le Pakistan et l’Inde ont libre accès aux ingrédients pharmaceutiques actifs peu chers, mais l’assurance qualité des produits concernés est douteuse. Dans des pays tels l’Egypte, où l’assurance qualité est strictement appliquée par les instances juridiques, les données concernant les médicaments génériques sont très prometteuses. L’OMS a mis en place un mécanisme en ce qui concerne l’assurance qualité de ces médicaments par le biais d’un programme de préqualification [75].
Des données préliminaires venant d’un centre au Pakistan, basées sur un générique de sofosbuvir à bas prix, ont montré un taux de réponse virologique rapide à 4 semaines de traitement (RVR) de 86.8% chez les patients avec un génotype 3 (abstrait soumis à la Digestive Diseases Week 2017). Deux abstracts présentés à l’AASLD à Boston, provenant de centres en Russie et au Qatar, ont également rapportés de bons résultats en ce qui concerne les génériques, avec une RVS d’environ 92% et 95% respectivement [76,77].
5.11 L’interféron reste-il nécessaire malgré l’arrivée des DAA? Une perspective locale
Dans le passé, l’interféron a certainement été le médicament clé dans le traitement du VHC, mais ses nombreux inconvénients et l’introduction d’alternatives sûres et efficaces sous forme des AAD ont fait que son utilisation est devenue limitée et que dans un avenir proche son utilisation pourrait même devenir obsolète pour le traitement du VHC. Il n’y a pas de raisons médicales à ne pas utiliser les AAD pour le traitement du VHC, mais dans des pays à faible revenu—en particulier dans la région d’Asie-pacifique—ils ne sont pas encore utilisés couramment. Actuellement, la seule indication à un traitement par IFN est quand il n’existe pas de libre accès aux AAD. Un autre argument pour son utilisation est que la réponse au traitement est meilleure dans des populations asiatiques, en partie dûe aux allèles de IL28B; cependant une éradication totale du virus dans le monde ne serait pas réalisable avec des traitements par IFN. Le libre accès aux AAD est la question principale à résoudre pour l’avenir. Un pas appréciable dans cette direction est représenté par les efforts effectués par Gilead Sciences, Inc. afin de fournir leurs produits aux 90 pays avec le PIB le plus bas mondialement.
5.12 Résistance aux AAD—une question sous-estimée
Le VHC a un taux de reproduction élevé, ce qui entraîne un processus de correction d’erreur par les ARN polymérisés peu efficace [78,79]. Ceci conduit à un très haut niveau de variation génétique même dans le cadre d’un seul génotype [80]. Ainsi tout individu avec une infection par VHC souffre d’une mélange de souches génétiquement similaires avec un phénotype sauvage qui prédomine et qui est sensible aux médicaments (détectable au début du traitement) ainsi que des taux bas de souches résistantes (non détectables au début du traitement). Ces souches résistantes comportent un acide aminé mutant qui rend les AAD moins efficaces ou qui rend le virus plus fort [81].
Lorsque le traitement débute avec les AAD, on constate une diminution rapide du variant sensible, ce qui rend négative l’analyse quantitative du VHC ARN. Si les AAD sont administrés pendant une période assez longue, à la fin du traitement les souches sensibles ont disparu, laissant la souche résistante à un niveau indétectable ce qui rend l’analyse quantitative du VHC ARN toujours négative. A la fin du traitement, la modification de l’environnement compétitif (avec l’élimination des souches sensibles) conduit à l’émergence de souches résistantes, avec rechute/échec par AAD.
Les souches résistantes aux différents AAD sont bien connues, avec une prévalence variable. Par exemple, pour le sofosbuvir les souches L159F, V321A et S282R sont bien connues comme étant résistantes. Aucune donnée n’est à disposition pour les deux premiers variants, tandis que le troisième variant a une résistance basse avec une prévalence d’environ 0.4%. Le daclatasvir a un variant hautement résistant, M28, avec une prévalence de 0.5–4.0%. Le ledipasvir a deux variants hautement résistants et l’un d’entre eux a une prévalence allant jusqu’à 100% pour les génotypes 2 et 4 [82].
De manière générale, la résistance aux inhibiteurs de protéase NS34A tels le boceprevir disparaît du sang périphérique dans l’espace de quelques semaines à quelques mois, tandis que la résistance aux inhibiteurs de NS5A—tels le daclatasvir, le ledipasvir et l’ombitasvir—persiste pendant des années [81]. Le sofosbuvir, un inhibiteur de la NS5B nucleoside polymerase, a une haute barrière à la résistance [82].
La résistance aux AAD représente un problème d’actualité qui mérite d’être évaluée de plus près. Des études concernant la résistance avant traitement seront probablement inclues dans les recommandations de traitement dans un proche avenir. Les guidelines de l’AASLD mis à jour en 2016 recommandent d’évaluer la résistance de NS5A chez les patients ayant subi un échec de traitement par AAD, en particulier avant d’envisager un traitement de elbasvir/grazoprevir chez les patients avec un génotype 1a [3]. Outre le génotype 1a, la résistance NS5A est également très répandue avec un génotype 3, plus prévalent au Pakistan. Il est nécessaire de mieux comprendre ce fait chez des patients ayant connu un échec de traitement par AAD au Pakistan et ces patients—en particulier ceux avec une fibrose avancée—peuvent nécessiter un renforcement du traitement avec le sofosbuvir/velpatasvir [57,58]. La résistance du VHC aux AAD peut empêcher l’obtention d’une RVS et tout patient chez qui un échec des AAD est constaté devrait être traité conformément aux recommandations dans la partie relative de ces guidelines.
5.13 Traitement du VHC par des praticiens non spécialisés
Avec la venue des AAD oraux et en particulier avec l’accès aux traitements de tous les génotypes avec prise unique par jour, le traitement du VHC semble être très facile et ne nécessite qu’une évaluation minime. La prévalence du VHC est très haute dans plusieurs pays à ressources limitées et les hépatologues et les gastroentérologues spécialisés y sont rares ; une certaine flexibilité est donc de mise. Kattakuzhy et al. ont initié l’étude ASCEND afin d’étudier la sûreté des traitements par AAD pour le VHC administrés par les médecins non spécialisés et il a été trouvé que ceux-ci étaient tout aussi sûrs et efficaces [83]. Ces résultats sont encourageants, mais il faudrait appliquer quelques modifications et limitations en tenant compte du cadre local—s’assurer d’une formation correcte des médecins généralistes tout en les encourageant à suivre les guidelines et à orienter les patients vers les spécialistes en cas de complications et de populations particulières. Ceci peut être effectué avec succès par l’usage de télé cliniques—similaires au modèle du projet ECHO [84].
5.14 Résumé
Avantage des AAD:
- Traitement oral, sans injection.
- Pour tous les génotypes: les études récentes confirment l’efficacité des AAD pour tous les génotypes (1 à 6).
- Absence d’échappement (breakthrough) du virus pendant le traitement et haut niveau de barrière à la résistance.
- Efficace pour les variants IL28B CT, TT
- Dosage simple, sans relation avec la nourriture, effets secondaires indésirables minimes et durée de traitement plus courte.
- Efficace pour les patients naïfs au traitement et les patients ayant déjà reçu un traitement
- Sûrs et efficaces chez les patients cirrhotiques.
Limitations des AAD:
- Coût élevé, en particulier pour les pays aux ressources limitées ; petites études publiées et peu d’expérience dans différents groupes de patients.
- Non disponibilité dans certains pays.
- Interactions avec d’autres médicaments.
- Résistance aux AAD.
1. European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol. 2017 Jan;66(1):153–94.
2. AASLD/IDSA HCV Guidance Panel. Recommendations for testing, managing, and treating hepatitis C [Internet]. American Association for the Study of Liver Diseases (AASLD); 2017 [cited 2017 Feb 5]. Available from: http://www.hcvguidelines.org/full-report-view.
3. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015 Sep;62(3):932–54.
4. Omata M, Kanda T, Wei L, Yu M-L, Chuang W-L, Ibrahim A, et al. APASL consensus statements and recommendation on treatment of hepatitis C. Hepatol Int. 2016 Sep;10(5):702–26.
5. World Health Organization. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version, April 2016 [Internet]. Geneva: World Health Organization; 2016 [cited 2017 Jan 5]. 138 p. Available from: http://www.who.int/hepatitis/publications/hepatitis-c-guidelines-2016/en/.
6. Mandeville KL, Krabshuis J, Ladep NG, Mulder CJ, Quigley EM, Khan SA. Gastroenterology in developing countries: Issues and advances. World J Gastroenterol. 2009 Jun 21;15(23):2839–54.
7. Zou S, Tepper M, El Saadany S. Prediction of hepatitis C burden in Canada. Can J Gastroenterol J Can Gastroenterol. 2000 Aug;14(7):575–80.
8. Palitzsch KD, Hottenträger B, Schlottmann K, Frick E, Holstege A, Schölmerich J, et al. Prevalence of antibodies against hepatitis C virus in the adult German population. Eur J Gastroenterol Hepatol. 1999 Nov;11(11):1215–20.
9. Umar M, Khaar H-B, Khan AA, Mohsin A, Din W, Shah HA, et al. Diagnosis, management and prevention of hepatitis C in Pakistan 2009. Pak J Gastroenterol. 2009;23(2):7–67.
10. Qureshi H. Prevalence of hepatitis B & C in Pakistan. Islamabad: Pakistan Medical Research Council; 2008.
11. Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000 Mar 11;355(9207):887–91.
12. Amon JJ, Garfein RS, Ahdieh-Grant L, Armstrong GL, Ouellet LJ, Latka MH, et al. Prevalence of hepatitis C virus infection among injection drug users in the United States, 1994–2004. Clin Infect Dis. 2008 Jun 15;46(12):1852–8.
13. Xia X, Luo J, Bai J, Yu R. Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis. Public Health. 2008 Oct;122(10):990–1003.
14. Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med. 2001 Jul 5;345(1):41–52.
15. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis. 2005 Sep;5(9):558–67.
16. Seeff LB. Natural history of chronic hepatitis C. Hepatology. 2002 Nov;36(5 Suppl 1):S35-46.
17. Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol. 2014 Nov;61(1 Suppl):S45-57.
18. Kandeel A, Genedy M, El-Refai S, Funk AL, Fontanet A, Talaat M. The prevalence of hepatitis C virus infection in Egypt 2015: implications for future policy on prevention and treatment. Liver Int. 2017 Jan;37(1):45–53.
19. Tohme RA, Holmberg SD. Is sexual contact a major mode of hepatitis C virus transmission? Hepatology. 2010 Oct;52(4):1497–505.
20. Vandelli C, Renzo F, Romanò L, Tisminetzky S, De Palma M, Stroffolini T, et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study. Am J Gastroenterol. 2004 May;99(5):855–9.
21. Puoti C, Guarisco R, Spilabotti L, Bellis L, Mitidieri Costanza O, Dell’ Unto O, et al. Should we treat HCV carriers with normal ALT levels? The “5Ws” dilemma. J Viral Hepat. 2012 Apr;19(4):229–35.
22. Kane A, Lloyd J, Zaffran M, Simonsen L, Kane M. Transmission of hepatitis B, hepatitis C and human immunodeficiency viruses through unsafe injections in the developing world: model-based regional estimates. Bull World Health Organ. 1999;77(10):801–7.
23. Khan AJ, Luby SP, Fikree F, Karim A, Obaid S, Dellawala S, et al. Unsafe injections and the transmission of hepatitis B and C in a periurban community in Pakistan. Bull World Health Organ. 2000;78(8):956–63.
24. Kaldor JM, Dore GJ, Correll PK. Public health challenges in hepatitis C virus infection. J Gastroenterol Hepatol. 2000 May;15 Suppl:E83–90.
25. World Health Organization. Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium. J Viral Hepat. 1999 Jan;6(1):35–47.
26. Janjua NZ, Nizamy M a. M. Knowledge and practices of barbers about hepatitis B and C transmission in Rawalpindi and Islamabad. JPMA J Pak Med Assoc. 2004 Mar;54(3):116–9.
27. World Health Organization. Global alert and response (GAR). Hepatitis C. [Internet]. Geneva: World Health Organization; 2002. Available from: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4.html.
28. Terrault NA, Dodge JL, Murphy EL, Tavis JE, Kiss A, Levin TR, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013 Mar;57(3):881–9.
29. Centers for Disease Control and Prevention. Viral hepatitis surveillance — United States, 2009 [Internet]. [cited 2017 May 2]. Available from: https://www.cdc.gov/hepatitis/Statistics/2009Surveillance/Commentary.htm.
30. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006 Apr 1;3(2):47–52.
31. Freeman AJ, Dore GJ, Law MG, Thorpe M, Von Overbeck J, Lloyd AR, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology. 2001 Oct;34(4 Pt 1):809–16.
32. Levine RA, Sanderson SO, Ploutz-Snyder R, Murray F, Kay E, Hegarty J, et al. Assessment of fibrosis progression in untreated Irish women with chronic hepatitis C contracted from immunoglobulin anti-D. Clin Gastroenterol Hepatol. 2006 Oct;4(10):1271–7.
33. Jacobson IM, Davis GL, El-Serag H, Negro F, Trépo C. Prevalence and challenges of liver diseases in patients with chronic hepatitis C virus infection. Clin Gastroenterol Hepatol. 2010 Nov;8(11):924–933; quiz e117.
34. Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, et al. Serum level of IP-10 increases predictive value of IL28B polymorphisms for spontaneous clearance of acute HCV infection. Gastroenterology. 2012 Jan;142(1):78–85.e2.
35. Vogt M, Lang T, Frösner G, Klingler C, Sendl AF, Zeller A, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood-donor screening. N Engl J Med. 1999 Sep 16;341(12):866–70.
36. Di Bisceglie AM. Hepatitis C and hepatocellular carcinoma. Hepatology. 1997 Sep;26(3 Suppl 1):34S–38S.
37. Kim WR. The burden of hepatitis C in the United States. Hepatology. 2002 Nov;36(5 Suppl 1):S30-34.
38. World Health Organization. Essential medicines and health products. First WHO prequalified hepatitis C rapid test opens the door to expanded treatment [press release] [Internet]. World Health Organization; 2016 [cited 2016 Dec 13]. Available from: http://www.who.int/medicines/news/prequal_hvc/en/.
39. Pockros PJ. Interferon-free hepatitis C therapy: how close are we? Drugs. 2012 Oct 1;72(14):1825–31.
40. Freeman JAD, Hill A. The use of generic medications for hepatitis C. Liver Int. 2016 Jul;36(7):929–32.
41. Hill A, Simmons B, Gotham D, Fortunak J. Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C. J Virus Erad. 2017 Jan 25;2(1):28–31.
42. Andrieux-Meyer I, Cohn J, de Araújo ESA, Hamid SS. Disparity in market prices for hepatitis C virus direct-acting drugs. Lancet Glob Health. 2015 Nov;3(11):e676-677.
43. Freeman J, Sallie R, Kennedy A, Hieu PTN, Freeman J, Jeffreys G, et al. High sustained virological response rates using generic direct acting antiviral treatment for hepatitis C, imported into Australia. J Hepatol. 2016 Jan 1;64(2):S209.
44. World Health Organization. Combating hepatitis B and C to reach elimination by 2030: advocacy brief [Internet]. Geneva: World Health Organization; 2016. Available from: http://www.who.int/hepatitis/publications/hep-elimination-by-2030-brief/en/.
45. Nguyen-Khac E. [Results and place of Fibroscan in the non-invasive diagnosis of hepatic fibrosis]. Rev Med Interne. 2007 Feb;28(2):94–102.
46. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015 Jul;63(1):237–64.
47. Houot M, Ngo Y, Munteanu M, Marque S, Poynard T. Systematic review with meta-analysis: direct comparisons of biomarkers for the diagnosis of fibrosis in chronic hepatitis C and B. Aliment Pharmacol Ther. 2016 Jan;43(1):16–29.
48. Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: Has anything changed for pregnant/lactating women? World J Hepatol. 2016 Apr 28;8(12):557–65.
49. University of Liverpool. Hepatitis drug interactions [Internet]. HEP Drug Interactions. 2017 [cited 2017 Jan 25]. Available from: http://www.hep-druginteractions.org/.
50. Lalezari JP, Nelson DR, Hyland RH, Lin M, Rossi SJ, Symonds WT, et al. Once daily sofosbuvir plus ribavirin for 12 and 24 weeks in treatment-naïve patients with HCV infection: the Quantum study [abstract, International Liver Congress 2013: 48th Annual Meeting of the European Association for the Study of the Liver, Amsterdam, Netherlands, 24 April–28 April 2013]. J Hepatol. 2013 Apr 1;58(Supplement 1):S346.
51. Osinusi A, Meissner EG, Lee Y-J, Bon D, Heytens L, Nelson A, et al. Sofosbuvir and ribavirin for hepatitis C genotype 1 in patients with unfavorable treatment characteristics: a randomized clinical trial. JAMA. 2013 Aug 28;310(8):804–11.
52. Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med. 2013 Jan 3;368(1):34–44.
53. Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May 16;368(20):1878–87.
54. Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Sofosbuvir for hepatitis C Genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May 16;368(20):1867–77.
55. FDA. U.S. Food & Drug Administration. FDA news release. FDA approves Epclusa for treatment of chronic hepatitis C virus infection [press release] [Internet]. Silver Spring : United States Food and Drug Administration; 2016 [cited 2017 Jan 26]. Available from: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm508915.htm.
56. Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med. 2015 Dec 31;373(27):2599–607.
57. Foster GR, Afdhal N, Roberts SK, Bräu N, Gane EJ, Pianko S, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med. 2015 Dec 31;373(27):2608–17.
58. Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med. 2015 Dec 31;373(27):2618–28.
59. Poordad F, Lawitz E, Gutierrez JA, Evans B, Howe A, Feng H-P, et al. C-swift: grazoprevir/elbasvir + sofosbuvir in cirrhotic and noncirrhotic, treatment-naive patients with hepatitis C virus genotype 1 infection, for durations of 4, 6 or 8 weeks and genotype 3 infection for durations of 8 or 12 weeks — abstract O006. J Hepatol. 2015 Apr 1;62:S192–3.
60. Gerlach JT, Diepolder HM, Zachoval R, Gruener NH, Jung M-C, Ulsenheimer A, et al. Acute hepatitis C: high rate of both spontaneous and treatment-induced viral clearance. Gastroenterology. 2003 Jul;125(1):80–8.
61. Lehmann M, Meyer MF, Monazahian M, Tillmann HL, Manns MP, Wedemeyer H. High rate of spontaneous clearance of acute hepatitis C virus genotype 3 infection. J Med Virol. 2004 Jul;73(3):387–91.
62. Nomura H, Sou S, Tanimoto H, Nagahama T, Kimura Y, Hayashi J, et al. Short-term interferon-alfa therapy for acute hepatitis C: a randomized controlled trial. Hepatology. 2004 May;39(5):1213–9.
63. Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, et al. Treatment of acute hepatitis C with interferon alfa-2b. N Engl J Med. 2001 Nov 15;345(20):1452–7.
64. Santantonio T, Fasano M, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, et al. Efficacy of a 24-week course of PEG-interferon alpha-2b monotherapy in patients with acute hepatitis C after failure of spontaneous clearance. J Hepatol. 2005 Mar;42(3):329–33.
65. Kamal S, Madwar M, He Q, Koziel M. Peginterferon alpha compared to conventional interferon alpha plus ribavirin combination therapy in symptomatic acute hepatitis C: a randomized trial of treatment onset, duration and cost effectiveness [abstract presented at 55th Annual Meeting of the American Association for the Study of Liver Diseases, Boston, Massachusetts, October 29–November 2, 2004]. Hepatology. 2004;40(Supplement S4):178A.
66. Deterding K, Grüner N, Buggisch P, Wiegand J, Galle PR, Spengler U, et al. Delayed versus immediate treatment for patients with acute hepatitis C: a randomised controlled non-inferiority trial. Lancet Infect Dis. 2013 Jun;13(6):497–506.
67. Mack CL, Gonzalez-Peralta RP, Gupta N, Leung D, Narkewicz MR, Roberts EA, et al. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents. J Pediatr Gastroenterol Nutr. 2012 Jun;54(6):838–55.
68. Wirth S, Lang T, Gehring S, Gerner P. Recombinant alfa-interferon plus ribavirin therapy in children and adolescents with chronic hepatitis C. Hepatology. 2002 Nov 1;36(5):1280–4.
69. Wirth S, Pieper-Boustani H, Lang T, Ballauff A, Kullmer U, Gerner P, et al. Peginterferon alfa-2b plus ribavirin treatment in children and adolescents with chronic hepatitis C. Hepatology. 2005 May;41(5):1013–8.
70. Wirth S, Ribes-Koninckx C, Calzado MA, Bortolotti F, Zancan L, Jara P, et al. High sustained virologic response rates in children with chronic hepatitis C receiving peginterferon alfa-2b plus ribavirin. J Hepatol. 2010 Apr;52(4):501–7.
71. Sokal EM, Bourgois A, Stéphenne X, Silveira T, Porta G, Gardovska D, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection in children and adolescents. J Hepatol. 2010 Jun;52(6):827–31.
72. González-Peralta RP, Kelly DA, Haber B, Molleston J, Murray KF, Jonas MM, et al. Interferon alfa-2b in combination with ribavirin for the treatment of chronic hepatitis C in children: efficacy, safety, and pharmacokinetics. Hepatology. 2005 Nov;42(5):1010–8.
73. El-Guindi MA. Hepatitis C Viral Infection in Children: Updated Review. Pediatr Gastroenterol Hepatol Nutr. 2016 Jun;19(2):83–95.
74. Hill A, Khoo S, Simmons B, Ford N. What is the minimum cost per person to cure HCV? In Kuala Lumpur, Malaysia: International Aids Society; 2013 [cited 2017 Jan 27]. Available from: http://pag.ias2013.org/abstracts.aspx?aid=3142.
75. World Health Organization. Notes on the design of a bioequivalance study: sofosbuvir. Guidance document, 13 October 2015 [Internet]. World Health Organization; 2015 [cited 2017 Jan 5]. Available from: https://extranet.who.int/prequal/.
76. Hill A, Golovin S, Dragunova J, Korologou-Linden RS. Virological response rates using generic direct acting antiviral treatment for hepatitis C, legally imported into Russia. AASLD Hepatol Poster Sess IV Abstr 1638-2112 [Internet]. 2017 Jan 25 [cited 2017 Jan 25]; Available from: http://onlinelibrary.wiley.com/doi/10.1002/hep.28800/full.
77. Derbala MF, Elsayad E, Hajelssedig O, Amer A, Eldweik N, Alkaabi SR, et al. Generic versus brand sofosbuvir-based therapy: safety and efficacy, real life data. AASLD Hepatol Poster Sess IV Abstr 1638-2112. 2016 Oct 1;64:811–1050.
78. Ogata N, Alter HJ, Miller RH, Purcell RH. Nucleotide sequence and mutation rate of the H strain of hepatitis C virus. Proc Natl Acad Sci U S A. 1991 Apr 15;88(8):3392–6.
79. Bartenschlager R, Lohmann V. Replication of hepatitis C virus. J Gen Virol. 2000 Jul;81(Pt 7):1631–48.
80. Ray SC, Thomas DL. Hepatitis C. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. 8th ed. Philadelphia: Elsevier Saunders; 2014. p. 1904–27.
81. Pawlotsky J-M. Hepatitis C virus resistance to direct-acting antiviral drugs in interferon-free regimens. Gastroenterology. 2016 Jul;151(1):70–86.
82. Ahmed A, Felmlee DJ. Mechanisms of hepatitis C viral resistance to direct acting antivirals. Viruses. 2015 Dec 18;7(12):6716–29.
83. Kattakuzhy S, Gross C, Teferi G, Jenkins V, Silk R, Akoth E, et al. A novel task shifting model to expand the HCV care continuum: the Ascend investigation [abstract of paper presented at International Liver Congress, Barcelona, Spain, 13–17 April 2015]. J Hepatol. 2016 Jan 1;64(2):S224–5.
84. Arora S, Thornton K, Murata G, Deming P, Kalishman S, Dion D, et al. Outcomes of treatment for hepatitis C virus infection by primary care providers. N Engl J Med. 2011 Jun 9;364(23):2199–207.