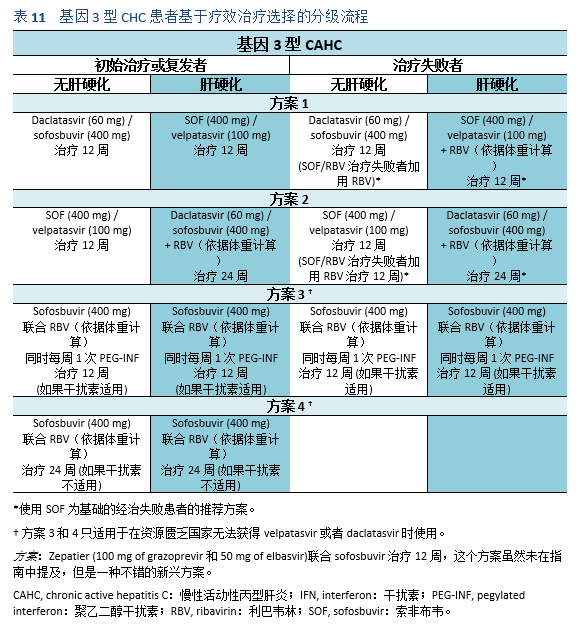
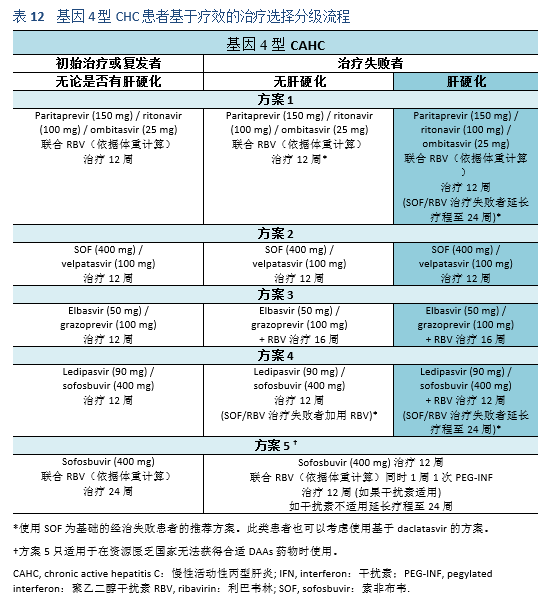
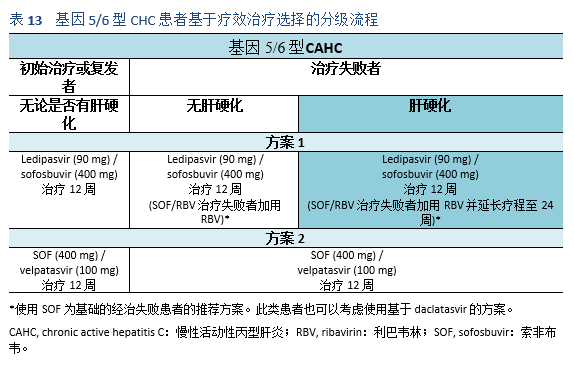
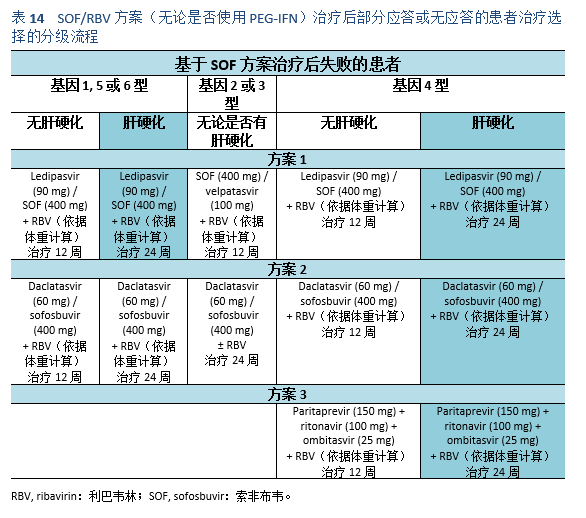
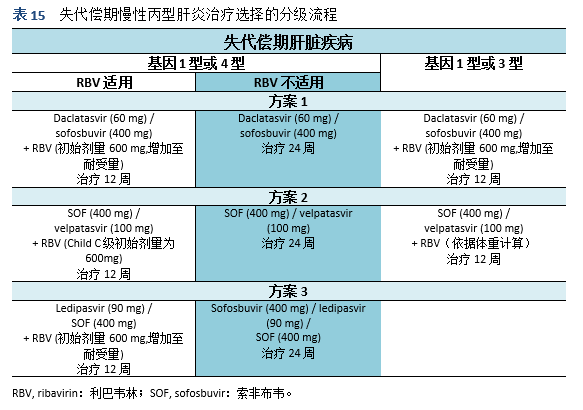
5.1 治疗目标
治疗HCV感染的目标是减少病毒相关的并发症,这取决于病毒的清除并保持持续的病毒学应答(sustained viral response, SVR)。获得SVR的患者实现了病毒的清除,病毒再激活的可能性很小。已有证据表明,患者获得SVR后,可改善肝脏的坏死性炎症和纤维化,降低肝癌发生的风险。
急性HCV感染者未经治疗而实现病毒清除的,无需抗病毒治疗。根据资料报道,15%至50%的患者可自愈。
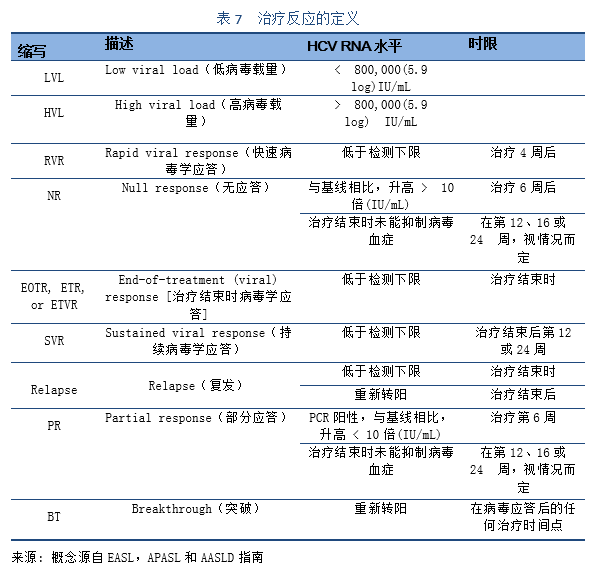
5.2 治疗原则
HCV的治疗和治愈被证实是减少长期并发症的有效举措,也是慢性HCV感染管理的主要方法。.
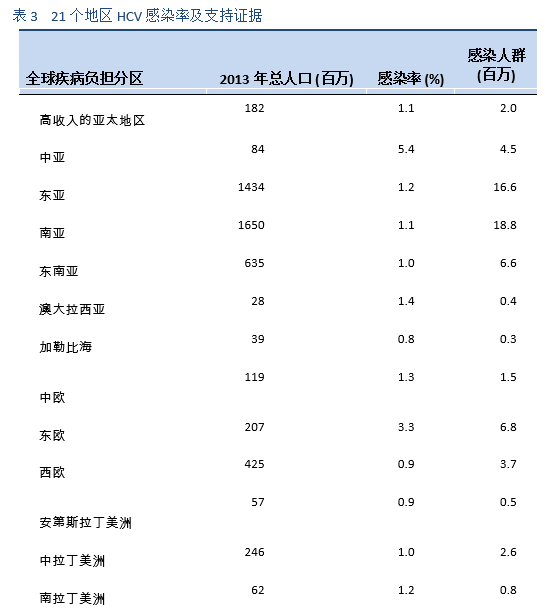
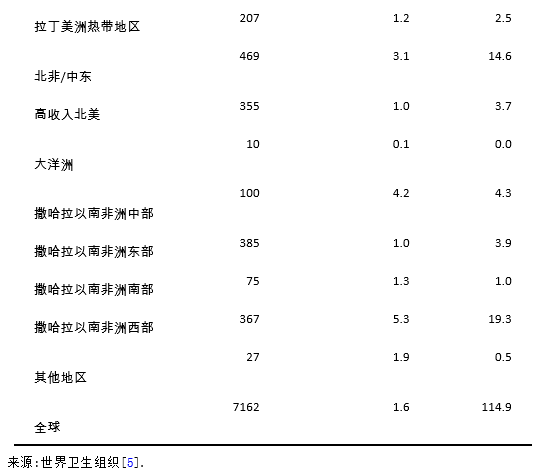
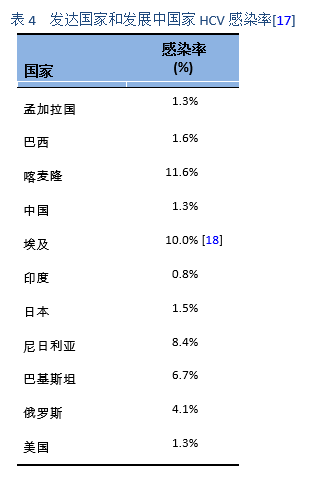
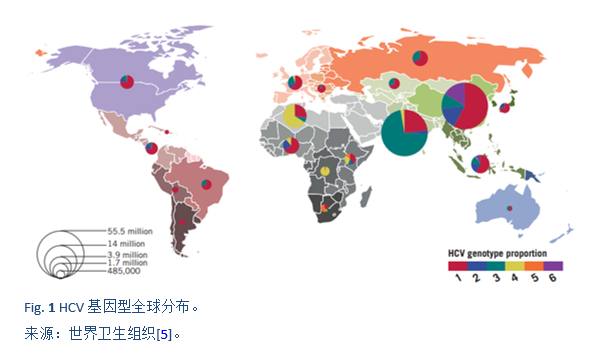
非基因1型的HCV在人口密集的国家如南亚,东亚,非洲和中东等国家最为常见。在PEG-IFN(pegylated interferon)出现之前,在世界的大部分地区采用常规干扰素单药或者联合利巴韦林(interferon/ribavirin, IFN/RBV)方案,这是治疗HCV的主要手段。2002年以后出现了PEG-IFN 联合利巴韦林(PEG-IFN/RBV)的治疗方案。在一些重要的临床试验中,PEG-IFN/RBV方案治疗基因1型患者可获得了40–45%的SVR,基因2型患者可高达80%的SVR,而基因3a型患者仅有50%的SVR。所有的这些治疗,都约有50-60%的慢性HCV患者表现为无反应或复发[35]。此外,这些疗法需要注射干扰素和利巴韦林24-48周,具有明显的毒副作用;有很多的患者由于副作用而不适合IFN治疗或不愿意接受治疗。因此,需要一种理想的治疗方案:全口服药物,每日一次剂量,疗程短,副作用最小,并且是泛基因型,具有高SVR值(> 95%),无论处于肝纤维化的哪个阶段,之前对IFN/RBV治疗是否为无反应,性别,种族和年龄[39]。
2011年之后,直接作用抗病毒药物(direct-acting antivirals, DAA)的时代到来了,这是目前的标准治疗方案。
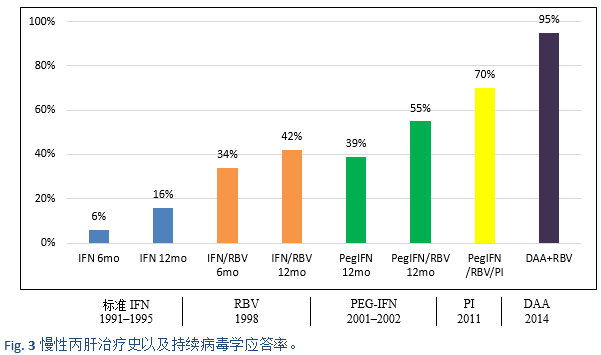
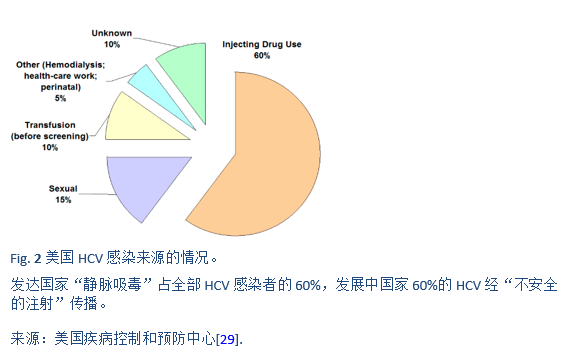
数据来源:the U.S. Food and Drug AdministrationAntiviral Drugs Advisory Committee Meeting, April 27–28, 2011, Silver Spring, MD。
IFN, interferon(干扰素);RBV, ribavirin(利巴韦林);PEG-IFN, pegylated interferon(聚乙二醇干扰素);PI, protease inhibitor(s)(蛋白酶抑制剂); DAA, direct-acting antiviral(s)(直接作用抗病毒药物)。
Sofosbuvir(SOF)在发展中国家很容易获得,剂量为400 mg/天。PEG-IFNα-2a的剂量应为180μg/周;而PEG-IFNα-2b为1.5μg/kg/周。利巴韦林的剂量取决于患者的体重(例如:1000 mg < 75kg,1200mg > 75kg)。
新的DAA最初只能以非常高的价格才能获得。经过努力地为低收入国家的价格谈判,导致了世界各地不同地区的价格差异。例如,在美国一盒SOF的价格为28,000美元,3个月的粗略成本约为84,000美元;而巴基斯坦和印度的价格仅为300美元(6个月的完整疗程仅花费1800美元)。

Sofosbuvir制造商Gilead Sciences有限公司已经与多家制造商签署了自愿许可协议,允许在一些低收入和中等收入国家销售当地仿制品,使得在那些特定的国家里,Sofosbuvir的价格有了进一步下降。但是,这些自愿许可协议并不适用于中国,巴西,阿根廷,伊朗和土耳其等,以及同样也有着很大疾病负担的几个中等收入国家。DAA的仿制药是一个相当便宜和有效的替代品。在一项包含448名患者的研究中,Freeman等报道使用仿制DAA的SVR大约为94%[43].
指南中讨论的治疗方案应依据合理的医疗保健和财政资源进行选择。所有选择都是基于地方专家和学会的治疗经验,并且很少与循证医学有分歧。这表明我们正努力使丙型肝炎的治疗成为全球适用的和实际可行的;通过不断更新各级临床医生的知识,使全球的HCV患者获得最大利益。
最后,这些指南并非是固定的规则,而是一个动态的、不断变化的过程,指导临床医生对病人进行相应的治疗,并且遵循个体化的治疗模式。当有新的研究或证据出现时,指南也应作相应的改进和更新。
5.3 哪些人应该治疗?
HCV感染可通过抗病毒治疗得到治愈。然而,由于该疾病常表现为无症状,许多患者没有意识到自己被感染;在一些情况下,被诊断出来并能够接受治疗的人依然较少[5]。
一份由世界卫生组织发表的“宣传简报”提出了到2030年消除乙肝和丙肝的目标[44]。因此,除了因严重合并症而导致预期寿命缩短的患者外,所有慢性HCV感染的患者都应接受治疗,尤其是那些肝脏相关并发症风险较高的患者,应立即接受治疗。
肝脏相关并发症风险高的患者包括如下:
- Metavir系统分级≥F2的晚期纤维化的患者
- 肝硬化失代偿期等待肝移植的患者
- 肝移植的患者
严重的肝外并发症,如血管炎,导致终末器官损伤的冷球蛋白血症,或导致明显蛋白尿的肾小球肾炎/肾病综合征
5.4 疗效预测因素
虽然推荐的HCV首选治疗方案在不断地更新,但有时仍取决于影响SVR的几个因素:
- HCV基因型
- 既往HCV治疗史
- 是否是肝病失代偿期
- 药物间相互作用
- 慢性肾脏病
- 实体器官移植者
以下是DAA联合治疗反应不佳的预测因素:
- 既往接受DAA治疗
- 肝硬化(Child-Pugh B和C)
- 治疗依从性差
5.5 治疗前评估
在开始DAA治疗前需完成以下的评估:
详细的病史和体格检查,包括任何其他可能对肝脏造成不良影响的肝脏疾病和医疗状况,如乙肝,酗酒,自身免疫性肝病,代谢性肝病或肝脏毒性药物。以上这些都需要被调查,并采取适当措施降低风险。
- 其他的评估(心肺和精神病学的评估)也需要考虑到,并且评估依从性不良带来的风险。需要采取适当的措施降低其带来的风险。
- 评估目前的和既往的用药史和以往治疗的依从性。评估严重的潜在药物间的不良作用。
- 采用非侵入性的手段评估肝脏纤维化的程度:
- —研究表明FibroScan是除肝活检外敏感的检测手段。在超过95%的患者中,FibroScan可以非常容易和可靠地量化纤维化的程度[45]。瞬时弹性成像的正确解读必须基于四分位差<30%以及血清ALT<5倍正常上限,排除过量饮酒的病史,同时,患者的BMI也需考虑在内。如果BMI超过30kg/m2,需考虑使用加大号的探头。
- —在资源有限或没有FibroScan的地区,可以使用纤维化 4 指数(FIB4),AST/血小板比值(APRI),和声脉冲辐射力成像(ARFI),ARFI≥2分可以预测肝硬化的存在,ARFI对预测肝硬化的敏感度为48%但特异度达94%。它可以用来预测显著的肝纤维化(2-4期);如果使用1.5作为分界点,对预测显著肝纤维化的敏感度为37%,特异度为95%[46,47]。
- —如存在其他病因的可能性时才会考虑肝脏活检。
- 使用敏感的基于实时PCR定量检测血清HCV-RNA的检测低限是≤15IU/mL。
- HCV基因型
- 对怀疑或已有肝硬化的患者,需行Child–Turcotte–Pugh和MELD评分。
5.5.1 治疗前监测推荐
1. 治疗开始前的12周内检查血常规(CBC),肝功能(LFT),血清白蛋白,INR,肾小球滤过率(GFR),促甲状腺激素(TSH)(如果计划使用IFN);
2. 治疗前的任意时间行定量PCR和基因型分型;
3. 育龄期妇女在治疗开始之前需行尿妊娠试验。目前,对所有新型的口服治疗方案,包括或不包括利巴韦林,因为缺少足够的安全信息,对育龄期或哺乳期的患者都是禁忌的,因此,常规推荐育龄期患者采取充分的避孕措施[48]。
4. 对包含利巴韦林的治疗方案,需考虑患者的年龄及继发性贫血引起的心血管疾病。
5.6 治疗中的评估
接受HCV治疗过程中的推荐:
1.通过门诊随访或电话鼓励患者的依从性。需询问任何的药物不良反应,对有关药物间的互相作用给出建议。利物浦大学提供了肝脏药物互相作用查询的网站(http://www.hep-druginteractions.org)[49]。
2.血常规,血清肌酐,GFR,肝功能需在治疗后的4周检测。对于接受利巴韦林治疗的患者,血常规可以更频繁地监测。
3. 对接受干扰素治疗的患者,在第12周检测促甲状腺激素。
4. 定量PCR需在治疗结束时及随后的第12周评估。
5.6.1 何时需考虑因药物副作用而停药
- 如果治疗4周后ALT有10倍及以上的升高。
- 如果ALT升高不到10倍但有如下几种情况:
- —出现症状(恶心,呕吐,乏力)
- —黄疸
- —胆红素,ALP或INR升高
- 如果ALT升高但不超过10倍且患者没有症状,需在第6周复查ALT,如果ALT持续升高,需考虑停药。
5.7 治疗后评估
5.7.1 对治疗无应答的患者
1. 每6-12月检测肝功能,血常规,INR评估疾病进展(F4患者)。
2.对进展期肝纤维化的患者(F3/F4)每6个月行超声检查监测HCC。
3. 对肝硬化静脉曲张的患者行内镜监测静脉曲张情况。
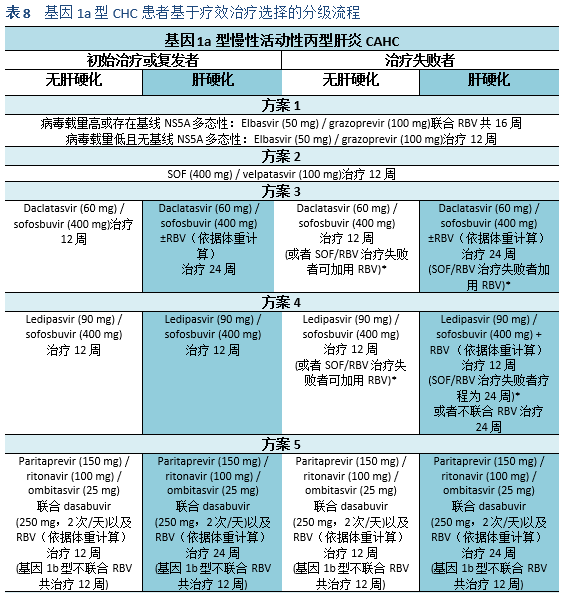
4. 一旦有其他有效的治疗选择,需行再治疗评估。治疗前需行突变检测以选择最佳的治疗方案。目前,指南推荐对DAA治疗失败的患者行NS5A耐药性评估,尤其对基因型1a的患者考虑elbasvir/grazoprevir治疗前
5.7.2 对获得持续病毒学应答(SVR)的患者
1. 对于纤维化F0-F2的患者,推荐如从未感染过HCV的随访;
2. 对于纤维化 F3-F4 的患者,推荐1年两次超声检查监测HCC;
3. 对于肝硬化的患者需行基线的内镜检查,如果发现有静脉曲张则按标准路径治疗和随访。
4. 如果在SVR的情况下肝功能仍然持续异常,需评估肝脏疾病的其他病因。
5.8 自2014年CHC无干扰素全口服药物治疗方案
- 2013年12月和2014年1月,第二代DAA被FDA批准用于治疗慢性丙型肝炎基因型1型,基因型1型是最普遍的及治疗比较困难的基因型。首先上市的包括sofosbuvir(SOF),是NS5B聚合酶抑制剂。第一个使用SOF/RBV的临床试验是ELECTRON研究,它报道的在25位接受初始治疗的患者中,24周的SVR是84%[50,51]。在随后的研究中,sofosbuvir和RBV联合治疗基因1型的60位患者,这些患者有预后不良的因素包括非洲-美洲种族,ccIL28B,病毒载量大于80000IU/mL,最终的24周SVR为68%[51]。
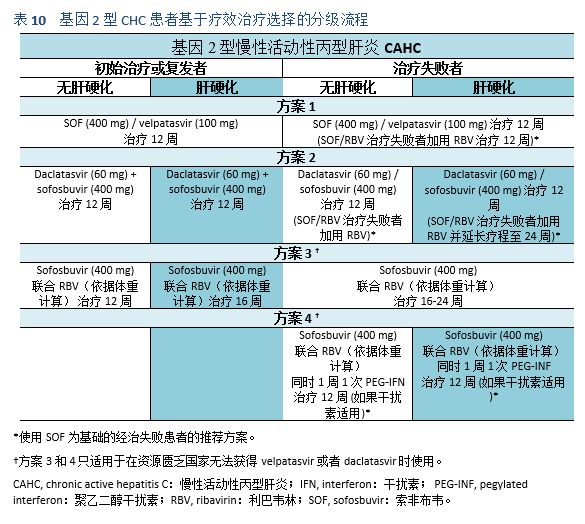
- 在ELECTRON研究中,SOF/RBV被用于基因2型和3型的无肝硬化患者,24周的SVR为100%[52]。在FISSION试验中,接受SOF/RBV初始治疗的499位基因型2型患者,12周的SVR为97%。而在基因3型患者中,SVR 12仅为56%[53]。类似地,在POSITRON试验中,基因2型和3型的SVR 24分别为61%和93%[54]。在FUSSION试验中也得到了类似的结果,基因3型患者的SVR率较差,为62%。
- 之后,一系列单药或固定剂量的复合药物被FDA批准,包括daclatasvir, 3D Regimen, paritaprevir + dasabuvir/ombitasvir+ritonavir (Viekirapak)。
- 最近被FDA批准的全基因型复合制剂之一,商品名为Epclusa,包含sofosbuvir + velpatasvir[55]。在3期临床试验中,Feld等将此药应用于基因1, 2, 4, 5,6型的患者,在第12周获得了99% 的SVR[56]。ASTRAL-3临床试验报道,基因3型患者予sofosbuvir+ velpatasvir联合治疗12周后,SVR12为95%[57]。在另外一项临床试验中,Curry将此药应用于失代偿性的患者,12周的SVR为83%,24周的SVR为86%,联合应用利巴韦林的SVR为94%[58]。
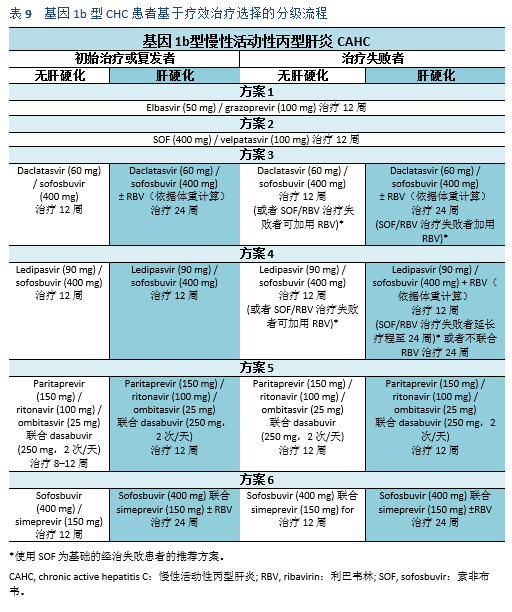
- Zepatier是另一个被批准的全基因型DAA复合制剂。包括100mg的grazoprevir和50mg的elbasvir。在C-SWIFT研究中,Zepatier和sofosbuvir的联合用药在第8周对基因1型及第12周对基因3型的有效性分别超过了90%[59]。
5.9 特殊人群的治疗
5.9.1 急性丙型肝炎的治疗
无症状的患者较难诊断,尤其当病毒感染的确切时间不明确的时候。有两件事情必须在急性丙肝患者中明确: 首先,何时开始治疗;其次,治疗的方案及治疗的疗程。
在一项包含16个研究的荟萃分析中,急性肝炎的患者接受早期治疗的小组比自发清除的小组预后较好。在另一个研究中,早期使用高剂量的干扰素治疗获得了85-100%的SVR。普通干扰素的常规剂量是5-10百万单位/天,治疗12周。另外一个选择是PEG干扰素1.2-1.3mg/kg每周一次,但是价格更高[60–65]。
Deterding等的研究表明延迟治疗和即刻治疗的效果一样。另外,延迟治疗可以减少对于部分可以自发清除病毒的患者不必要的治疗,但是需要密切的监测[66]。
由于新型的DAA有较好的有效性和安全性,对于早期治疗的争论有所减少。以下是新的推荐:
• 推荐规律监测HCV RNA至少6月,以评估病毒的自发清除。
• 对于急性HCV感染的患者,需确保其避免肝毒性的药物(如对乙酰氨基酚)和酒精;且需采取措施减少传播疾病给其他人的风险。
• 只有在特殊的情形下才考虑早期治疗:如患者的传播风险很高,(如静脉药瘾者,或外科医生),患者已经有其他进展期的肝脏疾病,以及那些失访的概率很高的患者。即使是这些患者,应至少等待12-16周才考虑开始治疗。
• 如果有治疗指征,急性HCV感染可以如慢性HCV感染一样使用DAA治疗。
• 不推荐对针刺伤的患者进行预防性的治疗,因为感染率是很低的。
5.9.2 儿童丙型肝炎的治疗
对于儿童丙型肝炎的治疗有不同的看法。由于慢性丙肝的自然病程进展缓慢,
治疗可以推迟到青春期。然而,青少年和年轻成人对治疗的依从性也是比较低的。
AASLD仍然推荐在儿童人群中应用干扰素联合利巴韦林的治疗方案,PEG-IFN比常规干扰素更优先[67]。PEG-IFN alfa-2b的剂量为60 µg/m2/周,PEG-IFN alfa-2a的剂量为180µg/1.73m2/周联合利巴韦林15mg/kg/天。联合治疗的疗程对基因1,4型的患者是48周,对基因2,3型是24周。
在儿童中,IFN/RBV治疗方案的应答率对基因1型,基因2,3型和基因4型的SVR分别为36-57%,84-100%,50-80%。副作用包括流感样症状,白细胞减少,头痛,腹痛,食欲减退,腹泻,和精神症状[68–72]。
由于药物副作用和较低的SVR,尤其对于基因1型的儿童,DAA的使用是值得商榷的。由Gilead Sciences赞助的两个临床试验已进入第2期,分别评估ledipasvir 和 sofosbuvir对于治疗基因1型及sofosbuvir 联合 RBV对于治疗基因2,3型的有效性和安全性。Sofosbuvir和 ledipasvir/sofosbuvir的药代动力学和安全性在12-17岁的儿童人群中已被评估并且结果已经被报道[73]。然而,这些DAA的获批还需要更深入的临床研究。
备注:
• 其他特殊的CHC人群:如合并肾功能衰竭,合并HCV/HIV 和 HBV感染,器官移植的患者等,可以在其他国际指南中找到相应的推荐(表1);
• 随着DAA的快速发展,丙型肝炎的治疗方案也在快速变化,读者可以查阅AASLD, EASL, 和 APASL 指南上新的治疗流程。
5.10 仿制和专利的DAA都是有效的吗?
随着新药和新的DAA的获批,产生了对这些药物治疗HCV有效,安全及廉价的期望。尽管在全世界范围内,仿制品的价格差别很大,但是Hill等在2013年指出,DAA原始制造的成本是很低的-比如,12周sofosbuvir的治疗大概需要101美元,daclatasvir治疗12周需要20美元[74]。
仿制品制造商之间的相互竞争会导致DAA价格的进一步降低。低收入国家比如巴基斯坦和印度可以获得价格低、有活性的药物原料,但产品的质量存疑。对于有严格质量保证的国家如埃及,仿制药的数据是很有前景的。WHO已通过资格预审的程序来保障药物质量[75]。
来自巴基斯坦某中心的初步数据,低价仿制的sofosbuvir,在基因3型的患者中快速病毒应答率为86.8%。在AASLD会议上的两篇和仿制品相关的药物治疗的摘要,数据分别来自俄罗斯和卡塔尔,显示的SVR分别接近92%和95%[76,77]。
5.11 随着DAA的出现,仍然需要干扰素吗?局部的观点
在过去,干扰素毫无疑问是治疗HCV的主流,但其许多劣势及更加安全和有效的药物DAA的出现限制了干扰素的使用,在不久的将来干扰素治疗HCV有可能被淘汰。尽管没有医学上的理由不使用DAA治疗HCV,但是在许多低收入国家,尤其在亚太地区,DAA的普及率是很低的。目前,使用干扰素为基础的治疗方法的唯一指征是无法获得DAA。另一个支持干扰素的观点是在亚洲人群中相对较好的应答率,部分是由于IL28B等位基因。然而,基于干扰素的方案不可能获得全球病毒清除。获得DAA是首先需要解决的事情。Gilead Sciences公司在这方面所做的努力是值得称道的,为90多个世界上GDP最低的国家提供药物。
5.12 一个被低估的问题—DAA耐药
HCV 有很高的复制率,导致了其RNA依赖的RNA聚合酶的校对能力较低[78,79]。这导致了甚至在同一基因型中高水平的基因变异[80]。因此,任何感染了HCV的患者都混合了一群遗传学上相似的HCV,其中包括了药物敏感的野生型为主的种类和较少的耐药的种类。这些耐药株具有使DAA更加耐药或使病毒更加适宜生存的氨基酸突变[81]。
随着DAA的治疗,敏感种类的数量快速下降,使得HCV RNA定量分析结果阴性。如果DAA治疗的疗程够长,敏感种类在治疗终点被清除,留下少量检测限以下的耐药种类,因此HCV RNA的定量检测仍然是阴性的。治疗停止后,竞争环境的改变(敏感种类的清除)导致耐药种类的涌现,导致DAA治疗失败或复发。
对不同的DAA已产生不同的耐药病毒种类,这些病毒的流行率也不一样。例如,常见的对sofosbuvir耐药的变异是L159F, V321A, 和 S282R。目前没有前两者变异的数据,第三种的耐药率较低,大约为为0.4%。Daclatasvir有高耐药的变异,M28,为 0.5-4%[82]。Ledipasvir有两个高耐药变异,其中之一对基因2和4型的耐药率接近100%。
总体来说,对NS34A 蛋白酶抑制剂比如boceprevir的耐药性在外周血中在数周至数月之间消失,而对NS5A 抑制剂—如 daclatasvir, ledipasvir和 ombitasvir的耐药性可以持续数年[81]。NS5B核苷聚合酶抑制剂sofosbuvir具有最高的耐药屏障[82]。
DAA的耐药性是目前突出的问题,需要进一步评估。关于治疗前耐药性的研究有可能被纳入近期的推荐中。目前,AASLD 2016更新的指南推荐对DAA治疗失败的患者进行NS5A耐药性评估,尤其在考虑用elbasvir/grazoprevir治疗基因1a型的患者前[3]。除了基因1a型, NS5A耐药在基因3型中也很常见,并且在巴基斯坦更加流行。巴基斯坦的DAA耐药情况需要更进一步的研究,尤其对那些进展期肝纤维化的患者,可能需要sofosbuvir/velpatasvir强化治疗[57,58]。DAA耐药使患者不能获得SVR,DAA治疗失败的患者需要根据指南相应部分的推荐进行管理。
5.13 非专科医师治疗HCV
随着口服DAA的出现,尤其是全基因、每日一次的治疗方案,对HCV的治疗显得很简单。HCV在一些资源受限的国家流行率很高,而被认证的肝脏病学家和胃肠病学家比较稀少,因此需要一定的灵活性。Kattakuzhy等开始的ASCEND临床试验,为了确定非专业从业者进行HCV相关的DAA治疗的安全性,结果表明是同样安全和有效的[83]。尽管这个结果鼓舞人心,但是考虑到当地的状况,必须进行某些改变,如保证对全科医生正确的培训,鼓励他们遵循指南,及时转诊具有并发症和特殊的人群。可以通过电子诊所实现这个过程—类似ECHO项目的一个模型[84]。
5.14 总结
DAAs的优势:
- 口服用药,无需注射
- 无基因型限制。最近研究支持DAAs对所有基因型都有效(1到6型)
- 治疗过程未发现病毒学突破,高耐药基因屏障
- 对 IL-28B CT 和 TT 亚型有效
- 初治和经治患者均有效
- 对肝硬化的患者安全有效
DAA 的缺点:
- 价格昂贵特别是对于资源匮乏的地区,在不同人群中治疗的经验尚缺乏
- 部分国家不能获得
- 药物互相作用
- DAA耐药。
1. European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol. 2017 Jan;66(1):153–94.
2. AASLD/IDSA HCV Guidance Panel. Recommendations for testing, managing, and treating hepatitis C [Internet]. American Association for the Study of Liver Diseases (AASLD); 2017 [cited 2017 Feb 5]. Available from: http://www.hcvguidelines.org/full-report-view.
3. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015 Sep;62(3):932–54.
4. Omata M, Kanda T, Wei L, Yu M-L, Chuang W-L, Ibrahim A, et al. APASL consensus statements and recommendation on treatment of hepatitis C. Hepatol Int. 2016 Sep;10(5):702–26.
5. World Health Organization. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version, April 2016 [Internet]. Geneva: World Health Organization; 2016 [cited 2017 Jan 5]. 138 p. Available from: http://www.who.int/hepatitis/publications/hepatitis-c-guidelines-2016/en/.
6. Mandeville KL, Krabshuis J, Ladep NG, Mulder CJ, Quigley EM, Khan SA. Gastroenterology in developing countries: Issues and advances. World J Gastroenterol. 2009 Jun 21;15(23):2839–54.
7. Zou S, Tepper M, El Saadany S. Prediction of hepatitis C burden in Canada. Can J Gastroenterol J Can Gastroenterol. 2000 Aug;14(7):575–80.
8. Palitzsch KD, Hottenträger B, Schlottmann K, Frick E, Holstege A, Schölmerich J, et al. Prevalence of antibodies against hepatitis C virus in the adult German population. Eur J Gastroenterol Hepatol. 1999 Nov;11(11):1215–20.
9. Umar M, Khaar H-B, Khan AA, Mohsin A, Din W, Shah HA, et al. Diagnosis, management and prevention of hepatitis C in Pakistan 2009. Pak J Gastroenterol. 2009;23(2):7–67.
10. Qureshi H. Prevalence of hepatitis B & C in Pakistan. Islamabad: Pakistan Medical Research Council; 2008.
11. Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000 Mar 11;355(9207):887–91.
12. Amon JJ, Garfein RS, Ahdieh-Grant L, Armstrong GL, Ouellet LJ, Latka MH, et al. Prevalence of hepatitis C virus infection among injection drug users in the United States, 1994–2004. Clin Infect Dis. 2008 Jun 15;46(12):1852–8.
13. Xia X, Luo J, Bai J, Yu R. Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis. Public Health. 2008 Oct;122(10):990–1003.
14. Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med. 2001 Jul 5;345(1):41–52.
15. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis. 2005 Sep;5(9):558–67.
16. Seeff LB. Natural history of chronic hepatitis C. Hepatology. 2002 Nov;36(5 Suppl 1):S35-46.
17. Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol. 2014 Nov;61(1 Suppl):S45-57.
18. Kandeel A, Genedy M, El-Refai S, Funk AL, Fontanet A, Talaat M. The prevalence of hepatitis C virus infection in Egypt 2015: implications for future policy on prevention and treatment. Liver Int. 2017 Jan;37(1):45–53.
19. Tohme RA, Holmberg SD. Is sexual contact a major mode of hepatitis C virus transmission? Hepatology. 2010 Oct;52(4):1497–505.
20. Vandelli C, Renzo F, Romanò L, Tisminetzky S, De Palma M, Stroffolini T, et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study. Am J Gastroenterol. 2004 May;99(5):855–9.
21. Puoti C, Guarisco R, Spilabotti L, Bellis L, Mitidieri Costanza O, Dell’ Unto O, et al. Should we treat HCV carriers with normal ALT levels? The “5Ws” dilemma. J Viral Hepat. 2012 Apr;19(4):229–35.
22. Kane A, Lloyd J, Zaffran M, Simonsen L, Kane M. Transmission of hepatitis B, hepatitis C and human immunodeficiency viruses through unsafe injections in the developing world: model-based regional estimates. Bull World Health Organ. 1999;77(10):801–7.
23. Khan AJ, Luby SP, Fikree F, Karim A, Obaid S, Dellawala S, et al. Unsafe injections and the transmission of hepatitis B and C in a periurban community in Pakistan. Bull World Health Organ. 2000;78(8):956–63.
24. Kaldor JM, Dore GJ, Correll PK. Public health challenges in hepatitis C virus infection. J Gastroenterol Hepatol. 2000 May;15 Suppl:E83–90.
25. World Health Organization. Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium. J Viral Hepat. 1999 Jan;6(1):35–47.
26. Janjua NZ, Nizamy M a. M. Knowledge and practices of barbers about hepatitis B and C transmission in Rawalpindi and Islamabad. JPMA J Pak Med Assoc. 2004 Mar;54(3):116–9.
27. World Health Organization. Global alert and response (GAR). Hepatitis C. [Internet]. Geneva: World Health Organization; 2002. Available from: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4.html.
28. Terrault NA, Dodge JL, Murphy EL, Tavis JE, Kiss A, Levin TR, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013 Mar;57(3):881–9.
29. Centers for Disease Control and Prevention. Viral hepatitis surveillance — United States, 2009 [Internet]. [cited 2017 May 2]. Available from: https://www.cdc.gov/hepatitis/Statistics/2009Surveillance/Commentary.htm.
30. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006 Apr 1;3(2):47–52.
31. Freeman AJ, Dore GJ, Law MG, Thorpe M, Von Overbeck J, Lloyd AR, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology. 2001 Oct;34(4 Pt 1):809–16.
32. Levine RA, Sanderson SO, Ploutz-Snyder R, Murray F, Kay E, Hegarty J, et al. Assessment of fibrosis progression in untreated Irish women with chronic hepatitis C contracted from immunoglobulin anti-D. Clin Gastroenterol Hepatol. 2006 Oct;4(10):1271–7.
33. Jacobson IM, Davis GL, El-Serag H, Negro F, Trépo C. Prevalence and challenges of liver diseases in patients with chronic hepatitis C virus infection. Clin Gastroenterol Hepatol. 2010 Nov;8(11):924–933; quiz e117.
34. Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, et al. Serum level of IP-10 increases predictive value of IL28B polymorphisms for spontaneous clearance of acute HCV infection. Gastroenterology. 2012 Jan;142(1):78–85.e2.
35. Vogt M, Lang T, Frösner G, Klingler C, Sendl AF, Zeller A, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood-donor screening. N Engl J Med. 1999 Sep 16;341(12):866–70.
36. Di Bisceglie AM. Hepatitis C and hepatocellular carcinoma. Hepatology. 1997 Sep;26(3 Suppl 1):34S–38S.
37. Kim WR. The burden of hepatitis C in the United States. Hepatology. 2002 Nov;36(5 Suppl 1):S30-34.
38. World Health Organization. Essential medicines and health products. First WHO prequalified hepatitis C rapid test opens the door to expanded treatment [press release] [Internet]. World Health Organization; 2016 [cited 2016 Dec 13]. Available from: http://www.who.int/medicines/news/prequal_hvc/en/.
39. Pockros PJ. Interferon-free hepatitis C therapy: how close are we? Drugs. 2012 Oct 1;72(14):1825–31.
40. Freeman JAD, Hill A. The use of generic medications for hepatitis C. Liver Int. 2016 Jul;36(7):929–32.
41. Hill A, Simmons B, Gotham D, Fortunak J. Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C. J Virus Erad. 2017 Jan 25;2(1):28–31.
42. Andrieux-Meyer I, Cohn J, de Araújo ESA, Hamid SS. Disparity in market prices for hepatitis C virus direct-acting drugs. Lancet Glob Health. 2015 Nov;3(11):e676-677.
43. Freeman J, Sallie R, Kennedy A, Hieu PTN, Freeman J, Jeffreys G, et al. High sustained virological response rates using generic direct acting antiviral treatment for hepatitis C, imported into Australia. J Hepatol. 2016 Jan 1;64(2):S209.
44. World Health Organization. Combating hepatitis B and C to reach elimination by 2030: advocacy brief [Internet]. Geneva: World Health Organization; 2016. Available from: http://www.who.int/hepatitis/publications/hep-elimination-by-2030-brief/en/.
45. Nguyen-Khac E. [Results and place of Fibroscan in the non-invasive diagnosis of hepatic fibrosis]. Rev Med Interne. 2007 Feb;28(2):94–102.
46. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015 Jul;63(1):237–64.
47. Houot M, Ngo Y, Munteanu M, Marque S, Poynard T. Systematic review with meta-analysis: direct comparisons of biomarkers for the diagnosis of fibrosis in chronic hepatitis C and B. Aliment Pharmacol Ther. 2016 Jan;43(1):16–29.
48. Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: Has anything changed for pregnant/lactating women? World J Hepatol. 2016 Apr 28;8(12):557–65.
49. University of Liverpool. Hepatitis drug interactions [Internet]. HEP Drug Interactions. 2017 [cited 2017 Jan 25]. Available from: http://www.hep-druginteractions.org/.
50. Lalezari JP, Nelson DR, Hyland RH, Lin M, Rossi SJ, Symonds WT, et al. Once daily sofosbuvir plus ribavirin for 12 and 24 weeks in treatment-naïve patients with HCV infection: the Quantum study [abstract, International Liver Congress 2013: 48th Annual Meeting of the European Association for the Study of the Liver, Amsterdam, Netherlands, 24 April–28 April 2013]. J Hepatol. 2013 Apr 1;58(Supplement 1):S346.
51. Osinusi A, Meissner EG, Lee Y-J, Bon D, Heytens L, Nelson A, et al. Sofosbuvir and ribavirin for hepatitis C genotype 1 in patients with unfavorable treatment characteristics: a randomized clinical trial. JAMA. 2013 Aug 28;310(8):804–11.
52. Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med. 2013 Jan 3;368(1):34–44.
53. Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May 16;368(20):1878–87.
54. Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Sofosbuvir for hepatitis C Genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May 16;368(20):1867–77.
55. FDA. U.S. Food & Drug Administration. FDA news release. FDA approves Epclusa for treatment of chronic hepatitis C virus infection [press release] [Internet]. Silver Spring: United States Food and Drug Administration; 2016 [cited 2017 Jan 26]. Available from: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm508915.htm.
56. Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med. 2015 Dec 31;373(27):2599–607.
57. Foster GR, Afdhal N, Roberts SK, Bräu N, Gane EJ, Pianko S, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med. 2015 Dec 31;373(27):2608–17.
58. Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med. 2015 Dec 31;373(27):2618–28.
59. Poordad F, Lawitz E, Gutierrez JA, Evans B, Howe A, Feng H-P, et al. C-swift: grazoprevir/elbasvir + sofosbuvir in cirrhotic and noncirrhotic, treatment-naive patients with hepatitis C virus genotype 1 infection, for durations of 4, 6 or 8 weeks and genotype 3 infection for durations of 8 or 12 weeks —abstract O006. J Hepatol. 2015 Apr 1;62:S192–3.
60. Gerlach JT, Diepolder HM, Zachoval R, Gruener NH, Jung M-C, Ulsenheimer A, et al. Acute hepatitis C: high rate of both spontaneous and treatment-induced viral clearance. Gastroenterology. 2003 Jul;125(1):80–8.
61. Lehmann M, Meyer MF, Monazahian M, Tillmann HL, Manns MP, Wedemeyer H. High rate of spontaneous clearance of acute hepatitis C virus genotype 3 infection. J Med Virol. 2004 Jul;73(3):387–91.
62. Nomura H, Sou S, Tanimoto H, Nagahama T, Kimura Y, Hayashi J, et al. Short-term interferon-alfa therapy for acute hepatitis C: a randomized controlled trial. Hepatology. 2004 May;39(5):1213–9.
63. Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, et al. Treatment of acute hepatitis C with interferon alfa-2b. N Engl J Med. 2001 Nov 15;345(20):1452–7.
64. Santantonio T, Fasano M, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, et al. Efficacy of a 24-week course of PEG-interferon alpha-2b monotherapy in patients with acute hepatitis C after failure of spontaneous clearance. J Hepatol. 2005 Mar;42(3):329–33.
65. Kamal S, Madwar M, He Q, Koziel M. Peginterferon alpha compared to conventional interferon alpha plus ribavirin combination therapy in symptomatic acute hepatitis C: a randomized trial of treatment onset, duration and cost effectiveness [abstract presented at 55th Annual Meeting of the American Association for the Study of Liver Diseases, Boston, Massachusetts, October 29–November 2, 2004]. Hepatology. 2004;40(Supplement S4):178A.
66. Deterding K, Grüner N, Buggisch P, Wiegand J, Galle PR, Spengler U, et al. Delayed versus immediate treatment for patients with acute hepatitis C: a randomised controlled non-inferiority trial. Lancet Infect Dis. 2013 Jun;13(6):497–506.
67. Mack CL, Gonzalez-Peralta RP, Gupta N, Leung D, Narkewicz MR, Roberts EA, et al. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents. J Pediatr Gastroenterol Nutr. 2012 Jun;54(6):838–55.
68. Wirth S, Lang T, Gehring S, Gerner P. Recombinant alfa-interferon plus ribavirin therapy in children and adolescents with chronic hepatitis C. Hepatology. 2002 Nov 1;36(5):1280–4.
69. Wirth S, Pieper-Boustani H, Lang T, Ballauff A, Kullmer U, Gerner P, et al. Peginterferon alfa-2b plus ribavirin treatment in children and adolescents with chronic hepatitis C. Hepatology. 2005 May;41(5):1013–8.
70. Wirth S, Ribes-Koninckx C, Calzado MA, Bortolotti F, Zancan L, Jara P, et al. High sustained virologic response rates in children with chronic hepatitis C receiving peginterferon alfa-2b plus ribavirin. J Hepatol. 2010 Apr;52(4):501–7.
71. Sokal EM, Bourgois A, Stéphenne X, Silveira T, Porta G, Gardovska D, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection in children and adolescents. J Hepatol. 2010 Jun;52(6):827–31.
72. González-Peralta RP, Kelly DA, Haber B, Molleston J, Murray KF, Jonas MM, et al. Interferon alfa-2b in combination with ribavirin for the treatment of chronic hepatitis C in children: efficacy, safety, and pharmacokinetics. Hepatology. 2005 Nov;42(5):1010–8.
73. El-Guindi MA. Hepatitis C Viral Infection in Children: Updated Review. Pediatr Gastroenterol Hepatol Nutr. 2016 Jun;19(2):83–95.
74. Hill A, Khoo S, Simmons B, Ford N. What is the minimum cost per person to cure HCV? In Kuala Lumpur, Malaysia: International Aids Society; 2013 [cited 2017 Jan 27]. Available from: http://pag.ias2013.org/abstracts.aspx?aid=3142.
75. World Health Organization. Notes on the design of a bioequivalance study: sofosbuvir. Guidance document, 13 October 2015 [Internet]. World Health Organization; 2015 [cited 2017 Jan 5]. Available from: https://extranet.who.int/prequal/.
76. Hill A, Golovin S, Dragunova J, Korologou-Linden RS. Virological response rates using generic direct acting antiviral treatment for hepatitis C, legally imported into Russia. AASLD Hepatol Poster Sess IV Abstr 1638-2112 [Internet]. 2017 Jan 25 [cited 2017 Jan 25]; Available from: http://onlinelibrary.wiley.com/doi/10.1002/hep.28800/full.
77. Derbala MF, Elsayad E, Hajelssedig O, Amer A, Eldweik N, Alkaabi SR, et al. Generic versus brand sofosbuvir-based therapy: safety and efficacy,real life data. AASLD Hepatol Poster Sess IV Abstr 1638-2112. 2016 Oct 1;64:811–1050.
78. Ogata N, Alter HJ, Miller RH, Purcell RH. Nucleotide sequence and mutation rate of the H strain of hepatitis C virus. Proc Natl Acad Sci U S A. 1991 Apr 15;88(8):3392–6.
79. Bartenschlager R, Lohmann V. Replication of hepatitis C virus. J Gen Virol. 2000 Jul;81(Pt 7):1631–48.
80. Ray SC, Thomas DL. Hepatitis C. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. 8th ed. Philadelphia: Elsevier Saunders; 2014. p. 1904–27.
81. Pawlotsky J-M. Hepatitis C virus resistance to direct-acting antiviral drugs in interferon-free regimens. Gastroenterology. 2016 Jul;151(1):70–86.
82. Ahmed A, Felmlee DJ. Mechanisms of hepatitis C viral resistance to direct acting antivirals. Viruses. 2015 Dec 18;7(12):6716–29.
83. Kattakuzhy S, Gross C, Teferi G, Jenkins V, Silk R, Akoth E, et al. A novel task shifting model to expand the HCV care continuum: the Ascend investigation [abstract of paper presented at International Liver Congress, Barcelona, Spain, 13–17 April 2015]. J Hepatol. 2016 Jan 1;64(2):S224–5.
84. Arora S, Thornton K, Murata G, Deming P, Kalishman S, Dion D, et al. Outcomes of treatment for hepatitis C virus infection by primary care providers. N Engl J Med. 2011 Jun 9;364(23):2199–207.