5.1 Objetivos do tratamento
O objetivo do tratamento do HCV é reduzir as complicações da doença através da erradicação do vírus com base na resposta virológica sustentada (RVS). Os pacientes que alcançam RVS têm liberação do vírus com possibilidades insignificantes de reativação. Melhorias na inflamação por necrose e fibrose do fígado, bem como no risco de carcinoma hepatocelular, foram demonstradas nos pacientes que alcançaram RVS.
Os pacientes com infecção aguda pelo HCV resolvida sem tratamento, não precisam terapia antiviral. Dependendo das fontes, tudo indica que 15% a 50% dos pacientes se recuperam espontaneamente.
5.2 Princípios do tratamento
O tratamento e cura da hepatite C demonstrou prevenir o risco de complicações a longo prazo e ser a principal forma de manejo da infecção crônica pelo HCV.
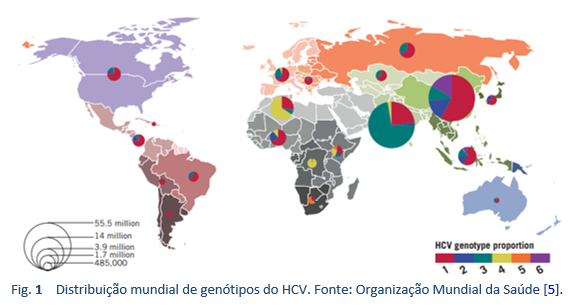
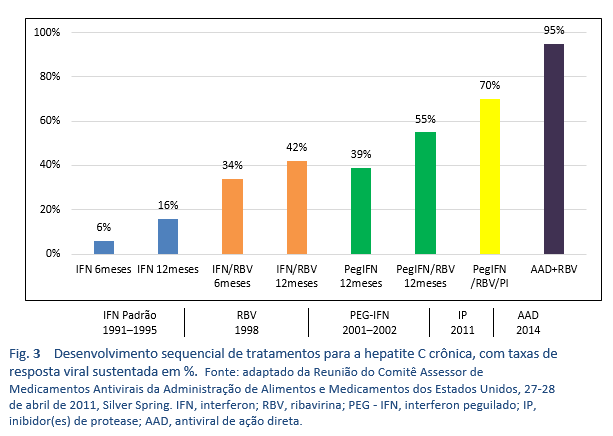
Os genótipos de não-1 do HCV são os mais comuns nos países densamente povoados da Ásia do Sul, Extremo Oriente, África e Oriente Médio. Antes do interferon peguilado (PEG-IFN), a base do tratamento do HCV, na maior parte do mundo, foi a monoterapia convencional com IFN ou a terapia convencional com interferon/ribavirina (IFN/RBV). Em 2002, ficou disponível o PEG-IFN/RBV. Os ensaios clínicos cruciais sobre o tratamento com PEG-IFN/RBV mostraram RVS de 40-45% em pacientes com genótipo 1, até 80% naqueles com genótipo 2 e só 50% naqueles com genótipo 3a. Todos esses tratamentos deixavam cerca de 50-60% dos pacientes com hepatite C crônica como não respondedores ou recidivantes [35]. Além disso, estas terapias requeriam 24-48 semanas de injeções com interferon e ribavirina, com importante toxicidade, e muitos dos pacientes eram inelegíveis para IFN ou eram reticentes em aceitar o tratamento devido aos efeitos adversos. Assim, foi necessário um esquema ideal envolvendo só fármacos via oral, em dose única diária, terapia de duração curta e efeitos colaterais mínimos que deveria servir para todos os genótipos e teria uma alta taxa de RVS (> 95%), independentemente da fase da fibrose hepática, não resposta prévia ao tratamento com IFN/RBV, gênero, raça e idade [39].
Depois de 2011, esta situação resultou na era dos antivirais de ação direta (AAD), que são o atual padrão de cuidados.
O sofosbuvir (SOF), facilmente disponível no mundo em desenvolvimento, é administrado um comprimido de 400 mg uma vez ao dia. A dose recomendada de PEG-IFN-a2a é de 180 μg uma vez por semana. A dose PEG-IFN alfa-2b deve ser baseada no peso de 1,5 μg/kg por semana. A dose de ribavirina (RBV) depende do peso do paciente (p.ex., 1000 mg em pacientes <75 kg e 1200 mg em pacientes > 75 kg).
No início, os novos AAD estavam disponíveis a um preço muito alto. Nos países de baixa renda foram feitos grandes esforços para negociar os preços. Isto levou a uma grande diversidade de preços nas diferentes regiões do mundo. Por exemplo, nos Estados Unidos sofosbuvir foi lançado a $ 28,000 por caixa, com um custo de cerca de $ 84,000 por 3 meses, sendo que o mesmo genérico se consegue no Paquistão e na Índia a um preço de $ 300 (o ciclo completo de 6 meses custa $ 1800).

Gilead Sciences, Inc., fabricante de Sofosbuvir, assinou acordos de licenciamento voluntários com vários fabricantes para comercializar versões locais destes medicamentos genéricos em países de baixa e média renda, em resultado do qual os preços diminuíram ainda mais, particularmente nesses países. No entanto, esses acordos não são aplicados em vários países de renda média com importante carga de morbidade como China, Brasil, Argentina, Irã e Turquia. As versões genéricas dos AAD são uma alternativa bastante barata e eficaz. Num estudo de 448 pacientes, Freeman e col. relataram uma RVS4 de aproximadamente 94% utilizando AAD genéricos [43].
As opções de tratamento analisadas nesta diretriz dependem dos recursos financeiros e sanitários disponíveis. Elas são baseadas em certa evidência empírica dos especialistas e das sociedades regionais, sem divergir muito das práticas médicas baseadas em evidências. Isto representa um esforço para que o tratamento contra a hepatite C seja aplicável e viável, atualizando o conhecimento dos médicos em todos os níveis, otimizando assim a vida dos pacientes com hepatite C do mundo.
Finalmente, as diretrizes não são regras fixas; constituem um processo dinâmico e cambiante, que leva os médicos a tratar os pacientes adequadamente, considerando a personalização para cada tratamento se for necessário. As diretrizes precisam sempre ser melhoradas e atualizadas à medida que vão aparecendo novos estudos e nova evidência.
5.3 ¿Quem deveria ser tratado?
A infecção pelo HCV pode ser curada com terapia antiviral; porém, dada a natureza assintomática da doença, muitas pessoas infectadas não estão conscientes da infecção, e para aquelas diagnosticadas com a doença, o acesso à terapia é ainda deficiente em muitos contextos [5].
Um documento publicado pela Organização Mundial da Saúde estabelece como objetivo eliminar a hepatite B e C para 2030 [44]. Portanto, todos os pacientes com infecção crônica pelo HCV devem receber terapia, exceto os pacientes com probabilidade de vida curta por causa de comorbidades graves. Os pacientes com alto risco de complicações hepáticas devem ter prioridade para tratamento imediato.
Estes são os pacientes com alto risco de complicações hepáticas:
- Pacientes com fibrose avançada com estádios Metavir ≥ F2
- Pacientes cirróticos descompensados que estão à espera de transplante de fígado
- Pacientes com transplante de fígado
- Pacientes com complicações extra-hepáticas graves como vasculite, crioglobulinemia causando lesão de órgãos terminais, ou glomerulonefrite/síndrome nefrítico causando proteinuria significativa
5.4 Preditores de resposta ao tratamento
As recomendações para os esquemas preferidos de tratamento do HCV seguem evoluindo, mas, em alguns casos, eles ainda dependem de vários fatores que comprometem uma RVS:
- Genótipo do HCV
- História previa de tratamento contra o HCV
- Doença hepática compensada versus descompensada
- Interações medicamentosas
- Doença renal crônica
- Pessoas que tenham recebido transplante de órgãos sólidos
Os fatores seguintes são preditivos para uma resposta menos favorável ao tratamento com combinações de AAD:
- Tratamento prévio com AAD
- Cirrose hepática (Child-Pugh B e C)
- Baixa adesão ao tratamento
5.5 Avaliação do pré-tratamento
Antes de começar o tratamento com AAD, deve ser avaliado o seguinte:
- É essencial fazer uma anamnese detalhada e um exame físico cuidadoso, incluindo os antecedentes do paciente de qualquer outra doença hepática e afecções médicas que possam afetar negativamente o estado do fígado, tais como infecção pela hepatite B, alcoolismo, patologia autoimune, doenças hepáticas metabólicas ou drogas/ medicações hepatotóxicas. Tudo isso deve ser investigado e devem ser adotadas medidas de redução de riscos apropriadas.
- É preciso considerar outras avaliações (cardiopulmonar e psiquiátrica), e analisar o risco de não adesão. Devem ser tomadas medidas apropriadas para reduzir estes riscos.
- Avaliar os medicamentos atuais/anteriores, adesão a tratamentos prévios e possíveis interações de importância entre medicamentos.
- Deve ser comprovado o grau de fibrose hepática através de medidas não invasivas:
- - Estudos demonstraram FibroScan ser uma técnica sensível alternativa à biopsia hepática. Em mais de 95% dos pacientes é possível quantificar o grau de fibrose com muita facilidade e fiabilidade [45]. Uma interpretação correta da elastografia transitória deve ter um intervalo interquartil/valores médios <30% e ALT sérica <5 × limite superior da normalidade. O paciente não pode ter ingerido álcool em excesso no momento do exame, e deve ser levado em conta seu IMC. Se o IMC do paciente for superior a 30 kg/m2, podem ser consideradas sondas extragrandes (XL).
—Em regiões com recursos limitados e lugares onde FibroScan não está disponível facilmente, podem ser usadas pontuações como índice de fibrose 4 (FIB4), índice de relação AST/plaquetas (APRI) e de radiação acústica da força do impulso (ARFI). Uma pontuação APRI ≥ 2 pode ser usada para predizer a presença de cirrose. Em seu ponto de corte, a pontuação de ARFI tem sensibilidade de 48%, porém, especificidade de 94% para predizer a cirrose. Também pode ser usado para predizer a presença de fibrose importante (estádios 2-4). Utilizando um valor de corte de 1,5, a sensibilidade é de 37% e a especificidade de 95% para fibrose significativa [46,47].
- A biopsia hepática só pode ser considerada quando houver possibilidade de etiologia adicional.
- Quantificação do soro do ARN do HCV utilizando ensaio sensível em tempo real baseado na PCR, com limite inferior de detecção de ≤ 15 UI/ml.
- Genotipificação do HCV.
Em pacientes com suspeita de cirrose ou cirrose conhecida, deve ser calculada a pontuação de Child-Turcotte-Pugh e o modelo para pontuação da doença hepática terminal (MELD).
5.5.1 Recomendações para monitorização prévia ao tratamento.
Fazer hemograma completo (HC), provas de função hepática (PFH), albumina, INR, taxa de filtração glomerular (TFG) e teste de TSH (se for previsto esquema de IFN) no prazo de 12 semanas após o início da terapia.
2. Fazer PCR quantitativa e genotipificação a qualquer momento antes de iniciar a terapia.
3. Mulheres em idade de procriar devem fazer teste urinário de detecção de gravidez antes de iniciar a terapia. Atualmente, estão contraindicados todos os novos esquemas de terapia oral, com ou sem ribavirina, durante a lactação devido à falta de informação sobre segurança nos seres humanos. As medidas adequadas de anticoncepção para mulheres em idade fértil ainda são rotineiramente recomendadas [48].
4. Com esquemas contendo ribavirina, levar em conta idade do paciente e comorbidade cardiovascular decorrente de anemia secundária.
5.6 Avaliação durante o tratamento
Recomendações para pacientes recebendo tratamento com HCV durante a terapia:
1. Convém favorecer o cumprimento tanto com visitas clínicas ou pelo telefone. Todo evento adverso deve ser analisado dando informação sobre as interações medicamentosas. A Universidade de Liverpool oferece uma ferramenta para verificar as interações: “HEP Drug Interaction Checker” (http://www.hep-druginteractions.org) [49].
2. Fazer exames de HC, creatinina sérica, TFG e PFH após 4 semanas de tratamento. Se clinicamente indicados, fazer hemogramas com maior frequência em pacientes recebendo ribavirina.
3. Para os pacientes recebendo interferon, fazer exames de TSH após 12 semanas.
4. Fazer avaliação PCR quantitativa ao final do tratamento e repetir às 12 semanas.
5.6.1 Quando interromper o tratamento por causa dos efeitos colaterais
- Se aumentar 10 vezes ou mais o nível de ALT após 4 semanas de terapia.
- Se houver aumento menor de 10 vezes de ALT com um dos seguintes fatores:
— Aparecimento de sintomas (náuseas, vômitos, fraqueza)
— Icterícia
—Aumento da bilirrubina, fosfatase alcalina (ALP) ou INR
- Se houver aumento menor que 10 vezes de ALT e o paciente for assintomático, repetir avaliação da ALT após 6 semanas; se persistir elevada, considerar a interrupção da terapia.
5.7 Avaliação pós-tratamento
5.7.1 Para pacientes não respondedores ao tratamento
1. PFH, HC e INR a cada 6-12 meses para avaliar a progressão da doença (pacientes F4).
2. Vigilância do HCC para pacientes com fibrose avançada (metavir F3/F4) através de ultrassons a cada 6 meses.
3. Vigilância endoscópica de varizes em pacientes cirróticos.
4. Avaliar a repetição do tratamento se um tratamento alternativo eficaz estiver disponível. Para selecionar o melhor esquema disponível hoje é necessário fazer testes de mutação antes do tratamento. Atualmente, as diretrizes recomendam avaliação da resistência à NS5A em pacientes com falha ao AAD, especialmente antes de considerar elbasvir/ grazoprevir para pacientes do genótipo 1a.
5.7.2 Para pacientes que alcançam RVS
1. Para pacientes com fibrose F0-F2, aplicar as mesmas recomendações, como se nunca tivessem sido infectados pelo HCV.
2. Para pacientes com fibrose F3-F4, é recomendado monitoramento ultrassonográfico duas vezes por ano para controlar o CHC.
3. Vigilância endoscópica basal para pacientes cirróticos, tratar varizes se forem achadas e seguir da maneira padrão.
4. Se as PFH seguirem anormais apesar de RVS, avaliar outras causas de doença hepática.
5.8 Esquemas de tratamento por via oral sem interferon para HCC desde 2014
- Em dezembro de 2013 e janeiro de 2014, a FDA aprovou os AAD de segunda geração para tratamento do genótipo 1 da hepatite crônica, considerado o mais prevalente e difícil de tratar. O primeiro foi o sofosbuvir (SOF), que atua como inibidor da polimerase NS5B. O primeiro ensaio a usar SOF/RBV foi o estudo ELECTRON, que informou taxas de RVS de 84% dos 25 pacientes não tratados previamente após 24 semanas de tratamento (RVS 24) [50,51]. Num estudo posterior de esquema consistente em sofosbuvir e RBV durante 24 semanas em 60 pacientes virgens de tratamento com genótipo 1 com fatores de mau prognóstico, tais como etnia afro-americana, ccIL28B e carga viral de mais de 800.000 UI/ml, as taxas de RVS 24 foram de 68% [51].
- No estudo ELECTRON, foi administrado SOF/RBV a pacientes genótipo 2 e 3 sem cirrose, e 100% alcançou a RVS 24 [52]. No ensaio FISSION, que administrou SOF/RBV durante 12 semanas a 499 pacientes virgens de tratamento, as taxas de RVS 12 foram 97% para pacientes genótipo 2 do HCV. Nos pacientes genótipo 3, as taxas de RVS 12 foram só de 56%. [53]. Também, no ensaio POSITRON as taxas de RVS 24 após 24 semanas de tratamento foram 61% para o genótipo 3 e 93% para o genótipo 2 [54]. Resultados similares obteve o ensaio FUSSION, com taxas baixas de RVS de 62% nos pacientes infectados com genótipo 3.
- Desde então, a FDA tem aprovado vários fármacos separados ou em combinações de doses fixas, como daclatasvir, esquema 3D, paritaprevir + dasabuvir/ombitasvir + ritonavir (Viekira pak).
- Uma das combinações pangenotípicas aprovada recentemente pela FDA, disponível sob o nome comercial Epclusa, contem sofosbuvir + velpatasvir [55]. Num ensaio de fase 3, Feld e col. administraram esta combinação durante 12 semanas e relataram RVS 12 de 99% em pacientes com genótipos 1, 2, 4, 5 e 6 [56]. O ensaio ASTRAL-3 informou RVS 12 de 95% em pacientes com genótipo 3 tratados com sofosbuvir + velpatasvir durante 12 semanas [57]. Em outro ensaio, Curry e col. usaram esta combinação em pacientes descompensados, com RVS de 83% em pacientes que usaram a combinação durante 12 semanas, 86% naqueles que a usaram durante 24 semanas e 94% em pacientes que usaram a combinação junto com ribavirina durante 12 semanas [58].
- Zepatier é outra combinação pangenotípica baseada em AAD; foi aprovada em 2016. A combinação contém 100 mg de grazoprevir e 50 mg de elbasvir. No estudo C-SWIFT, foi estudada uma combinação de Zepatier com sofosbuvir que, quando administrada durante 8 semanas em pacientes com genótipo 1 e 12 semanas naqueles com genótipo 3, mostrou uma eficácia maior de 90% [59].
5.9 Tratamento em populações especiais
5.9.1 Tratamento da hepatite C aguda
Hepatite C aguda é difícil de diagnosticar em pacientes assintomáticos, particularmente quando o tempo exato de aquisição do vírus não está definido. Há dois aspectos que devem ser considerados em pacientes com hepatite C aguda: em primeiro lugar, quando começar a terapia; e, em segundo lugar, qual deveria ser o esquema e duração da terapia.
Numa metanálise de 16 estudos, o resultado no grupo de pacientes que receberam terapia precoce em hepatite aguda foi melhor do que no grupo de pacientes observados por eliminação espontânea. Em outro estudo, a terapia precoce com doses mais altas de IFN convencional alcançou RVS de 85-100%. A dose de IFN convencional foi de 5-10 milhões de unidades/dia durante 12 semanas. Outra opção era PEG-IFN em dose de 1,2-1,3 mg/kg por semana, dada a conveniência do esquema posológico, porém, o custo era mais alto [60–65].
Um estudo de Deterding e col. mostrou que o tratamento tardio é tão efetivo quanto o tratamento imediato. Além disso, o tardio pode reduzir a possibilidade de tratamento desnecessário em pacientes capazes de eliminar o vírus espontaneamente sem qualquer tratamento; estes casos, no entanto, exigem um monitoramento rigoroso [66].
Aos novos AAD terem melhor eficácia e segurança, o argumento em favor do tratamento precoce se tornou mais fraco. Portanto, as novas recomendações são as seguintes:
- É recomendado fazer controles periódicos de laboratório com ARN do HCV no mínimo durante 6 meses para avaliar a eliminação espontânea.
- Os pacientes com infecção aguda pelo HCV precisam conselhos para garantir a ausência de fármacos hepatotóxicos (p.ex., acetaminofeno) e de álcool. Os pacientes devem tomar medidas preventivas para reduzir o risco de transmitir a doença para outros.
- O tratamento precoce só pode ser considerado em casos especiais - p.ex., pessoas que correm o risco de transmitir a doença (usuários de drogas intravenosas ilícitas, cirurgiões), pacientes sofrendo doença hepática avançada por outra razão e aqueles com maiores possibilidades de ter perdido o seguimento. Nestes casos, o paciente deve esperar pelo menos 12-16 semanas antes de iniciar a terapia.
- Se indicado, o tratamento para infecção da HCV aguda pode ser administrado usando DAA com os mesmos esquemas que para doença crônica.
- A terapia profiláctica não é recomendada em caso de lesões por picada de agulhas, uma vez que a taxa de infectividade é muito baixa.
5.9.2 Tratamento da infecção pelo HCV em crianças
Existem diferentes escolas de pensamento respeito do tratamento para hepatite C em crianças. O curso natural da infecção crônica por hepatite C é lento, portanto, o tratamento pode ser adiado até a adolescência. Contudo, os adolescentes e adultos jovens são considerados também mais despreocupados e menos propensos a aderir ao tratamento.
AASLD ainda recomenda só interferons concomitantemente com RBV na população pediátrica, e o PEG-IFN é considerado superior ao IFN convencional também nas crianças [67]. O peginterferon alfa-2b é administrado em dose de 60 μg/m2/semana, e o peginterferon alfa-2a é administrado em dose 180 μg/1,73 m2/semana junto com RBV em dose de 15 mg/kg/dia. A combinação é administrada durante 48 semanas nos pacientes com genótipos 1 ou 4, e durante 24 semanas naqueles com genótipos 2 ou 3.
A resposta pediátrica à terapia com IFN/RBV na infecção pelo HCV é de 36-57% de RVS para genótipo 1, 84-100% para genótipos 2 e 3 e 50-80% para genótipo 4. O perfil de efeitos colaterais de IFN/RBV em crianças inclui sintomas similares aos da gripe, febre, leucopenia, cefaleias, dor abdominal, perda de apetite, diarreia e efeitos psiquiátricos [68–72].
Devido aos efeitos colaterais e à baixa RVS, sobretudo no genótipo 1 em crianças, é preciso considerar o uso de AAD. Dois ensaios patrocinados por Gilead Sciences estão em fase 2, avaliando a eficácia e segurança de ledipasvir e sofosbuvir para genótipo 1 e sofosbuvir e RBV para genótipos 2 e 3, respectivamente. A excelente eficácia dos novos AAD na população adulta tem animado os pesquisadores a avaliar os fármacos na população adolescente. Foi avaliada a farmacocinética e o perfil de segurança de sofosbuvir e ledipasvir/sofosbuvir em crianças de 12 a 17 anos de idade, e foram obtidos resultados comparáveis neste grupo [73]. No entanto, são necessários ensaios mais profundos antes de poder aprovar o uso destes AAD em crianças.
Notas:
- Outros grupos especiais de pacientes com HCC -p.ex., pacientes com insuficiência renal, com coinfecção HCV/HIV e VHB, receptores de transplante de órgãos, são tratados em unidades hepáticas especializadas; recomendações práticas podem ser encontradas em outras diretrizes internacionais (ver Tabela 1).
- Como o tratamento da hepatite C está mudando rapidamente devido ao ritmo acelerado com que são desenvolvidos os AAD, é recomendado aos leitores consultar os novos algoritmos de tratamento nas diretrizes da AASLD, EASL e APASL.
5.10 ¿São eficazes os genéricos locais e os AAD de marca patenteada?
Com a aprovação de novos fármacos e novos AAD, surgiram expectativas em relação a um tratamento efetivo, seguro e barato para o HCV. Apesar da enorme diferença de preços dos genéricos em todo o mundo, Hill e col. apontaram em 2013 que os custos de patente dos AAD são muito baixos - p.ex., um ciclo de tratamento de 12 semanas de sofosbuvir custa aproximadamente $ 101, e um ciclo de daclatasvir de 12 semanas custa $ 20 [74].
Atualmente existem vários fabricantes de genéricos, e a concorrência entre eles está levando a uma redução nos preços dos AAD. Os países de baixa renda como Paquistão e Índia têm acesso a insumos farmacêuticos ativos de baixo custo, porém, a garantia de qualidade dos produtos é questionável. A informação proveniente de países como Egito, onde as autoridades aplicam uma garantia de qualidade estrita dos medicamentos genéricos, é muito promissória. A OMS tem desenvolvido um mecanismo para assegurar a qualidade destes medicamentos através de seu programa de pré-qualificação [75].
Os dados preliminares de um centro no Paquistão, com base em sofosbuvir genérico de preço baixo, mostraram uma taxa de resposta viral rápida de 86,8% nos pacientes com genótipo 3 (o resumo foi apresentado na Semana das Doenças Digestivas 2017). Do mesmo modo, grupos da Rússia e do Qatar apresentaram dois resumos sobre tratamento com genéricos na reunião da AASLD em Boston mostrando excelentes resultados, com RVS de aproximadamente 92% e 95% respectivamente [76,77].
5.11 Com a chegada dos AAD ¿será necessário o IFN? Uma perspectiva local
O interferon tem sido, sem dúvida, a base fundamental do tratamento do HCV no passado. Porém, suas muitas desvantagens e a introdução de alternativas seguras e eficazes em forma de AAD têm limitado seu uso, e corre o risco de ficar obsoleto no tratamento do HCV num futuro próximo. Não há razões médicas para não usar AAD no tratamento do HCV, mas nos países de baixa renda -especialmente na região Ásia-Pacífico- sua penetração foi até agora muito lenta. Atualmente, a única indicação para a terapia baseada em IFN é quando não seja possível o acesso ao AAD. Outro argumento em favor do IFN é que os asiáticos tendem a apresentar uma resposta relativamente melhor, em parte devido ao alelo IL28B; no entanto, com esquemas baseados no IFN não é possível erradicar o vírus mundialmente. O acesso aos AAD é o assunto principal a ser abordado. Os esforços realizados por Gilead Sciences, Inc. para fornecer sua medicação aos 90 países com valores de produto interno bruto mais baixos do mundo representam uma medida significativa nesse sentido.
5.12 Resistência aos AAD, um problema subestimado
O HCV tem alta taxa de reprodução, o que acarreta uma baixa capacidade de correção da ARN-polimerase dependente do ARN do HCV [78,79]. Isto provoca uma alta variação genética, inclusive dentro de um único genótipo [80]. Portanto, os indivíduos infectados com HCV possuem uma mistura de cepas geneticamente similares do HCV, com uma cepa do tipo natural predominante sensível aos fármacos (detectável no início da terapia) e baixos níveis de cepas resistentes (não detectável no início da terapia). Estas cepas resistentes têm um aminoácido mutante que, ou diminui a eficácia do AAD, ou faz o vírus mais apto [81].
Ao começar o tratamento com AAD, há uma rápida queda da variante sensível apresentando teste quantitativo do ARN do HCV negativo. Se a duração da terapia com AAD for suficientemente longa, no final do tratamento as cepas sensíveis terão sido eliminadas, ficando a variante resistente em níveis baixos indetectáveis, de modo que os testes quantitativos do ARN do HCV permanecem negativos. Se o tratamento for interrompido, a alteração no ambiente concorrencial (com a eliminação do tipo sensível) leva ao aparecimento de cepas resistentes, causando recaída e falha aos AAD.
Existem diferentes cepas de prevalência variável associadas à resistência que estão bem documentadas para diversos AAD. Por exemplo, as variantes comuns associadas à resistência para sofosbuvir são L159F, V321A e S282R. Não existem dados disponíveis para as duas primeiras variantes, uma vez que a terceira variante tem baixa resistência com prevalência de cerca de 0,4%. Daclatasvir tem variante de alta resistência M28 com prevalência de 0.5-4.0%. Ledipasvir tem duas variantes de alta resistência, uma das quais tem prevalência de até 100% para genótipos 2 e 4 [82].
Em geral, a resistência aos inibidores de protease NS34A, como o boceprevir, desaparece do sangue periférico em semanas ou meses, pois, a resistência aos inibidores NS5A -como daclatasvir, ledipasvir e ombitasvir- persiste durante anos [81]. O inibidor da polimerase nucleotídica NS5B sofosbuvir possui a maior barreira à resistência [82].
A resistência da AAD é um assunto emergente que requer maior avaliação. É provável que nas futuras recomendações sejam incluídos estudos sobre resistência prévia ao tratamento. Hoje, as diretrizes atualizadas da AASLD 2016 recomendam a avaliação da resistência NS5A em pacientes com falha aos AAD, especialmente antes de considerar elbasvir/grazoprevir para pacientes com genótipo 1a [3]. Além do genótipo 1a, a resistência NS5A é também muito comum no genótipo 3, o mais prevalente no Paquistão. É preciso compreender melhor o assunto para tratar os pacientes com falha ao tratamento com AAD no Paquistão, estes pacientes -especialmente aqueles com fibrose avançada- podem precisar reforço da terapia com sofosbuvir/velpatasvir [57,58]. A resistência do HCV aos AAD pode impedir que os pacientes alcancem RVS, e os pacientes com falha aos AAD devem ser tratados segundo as recomendações feitas na seção correspondente.
5.13 Tratamento do HCV por profissionais não especializados.
Com todos os AAD orais, e com a disponibilidade de esquemas pangenotípicos administrados uma vez por dia, o tratamento para o HCV parece ser muito fácil, com avaliação mínima. Nos países com recursos limitados e escassos hepatologistas e gastroenterologistas certificados, onde a prevalência do HCV é muito alta, é necessária uma certa flexibilidade. Kattakuzhy e col. iniciaram o ensaio ASCEND no intuito de determinar a segurança do tratamento do HCV com AAD dirigido por profissionais não especializados, e encontraram que era igualmente seguro e eficaz [83]. Os resultados são alentadores, mas tendo em vista o contexto local, algumas modificações e limitações deveriam ser implementadas, p.ex., garantir uma formação adequada dos médicos gerais e encorajá-los a seguir as diretrizes e encaminhar oportunamente os pacientes com complicações e as populações especiais. Isto pode ser bem sucedido usando teleclínicas - um modelo similar ao projeto ECHO [84].
5.14 Resumo
Vantagens dos AAD:
- Terapia oral, sem injeção.
- Pangenotípico: estudos recentes apoiam a eficácia dos AAD em todos os genótipos (1 a 6).
- Ausência de avanço viral durante o tratamento e alta barreira à resistência.
- Eficaz em IL28B CT, variantes TT
- Dosagem simples, sem relação com alimentos, efeitos colaterais mínimos e menor duração do tratamento.
- Eficazes em pacientes sem tratamento prévio e pacientes previamente tratados
- Seguros e eficazes em pacientes cirróticos
Limitações dos AAD:
- Custo alto, especialmente para regiões com recursos limitados. Os estudos publicados são de menor escala, com pouca experiência no uso em diferentes grupos de pacientes.
- Não estão disponíveis em alguns países.
- Interações medicamentosas.
- Resistência aos AAD.
1. European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol. 2017 Jan;66(1):153–94.
2. AASLD/IDSA HCV Guidance Panel. Recommendations for testing, managing, and treating hepatitis C [Internet]. American Association for the Study of Liver Diseases (AASLD); 2017 [cited 2017 Feb 5]. Available from: http://www.hcvguidelines.org/full-report-view.
3. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015 Sep;62(3):932–54.
4. Omata M, Kanda T, Wei L, Yu M-L, Chuang W-L, Ibrahim A, et al. APASL consensus statements and recommendation on treatment of hepatitis C. Hepatol Int. 2016 Sep;10(5):702–26.
5. World Health Organization. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version, April 2016 [Internet]. Geneva: World Health Organization; 2016 [cited 2017 Jan 5]. 138 p. Available from: http://www.who.int/hepatitis/publications/hepatitis-c-guidelines-2016/en/.
6. Mandeville KL, Krabshuis J, Ladep NG, Mulder CJ, Quigley EM, Khan SA. Gastroenterology in developing countries: Issues and advances. World J Gastroenterol. 2009 Jun 21;15(23):2839–54.
7. Zou S, Tepper M, El Saadany S. Prediction of hepatitis C burden in Canada. Can J Gastroenterol J Can Gastroenterol. 2000 Aug;14(7):575–80.
8. Palitzsch KD, Hottenträger B, Schlottmann K, Frick E, Holstege A, Schölmerich J, et al. Prevalence of antibodies against hepatitis C virus in the adult German population. Eur J Gastroenterol Hepatol. 1999 Nov;11(11):1215–20.
9. Umar M, Khaar H-B, Khan AA, Mohsin A, Din W, Shah HA, et al. Diagnosis, management and prevention of hepatitis C in Pakistan 2009. Pak J Gastroenterol. 2009;23(2):7–67.
10. Qureshi H. Prevalence of hepatitis B & C in Pakistan. Islamabad: Pakistan Medical Research Council; 2008.
11. Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000 Mar 11;355(9207):887–91.
12. Amon JJ, Garfein RS, Ahdieh-Grant L, Armstrong GL, Ouellet LJ, Latka MH, et al. Prevalence of hepatitis C virus infection among injection drug users in the United States, 1994–2004. Clin Infect Dis. 2008 Jun 15;46(12):1852–8.
13. Xia X, Luo J, Bai J, Yu R. Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis. Public Health. 2008 Oct;122(10):990–1003.
14. Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med. 2001 Jul 5;345(1):41–52.
15. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis. 2005 Sep;5(9):558–67.
16. Seeff LB. Natural history of chronic hepatitis C. Hepatology. 2002 Nov;36(5 Suppl 1):S35-46.
17. Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol. 2014 Nov;61(1 Suppl):S45-57.
18. Kandeel A, Genedy M, El-Refai S, Funk AL, Fontanet A, Talaat M. The prevalence of hepatitis C virus infection in Egypt 2015: implications for future policy on prevention and treatment. Liver Int. 2017 Jan;37(1):45–53.
19. Tohme RA, Holmberg SD. Is sexual contact a major mode of hepatitis C virus transmission? Hepatology. 2010 Oct;52(4):1497–505.
20. Vandelli C, Renzo F, Romanò L, Tisminetzky S, De Palma M, Stroffolini T, et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study. Am J Gastroenterol. 2004 May;99(5):855–9.
21. Puoti C, Guarisco R, Spilabotti L, Bellis L, Mitidieri Costanza O, Dell’ Unto O, et al. Should we treat HCV carriers with normal ALT levels? The “5Ws” dilemma. J Viral Hepat. 2012 Apr;19(4):229–35.
22. Kane A, Lloyd J, Zaffran M, Simonsen L, Kane M. Transmission of hepatitis B, hepatitis C and human immunodeficiency viruses through unsafe injections in the developing world: model-based regional estimates. Bull World Health Organ. 1999;77(10):801–7.
23. Khan AJ, Luby SP, Fikree F, Karim A, Obaid S, Dellawala S, et al. Unsafe injections and the transmission of hepatitis B and C in a periurban community in Pakistan. Bull World Health Organ. 2000;78(8):956–63.
24. Kaldor JM, Dore GJ, Correll PK. Public health challenges in hepatitis C virus infection. J Gastroenterol Hepatol. 2000 May;15 Suppl:E83–90.
25. World Health Organization. Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium. J Viral Hepat. 1999 Jan;6(1):35–47.
26. Janjua NZ, Nizamy M a. M. Knowledge and practices of barbers about hepatitis B and C transmission in Rawalpindi and Islamabad. JPMA J Pak Med Assoc. 2004 Mar;54(3):116–9.
27. World Health Organization. Global alert and response (GAR). Hepatitis C. [Internet]. Geneva: World Health Organization; 2002. Available from: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4.html.
28. Terrault NA, Dodge JL, Murphy EL, Tavis JE, Kiss A, Levin TR, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013 Mar;57(3):881–9.
29. Centers for Disease Control and Prevention. Viral hepatitis surveillance — United States, 2009 [Internet]. [cited 2017 May 2]. Available from: https://www.cdc.gov/hepatitis/Statistics/2009Surveillance/Commentary.htm.
30. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006 Apr 1;3(2):47–52.
31. Freeman AJ, Dore GJ, Law MG, Thorpe M, Von Overbeck J, Lloyd AR, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology. 2001 Oct;34(4 Pt 1):809–16.
32. Levine RA, Sanderson SO, Ploutz-Snyder R, Murray F, Kay E, Hegarty J, et al. Assessment of fibrosis progression in untreated Irish women with chronic hepatitis C contracted from immunoglobulin anti-D. Clin Gastroenterol Hepatol. 2006 Oct;4(10):1271–7.
33. Jacobson IM, Davis GL, El-Serag H, Negro F, Trépo C. Prevalence and challenges of liver diseases in patients with chronic hepatitis C virus infection. Clin Gastroenterol Hepatol. 2010 Nov;8(11):924–933; quiz e117.
34. Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, et al. Serum level of IP-10 increases predictive value of IL28B polymorphisms for spontaneous clearance of acute HCV infection. Gastroenterology. 2012 Jan;142(1):78–85.e2.
35. Vogt M, Lang T, Frösner G, Klingler C, Sendl AF, Zeller A, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood-donor screening. N Engl J Med. 1999 Sep 16;341(12):866–70.
36. Di Bisceglie AM. Hepatitis C and hepatocellular carcinoma. Hepatology. 1997 Sep;26(3 Suppl 1):34S–38S.
37. Kim WR. The burden of hepatitis C in the United States. Hepatology. 2002 Nov;36(5 Suppl 1):S30-34.
38. World Health Organization. Essential medicines and health products. First WHO prequalified hepatitis C rapid test opens the door to expanded treatment [press release] [Internet]. World Health Organization; 2016 [cited 2016 Dec 13]. Available from: http://www.who.int/medicines/news/prequal_hvc/en/.
39. Pockros PJ. Interferon-free hepatitis C therapy: how close are we? Drugs. 2012 Oct 1;72(14):1825–31.
40. Freeman JAD, Hill A. The use of generic medications for hepatitis C. Liver Int. 2016 Jul;36(7):929–32.
41. Hill A, Simmons B, Gotham D, Fortunak J. Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C. J Virus Erad. 2017 Jan 25;2(1):28–31.
42. Andrieux-Meyer I, Cohn J, de Araújo ESA, Hamid SS. Disparity in market prices for hepatitis C virus direct-acting drugs. Lancet Glob Health. 2015 Nov;3(11):e676-677.
43. Freeman J, Sallie R, Kennedy A, Hieu PTN, Freeman J, Jeffreys G, et al. High sustained virological response rates using generic direct acting antiviral treatment for hepatitis C, imported into Australia. J Hepatol. 2016 Jan 1;64(2):S209.
44. World Health Organization. Combating hepatitis B and C to reach elimination by 2030: advocacy brief [Internet]. Geneva: World Health Organization; 2016. Available from: http://www.who.int/hepatitis/publications/hep-elimination-by-2030-brief/en/.
45. Nguyen-Khac E. [Results and place of Fibroscan in the non-invasive diagnosis of hepatic fibrosis]. Rev Med Interne. 2007 Feb;28(2):94–102.
46. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015 Jul;63(1):237–64.
47. Houot M, Ngo Y, Munteanu M, Marque S, Poynard T. Systematic review with meta-analysis: direct comparisons of biomarkers for the diagnosis of fibrosis in chronic hepatitis C and B. Aliment Pharmacol Ther. 2016 Jan;43(1):16–29.
48. Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: Has anything changed for pregnant/lactating women? World J Hepatol. 2016 Apr 28;8(12):557–65.
49. University of Liverpool. Hepatitis drug interactions [Internet]. HEP Drug Interactions. 2017 [cited 2017 Jan 25]. Available from: http://www.hep-druginteractions.org/.
50. Lalezari JP, Nelson DR, Hyland RH, Lin M, Rossi SJ, Symonds WT, et al. Once daily sofosbuvir plus ribavirin for 12 and 24 weeks in treatment-naïve patients with HCV infection: the Quantum study [abstract, International Liver Congress 2013: 48th Annual Meeting of the European Association for the Study of the Liver, Amsterdam, Netherlands, 24 April–28 April 2013]. J Hepatol. 2013 Apr 1;58(Supplement 1):S346.
51. Osinusi A, Meissner EG, Lee Y-J, Bon D, Heytens L, Nelson A, et al. Sofosbuvir and ribavirin for hepatitis C genotype 1 in patients with unfavorable treatment characteristics: a randomized clinical trial. JAMA. 2013 Aug 28;310(8):804–11.
52. Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med. 2013 Jan 3;368(1):34–44.
53. Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May 16;368(20):1878–87.
54. Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Sofosbuvir for hepatitis C Genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May 16;368(20):1867–77.
55. FDA. U.S. Food & Drug Administration. FDA news release. FDA approves Epclusa for treatment of chronic hepatitis C virus infection [press release] [Internet]. Silver Spring : United States Food and Drug Administration; 2016 [cited 2017 Jan 26]. Available from: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm508915.htm.
56. Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med. 2015 Dec 31;373(27):2599–607.
57. Foster GR, Afdhal N, Roberts SK, Bräu N, Gane EJ, Pianko S, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med. 2015 Dec 31;373(27):2608–17.
58. Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med. 2015 Dec 31;373(27):2618–28.
59. Poordad F, Lawitz E, Gutierrez JA, Evans B, Howe A, Feng H-P, et al. C-swift: grazoprevir/elbasvir + sofosbuvir in cirrhotic and noncirrhotic, treatment-naive patients with hepatitis C virus genotype 1 infection, for durations of 4, 6 or 8 weeks and genotype 3 infection for durations of 8 or 12 weeks — abstract O006. J Hepatol. 2015 Apr 1;62:S192–3.
60. Gerlach JT, Diepolder HM, Zachoval R, Gruener NH, Jung M-C, Ulsenheimer A, et al. Acute hepatitis C: high rate of both spontaneous and treatment-induced viral clearance. Gastroenterology. 2003 Jul;125(1):80–8.
61. Lehmann M, Meyer MF, Monazahian M, Tillmann HL, Manns MP, Wedemeyer H. High rate of spontaneous clearance of acute hepatitis C virus genotype 3 infection. J Med Virol. 2004 Jul;73(3):387–91.
62. Nomura H, Sou S, Tanimoto H, Nagahama T, Kimura Y, Hayashi J, et al. Short-term interferon-alfa therapy for acute hepatitis C: a randomized controlled trial. Hepatology. 2004 May;39(5):1213–9.
63. Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, et al. Treatment of acute hepatitis C with interferon alfa-2b. N Engl J Med. 2001 Nov 15;345(20):1452–7.
64. Santantonio T, Fasano M, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, et al. Efficacy of a 24-week course of PEG-interferon alpha-2b monotherapy in patients with acute hepatitis C after failure of spontaneous clearance. J Hepatol. 2005 Mar;42(3):329–33.
65. Kamal S, Madwar M, He Q, Koziel M. Peginterferon alpha compared to conventional interferon alpha plus ribavirin combination therapy in symptomatic acute hepatitis C: a randomized trial of treatment onset, duration and cost effectiveness [abstract presented at 55th Annual Meeting of the American Association for the Study of Liver Diseases, Boston, Massachusetts, October 29–November 2, 2004]. Hepatology. 2004;40(Supplement S4):178A.
66. Deterding K, Grüner N, Buggisch P, Wiegand J, Galle PR, Spengler U, et al. Delayed versus immediate treatment for patients with acute hepatitis C: a randomised controlled non-inferiority trial. Lancet Infect Dis. 2013 Jun;13(6):497–506.
67. Mack CL, Gonzalez-Peralta RP, Gupta N, Leung D, Narkewicz MR, Roberts EA, et al. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents. J Pediatr Gastroenterol Nutr. 2012 Jun;54(6):838–55.
68. Wirth S, Lang T, Gehring S, Gerner P. Recombinant alfa-interferon plus ribavirin therapy in children and adolescents with chronic hepatitis C. Hepatology. 2002 Nov 1;36(5):1280–4.
69. Wirth S, Pieper-Boustani H, Lang T, Ballauff A, Kullmer U, Gerner P, et al. Peginterferon alfa-2b plus ribavirin treatment in children and adolescents with chronic hepatitis C. Hepatology. 2005 May;41(5):1013–8.
70. Wirth S, Ribes-Koninckx C, Calzado MA, Bortolotti F, Zancan L, Jara P, et al. High sustained virologic response rates in children with chronic hepatitis C receiving peginterferon alfa-2b plus ribavirin. J Hepatol. 2010 Apr;52(4):501–7.
71. Sokal EM, Bourgois A, Stéphenne X, Silveira T, Porta G, Gardovska D, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection in children and adolescents. J Hepatol. 2010 Jun;52(6):827–31.
72. González-Peralta RP, Kelly DA, Haber B, Molleston J, Murray KF, Jonas MM, et al. Interferon alfa-2b in combination with ribavirin for the treatment of chronic hepatitis C in children: efficacy, safety, and pharmacokinetics. Hepatology. 2005 Nov;42(5):1010–8.
73. El-Guindi MA. Hepatitis C Viral Infection in Children: Updated Review. Pediatr Gastroenterol Hepatol Nutr. 2016 Jun;19(2):83–95.
74. Hill A, Khoo S, Simmons B, Ford N. What is the minimum cost per person to cure HCV? In Kuala Lumpur, Malaysia: International Aids Society; 2013 [cited 2017 Jan 27]. Available from: http://pag.ias2013.org/abstracts.aspx?aid=3142.
75. World Health Organization. Notes on the design of a bioequivalance study: sofosbuvir. Guidance document, 13 October 2015 [Internet]. World Health Organization; 2015 [cited 2017 Jan 5]. Available from: https://extranet.who.int/prequal/.
76. Hill A, Golovin S, Dragunova J, Korologou-Linden RS. Virological response rates using generic direct acting antiviral treatment for hepatitis C, legally imported into Russia. AASLD Hepatol Poster Sess IV Abstr 1638-2112 [Internet]. 2017 Jan 25 [cited 2017 Jan 25]; Available from: http://onlinelibrary.wiley.com/doi/10.1002/hep.28800/full.
77. Derbala MF, Elsayad E, Hajelssedig O, Amer A, Eldweik N, Alkaabi SR, et al. Generic versus brand sofosbuvir-based therapy: safety and efficacy, real life data. AASLD Hepatol Poster Sess IV Abstr 1638-2112. 2016 Oct 1;64:811–1050.
78. Ogata N, Alter HJ, Miller RH, Purcell RH. Nucleotide sequence and mutation rate of the H strain of hepatitis C virus. Proc Natl Acad Sci U S A. 1991 Apr 15;88(8):3392–6.
79. Bartenschlager R, Lohmann V. Replication of hepatitis C virus. J Gen Virol. 2000 Jul;81(Pt 7):1631–48.
80. Ray SC, Thomas DL. Hepatitis C. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. 8th ed. Philadelphia: Elsevier Saunders; 2014. p. 1904–27.
81. Pawlotsky J-M. Hepatitis C virus resistance to direct action antiviral drugs in interferon-free regimens. Gastroenterology. 2016 Jul;151(1):70–86.
82. Ahmed A, Felmlee DJ. Mechanisms of hepatitis C viral resistance to direct acting antivirals. Viruses. 2015 Dec 18;7(12):6716–29.
83. Kattakuzhy S, Gross C, Teferi G, Jenkins V, Silk R, Akoth E, et al. A novel task shifting model to expand the HCV care continuum: the Ascend investigation [abstract of paper presented at International Liver Congress, Barcelona, Spain, 13–17 April 2015]. J Hepatol. 2016 Jan 1;64(2):S224–5.
84. Arora S, Thornton K, Murata G, Deming P, Kalishman S, Dion D, et al. Outcomes of treatment for hepatitis C virus infection by primary care providers. N Engl J Med. 2011 Jun 9;364(23):2199–207.