5.1 Objetivos del tratamiento
El objetivo en el tratamiento de la infección por VHC es reducir las complicaciones relacionadas con el virus. Este objetivo se logra mediante la erradicación del virus hasta lograr una respuesta viral sostenida (RVS). En los pacientes que consiguen una RVS se produce una eliminación del virus, y las posibilidades de que éste se reactive son insignificantes. Se han demostrado mejoras en la necroinflamación y la fibrosis hepática, y en el riesgo de carcinoma hepatocelular en pacientes que han logrado una RVS.
Los pacientes en los que la infección aguda por VHC se ha resuelto sin tratamiento no necesitan tratamiento antiviral. Dependiendo de las fuentes, los autores comunican que entre el 15% y el 50% de los pacientes se recuperan espontáneamente.
5.2 Principios del tratamiento
Se ha demostrado que el tratamiento y curación de la hepatitis C previenen el riesgo a largo plazo de complicaciones y es la forma más importante de manejo de la infección crónica por VHC.
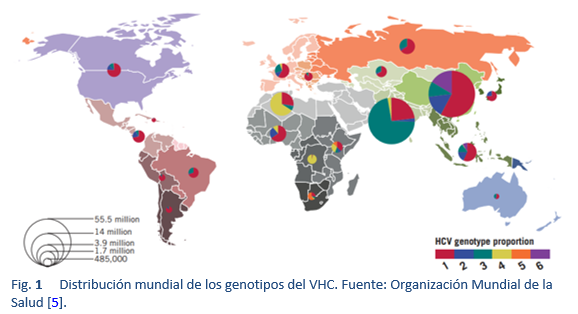
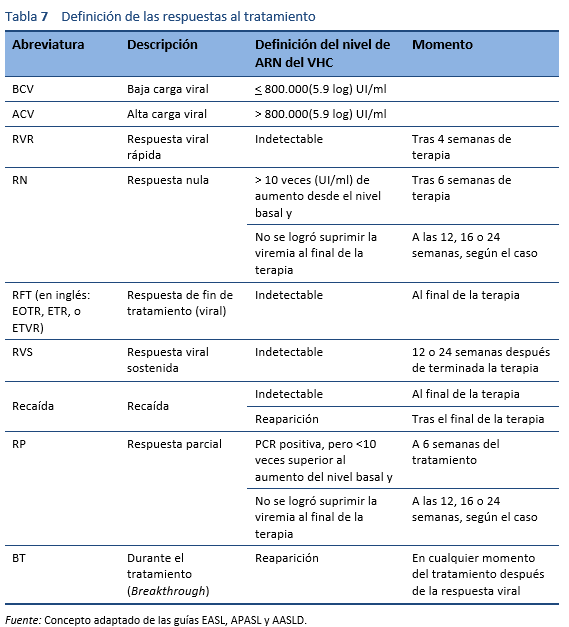
Los genotipos no 1 del HCV son los más comunes en los países densamente poblados de Asia meridional, Asia oriental, África y Oriente Medio. En la era previa del interferón pegilado (PEG-IFN), la monoterapia con IFN convencional o la terapia convencional con interferón/ribavirina (IFN/RBV) constituían el pilar fundamental del tratamiento del VHC en la mayor parte del mundo. Después de 2002, apareció PEG-IFN/RBV. Los ensayos clínicos cruciales sobre el tratamiento con PEG-IFN/RBV mostraron una RVS del 40-45% en pacientes con el genotipo 1, hasta un 80% en aquellos con genotipo 2, y sólo un 50% en aquellos con genotipo 3a. Todos estos tratamientos dejaban alrededor del 50-60% de los pacientes con hepatitis C crónica como no respondedores o con recaídas [35]. Además, estas terapias requerían 24-48 semanas de inyecciones con interferón y ribavirina, con una importante toxicidad, y demasiados pacientes no eran elegibles para IFN o eran reacios a aceptar el tratamiento debido a efectos adversos. Por lo tanto, se necesitaba un régimen ideal que implicara solo fármacos por vía oral, en una dosis diaria, una corta duración de la terapia y efectos secundarios mínimos; además, debería servir para todos los genotipos y tendría un alto valor de RVS (> 95%), independientemente de la etapa de la fibrosis hepática, la no respuesta previa al tratamiento con IFN/RBV, el sexo, la raza y la edad [39].
Después de 2011, esto llevó a la era de los antivirales de acción directa (AAD), que constituyen el actual estándar de cuidado.
El sofosbuvir (SOF), se encuentra fácilmente disponible en el mundo en desarrollo, se toma un comprimido de 400 mg una vez al día. La dosis a usar de PEG-IFN-a2a es de 180 μg una vez por semana, mientras que PEG-IFN alfa-2b debe usarse en una dosis basada en el peso de 1,5 μg/kg por semana. La dosis de ribavirina (RBV) depende del peso del paciente (por ejemplo, 1000 mg en pacientes <75 kg y 1200 mg en pacientes > 75 kg).
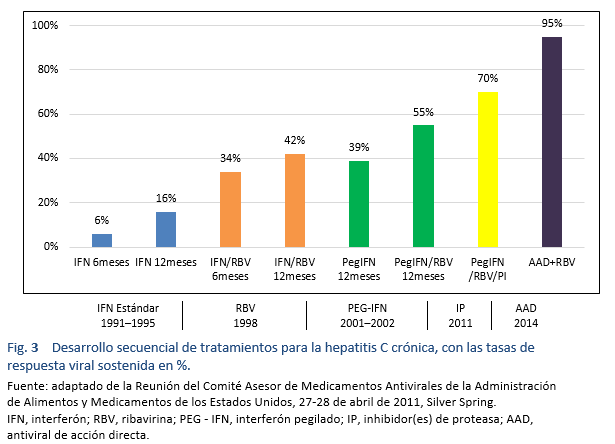
Al principio los nuevos AAD se conseguían sólo a un precio muy alto. En los países de bajos ingresos se hicieron grandes esfuerzos por negociar los precios. Esto llevó a una gran disparidad de precios en las diferentes regiones del mundo. Por ejemplo, en los Estados Unidos se lanzó el sofosbuvir a $ 28,000 la caja, con un costo aproximado de alrededor de $ 84,000 por 3 meses, mientras que el mismo genérico se consigue en Pakistán e India a un precio de $ 300 (el ciclo completo de 6 meses cuesta $ 1800).
Gilead Sciences, Inc., fabricante de Sofosbuvir, ha firmado acuerdos voluntarios de licencia con varios fabricantes para comercializar versiones locales de estos medicamentos genéricos en algunos países de ingresos bajos y medianos, por lo que los precios han disminuido aún más, particularmente en esos países. Sin embargo, estos acuerdos de licencia voluntaria no se aplican en varios países de ingresos medios que también tienen una importante carga de morbilidad, como China, Brasil, Argentina, Irán y Turquía. Las versiones genéricas de los AAD son una alternativa bastante barata y efectiva. En un estudio de 448 pacientes, Freeman y col. informaron una RVS4 de aproximadamente el 94% utilizando AAD genéricos [43].
Las opciones de tratamiento que se presentan en las directrices deben seleccionarse sobre la base de los recursos sanitarios y financieros disponibles. Todas las opciones se basan en pruebas empíricas de expertos regionales y sociedades científicas, que divergen muy poco de la práctica médica basada en la evidencia. Esto representa un esfuerzo por hacer que el tratamiento contra la hepatitis C se pueda aplicar a nivel mundial y que sea factible en la práctica, actualizando la información disponible para los médicos que ejercen a todos los niveles y permitiendo así que los pacientes con hepatitis C en todo el mundo reciban el máximo beneficio.
Por último, las directrices no son reglas fijas, sino que representan un proceso dinámico y siempre cambiante, que orienta a los médicos a tratar a los pacientes en consecuencia y teniendo en cuenta enfoques individualizados siempre que sea necesario. Las directrices siempre necesitan mejorar y actualizarse a medida que van surgiendo nuevos estudios y pruebas.
5.3 ¿A quién habría que tratar?
La infección por el VHC puede curarse mediante un tratamiento antiviral; sin embargo, debido a la naturaleza asintomática de la enfermedad, muchas personas infectadas no son conscientes de la infección, y para aquellos a los que se les diagnostica la enfermedad, el acceso al tratamiento sigue siendo malo en muchos contextos [5].
Por lo tanto, todos los pacientes con infección crónica por VHC deben recibir terapia, excepto los que tengan una corta esperanza de vida debido a comorbilidades graves. Los pacientes que tienen un alto riesgo de complicaciones hepáticas deben tener la prioridad al considerar el tratamiento inmediato.
He aquí los pacientes que están en alto riesgo de complicaciones hepáticas:
- Pacientes con fibrosis avanzada con estadios metavirales ≥ F2
- Pacientes con cirrosis descompensada que están a la espera de trasplante de hígado
- Pacientes con trasplante de hígado
- Pacientes con complicaciones extrahepáticas graves tales como vasculitis, crioglobulinemia que daña órganos terminales, o glomerulonefritis/síndrome nefrótico que causa proteinuria significativa
5.4 Predictores de respuesta al tratamiento
Las recomendaciones para los regímenes preferidos de tratamiento con VHC continúan evolucionando, pero en algunos casos todavía dependen de varios factores que comprometen una RVS:
- Genotipo del VHC
- Historia previa del tratamiento contra el VHC
- Enfermedad hepática compensada versus descompensada
- Interacciones medicamentosas
- Enfermedad renal crónica
- Personas que hayan recibido trasplante de órganos sólidos
Los siguientes son factores predictivos para una respuesta menos favorable al tratamiento con combinaciones de AAD:
- Tratamiento previo con AAD
- Cirrosis hepática (Child-Pugh B y C)
- Mala adherencia al tratamiento
5.5 Evaluación de pretratamiento
Antes de comenzar el tratamiento con AAD, debe evaluarse lo siguiente:
- Es esencial tomar una anamnesis detallada y hacer un examen físico cuidadoso, incluyendo los antecedentes del paciente de cualquier otra enfermedad hepática y afecciones médicas que pueden afectar negativamente el estado del hígado, como la infección por hepatitis B, alcoholismo, patología autoinmune, enfermedades hepáticas metabólicas o drogas/medicaciones hepatotóxicas. Todo eso debe investigarse y se deben adoptar las medidas de reducción de riesgos apropiadas.
- Es preciso considerar otras evaluaciones (evaluación cardiopulmonar y psiquiátrica), y se debe analizar el riesgo de no adherencia. Deben tomarse medidas apropiadas para reducir estos riesgos.
- Evaluación de los medicamentos actuales/anteriores y de la adherencia a tratamientos previos. También se deben evaluar las posibles interacciones de importancia entre medicamentos.
- Debe comprobarse el grado de fibrosis hepática mediante medidas no invasivas:
- - Hay estudios que han demostrado a FibroScan como una técnica sensible alternativa a la biopsia hepática. En más del 95% de los pacientes se puede cuantificar el grado de fibrosis con mucha facilidad y fiabilidad [45]. Una interpretación correcta de la elastografía transitoria debe tener un rango intercuartílico/valores medianos <30% y ALT sérica <5 × límite superior de la normalidad. El paciente no puede haber ingerido alcohol en exceso al momento del examen, y se debe tener en cuenta su IMC. Si el IMC del paciente es superior a 30 kg/m2, se pueden considerar sondas extra grandes (XL).
— En regiones con recursos limitados y en lugares donde no se dispone fácilmente de FibroScan, pueden utilizarse puntuaciones como el índice de fibrosis 4 (FIB4), el índice de relación AST/plaquetas (APRI) y el impulso de fuerza de radiación acústica (ARFI). Se puede utilizar una puntuación APRI ≥ 2 para predecir la presencia de cirrosis. En su punto de corte, la puntuación de ARFI tiene una sensibilidad del 48%, pero una especificidad del 94% para predecir la cirrosis. También puede usarse para predecir la presencia de fibrosis importante (estadios 2-4). Utilizando un valor de corte de 1,5, la sensibilidad es del 37% y la especificidad del 95% para la fibrosis significativa [46,47].
— La biopsia hepática sólo se puede considerar cuando existe la posibilidad de una etiología adicional.
- Cuantificación del suero del ARN del VHC utilizando un ensayo sensible en tiempo real basado en la PCR, con un límite inferior de detección de ≤ 15 UI/ml.
- Genotipificación del VHC.
- En pacientes con sospecha de cirrosis o cirrosis conocida, se debe calcular el puntaje de Child-Turcotte-Pugh y el modelo para la puntuación de la enfermedad hepática terminal (MELD).
5.5.1 Recomendaciones para el monitoreo previo al tratamiento.
1. Se debe realizar un hemograma completo (HC), pruebas de función hepática (PFH), albuminemia, INR, tasa de filtración glomerular (TFG) y una prueba de TSH (si se planea un régimen de IFN) dentro de las 12 semanas del inicio de la terapia.
2. Se debe hacer una PCR cuantitativa y genotipificación en cualquier momento antes de iniciar la terapia.
3. Las mujeres en edad de procrear deben someterse a pruebas urinarias de detección del embarazo antes de iniciar la terapia. En la actualidad, están contraindicados todos los nuevos regímenes de terapia oral, con o sin ribavirina, durante la lactancia debido a la falta de información sobre seguridad en los seres humanos, y se siguen recomendando medidas adecuadas de anticoncepción de rutina para las mujeres en edad fértil [48].
4. Con regímenes que contienen ribavirina, se deben tener en cuenta la edad del paciente y la comorbilidad cardiovascular debida a anemia secundaria.
5.6 Evaluación durante el tratamiento
Recomendaciones para los pacientes que reciben tratamiento con VHC mientras lo reciben:
1. Se debe alentar el cumplimiento cuando el paciente acude a las visitas clínicas o por teléfono. Se debe investigar todo evento adverso, dando asesoramiento sobre las interacciones medicamentosas. La Universidad de Liverpool ofrece una herramienta para verificar las interacciones: “HEP Drug Interaction Checker” (http://www.hep-druginteractions.org) [49].
2. Se deben realizar pruebas de HC, creatinina sérica, TFG y PFH luego de 4 semanas de tratamiento. Se pueden realizar los hemogramas con más frecuencia en pacientes que reciben ribavirina, si están clínicamente indicados.
3. Las pruebas de TSH deben hacerse a las 12 semanas para aquellos pacientes que reciben interferón.
4. La evaluación PCR cuantitativa debe realizarse al final del tratamiento y repetirse a las 12 semanas.
5.6.1 Cuándo suspender el tratamiento debido a los efectos secundarios
- Si se multiplica 10 veces o más el nivel de ALT después de 4 semanas de terapia.
- Si hay un aumento de menos de 10 veces de ALT con uno de los siguientes:
— Aparición de síntomas (náuseas, vómitos, debilidad)
— Ictericia
—Aumentos de la bilirrubina, fosfatasa alcalina (ALP) o INR
- Si hay un aumento de menos de 10 veces de ALT y el paciente está asintomático, la valoración de ALT debe repetirse a las 6 semanas; si persiste elevada, se puede considerar la interrupción de la terapia.
5.7 Evaluación post tratamiento
5.7.1 Para los pacientes que no responden al tratamiento
1. PFH, HC e INR cada 6-12 meses para evaluar la progresión de la enfermedad (pacientes F4).
2. Vigilancia de HCC para pacientes con fibrosis avanzada (metavir F3/F4) mediante controles ecográficos cada 6 meses.
3. Vigilancia endoscópica de varices en pacientes cirróticos.
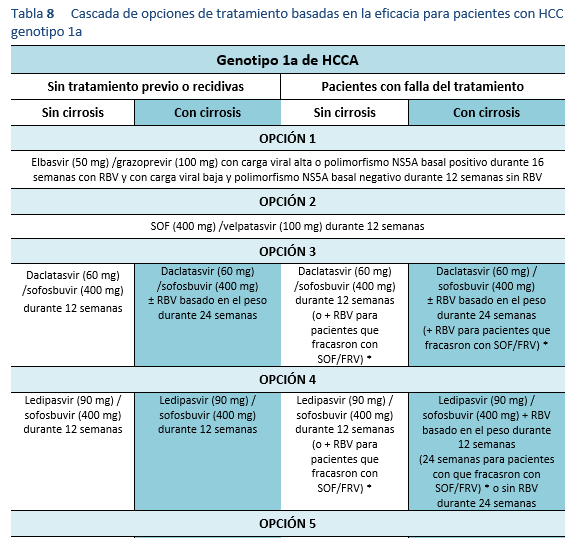
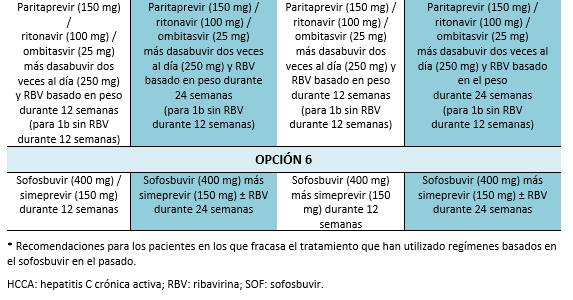
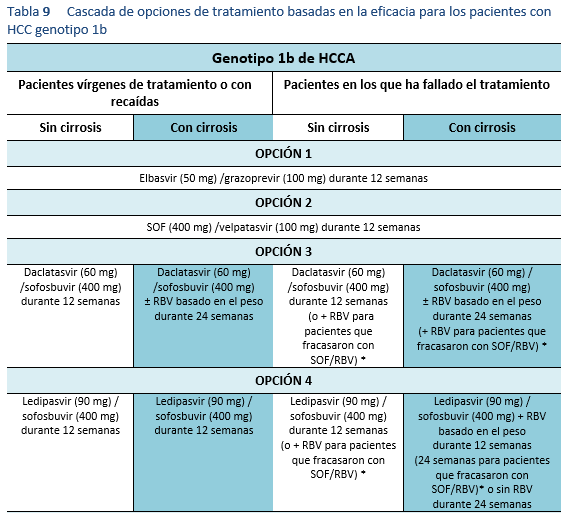
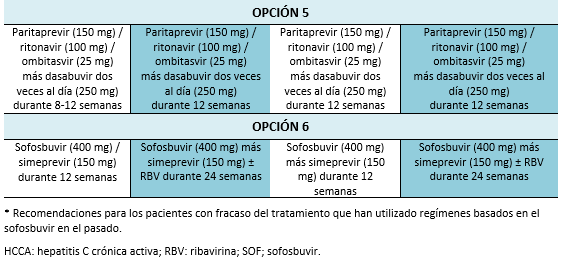
4. Evaluación de una repetición del tratamiento en cuanto se disponga de un tratamiento alternativo eficaz. Es preciso realizar pruebas de mutación antes del tratamiento para seleccionar el mejor régimen disponible a la fecha. En la actualidad, las directrices recomiendan evaluación de la resistencia a NS5A en pacientes en los que ha fracasado AAD, especialmente antes de considerar elbasvir/grazoprevir para los pacientes del genotipo 1a.
5.7.2 Para los pacientes que logran una RVS
1. Para los pacientes con fibrosis F0-F2, se aplican las mismas recomendaciones, igual que si nunca se hubieran infectado con el VHC.
2. Para los pacientes con fibrosis F3-F4, se recomienda la monitorización ecográfica dos veces al año para controlar el CHC.
3. Vigilancia endoscópica de base para los pacientes cirróticos, y si se encuentran várices, se los debe tratar y seguir de la manera estándar.
4. Si las PFH se mantienen anormales a pesar de una RVS, deben evaluarse otras causas de enfermedad hepática.
5.8 Regímenes de tratamiento exclusivamente por vía oral sin interferón para HCC desde 2014
- En diciembre de 2013 y enero de 2014, la FDA aprobó los AAD de segunda generación para el tratamiento del genotipo 1 de hepatitis crónica, que es el genotipo más prevalente, y uno al que se considera difícil de tratar. El primero de ellos fue el sofosbuvir (SOF), que es un inhibidor de la polimerasa NS5B. El primer ensayo que utilizó SOF/RBV fue el estudio ELECTRON, el que informó tasas de RVS del 84% de los 25 pacientes no tratados previamente después de 24 semanas de tratamiento (RVS 24) [50,51]. En un estudio posterior de un régimen consistente en sofosbuvir y RBV durante 24 semanas en 60 pacientes sin tratamiento previo con genotipo 1 con factores de mal pronóstico, tales como etnia afro-americana, ccIL28B y carga viral de más de 800.000 UI/ml, las tasas de RVS 24 fueron del 68% [51].
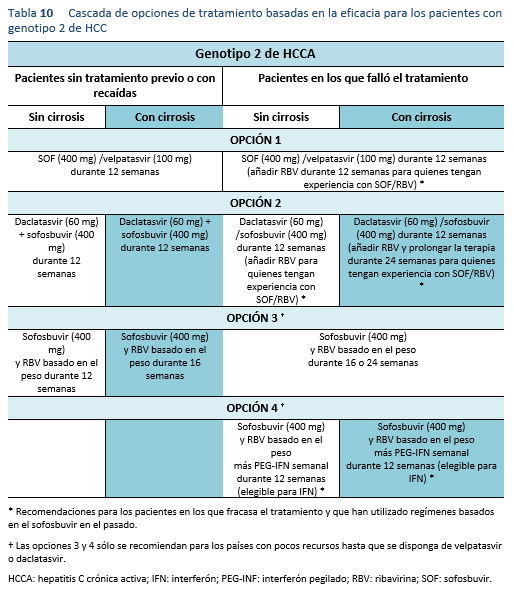
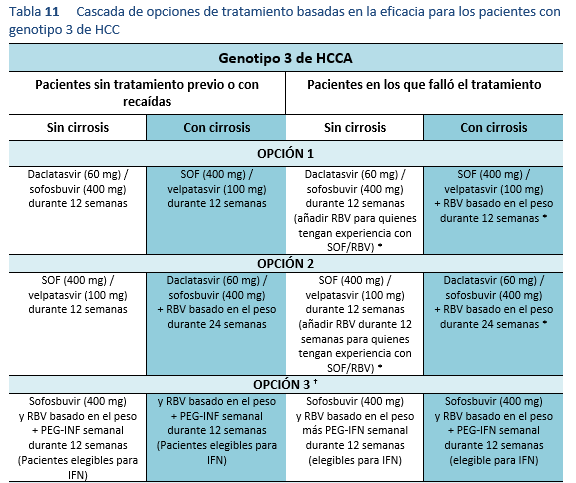
- En el estudio ELECTRON, se administró SOF/RBV a pacientes del genotipo 2 y 3 sin cirrosis, y el 100% logró la RVS 24 [52]. En el ensayo FISSION, en el que se administró SOF/RBV durante 12 semanas a 499 pacientes sin tratamiento previo, las tasas de RVS 12 fueron del 97% para los pacientes con el genotipo 2 del VHC. En los pacientes con el genotipo 3, las tasas de RVS 12 fueron sólo del 56%. [53]. Asimismo, en el ensayo POSITRON las tasas de RVS 24 después de 24 semanas de tratamiento fueron 61% para el genotipo 3 y 93% para el genotipo 2 [54]. Se obtuvieron resultados similares en el ensayo FUSSION, con malas tasas de RVS del 62% en los pacientes infectados con el genotipo 3.
- Desde entonces, la FDA ha aprobado varios fármacos separados o en combinaciones de dosis fijas, entre ellos el daclatasvir, el régimen 3D, el paritaprevir + dasabuvir/ombitasvir + ritonavir (Viekira pak).
- Una de las combinaciones pan-genotipo aprobadas por la FDA más recientemente, que está disponible bajo el nombre comercial Epclusa, contiene sofosbuvir + velpatasvir [55]. En un ensayo de fase 3, Feld y col. administraron esta combinación durante 12 semanas y comunicaron una RVS 12 del 99% en pacientes con genotipos 1, 2, 4, 5 y 6 [56]. El ensayo ASTRAL-3 informó una RVS 12 del 95% en pacientes con el genotipo 3 tratados con sofosbuvir + velpatasvir durante 12 semanas [57]. En otro ensayo, Curry y col. utilizaron esta combinación en pacientes descompensados, con RVS de 83% en pacientes que usaron la combinación durante 12 semanas, 86% en quienes lo usaron durante 24 semanas y 94% en pacientes que usaron la combinación junto con ribavirina durante 12 semanas [58].
- Zepatier es otra combinación pan-genotípica basada en AAD; fue aprobada en 2016. La combinación contiene 100 mg de grazoprevir y 50 mg de elbasvir. en el estudio C-SWIFT se estudió una combinación de Zepatier con sofosbuvir, y al administrarse durante 8 semanas en pacientes con genotipo 1 y 12 semanas en aquellos con genotipo 3 mostró una eficacia de más del 90% [59].
5.9 Tratamiento de poblaciones especiales
5.9.1 Tratamiento de la hepatitis C aguda
La hepatitis C aguda es difícil de diagnosticar en pacientes asintomáticos, particularmente cuando no queda claro el momento exacto en que se contrajo el virus. Hay dos cuestiones que deben abordarse en pacientes con hepatitis C aguda: en primer lugar, cuándo comenzar la terapia; y, en segundo lugar, cuál debe ser el régimen y la duración de la terapia.
En un metaanálisis de 16 estudios, el resultado en el grupo de pacientes a los que se les ofreció terapia temprana en la hepatitis aguda fue mejor que en el grupo de pacientes observados por aclaramiento espontáneo. En otro estudio, la terapia temprana con dosis más altas de IFN convencional alcanzó una RVS de 85-100%. La dosis de IFN convencional fue de 5-10 millones de unidades/día durante 12 semanas. Otra opción era PEG-IFN en una dosis de 1,2-1,3 mg/kg por semana, considerando la conveniencia del esquema posológico, pero el costo era más alto [60–65].
Un estudio de Deterding y col. mostraron que la demora en instaurar el tratamiento no disminuía su eficacia, comparado don el tratamiento inmediato. Además, la ventaja de demorar el tratamiento es que puede evitar un tratamiento innecesario en pacientes que luego lograrían eliminar el virus espontáneamente sin ningún tratamiento; sin embargo, cuando se decide no tratar, es preciso realizar una estrecha vigilancia de los pacientes [66].
Dado que los nuevos AAD tienen una mayor eficacia y seguridad, el argumento a favor del tratamiento temprano ha perdido fuerza relativamente. Por lo tanto, las nuevas recomendaciones son las siguientes.
- Se recomiendan controles periódicos de laboratorio con ARN del VHC por lo menos durante 6 meses para evaluar la eliminación espontánea.
- Los pacientes con infección aguda por VHC necesitan asesoramiento, para asegurarse que eviten los fármacos hepatotóxicos (por ejemplo, acetaminofeno) y alcohol. Los pacientes también deben tomar medidas de precaución para reducir el riesgo de transmitir la enfermedad a otros.
- El tratamiento temprano sólo puede considerarse en circunstancias especiales - por ejemplo, en individuos que corren el riesgo de transmitir la enfermedad a otros (como los usuarios de drogas intravenosas ilícitas o los cirujanos), los pacientes que ya sufren de enfermedad hepática avanzada por alguna otra razón, y aquellos con mayores posibilidades de perderse del seguimiento. Incluso en estos pacientes, uno debe por lo menos esperar 12-16 semanas antes de comenzar la terapia.
- De estar indicado, el tratamiento para la infección aguda por VHC se puede administrar usando AAD con los mismos regímenes que para la enfermedad crónica.
- No se recomienda terapia profiláctica en casos de lesiones por pinchazo de agujas, ya que la tasa de infectividad es muy baja.
5.9.2 Tratamiento de la infección por VHC en niños
Hay diferentes escuelas de pensamiento con respecto al tratamiento de la hepatitis C en niños. Como el curso natural de la infección crónica por la hepatitis C es lento, el tratamiento puede ser aplazado hasta la adolescencia. Sin embargo, también se piensa que los adolescentes y adultos jóvenes son más despreocupados y menos propensos a cumplir con el tratamiento.
AASLD todavía recomienda sólo interferones concomitantemente con RBV en la población pediátrica, y se piensa que PEG-IFN es superior al IFN convencional en los niños también [67]. El peginterferón alfa-2b se administra a una dosis de 60 μg/m2/semana, mientras que el peginterferón alfa-2a se administra a una dosis de 180 μg/1,73 m2/semana junto con RBV a una dosis de 15 mg/kg/día. La combinación se administra durante 48 semanas en los pacientes con los genotipos 1 o 4, y durante 24 semanas en aquellos con los genotipos 2 o 3.
La respuesta pediátrica al tratamiento con IFN/RBV en la infección por VHC es de 36-57% de RVS para el genotipo 1, 84-100% para los genotipos 2 y 3 y 50-80% para el genotipo 4. El perfil de efectos secundarios de IFN/RBV en niños incluye síntomas similares a los de la gripe, fiebre, leucopenia, cefaleas, dolor abdominal, pérdida del apetito, diarrea y efectos psiquiátricos [68–72].
Debido a los efectos secundarios y a la baja RVS, particularmente en el genotipo 1 en niños, es preciso considerar el uso de AAD. Dos ensayos patrocinados por Gilead Sciences se encuentran en fase 2, evaluando la eficacia y seguridad de ledipasvir y sofosbuvir para el genotipo 1 y sofosbuvir y RBV para los genotipos 2 y 3, respectivamente. La excelente eficacia de los nuevos AAD en la población adulta ha animado a los investigadores a evaluar los fármacos en la población adolescente. Se ha evaluado la farmacocinética y el perfil de seguridad de sofosbuvir y ledipasvir/sofosbuvir en niños de 12 a 17 años de edad, y se han reportado resultados comparables en este grupo [73]. Sin embargo, se requieren ensayos más profundos antes de poderse aprobar el uso de estos AAD en niños.
Notas:
- Otros grupos especiales de pacientes con HCC - por ejemplo, pacientes con insuficiencia renal, aquellos con coinfección con VHC/VIH y VHB, receptores de trasplante de órganos, entre otros se tratan en unidades hepáticas especializadas; en otras directrices internacionales se pueden encontrar las recomendaciones prácticas (ver Tabla 1).
- Como el tratamiento de la hepatitis C está cambiando rápidamente debido a la rapidez con que se están desarrollando los AAD, se recomienda a los lectores consultar los nuevos algoritmos de tratamiento en las guías de AASLD, EASL y APASL.
5.10 ¿Son eficaces los genéricos locales y los AAD de marca patentada?
Con la aprobación de nuevos fármacos y nuevos AAD, han surgido expectativas de que estos medicamentos brinden un tratamiento efectivo, seguro y barato para el VHC. Aunque existe una enorme diferencia de precios de los genéricos en todo el mundo, Hill y col. señalaron en 2013 que los costos de los AAD de patente son muy bajos - por ejemplo, un ciclo de tratamiento de 12 semanas de sofosbuvir cuesta aproximadamente $ 101, y un ciclo de daclatasvir de 12 semanas cuesta $ 20 [74].
En la actualidad hay varios fabricantes de genéricos, y la competencia entre ellos está llevando a que sigan reduciendo los precios de los AAD. Los países de bajos ingresos como Pakistán e India tienen acceso a ingredientes farmacéuticos activos de bajo costo, pero la garantía de calidad de los productos es cuestionable. La información proveniente de países como Egipto, donde las autoridades aplican una garantía de calidad estricta de los medicamentos genéricos es muy promisoria. La OMS ha desarrollado un mecanismo para la garantía de la calidad de estos medicamentos a través de su programa de precalificación [75].
Los datos preliminares de un centro en Pakistán, basado en sofosbuvir genérico de bajo precio, mostraron una tasa de respuesta viral rápida del 86,8% en los pacientes con genotipo 3 (presentaron el resumen en la Semana de las Enfermedades Digestivas 2017). Asimismo, grupos de Rusia y Qatar que presentaron dos resúmenes sobre el tratamiento con genéricos en la reunión de la AASLD en Boston han mostrado excelentes resultados, con RVS de aproximadamente 92% y 95% respectivamente [76,77].
5.11 ¿Se sigue necesitando el IFN pese al advenimiento de los AAD? Una perspectiva local
El interferón ha sido sin duda el pilar fundamental del tratamiento del VHC en el pasado, pero sus muchas desventajas y la introducción de alternativas seguras y eficaces en forma de AAD han limitado su uso, con riesgo de quedar obsoleto en el tratamiento del VHC en un futuro cercano. No hay razones médicas para abstenerse de usar AAD para el tratamiento del VHC, pero en los países de bajos ingresos -especialmente en la región de Asia-Pacífico- su penetración ha sido hasta ahora muy lenta. Actualmente, la única indicación para la terapia basada en IFN es cuando no hay acceso a AAD. Otro argumento a favor del IFN es que los asiáticos tienden a presentar una respuesta relativamente mejor, en parte debido al alelo IL28B; sin embargo, con regímenes basados en IFN no es posible erradicar el virus mundialmente. El acceso a los AAD es el tema principal que debe abordarse. Los esfuerzos realizados por Gilead Sciences, Inc. para suministrar su medicación a los 90 países con las cifras de producto interno bruto más bajas del mundo representan un paso apreciable en esa dirección.
5.12 Resistencia a los AAD, un problema subestimado
El VHC tiene una alta tasa de replicación, lo que entraña una baja capacidad de corrección de la ARN-polimerasa dependiente del ARN del VHC [78,79]. Esto provoca una alta variación genética, incluso dentro de un único genotipo [80]. Por lo tanto, los individuos infectados con VHC tienen una mezcla de cepas genéticamente similares de HCV, con una cepa de tipo no mutada predominante que es sensible a fármacos (detectable al inicio de la terapia) y bajos niveles de cepas resistentes (no detectable al inicio de la terapia). Estas cepas resistentes tienen un aminoácido mutante que o bien disminuye la eficacia del AAD o hace que el virus sea más apto [81].
Al comenzar el tratamiento con AAD, hay un rápido descenso de la variante sensible, lo que negativiza el análisis cuantitativo del ARN del VHC. Si la duración de la terapia con AAD es suficientemente prolongada, al final del tratamiento se habrán eliminado las cepas sensibles, quedando la variante resistente a niveles bajos indetectables, de manera que los análisis cuantitativos del ARN del VHC siguen siendo negativos. Al interrumpirse el tratamiento, el cambio en el entorno competitivo (con la eliminación del tipo sensible) conduce a la aparición de cepas resistentes, causando recaída y falla de los AAD.
Hay distintas cepas de prevalencia variable asociadas a resistencia que están bien documentadas para diversos AAD. Por ejemplo, las variantes comunes asociadas a resistencia para el sofosbuvir son L159F, V321A y S282R. No hay datos disponibles para las dos primeras variantes, mientras que la tercera variante tiene baja resistencia, con una prevalencia de alrededor del 0,4%. Daclatasvir tiene una variante de alta resistencia, M28, con una prevalencia de 0.5-4.0%. Ledipasvir tiene dos variantes de alta resistencia, una de las cuales tiene una prevalencia de hasta el 100% para los genotipos 2 y 4 [82].
En general, la resistencia a los inhibidores de la proteasa NS34A, como el boceprevir, desaparece de la sangre periférica en unas semanas a meses, mientras que la resistencia a los inhibidores NS5A -como daclatasvir, ledipasvir y ombitasvir- persiste durante años [81]. El inhibidor de la polimerasa nucleosídica NS5B, el sofosbuvir, tiene la mayor barrera a la resistencia [82].
La resistencia de la AAD es un tema emergente que requiere una mayor evaluación. Es probable que en las futuras recomendaciones incluyan estudios sobre resistencia previo al tratamiento. En la actualidad, las directrices actualizadas de la AASLD 2016 recomiendan la evaluación de la resistencia NS5A en pacientes en los que fallen los AAD, especialmente antes de considerar elbasvir/grazoprevir para los pacientes con genotipo 1a [3]. Aparte del genotipo 1a, la resistencia NS5A es también muy común en el genotipo 3, que es más prevalente en Pakistán. Se necesita una mayor comprensión del tema para tratar a los pacientes en los que los AAD han fracasado en Pakistán, y estos pacientes -especialmente quienes tienen fibrosis avanzada- pueden necesitar refuerzo de la terapia con sofosbuvir/velpatasvir [57,58]. La resistencia del HCV a los AAD puede impedir que los pacientes alcancen una RVS, y los pacientes en los que fallen los AAD deben manejarse según las recomendaciones hechas en la sección correspondiente.
5.13 Tratamiento del VHC por profesionales no especializados.
Con todos los AAD orales, y particularmente con la disponibilidad de regímenes pan-genotípicos que se administran una vez al día, el tratamiento para el VHC parece ser muy fácil, requiriendo una evaluación mínima. Dado que la prevalencia del VHC es muy alta en varios países con recursos limitados y con escasos hepatólogos y gastroenterólogos certificados, el tema requiere flexibilidad. Kattakuzhy y col. iniciaron el ensayo ASCEND con el fin de determinar la seguridad del tratamiento del VHC con AAD manejado por profesionales no especializados, y encontraron que era igualmente seguro y eficaz [83]. Los resultados son alentadores, pero teniendo en cuenta el contexto local, se deben implementar algunas modificaciones y limitaciones, como asegurar una formación adecuada de los médicos generales y animarlos a seguir las pautas y a derivar oportunamente a los pacientes con complicaciones y las poblaciones especiales. Esto se puede lograr con éxito utilizando teleclínicas - un modelo similar al proyecto ECHO [84].
5.14 Resumen
Ventajas de los AAD:
- Terapia oral, sin inyección.
- Pan-genotípico: estudios recientes apoyan la eficacia de AAD en todos los genotipos (1 a 6).
- Ausencia de avance viral durante el tratamiento y alta barrera a la resistencia.
- Efectivo en IL28B CT, variantes TT
- Fácil dosificación, independientemente de los alimentos, efectos secundarios mínimos y tratamiento más corto.
- Eficaces en pacientes no tratados previamente y tratados previamente
- Seguros y eficaces en pacientes cirróticos
Limitaciones de los AAD:
- El costo es alto, especialmente para regiones con recursos limitados, y los estudios publicados son más pequeños con poca experiencia de uso en diferentes grupos de pacientes.
- No están disponibles en algunos países.
- Interacciones medicamentosas.
- Resistencia a los AAD.
1. European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol. 2017 Jan;66(1):153–94.
2. AASLD/IDSA HCV Guidance Panel. Recommendations for testing, managing, and treating hepatitis C [Internet]. American Association for the Study of Liver Diseases (AASLD); 2017 [cited 2017 Feb 5]. Available from: http://www.hcvguidelines.org/full-report-view.
3. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015 Sep;62(3):932–54.
4. Omata M, Kanda T, Wei L, Yu M-L, Chuang W-L, Ibrahim A, et al. APASL consensus statements and recommendation on treatment of hepatitis C. Hepatol Int. 2016 Sep;10(5):702–26.
5. World Health Organization. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version, April 2016 [Internet]. Geneva: World Health Organization; 2016 [cited 2017 Jan 5]. 138 p. Available from: http://www.who.int/hepatitis/publications/hepatitis-c-guidelines-2016/en/.
6. Mandeville KL, Krabshuis J, Ladep NG, Mulder CJ, Quigley EM, Khan SA. Gastroenterology in developing countries: Issues and advances. World J Gastroenterol. 2009 Jun 21;15(23):2839–54.
7. Zou S, Tepper M, El Saadany S. Prediction of hepatitis C burden in Canada. Can J Gastroenterol J Can Gastroenterol. 2000 Aug;14(7):575–80.
8. Palitzsch KD, Hottenträger B, Schlottmann K, Frick E, Holstege A, Schölmerich J, et al. Prevalence of antibodies against hepatitis C virus in the adult German population. Eur J Gastroenterol Hepatol. 1999 Nov;11(11):1215–20.
9. Umar M, Khaar H-B, Khan AA, Mohsin A, Din W, Shah HA, et al. Diagnosis, management and prevention of hepatitis C in Pakistan 2009. Pak J Gastroenterol. 2009;23(2):7–67.
10. Qureshi H. Prevalence of hepatitis B & C in Pakistan. Islamabad: Pakistan Medical Research Council; 2008.
11. Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000 Mar 11;355(9207):887–91.
12. Amon JJ, Garfein RS, Ahdieh-Grant L, Armstrong GL, Ouellet LJ, Latka MH, et al. Prevalence of hepatitis C virus infection among injection drug users in the United States, 1994–2004. Clin Infect Dis. 2008 Jun 15;46(12):1852–8.
13. Xia X, Luo J, Bai J, Yu R. Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis. Public Health. 2008 Oct;122(10):990–1003.
14. Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med. 2001 Jul 5;345(1):41–52.
15. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis. 2005 Sep;5(9):558–67.
16. Seeff LB. Natural history of chronic hepatitis C. Hepatology. 2002 Nov;36(5 Suppl 1):S35-46.
17. Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol. 2014 Nov;61(1 Suppl):S45-57.
18. Kandeel A, Genedy M, El-Refai S, Funk AL, Fontanet A, Talaat M. The prevalence of hepatitis C virus infection in Egypt 2015: implications for future policy on prevention and treatment. Liver Int. 2017 Jan;37(1):45–53.
19. Tohme RA, Holmberg SD. Is sexual contact a major mode of hepatitis C virus transmission? Hepatology. 2010 Oct;52(4):1497–505.
20. Vandelli C, Renzo F, Romanò L, Tisminetzky S, De Palma M, Stroffolini T, et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study. Am J Gastroenterol. 2004 May;99(5):855–9.
21. Puoti C, Guarisco R, Spilabotti L, Bellis L, Mitidieri Costanza O, Dell’ Unto O, et al. Should we treat HCV carriers with normal ALT levels? The “5Ws” dilemma. J Viral Hepat. 2012 Apr;19(4):229–35.
22. Kane A, Lloyd J, Zaffran M, Simonsen L, Kane M. Transmission of hepatitis B, hepatitis C and human immunodeficiency viruses through unsafe injections in the developing world: model-based regional estimates. Bull World Health Organ. 1999;77(10):801–7.
23. Khan AJ, Luby SP, Fikree F, Karim A, Obaid S, Dellawala S, et al. Unsafe injections and the transmission of hepatitis B and C in a periurban community in Pakistan. Bull World Health Organ. 2000;78(8):956–63.
24. Kaldor JM, Dore GJ, Correll PK. Public health challenges in hepatitis C virus infection. J Gastroenterol Hepatol. 2000 May;15 Suppl:E83–90.
25. World Health Organization. Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium. J Viral Hepat. 1999 Jan;6(1):35–47.
26. Janjua NZ, Nizamy M a. M. Knowledge and practices of barbers about hepatitis B and C transmission in Rawalpindi and Islamabad. JPMA J Pak Med Assoc. 2004 Mar;54(3):116–9.
27. World Health Organization. Global alert and response (GAR). Hepatitis C. [Internet]. Geneva: World Health Organization; 2002. Available from: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4.html.
28. Terrault NA, Dodge JL, Murphy EL, Tavis JE, Kiss A, Levin TR, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013 Mar;57(3):881–9.
29. Centers for Disease Control and Prevention. Viral hepatitis surveillance — United States, 2009 [Internet]. [cited 2017 May 2]. Available from: https://www.cdc.gov/hepatitis/Statistics/2009Surveillance/Commentary.htm.
30. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006 Apr 1;3(2):47–52.
31. Freeman AJ, Dore GJ, Law MG, Thorpe M, Von Overbeck J, Lloyd AR, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology. 2001 Oct;34(4 Pt 1):809–16.
32. Levine RA, Sanderson SO, Ploutz-Snyder R, Murray F, Kay E, Hegarty J, et al. Assessment of fibrosis progression in untreated Irish women with chronic hepatitis C contracted from immunoglobulin anti-D. Clin Gastroenterol Hepatol. 2006 Oct;4(10):1271–7.
33. Jacobson IM, Davis GL, El-Serag H, Negro F, Trépo C. Prevalence and challenges of liver diseases in patients with chronic hepatitis C virus infection. Clin Gastroenterol Hepatol. 2010 Nov;8(11):924–933; quiz e117.
34. Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, et al. Serum level of IP-10 increases predictive value of IL28B polymorphisms for spontaneous clearance of acute HCV infection. Gastroenterology. 2012 Jan;142(1):78–85.e2.
35. Vogt M, Lang T, Frösner G, Klingler C, Sendl AF, Zeller A, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood-donor screening. N Engl J Med. 1999 Sep 16;341(12):866–70.
36. Di Bisceglie AM. Hepatitis C and hepatocellular carcinoma. Hepatology. 1997 Sep;26(3 Suppl 1):34S–38S.
37. Kim WR. The burden of hepatitis C in the United States. Hepatology. 2002 Nov;36(5 Suppl 1):S30-34.
38. World Health Organization. Essential medicines and health products. First WHO prequalified hepatitis C rapid test opens the door to expanded treatment [press release] [Internet]. World Health Organization; 2016 [cited 2016 Dec 13]. Available from: http://www.who.int/medicines/news/prequal_hvc/en/.
39. Pockros PJ. Interferon-free hepatitis C therapy: how close are we? Drugs. 2012 Oct 1;72(14):1825–31.
40. Freeman JAD, Hill A. The use of generic medications for hepatitis C. Liver Int. 2016 Jul;36(7):929–32.
41. Hill A, Simmons B, Gotham D, Fortunak J. Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C. J Virus Erad. 2017 Jan 25;2(1):28–31.
42. Andrieux-Meyer I, Cohn J, de Araújo ESA, Hamid SS. Disparity in market prices for hepatitis C virus direct-acting drugs. Lancet Glob Health. 2015 Nov;3(11):e676-677.
43. Freeman J, Sallie R, Kennedy A, Hieu PTN, Freeman J, Jeffreys G, et al. High sustained virological response rates using generic direct acting antiviral treatment for hepatitis C, imported into Australia. J Hepatol. 2016 Jan 1;64(2):S209.
44. World Health Organization. Combating hepatitis B and C to reach elimination by 2030: advocacy brief [Internet]. Geneva: World Health Organization; 2016. Available from: http://www.who.int/hepatitis/publications/hep-elimination-by-2030-brief/en/.
45. Nguyen-Khac E. [Results and place of Fibroscan in the non-invasive diagnosis of hepatic fibrosis]. Rev Med Interne. 2007 Feb;28(2):94–102.
46. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015 Jul;63(1):237–64.
47. Houot M, Ngo Y, Munteanu M, Marque S, Poynard T. Systematic review with meta-analysis: direct comparisons of biomarkers for the diagnosis of fibrosis in chronic hepatitis C and B. Aliment Pharmacol Ther. 2016 Jan;43(1):16–29.
48. Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: Has anything changed for pregnant/lactating women? World J Hepatol. 2016 Apr 28;8(12):557–65.
49. University of Liverpool. Hepatitis drug interactions [Internet]. HEP Drug Interactions. 2017 [cited 2017 Jan 25]. Available from: http://www.hep-druginteractions.org/.
50. Lalezari JP, Nelson DR, Hyland RH, Lin M, Rossi SJ, Symonds WT, et al. Once daily sofosbuvir plus ribavirin for 12 and 24 weeks in treatment-naïve patients with HCV infection: the Quantum study [abstract, International Liver Congress 2013: 48th Annual Meeting of the European Association for the Study of the Liver, Amsterdam, Netherlands, 24 April–28 April 2013]. J Hepatol. 2013 Apr 1;58(Supplement 1):S346.
51. Osinusi A, Meissner EG, Lee Y-J, Bon D, Heytens L, Nelson A, et al. Sofosbuvir and ribavirin for hepatitis C genotype 1 in patients with unfavorable treatment characteristics: a randomized clinical trial. JAMA. 2013 Aug 28;310(8):804–11.
52. Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med. 2013 Jan 3;368(1):34–44.
53. Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May 16;368(20):1878–87.
54. Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Sofosbuvir for hepatitis C Genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May 16;368(20):1867–77.
55. FDA. U.S. Food & Drug Administration. FDA news release. FDA approves Epclusa for treatment of chronic hepatitis C virus infection [press release] [Internet]. Silver Spring : United States Food and Drug Administration; 2016 [cited 2017 Jan 26]. Available from: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm508915.htm.
56. Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med. 2015 Dec 31;373(27):2599–607.
57. Foster GR, Afdhal N, Roberts SK, Bräu N, Gane EJ, Pianko S, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med. 2015 Dec 31;373(27):2608–17.
58. Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med. 2015 Dec 31;373(27):2618–28.
59. Poordad F, Lawitz E, Gutierrez JA, Evans B, Howe A, Feng H-P, et al. C-swift: grazoprevir/elbasvir + sofosbuvir in cirrhotic and noncirrhotic, treatment-naive patients with hepatitis C virus genotype 1 infection, for durations of 4, 6 or 8 weeks and genotype 3 infection for durations of 8 or 12 weeks — abstract O006. J Hepatol. 2015 Apr 1;62:S192–3.
60. Gerlach JT, Diepolder HM, Zachoval R, Gruener NH, Jung M-C, Ulsenheimer A, et al. Acute hepatitis C: high rate of both spontaneous and treatment-induced viral clearance. Gastroenterology. 2003 Jul;125(1):80–8.
61. Lehmann M, Meyer MF, Monazahian M, Tillmann HL, Manns MP, Wedemeyer H. High rate of spontaneous clearance of acute hepatitis C virus genotype 3 infection. J Med Virol. 2004 Jul;73(3):387–91.
62. Nomura H, Sou S, Tanimoto H, Nagahama T, Kimura Y, Hayashi J, et al. Short-term interferon-alfa therapy for acute hepatitis C: a randomized controlled trial. Hepatology. 2004 May;39(5):1213–9.
63. Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, et al. Treatment of acute hepatitis C with interferon alfa-2b. N Engl J Med. 2001 Nov 15;345(20):1452–7.
64. Santantonio T, Fasano M, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, et al. Efficacy of a 24-week course of PEG-interferon alpha-2b monotherapy in patients with acute hepatitis C after failure of spontaneous clearance. J Hepatol. 2005 Mar;42(3):329–33.
65. Kamal S, Madwar M, He Q, Koziel M. Peginterferon alpha compared to conventional interferon alpha plus ribavirin combination therapy in symptomatic acute hepatitis C: a randomized trial of treatment onset, duration and cost effectiveness [abstract presented at 55th Annual Meeting of the American Association for the Study of Liver Diseases, Boston, Massachusetts, October 29–November 2, 2004]. Hepatology. 2004;40(Supplement S4):178A.
66. Deterding K, Grüner N, Buggisch P, Wiegand J, Galle PR, Spengler U, et al. Delayed versus immediate treatment for patients with acute hepatitis C: a randomised controlled non-inferiority trial. Lancet Infect Dis. 2013 Jun;13(6):497–506.
67. Mack CL, Gonzalez-Peralta RP, Gupta N, Leung D, Narkewicz MR, Roberts EA, et al. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents. J Pediatr Gastroenterol Nutr. 2012 Jun;54(6):838–55.
68. Wirth S, Lang T, Gehring S, Gerner P. Recombinant alfa-interferon plus ribavirin therapy in children and adolescents with chronic hepatitis C. Hepatology. 2002 Nov 1;36(5):1280–4.
69. Wirth S, Pieper-Boustani H, Lang T, Ballauff A, Kullmer U, Gerner P, et al. Peginterferon alfa-2b plus ribavirin treatment in children and adolescents with chronic hepatitis C. Hepatology. 2005 May;41(5):1013–8.
70. Wirth S, Ribes-Koninckx C, Calzado MA, Bortolotti F, Zancan L, Jara P, et al. High sustained virologic response rates in children with chronic hepatitis C receiving peginterferon alfa-2b plus ribavirin. J Hepatol. 2010 Apr;52(4):501–7.
71. Sokal EM, Bourgois A, Stéphenne X, Silveira T, Porta G, Gardovska D, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection in children and adolescents. J Hepatol. 2010 Jun;52(6):827–31.
72. González-Peralta RP, Kelly DA, Haber B, Molleston J, Murray KF, Jonas MM, et al. Interferon alfa-2b in combination with ribavirin for the treatment of chronic hepatitis C in children: efficacy, safety, and pharmacokinetics. Hepatology. 2005 Nov;42(5):1010–8.
73. El-Guindi MA. Hepatitis C Viral Infection in Children: Updated Review. Pediatr Gastroenterol Hepatol Nutr. 2016 Jun;19(2):83–95.
74. Hill A, Khoo S, Simmons B, Ford N. What is the minimum cost per person to cure HCV? In Kuala Lumpur, Malaysia: International Aids Society; 2013 [cited 2017 Jan 27]. Available from: http://pag.ias2013.org/abstracts.aspx?aid=3142.
75. World Health Organization. Notes on the design of a bioequivalance study: sofosbuvir. Guidance document, 13 October 2015 [Internet]. World Health Organization; 2015 [cited 2017 Jan 5]. Available from: https://extranet.who.int/prequal/.
76. Hill A, Golovin S, Dragunova J, Korologou-Linden RS. Virological response rates using generic direct acting antiviral treatment for hepatitis C, legally imported into Russia. AASLD Hepatol Poster Sess IV Abstr 1638-2112 [Internet]. 2017 Jan 25 [cited 2017 Jan 25]; Available from: http://onlinelibrary.wiley.com/doi/10.1002/hep.28800/full.
77. Derbala MF, Elsayad E, Hajelssedig O, Amer A, Eldweik N, Alkaabi SR, et al. Generic versus brand sofosbuvir-based therapy: safety and efficacy, real life data. AASLD Hepatol Poster Sess IV Abstr 1638-2112. 2016 Oct 1;64:811–1050.
78. Ogata N, Alter HJ, Miller RH, Purcell RH. Nucleotide sequence and mutation rate of the H strain of hepatitis C virus. Proc Natl Acad Sci U S A. 1991 Apr 15;88(8):3392–6.
79. Bartenschlager R, Lohmann V. Replication of hepatitis C virus. J Gen Virol. 2000 Jul;81(Pt 7):1631–48.
80. Ray SC, Thomas DL. Hepatitis C. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. 8th ed. Philadelphia: Elsevier Saunders; 2014. p. 1904–27.
81. Pawlotsky J-M. Hepatitis C virus resistance to direct action antiviral drugs in interferon-free regimens. Gastroenterology. 2016 Jul;151(1):70–86.
82. Ahmed A, Felmlee DJ. Mechanisms of hepatitis C viral resistance to direct acting antivirals. Viruses. 2015 Dec 18;7(12):6716–29.
83. Kattakuzhy S, Gross C, Teferi G, Jenkins V, Silk R, Akoth E, et al. A novel task shifting model to expand the HCV care continuum: the Ascend investigation [abstract of paper presented at International Liver Congress, Barcelona, Spain, 13–17 April 2015]. J Hepatol. 2016 Jan 1;64(2):S224–5.
84. Arora S, Thornton K, Murata G, Deming P, Kalishman S, Dion D, et al. Outcomes of treatment for hepatitis C virus infection by primary care providers. N Engl J Med. 2011 Jun 9;364(23):2199–207.