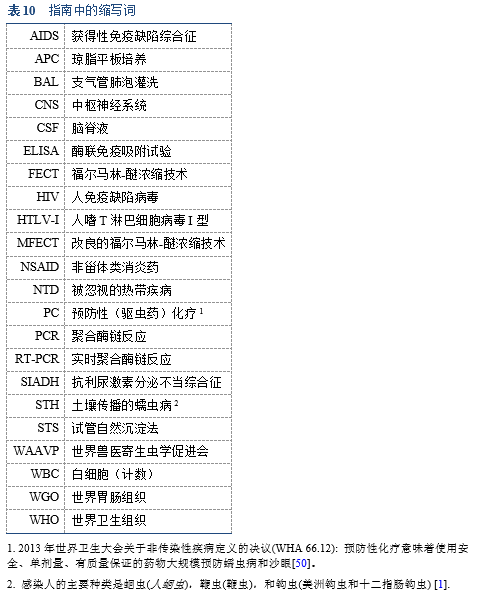
6.1 缩写
6.2 金标准指南
6.3 参考文献
1. World Health Organization. Soil-transmitted helminth infections [Internet]. Geneva: World Health Organization; 2017 [accessed 2018 Mar 13]. Available from: http://www.who.int/mediacentre/factsheets/fs366/en/.
2. Bisoffi Z, Buonfrate D, Montresor A, Requena-Méndez A, Muñoz J, Krolewiecki AJ, et al. Strongyloides stercoralis: a plea for action. PLoS Negl Trop Dis 2013 May 9;7(5):e2214.
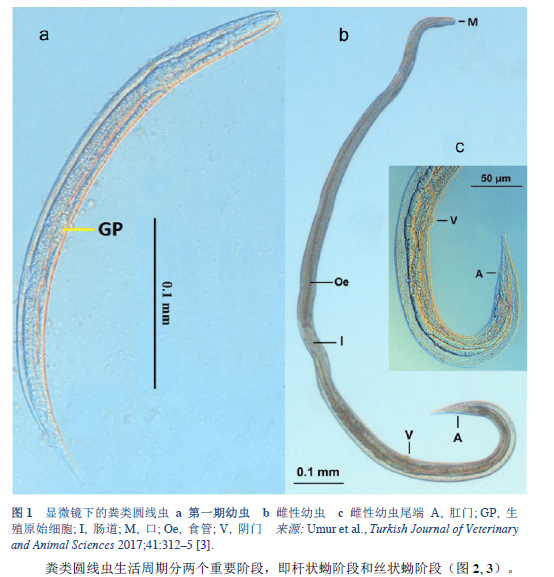
3. Umur Ş, Meral Y, Bölükbaş CS, Gürler AT, Açici M. First clinical Strongyloides stercoralis case in a dog in Turkey. Turk J Vet Anim Sci 2017;41:312–5.
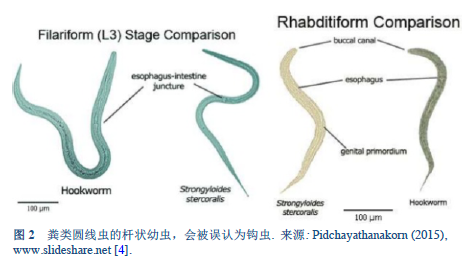
4. Pidchayathanakorn P. Nemathelminthes [46 slides] [Internet] 2015 [accessed 2018 Mar 13]. Available from: https://www.slideshare.net/PaemikaPidchayathana/nemathelminthes-review.
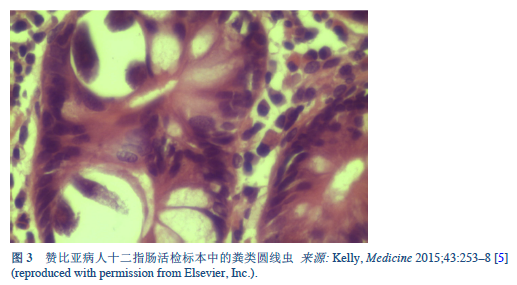
5. Kelly P. Infectious diarrhoea. Med Abingdon 2015 May;43(5):253–8.
6. Knopp S, Mohammed KA, Rollinson D, Stothard JR, Khamis IS, Utzinger J, et al. Changing patterns of soil-transmitted helminthiases in Zanzibar in the context of national helminth control programs. Am J Trop Med Hyg 2009 Dec;81(6):1071–8.
7. Anselmi M, Buonfrate D, Guevara Espinoza A, Prandi R, Marquez M, Gobbo M, et al. Mass administration of ivermectin for the elimination of onchocerciasis significantly reduced and maintained low the prevalence of Strongyloides stercoralis in Esmeraldas, Ecuador. PLoS Negl Trop Dis 2015 Nov;9(11):e0004150.
8. Barda B, Albonico M, Buonfrate D, Ame SM, Ali S, Speich B, et al. Side benefits of mass drug administration for lymphatic filariasis on Strongyloides stercoralis. Prevalence on Pemba Island, Tanzania. Am J Trop Med Hyg 2017 Sep;97(3):681–3.
9. Bisoffi Z. Human strongyloidiasis: time to act? Paper presented at the 27th European Congress of Clinical Microbiology And Infectious Diseases (ECCMID), Vienna, April 2017. Basel, Switzerland: European Society of Clinical Microbiology and Infectious Diseases; 2017. (ESCMID eLibrary). Available from: www.escmid.org/escmid_publications/escmid_elibrary/material/?mid=44339.
10. World Health Organization. What are intestinal worms (soil transmitted helminthiasis)? [Internet]. Geneva: World Health Organization; [accessed 2018 Mar 13]. Available from: http://www.who.int/intestinal_worms/disease/en/.
11. Bundy DAP, Appleby LJ, Bradley M, Croke K, Hollingsworth TD, Pullan R, et al. Mass deworming programs in middle childhood and adolescence. In: Bundy DAP, de Silva N, Horton S, Jamison DT, Patton GC, editors. Child and Adolescent Health and Development [Internet]. 3rd ed. Washington, DC: International Bank for Reconstruction and Development / World Bank Group; 2017. p. 165–82. (Disease Control Priorities; vol. 8). Available from: http://dcp-3.org/chapter/2437/deworming.
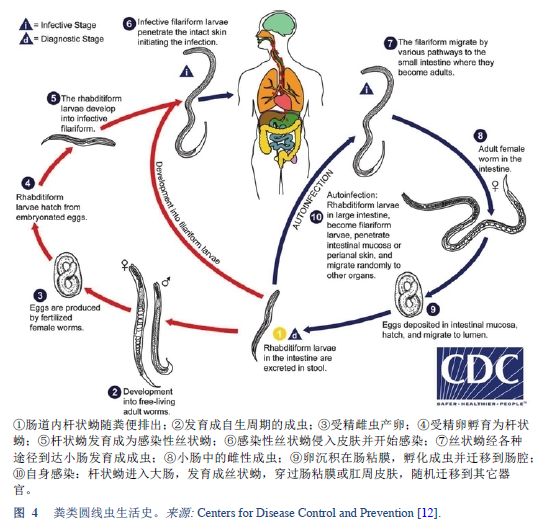
12. Centers for Disease Control and Prevention. Parasites — Strongyloides [Internet]. Atlanta, GA: Centers for Disease Control and Prevention; 2015 [accessed 2018 Mar 13]. Available from: https://www.cdc.gov/parasites/strongyloides/biology.html.
13. Ross KE, Bradbury RS, Garrard TA, O’Donahoo FJ, Shield JM, Page W, et al. The National Strongyloides Working Group in Australia 10 workshops on: commendations and recommendations. Aust N Z J Public Health 2017 Jun;41(3):221–3.
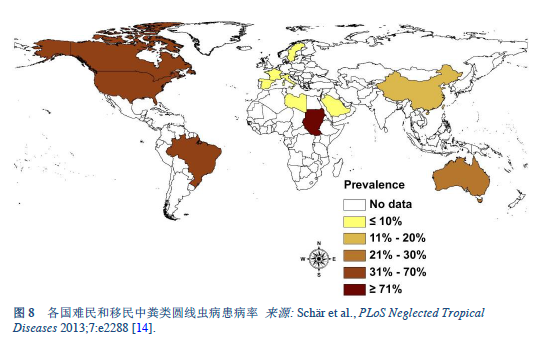
14. Schär F, Trostdorf U, Giardina F, Khieu V, Muth S, Marti H, et al. Strongyloides stercoralis: global distribution and risk factors. PLoS Negl Trop Dis 2013;7(7):e2288.
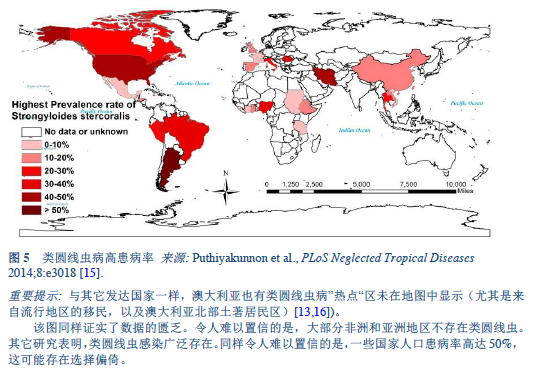
15. Puthiyakunnon S, Boddu S, Li Y, Zhou X, Wang C, Li J, et al. Strongyloidiasis — an insight into its global prevalence and management. PLoS Negl Trop Dis 2014 Aug;8(8):e3018.
16. Kearns TM, Currie BJ, Cheng AC, McCarthy J, Carapetis JR, Holt DC, et al. Strongyloides seroprevalence before and after an ivermectin mass drug administration in a remote Australian Aboriginal community. PLoS Negl Trop Dis 2017 May;11(5):e0005607.
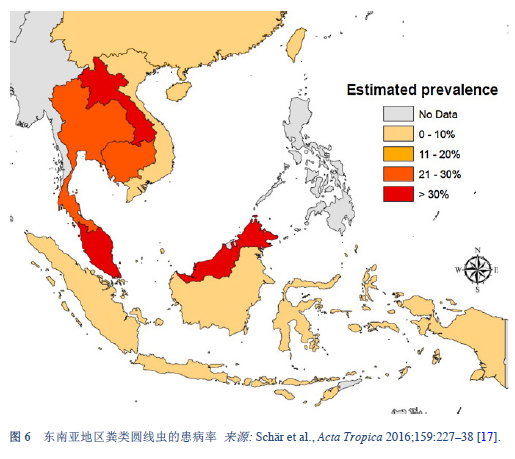
17. Schär F, Giardina F, Khieu V, Muth S, Vounatsou P, Marti H, et al. Occurrence of and risk factors for Strongyloides stercoralis infection in South-East Asia. Acta Trop 2016 Jul;159:227–38.
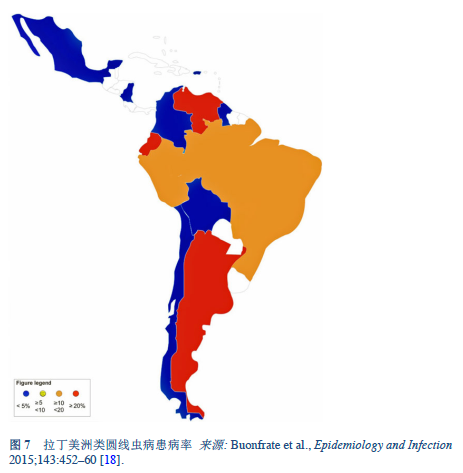
18. Buonfrate D, Mena MA, Angheben A, Requena-Mendez A, Muñoz J, Gobbi F, et al. Prevalence of strongyloidiasis in Latin America: a systematic review of the literature. Epidemiol Infect 2015 Feb;143(3):452–60.
19. Crompton DWT, Engels D, Savioli L, Montresor A, Neira M, editors. Preparing to control schistosomiasis and soil-transmitted helminthiasis in the twenty-first century [special double issue of journal]. Acta Trop 2003;86(2–3):121–347.
20. Centers for Disease Control and Prevention. Parasites — Strongyloides. Resources for health professionals [Internet]. Atlanta, GA: Centers for Disease Control and Prevention; 2016 [accessed 2018 Mar 13]. Available from: https://www.cdc.gov/parasites/strongyloides/health_professionals/index.html.
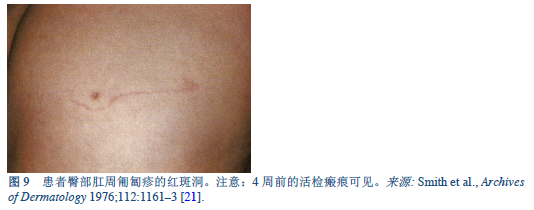
21. Smith JD, Goette DK, Odom RB. Larva currens. Cutaneous strongyloidiasis. Arch Dermatol 1976 Aug;112(8):1161–3.
22. Repetto SA, Ruybal P, Solana ME, López C, Berini CA, Alba Soto CD, et al. Comparison between PCR and larvae visualization methods for diagnosis of Strongyloides stercoralis out of endemic area: A proposed algorithm. Acta Trop 2016 May;157:169–77.
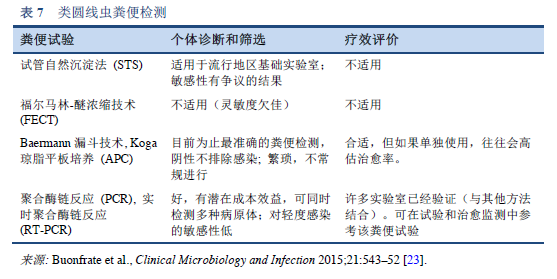
23. Buonfrate D, Formenti F, Perandin F, Bisoffi Z. Novel approaches to the diagnosis of Strongyloides stercoralis infection. Clin Microbiol Infect 2015 Jun;21(6):543–52.
24. Knopp S, Mgeni AF, Khamis IS, Steinmann P, Stothard JR, Rollinson D, et al. Diagnosis of soil-transmitted helminths in the era of preventive chemotherapy: effect of multiple stool sampling and use of different diagnostic techniques. PLoS Negl Trop Dis 2008;2(11):e331.
25. Lodh N, Caro R, Sofer S, Scott A, Krolewiecki A, Shiff C. Diagnosis of Strongyloides stercoralis: detection of parasite-derived DNA in urine. Acta Trop 2016 Nov;163:9–13.
26. van Doorn HR, Koelewijn R, Hofwegen H, Gilis H, Wetsteyn JCFM, Wismans PJ, et al. Use of enzyme-linked immunosorbent assay and dipstick assay for detection of Strongyloides stercoralis infection in humans. J Clin Microbiol 2007 Feb;45(2):438–42.
27. Anamnart W, Pattanawongsa A, Intapan PM, Maleewong W. Albendazole stimulates the excretion of Strongyloides stercoralis larvae in stool specimens and enhances sensitivity for diagnosis of strongyloidiasis. J Clin Microbiol 2010 Nov;48(11):4216–20.
28. Tello R, Terashima A, Marcos LA, Machicado J, Canales M, Gotuzzo E. Highly effective and inexpensive parasitological technique for diagnosis of intestinal parasites in developing countries: spontaneous sedimentation technique in tube. Int J Infect Dis 2012 Jun;16(6):e414-416.
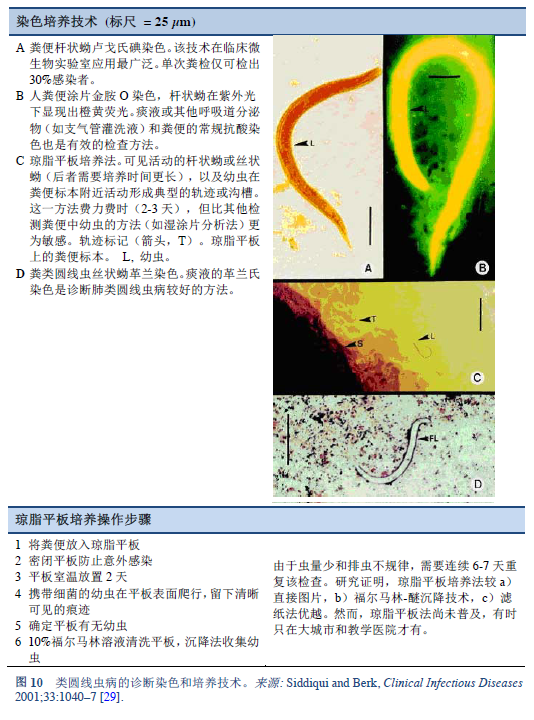
29. Siddiqui AA, Berk SL. Diagnosis of Strongyloides stercoralis infection. Clin Infect Dis 2001 Oct 1;33(7):1040–7.
30. World Gastroenterology Organisation. Acute diarrhea in adults and children: a global perspective [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2012 [accessed 2018 Mar 13]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/acute-diarrhea/acute-diarrhea-english.
31. Varatharajalu R, Kakuturu R. Strongyloides stercoralis: current perspectives. Rep Parasitol 2016;(5):23–33.
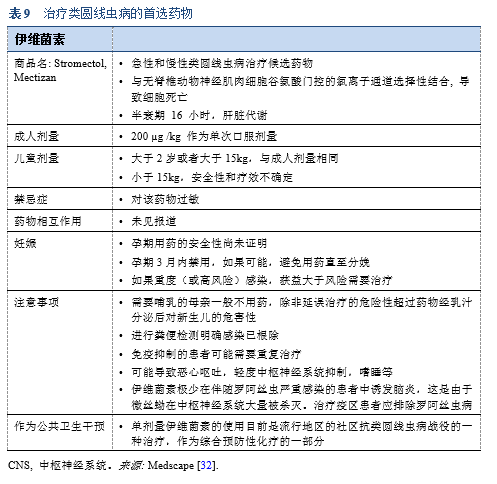
32. Medscape. Ivermectin (Rx). Brand and other names: Stromectol. Dosage forms & strengths. [Internet]. Medscape; [accessed 2018 Mar 13]. Available from: https://reference.medscape.com/drug/stromectol-ivermectin-342657.
33. Horton J. Albendazole: a review of anthelmintic efficacy and safety in humans. Parasitology 2000;121 Suppl:S113-132.
34. Venkatesan P. Albendazole. J Antimicrob Chemother 1998 Feb;41(2):145–7.
35. Henriquez-Camacho C, Gotuzzo E, Echevarria J, White AC, Terashima A, Samalvides F, et al. Ivermectin versus albendazole or thiabendazole for Strongyloides stercoralis infection. Cochrane Database Syst Rev 2016 Jan 18;(1):CD007745.
36. Chiodini PL, Reid AJ, Wiselka MJ, Firmin R, Foweraker J. Parenteral ivermectin in Strongyloides hyperinfection. Lancet 2000 Jan 1;355(9197):43–4.
37. Boulware DR. Strongyloides infection. BMJ Best Pract [Internet]. Available from: http://bestpractice.bmj.com/best-practice/monograph/907/treatment/step-by-step.html.
38. Albonico M, Becker SL, Odermatt P, Angheben A, Anselmi M, Amor A, et al. StrongNet: An international network to improve diagnostics and access to treatment for strongyloidiasis control. PLoS Negl Trop Dis 2016 Sep;10(9):e0004898.
39. Luvira V, Watthanakulpanich D, Pittisuttithum P. Management of Strongyloides stercoralis: a puzzling parasite. Int Health 2014 Dec;6(4):273–81.
40. Maskery B, Coleman MS, Weinberg M, Zhou W, Rotz L, Klosovsky A, et al. Economic analysis of the impact of overseas and domestic treatment and screening options for intestinal helminth infection among US-bound refugees from Asia. PLoS Negl Trop Dis 2016 Aug;10(8):e0004910.
41. Nelson GS. [Review of D.I. Grove, A history of human helminthology (1990).]. J Helminthol 1991;65(2):120.
42. Ross KE, O’Donahoo FJ, Garrard TA, Taylor MJ. Simple solutions to Strongyloides stercoralis infection. BMJ Clin Res Ed 2013 Oct 22;347:f6294.
43. European Medicines Agency Committee for Medicinal Products for Veterinary Use (CVMP). Reflection paper on anthelmintic resistance [Internet]. London: European Medicines Agency; 2017 [accessed 2018 Mar 13]. Available from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_001563.jsp&mid=WC0b01ac058002ddc2.
44. Wood IB, Amaral NK, Bairden K, Duncan JL, Kassai T, Malone JB, et al. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) second edition of guidelines for evaluating the efficacy of anthelmintics in ruminants (bovine, ovine, caprine). Vet Parasitol 1995 Jun;58(3):181–213.
45. Coles GC, Bauer C, Borgsteede FH, Geerts S, Klei TR, Taylor MA, et al. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet Parasitol 1992 Sep;44(1–2):35–44.
46. Forrer A, Khieu V, Schindler C, Schär F, Marti H, Char MC, et al. Ivermectin treatment and sanitation effectively reduce Strongyloides stercoralis infection risk in rural communities in Cambodia. PLoS Negl Trop Dis 2016 Aug;10(8):e0004909.
47. Khieu V, Schär F, Forrer A, Hattendorf J, Marti H, Duong S, et al. High prevalence and spatial distribution of Strongyloides stercoralis in rural Cambodia. PLoS Negl Trop Dis 2014 Jun;8(6):e2854.
48. Croker C, She R. Increase in reports of Strongyloides infection — Los Angeles County, 2013–2014. MMWR Morb Mortal Wkly Rep 2015 Aug 28;64(33):922–3.
49. Keiser PB, Nutman TB. Strongyloides stercoralis in the immunocompromised population. Clin Microbiol Rev 2004 Jan;17(1):208–17.
50. World Health Organization. World Health Assembly adopts resolution on neglected tropical diseases [Internet]. Geneva: World Health Organization; 2013 [accessed 2018 Mar 13]. Available from: http://www.who.int/neglected_diseases/WHA_66_seventh_day_resolution_adopted/en/.