2.1 Introduction
Les fibres alimentaires sont des hydrates de carbone (tant naturels que synthétiques) qui résistent au processus de digestion dans l’intestin grêle chez les humains et qui fournissent un bénéfice physiologique à la santé [3,4]. Les fibres ajoutent du volume au régime alimentaire, diminuent la densité d’énergie des aliments et peuvent améliorer le contrôle de la glycémie et prévenir ou diminuer la constipation [3,5]. Dans de nombreux pays, une grande proportion d’individus ne consomme pas assez de fibres alimentaires selon les recommandations actuelles [3,5]. Les bonnes sources de fibres alimentaires comprennent notamment les céréales complètes, les noix et les graines, les légumes et les fruits [3,5]. Une augmentation de la consommation de fibres alimentaires est associée à un risque plus faible de développer certaines maladies chroniques, notamment les maladies cardiovasculaires et la diabète et peut diminuer le risque de mortalité toutes causes confondues [5–9]. Le teneur en fibres alimentaires peut figurer sur le tableau de la valeur nutritive des aliments et est typiquement noté comme étant un sous-groupe du total de l’ensemble des hydrates de carbone.
2.1.1 Types de fibres alimentaires
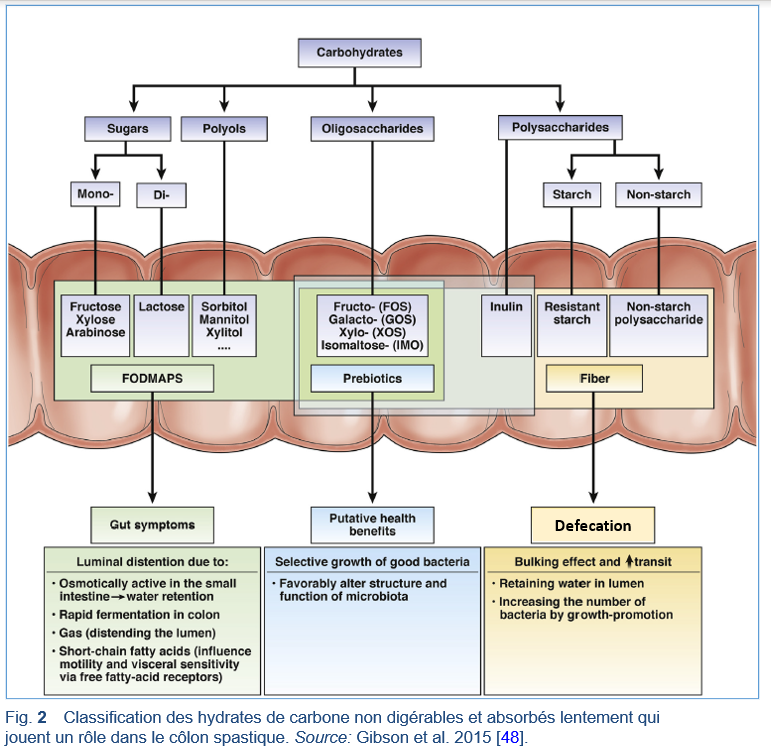
Les aliments contiennent naturellement un mélange de fibres solubles et insolubles et les deux types de fibres ont un rôle important à jouer dans la santé dans le contexte d’un régime riches en fibres [3,5]. Bien que la solubilité des fibres a été un temps considérée comme un facteur déterminant dans leur effet physiologique, des études plus récentes suggèrent que d’autres caractéristiques des fibres alimentaires, en particulier leur fermentabilité et leur viscosité, sont d’une plus grande importance et que les composants végétaux (par exemple, les antioxydants) en association avec les fibres alimentaires peuvent également conduire à un risque plus faible de développer certaines maladies [5,13].
2.1.2 Effets bénéfiques des fibres alimentaires
Les caractéristiques physiques et les bénéfices physiologiques des fibres naturelles sont résumés dans le tableau 5. Les bénéfices physiologiques connus associées à la consommation d’un régime riche en fibres avec les aliments entiers en général sont listés ci-après [12]:
- Diminution des taux sanguins de cholestérol total ou des taux liés aux lipoprotéines de faible densité (LDL)
- Diminution de la glycémie postprandiale et/ou des taux d’insuline
- Augmentation du volume des selles et/ou diminution du temps de transit intestinal
- Augmentation de la production d’acides gras à chaîne courte par fermentation par la microbiote colique
De plus, les effets physiologiques suivants des fibres alimentaires sont considérés comme probables mais nécessitent des confirmations supplémentaires [12]:
- Diminution de la tension artérielle
- Augmentation de la satiété
- Perte pondérale/diminution de l’obésité
- Modulation positive de la flore microbienne colique
2.1.3 Interaction entre les fibres alimentaires et le microbiote intestinal
L’ingestion de fibres alimentaires peut influencer le profil du microbiote fécal, être à l’origine des changements dans l’environnement gastro-intestinal complexe et favoriser la croissance de bactéries en général et tout particulièrement des bactéries avec un effet potentiellement bénéfique [14–16]. Les oligosaccharides, y compris les fructo-oligosaccharides et les galacto-oligosaccharides, l’inuline, et éventuellement d’autres fibres alimentaires solubles, sont par conséquent considérées comme étant des prébiotiques pouvant stimuler de manière préférentielle la croissance dans le côlon de lactobacilles, bifidobactéries, et d’autres bactéries bénéfiques pour la santé [3,14–16]. On considère que le microbiote intestinal joue un rôle crucial dans la santé des humains ainsi que dans la prévention des maladies par toute une variété de mécanismes, y compris la production d’acides gras à courte chaîne (short-chain fatty acids; SCFA), qui jouent un rôle important dans le maintien de l’homéostasie intestinale et une fonction immune optimale [3,14–16]. Les modifications du microenvironnement intestinal ont été associées à plusieurs affections courantes telles le syndrome de l’intestin irritable, l’obésité, les maladies cardiovasculaires et l’asthme [15,16]. La relation entre le microbiote intestinal, les fibres alimentaires et les résultats en matière de santé représente un sujet d’intérêt rapidement croissant, mais des études bien contrôlées chez l’homme sont nécessaires afin de confirmer les liens qui semblent se dessiner dans les études chez les animaux et les études épidémiologiques [15,16].
2.2 Rôle des fibres alimentaires dans les affections gastro-intestinales
2.2.1 Constipation
- L’augmentation de fibres dans le régime alimentaire a depuis longtemps été considérée comme le traitement de première intention en cas de constipation [3,17,18].
- L’augmentation de l’apport en liquides a également été considérée depuis longtemps comme un traitement de première intention pour la constipation [3,17,18], mais les avis en sa faveur sont partagés.
- Une amélioration dans la fréquence et la consistance des selles peut être observée avec l’augmentation graduelle des fibres alimentaires (ou par l’adjonction de suppléments en fibres) jusqu’à une dose cible de 20–30 g par jour de l’apport total journalier de fibres alimentaires et/ou de suppléments de fibres. Afin que le corps puisse s’adapter, l’apport en fibres devrait être augmenté graduellement pendant quelques semaines plutôt que d’un coup sur quelques jours [18,19].
- La fréquence des selles semble être améliorée pour les fibres solubles par à une augmentation du volume des selles et de leur poids et pour la prise de fibres non-solubles par une accélération du temps de transit intestinal; dans les deux cas cependant, et en particulier pour les fibres non solubles, des données de qualité manquent dans la littérature à l’heure actuelle [14].
- En ce qui concerne la supplémentation en fibres alimentaire, les meilleures données concernent le psyllium pour le traitement de la constipation chronique [18].
- Par contre, il manque des données concernant l’efficacité des fibres alimentaires dans le traitement de sous-types de constipation : métabolique, neurologique, liée à l’alimentation, liée à un trouble musculaire, liée à la prise médicamenteuse et liée à un dysfonctionnement du plancher pelvien [14].
- Il faut éviter de conseiller un régime riche en fibres alimentaires chez les patients avec une maladie obstructive intestinale.
- Dans les cas où les patients font état d’une péjoration marquée de leurs symptômes liés à la constipation sous prise de fibres alimentaires, il peut exister un transit retardé ou une dyssynergie de la défécation, c’est-à-dire un problème de fonctionnement de certains nerfs et muscles du plancher pelvien [17,20,21].
Conclusion: Un régime riche en fibres alimentaires peut protéger contre la constipation et être utile du point de vue thérapeutique dans sa prise en charge. Une augmentation progressive de l’apport en fibres dans le régime alimentaire et/ou par supplémentation jusqu’à 20–30 g/jour est recommandé avec un apport adéquat en liquides. De plus, une supplémentation avec le psyllium peut être utile dans la prise en charge d’une constipation chronique. Le rôle de l’augmentation de la prise de fibres alimentaires dans d’autres types de constipation reste limité et un régime riche en fibres peut même aggraver la symptomatologie chez certains patients.
2.2.2 Syndrome de l’intestin irritable (IBS)
- L’effet de la prise de fibres alimentaires sur les symptômes liés au syndrome de l’intestin irritable est variable et spécifique aux différents types de fibres [14,22,23].
- La supplémentation en fibres solubles—par exemple les graines de lin, la méthylcellulose, la gomme de guar partiellement hydrolysée et le psyllium—a démontré une bénéfice thérapeutique dans plusieurs études cliniques, en particulier chez les patients souffrant d’un syndrome de l’intestin irritable à prédominance de constipation (IBS-C) [3,14,22,23].
- Les fibres à fermentation élevée, tels les oligosaccharides, l’inuline et les fibres de son de blé (en raison de leur contenu en oligosaccharides) peuvent contribuer à une augmentation des gaz intestinaux et ainsi exacerber les symptômes de ballonnement, de flatulences et d’inconfort gastro-intestinal chez les patients atteints du syndrome de l’intestin irritable [14,22,23].
- Une réduction de l’apport en fibres à fermentation élevée dans le cadre d’un régime pauvre en FODMAPs (voir section 3) est conseillée dans la prise en charge du syndrome de l’intestin irritable et mène à une amélioration de la symptomatologie chez environ 75% de patients [14,22].
Conclusion: l’ingestion de fibres à fermentation élevée, y compris les oligosaccharides, l’inuline et le son de blé, peut exacerber les symptômes dans le syndrome de l’intestin irritable. Les meilleures données à disposition actuellement indiquent qu’une réduction de l’apport de ces fibres à fermentation élevée dans le cadre d’un régime pauvre en FODMAP (voir section 3) est efficace chez une majorité de patients pour la maîtrise des symptômes dans le cadre du syndrome de l’intestin irritable. En revanche, des suppléments en fibres solubles tel le psyllium, les graines de lin et le méthylcellulose peuvent montrer un bénéfice thérapeutique, en particulier dans le syndrome de l’intestin irritable à prédominance de constipation.
2.2.3 Maladies inflammatoires chroniques de l’intestin (MICI (IBD))
- Il n’existe pas de données en faveur d’un effet thérapeutique de l’ingestion de fibres alimentaires dans les maladies inflammatoires chroniques de l’intestin (MICI), mais ceci mériterait cependant d’être examiné de façon plus approfondie vu les effets anti-inflammatoires et immunomodulateurs potentiels [24].
- Il n’est pas nécessaire de restreindre l’ingestion de fibres alimentaires dans le cadre des MICI sauf s’il existe une sténose intestinale importante [24].
- Il peut s’avérer utile de restreindre la prise de fibres alimentaires hautement fermentables dans le cadre d’une approche pauvre en FODMAP dans la prise en charge des patients ayant des MICI avec un syndrome de l’intestin irritable coexistant (voir section 3) [25,26].
Conclusion: Il n’existe que peu de données en faveur d’un rôle thérapeutique de la prise de fibres alimentaires chez les patients atteints de MICI et il serait ainsi souhaitable d’effectuer des études de haute qualité à ce sujet. Il n’est pas nécessaire de limiter l’ingestion de fibres alimentaires chez les patients atteints de MICI sauf en présence d’une obstruction intestinale. Les patients atteints de MICI avec un syndrome de l’intestin irritable coexistant peuvent éventuellement tirer bénéfice d’une réduction de l’apport en fibres alimentaires hautement fermentables dans le cadre d’une approche pauvre en FODMAP.
2.2.4 Maladie diverticulaire
- Un apport augmenté en fibres alimentaires peut être associé à un risque moindre de développer une maladie diverticulaire [27,28].
- La pathogénèse de la maladie diverticulaire étant probablement multifactorielle et complexe, il n’est pas clair si un régime riche en fibres peut s’avérer bénéfique chez les patients souffrant de diverticulose. Des études supplémentaires seraient nécessaires afin d’évaluer le rôle des fibres alimentaires dans la parthogénèse et le traitement de la maladie diverticulaire [27,28].
- Quelques études de qualité médiocre ont suggéré que l’ingestion de fibres alimentaires pourrait être utile afin de soulager les symptômes liés à une diverticulose non compliquée et de diminuer le risque de développer une diverticulite, mais des données de haute qualité manquent [27,28].
- Un régime pauvre en fibres alimentaires est souvent conseillé lors d’un épisode de diverticulite aiguë afin de réduire au minimum l’irritation de l’intestin [27,28]. Cependant il n’existe que peu de données en faveur de cette approche.
Conclusion: Un régime alimentaire riche en fibres pourrait avoir un effet préventif sur le développement d’une maladie diverticulaire et le risque de développer des complications (diverticulite) pourrait s’avérer plus important chez les patients avec un régime pauvre en fibres alimentaires. L’usage à court terme d’un régime pauvre en fibres alimentaires peut être indiqué dans le cas d’une diverticulite. Ces recommandations se basent cependant sur un faible niveau d’évidence et uniquement sur l’avis d’expert.
2.2.5 Cancer colorectal
- Les données concernant la diminution du risque de développer un cancer colorectal par la prise de fibres alimentaires sont mitigées et des études complémentaires sont nécessaires à ce sujet [29].
- Un analyse en 2012 venant de « European Prospective Investigation into Cancer and Nutrition » (EPIC) a montré que l’ingestion totale de fibres alimentaires était inversement associée au risque de développer un cancer colorectal, tant dans le côlon que dans le rectum. De façon similaire, les fibres alimentaires provenant de céréales, de fruits et de légumes étaient également associées à un risque moindre de développer un cancer colique [30], mais uniquement les fibres provenant de céréales étaient associées à un risque moindre de développer un cancer rectal [30].
- Il n’existe pas d’études contrôlées randomisées (RCTs) montrant qu’une augmentation de l’apport en fibres alimentaires puisse réduire l’incidence ou la récidive de polypes adénomateux sur une période de 2–8-year ans [31]. Des études à plus long terme avec une augmentation de l’apport en fibres alimentaires sont nécessaires afin de permettre une meilleure évaluation [31].
Conclusion: Des données venant d’études de cohorte indiquent en général qu’il existe un effet protecteur d’un régime riche en fibres contre le cancer colorectal; il n’est cependant pas clair si cette relation se base sur une relation de cause à effet. Il est donc nécessaire d’effectuer davantage d’études de haute qualité afin d’élucider cette relation et d’identifier ses mécaniques d’action potentiels.
2.2.6 Indications cliniques à un régime pauvre en fibres
- L’ingestion d’aliments pauvres en fibres peut aider à diminuer les diarrhées, les gaz intestinaux et le ballonnement en ralentissant le transit intestinal et en diminuant la fermentation intestinale dans le côlon [32].
- L’utilisation à court terme d’un régime pauvre en fibres (< 10 g/jour) peut être recommandée dans les jours qui précèdent une procédure à visée diagnostique telle une coloscopie, une colonographie et une chirurgie gynécologique laparoscopique. Des études ont montré que comparé à des régimes de préparation colique traditionnels (régime liquide associé à des agents laxatifs) une approche comprenant un régime pauvre en fibres peut s’avérer mieux toléré avec moins d’effets secondaires et peut permettre une réduction du dosage des agents laxatifs sans pour autant compromettre la qualité de la préparation [32,33].
- Un régime pauvre en fibres est souvent recommandé temporairement après une poussée de diverticulite, d’une maladie de Crohn ou d’une colite ulcéreuse, ou après une chirurgie gastro-intestinale. Des études supplémentaires sont cependant nécessaires afin de clarifier s’il en résulte un bénéfice thérapeutique ou non [32]. Une utilisation à court terme ne comporte qu’un faible risque sur le point de vue nutritionnel, notamment si celle-ci est administrée sous la direction d’une diététicienne [32] et que les fibres sont réintroduites dans le régime alimentaire à long terme.
- Des conseils diététiques en ce qui concerne un régime pauvre en fibres peuvent comprendre les éléments suivants: éviter les noix et les graines, utiliser des pains et des céréales à farine plus raffinée, diminuer l’apport en fruits et légumes dans la mesure du possible et éplucher tout fruit et légume consommé [32].
- Dans certains cas, la teneur en fibres n’est pas l’unique facteur diététique à prendre en considération quand un régime pauvre en fibres est à conseiller. Les conseils diététiques chez les patients avec des ballonnements, des douleurs et d’autres symptômes de type syndrome de l’intestin irritable peuvent également comprendre l’évitement des aliments épicés, des aliments gras, des irritants de l’intestin (tels l’alcool et les boissons contenant de la caféine) et des aliments qui sont mal tolérés [19].
Conclusion: Il n’existe que peu de données en faveur de l’utilisation thérapeutique d’un régime pauvre en fibres dans le contexte des maladies gastro-intestinales et des interventions chirurgicales. Celle-ci est cependant utilisée couramment dans la pratique clinique et une utilisation à court terme ne pose pas de risque nutritionnel majeur. Un régime pauvre en fibres peut s’avérer utile dans le contexte d’une préparation colique avant une procédure à visé diagnostique et peut améliorer la satisfaction des patients ainsi que leur compliance.
2.3 Apport en fibres et recommandations
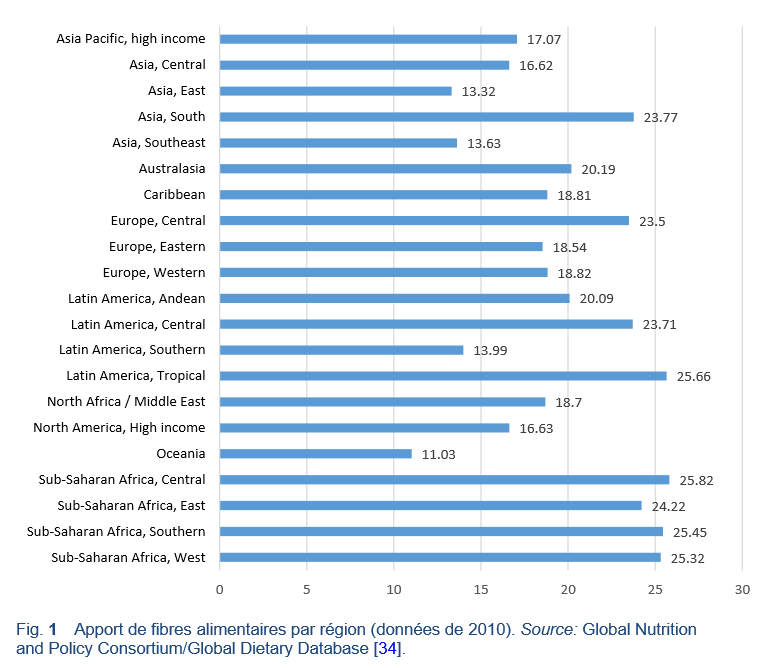
Les objectifs en matière de conseils en ce qui concerne l’apport alimentaire en fibres varient au niveau mondial (Tableau 6). Cependant, les guidelines recommandent typiquement un apport de > 20 g/jour [4,5]. Dans beaucoup de pays, l’apport en fibres alimentaires se situe en-dessous du niveau recommandé, mais est sensiblement plus élevé dans les régions où le régime alimentaire habituel est composé essentiellement de végétaux, par exemple en Afrique sub-saharienne (Fig. 1) [3–5].
2.4 Comment s’attaquer au problème de l’écart entre les recommandations et la réalité en ce qui concerne l’apport en fibres
Un apport adéquat de fibres alimentaires peut être réalisé en variant les schémas d’alimentation quotidiens [5]. La consommation d’au moins 400 g ou cinq portions de fruits et de légumes par jour permet de réduire le risque de développer une maladie chronique et aide à avoir un apport quotidien suffisant en fibres alimentaires [11,35]. Les conseils diététiques concernant la nécessité d’augmenter la consommation d’aliments riches en fibres, tels les céréales complètes, les légumineuses, les fruits et les légumes, devraient être renforcés auprès des patients par des professionnels de la diététique et de la nutrition [5,35].
Même si les consommateurs se tournent vers les suppléments en fibres et les laxatifs mucilagineux comme les sources supplémentaires en fibres, les meilleurs conseils consistent à recommander un apport de fibres venant de l’alimentation. Peu de suppléments en fibres ont été étudiés en ce qui concerne leur efficacité physiologique [5]. Une augmentation trop rapide de l’apport en fibres alimentaires peut conduire à des symptômes tels que les gaz intestinaux, le ballonnement et les crampes abdominales et il est donc toujours souhaitable de recommander une augmentation progressive de l’apport en fibres [5].
Les céréales complètes, les fruits, les légumes, les haricots, les pois et les légumineuses, ainsi que les noix et les graines, sont d’excellentes sources de fibres alimentaires. Les aliments dits « riches en fibres » contiennent d’habitude au moins 5 g de fibres par portion. Il est cependant vrai que les exigences en matière d’étiquetage des aliments peuvent varier selon les pays [4,5].
Voici quelques exemples d’aliments courants riches en fibres [36]:
- Une demi-tasse d’haricots rouges cuits (6.5 g de fibres)
- Une demi-tasse de céréales de son de blé (9.1 g de fibres)
- Une tasse de courge butternut cuite au four (6.6 g de fibres)
- Une grande orange (7.2 g de fibres)
- Une tasse de framboises (8.0 g de fibres)
- Une tasse de spaghettis de blé complet cuits (5.9 g de fibres)
- Une tasse de brocoli bouillis (5.5 g de fibres)
Les patients ont tout intérêt à augmenter leur consommation de fibres, mais ceci peut s’avérer difficile pour des raisons de compliance et de coût. Tout changement de régime alimentaire nécessite une modification des habitudes alimentaires à long terme et peut s’avérer difficile à accomplir malgré les effets bénéfiques bien connus. Le maintien de toute modification alimentaire nécessite de la motivation, des compétences comportementales ainsi qu’un environnement propice tant sur le point de vue social que politique (Tableau 7) [5,37].
Beaucoup de facteurs et d’interactions complexes peuvent influencer l’évolution et la forme des schémas alimentaires avec le temps: le revenu, les prix des aliments (la disponibilité et les prix abordables), les préférences et croyances individuelles, les traditions culturelles, ainsi que les facteurs géographiques, environnementaux, sociaux et économiques [35].
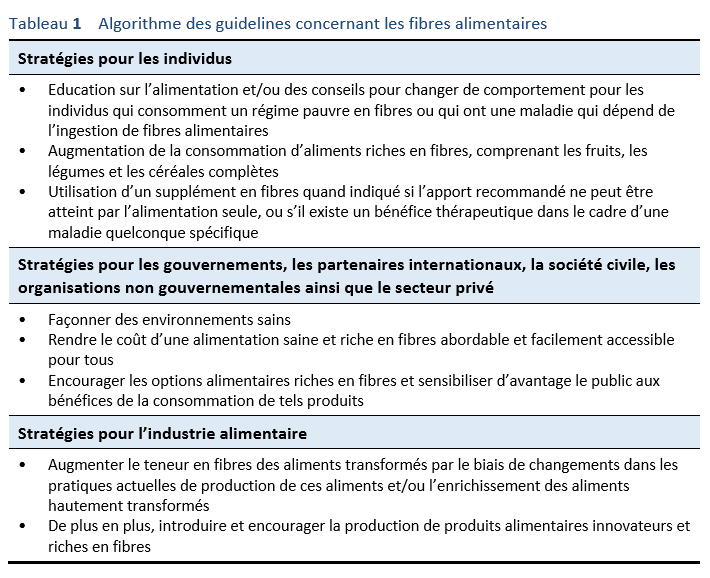
2.5 Algorithme pour les fibres alimentaires
Se référer à la section 1.2 Algorithmes, Tableau 1.
4.1 Intolérance au lactose / déficit en lactase
4.1.1 Définition des termes
Lactose: Disaccharide couramment trouvé dans les produits laitiers, les concentrations les plus élevées se trouvant dans le lait et le yoghourt.
Lactase: Enzyme de la bordure en brosse qui est essentielle pour le clivage du lactose (un disaccharide) en deux monosaccharides le glucose et le galactose.
Carence en lactase: activité de la lactase de la bordure de brosse considérablement réduite par rapport avec l’activité habituellement observée chez les enfants.
Malabsorption du lactose: se produit quand une quantité importante de lactose n’est pas absorbée dans l’intestin grêle.
Intolérance au lactose: se produit lorsque la malabsorption du lactose induit les symptômes gastro-intestinaux [68].
4.1.2 L’intolérance au lactose mise en perspective: quand est-elle significative?
Après le sevrage, l’expression de la lactase est diminuée chez environ 65–75% des êtres humains. La malabsorption du lactose est plus répandue chez les asiatiques, en Amérique du Sud et en Afrique [69]. Une persistance de la lactase (poursuite de la production de lactase chez les adultes) est déterminée par des prédispositions génétiques et se rencontre le plus souvent chez les européens et chez quelques populations africaines, du Moyen Orient et du sud de l’Asie [70].
La vitesse à laquelle l’activité de la lactase disparaît varie selon l’ethnicité. Les chinois et les japonais perdent 80–90% de l’activité de la lactase dans les 3–4 ans après le sevrage, contre 7 ans après le sevrage chez les juifs et 18–20 ans après le sevrage chez les européens du nord [71].
Une intolérance au lactose secondaire peut résulter d’une lésion de l’intestin grêle, comme dans une maladie cœliaque non traitée ou une gastro-entérite virale. L’intolérance au lactose secondaires est le plus souvent réversible une fois l’affection primaire traitée [69].
A la différence de l’intolérance au lactose, l’allergie au lait de vache représente une réponse inflammatoire aux protéines du lait. Les symptômes d’une intolérance au lactose et d’une allergie au lait de vache peuvent se chevaucher et une erreur de diagnostic est par conséquent possible. Une allergie aux protéines du lait de vache se rencontre chez 2–6% des enfants et chez 0.1–0.5% des adultes [72]. En plus des symptômes gastro-intestinaux, l’allergie aux protéines du lait de vache peut comporter des symptômes cutanés (érythème, prurit) et des manifestations du système respiratoire (respiration sifflante, essoufflement) et même une anaphylaxie [72]. Il est important que les professionnels de la santé soient au courant des différences entre les deux affections en raison de la ressemblance de certains symptômes. Une allergie au lait de vache peut également être induite par des produits laitiers avec un contenu en lactose minime (tels les fromages à pâte dure).
4.1.3 Symptomatologie de l’intolérance au lactose
Les symptômes typiques d’une intolérance au lactose sont les douleurs abdominales, le ballonnement, les flatulences, les diarrhées et les borborygmes. Des nausées et des vomissements peuvent également être présents mais se rencontrent moins fréquemment [69].
Chez les patients adultes avec une hypolactasie, les quantités de lactose ingérées qui peuvent provoquer des symptômes varient entre 12 à 18 g, ou 227 à 340 g de lait. L’ingestion de petites quantités ou de quantités modérées de lactose provoquent habituellement des ballonnements, des crampes et des flatulences mais pas de diarrhées. L’ingestion de quantités plus importantes de lactose, une vidange gastrique accélérée et un temps de transit intestinal plus rapide peuvent tous mener à des symptômes plus sévères. Il y a plusieurs facteurs qui déterminent l’apparition de symptômes d’une intolérance au lactose : ce sont le contenu en lactose du régime alimentaire, le temps de transit intestinal, la capacité de fermentation du microbiote intestinal, l’hypersensibilité viscérale [73], et (possiblement) des facteurs neuropsychologiques [74].
4.1.4 Comment faire un diagnostic dans les situations de ressources faibles et de ressources élevées
Un diagnostic d’intolérance au lactose se base sur l’observation par le patient de symptômes après l’ingestion de lactose [54]. La détermination de la dose de lactose que le patient souffrant d’une intolérance peut tolérer est cruciale en ce qui concerne les conséquences sur la santé du patient [68]. La malabsorption de lactose n’est généralement pas associée à des symptômes. Ce n’est qu’une fois que la malabsorption du lactose provoque des symptômes que l’intolérance au lactose est diagnostiquée.
- Breath-test à l’hydrogène expiré. Le breath-test à l’hydrogène expiré pour le lactose est actuellement considéré comme la méthode de mesure de la malabsorption du lactose la plus économique, non invasive et fiable [69]. Le test consiste en la prise de 25 g ou 50 g de lactose, suivi d’une mesure de l’hydrogène et du méthane expirés pendant les 3–4 heures qui suivent. Les guidelines diagnostiques varient mais une augmentation de 20 ppm (parties par million) au-dessus de la valeur de référence d’hydrogène expiré ou de 10 ppm au-dessus de la valeur de référence de méthane expiré suggère fortement la présence d’une malabsorption du lactose [69].
- Test de tolérance au lactose [74]. Ceci est un test sanguin afin de déterminer une éventuelle déficience en lactase et la mention traditionnelle de test de « tolérance » est en fait trompeuse. Le patient consomme 50 g de lactose dissouts en eau. Des échantillons de sang capillaire sont prélevés afin de doser la glycémie plasmatique à −5, 0, 15, 30, 45, et 60 minutes. En présence d’une malabsorption au lactose, la glycémie n’augmente pas. Normalement la glycémie devrait augmenter d’au moins 1.4 mmol/L (25.2 mg/dL), faute de quoi une malabsorption du lactose est présente. La sensibilité et la spécificité du test pour une déficience en lactase sont élevées (> 90% pour les deux).
- Test génétique [74]. Le test génétique sert à identifier les polymorphismes d’un mono nucléotide qui sont habituellement associés à une persistance ou à une non persistance de lactase. Par exemple, le génotype CC est corrélé avec une hypolactasémie, tandis que le génotype TT est corrélé avec une persistance de la lactase. Cependant toutes les personnes avec le génotype CC ne souffriront pas de symptômes d’une malabsorption de lactose. Les mutations relevantes dépendent cependant de l’ethnicité de la population étudiée.
- Biopsie intestinale. Une biopsie jéjunale peut être effectuée afin d’évaluer l’activité de la lactase, mais celle-ci est moins sensible et plus invasive qu’un test respiratoire au lactose. Son utilisation dans la pratique clinique n’est pas à recommander.
- Test de provocation alimentaire. Dans la plupart des cas un test de provocation alimentaire peut suffire afin d’identifier une malabsorption du lactose. Les aliments utilisés dans ce test de provocation devraient correspondre aux besoins de l’individu et à ses préférences alimentaires. Un test de provocation standard comprend l’ingestion d’une tasse (250 mL) de lait écrémé* en une fois, avec un suivi des éventuels symptômes par le sujet mais ceci devrait être adapté à l’individu. Par exemple, si une personne en particulier ne consomme que rarement une telle quantité de lait et qu’elle aimerait plutôt faire le test de provocation avec 200 g de yoghourt, un yoghourt au lait écrémé* devrait être utilisé lors du test [56].
* Car certaines personnes ont une intolérance aux graisses alimentaires (triacylglycerol).
4.1.5 Comment traiter une intolérance au lactose
Il existe deux méthodes principales de traiter une intolérance au lactose : soit en évitant les aliments contenant des quantités importantes de lactose (Tableau 12), soit en utilisant la β-galactosidase afin d’hydrolyser le lactose contenu dans les aliments.
- Modification du régime alimentaire—diminution des grandes quantités de lactose. La plupart des personnes avec une intolérance au lactose peuvent tolérer 12–15 g de lactose sans provoquer le déclanchement de symptômes gastro-intestinaux [68]. Un repas normal à base de produits laitiers contient environ 12 g de lactose [75], ces petites quantités de lactose sont vraisemblablement bien tolérées même par ceux qui souffrent d’une intolérance au lactose. L’estimation du dosage en lactose dans la consommation devrait absolument être prise en considération dans le traitement d’une intolérance au lactose. Des produits laitiers, tel le fromage à pâte dure, qui représente une bonne source de calcium, contiennent < 1 g de lactose et devraient ainsi figurer dans le régime alimentaire des patients souffrant d’une intolérance au lactose. Un enseignement approprié est indispensable afin de s’assurer d’un apport adéquat d’aliments riches en calcium.
Il faut envisager de diminuer la consommation de grandes quantités de lactose, en diminuant l’apport en produits riches en lactose et/ou en utilisant les produits alimentaires sans lactose. Les produits laitiers tels le lait de vache et le yoghourt peuvent être pré incubés avec la β-galactosidase afin d’hydrolyser le contenu en lactose. Dans certains pays, il existe une demande croissante pour les produits sans lactose, ce qui a pour effet que le lait, le yoghourt, le fromage, la crème et la glace sans lactose sont ainsi à disposition. Le besoin de produits tels le fromage et la crème sans lactose est discutable vu leur teneur en lactose minime [54].
TABLE 12
- Supplémentation en enzymes. Une intolérance au lactose peut également être traitée par une supplémentation en lactase (β-galactosidase), enzyme à prendre oralement lors des repas. Les études ont montré que ce traitement est efficace afin de diminuer l’hydrogène expiré et d’obtenir une amélioration de la symptomatologie [76–78], bien que des doses plus élevées de lactose (par exemple 50 g) semblent dépasser la capacité de l’enzyme [77].
4.2 Intolérance au fructose
4.2.1 Définition des termes
- Fructose: Un monosaccharide habituellement rencontré dans le miel, la mangue, la pomme, la poire et le sirop de maïs riche en fructose.
- Excès de fructose: le fructose et le glucose coexistent habituellement dans les aliments; un excès de fructose signifie la présence d’une quantité de fructose supérieure à celle du glucose (appelé également fructose libre). L’absorption de l’excès de fructose dépend des voies d’absorption à faible capacité qui semblent être présentes tout au long de l’intestin grêle. Les molécules de fructose sont donc en toute probabilité présentes dans la lumière de l’intestin grêle pendant plus longtemps et ainsi exercent leurs effets osmotiques sur une grande partie de sa longueur, avec ou sans débordement dans le côlon (c’est-à-dire, une malabsorption du fructose) [46,54]. Le fructose qui parvient à atteindre le gros intestin est par la suite accessible à la fermentation dans le colon, créant ainsi des produits dérivés contenant de l’hydrogène et du méthane qui peuvent être mesurés dans l’air expiré.
- Malabsorption du fructose: Une absorption incomplète d’une dose donnée de fructose dans l’intestin grêle avec débordement dans le gros intestin. Il a été démontré que la malabsorption du fructose est un phénomène tout à fait normal et qui est présent chez environ 35% des patients sains [79].
- Intolérance au fructose: Une intolérance au fructose se produit quand la consommation de fructose induit des symptômes gastro-intestinaux.
4.2.2 Mécanismes proposés
- Il a été démontré que le fructose possède un effet osmotique qui va augmenter le contenu en liquide dans l’intestin grêle, ce qui provoque une distension (étirement) de la paroi de l’intestin. Si celle-ci est marquée ou s’il existe une hypersensibilité viscérale, des symptômes tels des douleurs abdominales, un ballonnement et parfois des diarrhées peuvent en résulter. Un tel effet peut se produire quelle que soit le degré d’absorption du fructose dans l’intestin grêle [46]. Ce n’est donc pas la présence d’une malabsorption mais plutôt la présence d’une hypersensibilité viscérale qui est à l’origine des symptômes après l’ingestion de fructose, comme c’est le cas dans les maladies gastro-intestinales fonctionnelles [47].
- Le test à l’hydrogène expiré est un outil courant afin de mieux cibler une thérapie alimentaire; il a été considéré que les patients avec un test respiratoire au fructose négatif n’avaient aucun besoin d’une restriction de fructose. Des symptômes peuvent cependant se produire qu’il y ait ou non une malabsorption basée sur un test respiratoire à l’hydrogène ou au méthane en raison des effets du fructose sur l’intestin grêle. Il n’est donc plus recommandé d’utiliser le test à l’hydrogène expiré afin d’évaluer l’absorption de fructose [80].
4.2.3 Consommation de fructose
Les estimations de la consommation de fructose suggèrent que la consommation de fructose a augmenté ces dernières années, en grande partie en raison de l’utilisation augmentée des sirops de maïs riches en fructose. Une étude aux Etats-Unis comparant la consommation dans les années 1977–1978 et 1999–2004 a fait état d’une augmentation de seulement 1% de la consommation de fructose en tant que pourcentage de l’apport calorique, comparée à une augmentation de 41% dans l’apport total en hydrates de carbone [74,81]—ce qui semble indiquer que l’augmentation de la consommation de fructose n’est pas aussi importante qu’on la pensait. Les sources principales de fructose alimentaire en 1999–2004 étaient représentées par les fruits et les produits fruitiers [81].
4.2.4 Modification des habitudes alimentaires
Les anciennes études sur l’effet d’un excès de fructose sur les symptômes gastro-intestinaux ne se sont concentrées que sur le fructose seul ou sur le fructose en association avec le sorbitol. Ces régimes pauvres en fructose étaient cependant mal décrits. Un excès de fructose étant souvent consommé avec d’autres hydrates de carbone à courte chaîne qui ont des effets similaires sur l’intestin (i.e., FODMAPs), c’est le rôle de ces hydrates de carbone spécifiques en combinaison dans la pathogénèse de symptômes gastro-intestinaux qui est à l’origine de ces symptômes et non leurs effets individuels [49–51]. L’association de ces hydrates de carbone fermentables dans le cadre d’un régime pauvre en FODMAP a été montré efficace dans l’amélioration des symptômes chez trois-quarts de patients souffrant de troubles digestifs fonctionnels [40,41,44,82].
4.2.5 Recommandations
- L’ingestion de fructose (supérieure au glucose) se trouve modifiée en tant que composant d’un régime pauvre en FODMAP. Une diminution de la consommation de tous les FODMAP alimentaires plus qu’une diminution de la consommation de fructose seule a un effet plus bénéfique sur la diminution des symptômes gastro-intestinaux.
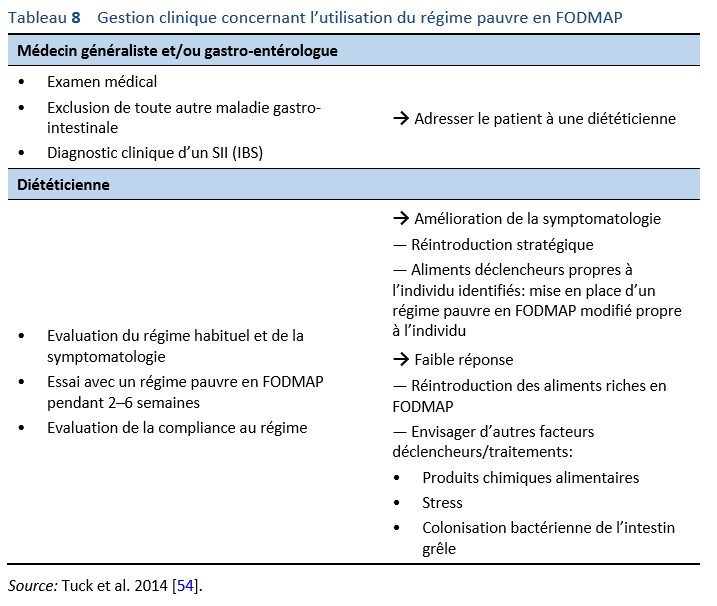
- Une malabsorption du fructose (“Fructose malabsorption”) n’est ni un diagnostic ni une maladie. La consommation de fructose peut être plutôt à l’origine de symptômes gastro-intestinaux pouvant ressembler à ceux d’un syndrome de l’intestin irritable (SII/IBS) et ses effets devraient être considérés en association avec les effets des autres FODMAP alimentaires FODMAPs (voir section 3).
- Les tests respiratoires n’ont qu’une valeur limitée dans l’identification d’une malabsorption de fructose.
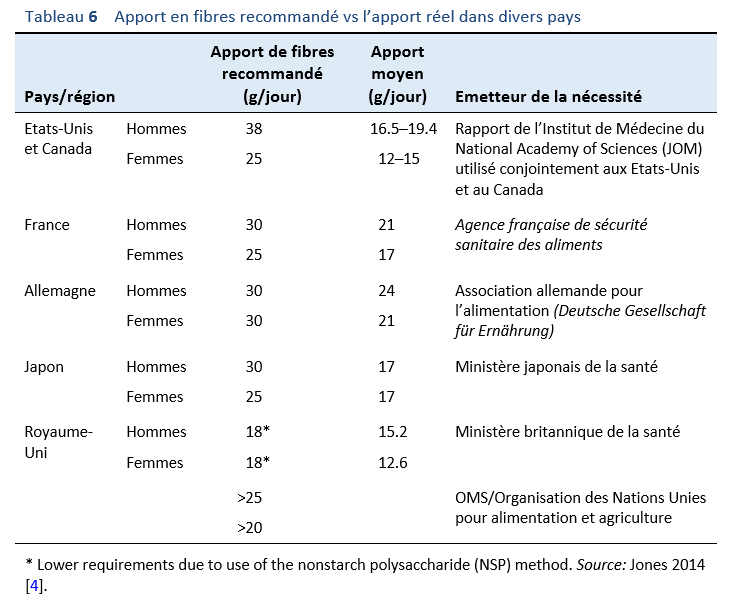
- En ce qui concerne les aliments à éviter, il faut se référer au tableau qui établit la liste des sources les plus riches en FODMAP (Tableau 10).
4.3 Carence en sucrase–isomaltase
Une carence en sucrase–isomaltase (connue également comme une intolérance au sucrose) se manifeste habituellement tôt dans la vie et peut être à l’origine d’une malabsorption d’hydrates de carbone, avec des symptômes tels des diarrhées, un ballonnement et des douleurs abdominales qui sont similaires à ceux d’un syndrome de l’intestin irritable à prédominance de diarrhées. L’étiologie de la carence en sucrase–isomaltase résulte d’une diminution de l’activité d’une enzyme appelée glucosidase dans l’intestin grêle. Cette enzyme joue normalement un rôle dans la digestion de l’amidon et des sucres. En raison d’une diminution de l’activité de la glucosidase, les hydrates de carbone—et en particulier le sucrose—se comportent alors comme des FODMAP, avec une augmentation de l’activité osmotique et une fermentation dans l’intestin qui peuvent potentiellement être à l’origine de symptômes d’un syndrome de l’intestin irritable (SII/IBS) [83]. Le rôle d’une carence en sucrase–isomaltase dans l’apparition plus tardive d’un syndrome de l’intestin irritable est mal documenté.
4.3.1 Carence congénitale en sucrase–isomaltase
Dans la carence congénitale en sucrase–isomaltase, les mutations dans le gène de la sucrase–isomaltase (SI) conduisent à des symptômes sévères. Il s’agit d’une affection rare. Des études récentes ont cependant permis d’identifier de multiples variations du gène SI avec une fonction diminuée. Environ 2–9% des personnes d’origine nord-américaine et européenne peuvent en souffrir, ce qui tend à suggérer que c’est une maladie peu reconnue [84]. Il n’a cependant pas été démontré jusqu’à présent qu’elle est impliquée dans la pathogénèse de symptômes chez les patients avec des maladies gastro-intestinales fonctionnelles.
4.3.2 Carence secondaire ou acquise en sucrase–isomaltase
Une carence secondaire ou acquise en sucrase–isomaltase peut également théorétiquement se produire, mais celle-ci est le plus souvent transitoire. Des études chez les animaux ont montré qu’une atrophie villositaire, telle celle rencontrée dans la maladie coeliaque non traitée, peut avoir pour conséquence une carence en sucrase–isomaltase, qui devrait être réversible lors de la guérison de l’atrophie villositaire [84].
4.3.3 Diagnostic
Un diagnostic de carence en sucrase–isomaltase peut être posé à l’aide de biopsies duodénales ou jéjunales chez l’enfant afin d’évaluer l’activité de la sucrase, de la lactase, de l’isomaltase et de la maltase [84]. Les échantillons de biopsies devraient cependant être tout de suite congelés; en raison du processus complexe de gel/dégel nécessaire pour l’analyse des échantillons, il est possible que les résultats puissent être erronés [85]. D’autres méthodes diagnostiques existent, par exemple le test respiratoire au sucrose, mais effectuer un test respiratoire à l’hydrogène expire chez les jeunes enfants peut s’avérer problématique [85]. Plus récemment le séquençage génétique a été mis au point afin de pouvoir identifier les différentes formes de carence congénitale en sucrase–isomaltase [84]. Les résultats obtenus doivent néanmoins être pris en considération en combinaison avec le tableau clinique. Il n’existe que peu de données sur la valeur de ces examens chez les adultes.
4.3.4 Traitement
Il n’existe que peu de données concernant le traitement d’une carence en sucrase–isomaltase. Les options thérapeutiques comprennent notamment la restriction des sucres et des féculents, mais des études fiables à ce sujet manquent. Les patients entreprennent une phase initiale restrictive, suivie d’une réintroduction graduelle afin de déterminer la tolérance. Ces restrictions alimentaires sont cependant difficiles et les patients sont souvent non-compliants [85]. Une solution alternative aux modifications alimentaires est la substitution enzymatique avec la sacrosidase, ce qui s’est révélé bénéfique dans des études portant sur un petit nombre de patients [85,86]. La supplémentation enzymatique s’avère toutefois très coûteuse et n’est pas à disposition partout dans le monde.
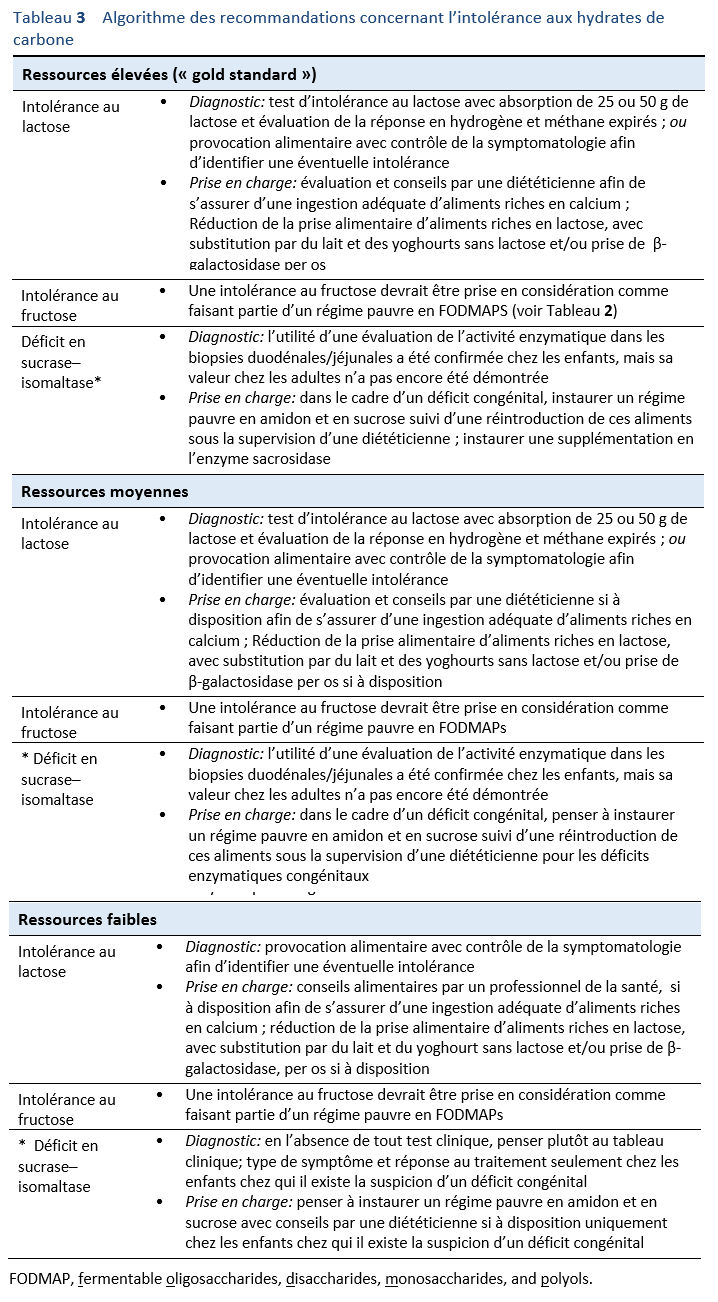
4.4 Guidelines
Se référer à la section 1.2 Algorithmes, Tableau 3.
6.1 Abréviations

6.2 Organismes ayant établi les guidelines relevants
Guidelines de World Gastroenterology Organisation (WGO): Comment faire face aux symptômes gastro-intestinaux courants (Hunt et al., 2014) [19]
https://journals.lww.com/jcge/Fulltext/2014/08000/Coping_With_Common_Gastrointestinal_Symptoms_in.4.aspx
http://www.worldgastroenterology.org/guidelines/global-guidelines/common-gi-symptoms
6.3 References
1. Bai JC, Ciacci C, Corazza GR, Fried M, Olano C, Rostami-Nejad M, et al. Celiac disease. World Gastroenterology Organisation global guidelines [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2016 [cited 2017 Jul 19]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/celiac-disease/celiac-disease-english
2. Bai JC, Ciacci C. World Gastroenterology Organisation global guidelines: celiac disease. February 2017. J Clin Gastroenterol. 2017;51(9):755–68.
3. Anderson JW, Baird P, Davis RH, Ferreri S, Knudtson M, Koraym A, et al. Health benefits of dietary fiber. Nutr Rev. 2009;67(4):188–205.
4. Jones JM. CODEX-aligned dietary fiber definitions help to bridge the “fiber gap.” Nutr J. 2014;13:34.
5. Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc. 2008;108(10):1716–31.
6. Kim Y, Je Y. Dietary fiber intake and total mortality: a meta-analysis of prospective cohort studies. Am J Epidemiol. 2014;180(6):565–73.
7. Threapleton DE, Greenwood DC, Evans CEL, Cleghorn CL, Nykjaer C, Woodhead C, et al. Dietary fibre intake and risk of cardiovascular disease: systematic review and meta-analysis. BMJ. 2013;347:f6879.
8. Yang Y, Zhao L-G, Wu Q-J, Ma X, Xiang Y-B. Association between dietary fiber and lower risk of all-cause mortality: a meta-analysis of cohort studies. Am J Epidemiol. 2015;181(2):83–91.
9. Yao B, Fang H, Xu W, Yan Y, Xu H, Liu Y, et al. Dietary fiber intake and risk of type 2 diabetes: a dose-response analysis of prospective studies. Eur J Epidemiol. 2014;29(2):79–88.
10. American Association of Cereal Chemists. The definition of dietary fiber. Report of the Dietary Fiber Definition Committee to the Board of Directors of the American Association Of Cereal Chemists. Submitted January 10, 2001. Cereal Foods World. 2001;46(3):112–26.
11. Livingston KA, Chung M, Sawicki CM, Lyle BJ, Wang DD, Roberts SB, et al. Development of a publicly available, comprehensive database of fiber and health outcomes: rationale and methods. PloS One. 2016;11(6):e0156961.
12. Howlett JF, Betteridge VA, Champ M, Craig SAS, Meheust A, Jones JM. The definition of dietary fiber – discussions at the Ninth Vahouny Fiber Symposium: building scientific agreement. Food Nutr Res [Internet]. 2010 [cited 2017 Jan 15];54. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2972185/
13. McRorie JW, McKeown NM. Understanding the physics of functional fibers in the gastrointestinal tract: an evidence-based approach to resolving enduring misconceptions about insoluble and soluble fiber. J Acad Nutr Diet. 2017;117(2):251–64.
14. Eswaran S, Muir J, Chey WD. Fiber and functional gastrointestinal disorders. Am J Gastroenterol. 2013;108(5):718–27.
15. Maslowski KM, Mackay CR. Diet, gut microbiota and immune responses. Nat Immunol. 2011;12(1):5–9.
16. Slavin J. Fiber and prebiotics: mechanisms and health benefits. Nutrients. 2013;5(4):1417–35.
17. Christodoulides S, Dimidi E, Fragkos KC, Farmer AD, Whelan K, Scott SM. Systematic review with meta-analysis: effect of fibre supplementation on chronic idiopathic constipation in adults. Aliment Pharmacol Ther. 2016;44(2):103–16.
18. Lindberg G, Hamid SS, Malfertheiner P, Thomsen OO, Fernandez LB, Garisch J, et al. World Gastroenterology Organisation global guideline: Constipation--a global perspective. J Clin Gastroenterol. 2011;45(6):483–7.
19. Hunt R, Quigley E, Abbas Z, Eliakim A, Emmanuel A, Goh K-L, et al. Coping with common gastrointestinal symptoms in the community: a global perspective on heartburn, constipation, bloating, and abdominal pain/discomfort May 2013. J Clin Gastroenterol. 2014;48(7):567–78.
20. Rao SSC, Patcharatrakul T. Diagnosis and treatment of dyssynergic defecation. J Neurogastroenterol Motil. 2016;22(3):423–35.
21. Suares NC, Ford AC. Systematic review: the effects of fibre in the management of chronic idiopathic constipation. Aliment Pharmacol Ther. 2011;33(8):895–901.
22. McKenzie YA, Bowyer RK, Leach H, Gulia P, Horobin J, O’Sullivan NA, et al. British Dietetic Association systematic review and evidence-based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):549–75.
23. Nagarajan N, Morden A, Bischof D, King EA, Kosztowski M, Wick EC, et al. The role of fiber supplementation in the treatment of irritable bowel syndrome: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2015 Sep;27(9):1002–10.
24. Wedlake L, Slack N, Andreyev HJN, Whelan K. Fiber in the treatment and maintenance of inflammatory bowel disease: a systematic review of randomized controlled trials. Inflamm Bowel Dis. 2014;20(3):576–86.
25. Gibson PR. Use of the low-FODMAP diet in inflammatory bowel disease. J Gastroenterol Hepatol. 2017;32 Suppl 1:40–2.
26. Gearry RB, Irving PM, Barrett JS, Nathan DM, Shepherd SJ, Gibson PR. Reduction of dietary poorly absorbed short-chain carbohydrates (FODMAPs) improves abdominal symptoms in patients with inflammatory bowel disease-a pilot study. J Crohns Colitis. 2009;3(1):8–14.
27. Böhm SK. Risk factors for diverticulosis, diverticulitis, diverticular perforation, and bleeding: a plea for more subtle history taking. Viszeralmedizin. 2015;31(2):84–94.
28. Carabotti M, Annibale B, Severi C, Lahner E. Role of fiber in symptomatic uncomplicated diverticular disease: a systematic review. Nutrients. 2017;9(2):161.
29. Asano T, McLeod RS. Dietary fibre for the prevention of colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2002;(2):CD003430.
30. Murphy N, Norat T, Ferrari P, Jenab M, Bueno-de-Mesquita B, Skeie G, et al. Dietary fibre intake and risks of cancers of the colon and rectum in the European prospective investigation into cancer and nutrition (EPIC). PloS One. 2012;7(6):e39361.
31. Yao Y, Suo T, Andersson R, Cao Y, Wang C, Lu J, et al. Dietary fibre for the prevention of recurrent colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2017 Jan 8;1:CD003430.
32. Vanhauwaert E, Matthys C, Verdonck L, Preter VD. Low-residue and low-fiber diets in gastrointestinal disease management. Adv Nutr. 2015;6(6):820–7.
33. Butt J, Bunn C, Paul E, Gibson P, Brown G. The White Diet is preferred, better tolerated, and non-inferior to a clear-fluid diet for bowel preparation: A randomized controlled trial. J Gastroenterol Hepatol. 2016 Feb;31(2):355–63.
34. Global Nutrition and Policy Consortium. Dietary intake of major foods by region, 1990 [Internet]. 2017 [cited 2017 Apr 22]. Available from: http://www.globaldietarydatabase.org/dietary-data-by-region.html
35. World Health Organization. Healthy diet [Internet]. WHO. 2017 [cited 2017 Jan 18]. Available from: http://www.who.int/mediacentre/factsheets/fs394/en/
36. United States Department of Agriculture. Agricultural Research Service. USDA food composition databases [Internet]. 2017 [cited 2017 Apr 21]. Available from: https://ndb.nal.usda.gov/ndb/nutrients/index
37. European Food Information Council (EUFIC). Why we eat what we eat: the barriers to dietary and lifestyle change [Internet]. 2004 [cited 2018 May 19]. Available from: http://www.eufic.org/en/healthy-living/article/why-we-eat-what-we-eat-the-barriers-to-dietary-and-lifestyle-change
38. Ong DK, Mitchell SB, Barrett JS, Shepherd SJ, Irving PM, Biesiekierski JR, et al. Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome. J Gastroenterol Hepatol. 2010;25(8):1366–73.
39. Barrett JS, Gearry RB, Muir JG, Irving PM, Rose R, Rosella O, et al. Dietary poorly absorbed, short-chain carbohydrates increase delivery of water and fermentable substrates to the proximal colon. Aliment Pharmacol Ther. 2010;31(8):874–82.
40. Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology. 2014;146(1):67-75.e5.
41. Eswaran SL, Chey WD, Han-Markey T, Ball S, Jackson K. A randomized controlled trial comparing the low FODMAP diet vs. modified NICE guidelines in US adults with IBS-D. Am J Gastroenterol. 2016;111(12):1824–32.
42. Staudacher HM, Lomer MCE, Anderson JL, Barrett JS, Muir JG, Irving PM, et al. Fermentable carbohydrate restriction reduces luminal bifidobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. J Nutr. 2012;142(8):1510–8.
43. McIntosh K, Reed DE, Schneider T, Dang F, Keshteli AH, De Palma G, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomised controlled trial. Gut. 2016;66(7):1241–51.
44. de Roest RH, Dobbs BR, Chapman BA, Batman B, O’Brien LA, Leeper JA, et al. The low FODMAP diet improves gastrointestinal symptoms in patients with irritable bowel syndrome: a prospective study. Int J Clin Pract. 2013;67(9):895–903.
45. Pedersen N, Vegh Z, Burisch J, Jensen L, Ankersen DV, Felding M, et al. Ehealth monitoring in irritable bowel syndrome patients treated with low fermentable oligo-, di-, mono-saccharides and polyols diet. World J Gastroenterol. 2014;20(21):6680–4.
46. Murray K, Wilkinson-Smith V, Hoad C, Costigan C, Cox E, Lam C, et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol. 2014;109(1):110–9.
47. Major G, Pritchard S, Murray K, Alappadan JP, Hoad CL, Marciani L, et al. Colon hypersensitivity to distension, rather than excessive gas production, produces carbohydrate-related symptoms in individuals with irritable bowel syndrome. Gastroenterology. 2017;152(1):124-133.e2.
48. Gibson PR, Varney J, Malakar S, Muir JG. Food components and irritable bowel syndrome. Gastroenterology. 2015;148(6):1158-1174.e4.
49. Muir JG, Shepherd SJ, Rosella O, Rose R, Barrett JS, Gibson PR. Fructan and free fructose content of common Australian vegetables and fruit. J Agric Food Chem. 2007;55(16):6619–27.
50. Muir JG, Rose R, Rosella O, Liels K, Barrett JS, Shepherd SJ, et al. Measurement of short-chain carbohydrates in common Australian vegetables and fruits by high-performance liquid chromatography (HPLC). J Agric Food Chem. 2009;57(2):554–65.
51. Biesiekierski JR, Rosella O, Rose R, Liels K, Barrett JS, Shepherd SJ, et al. Quantification of fructans, galacto-oligosacharides and other short-chain carbohydrates in processed grains and cereals. J Hum Nutr Diet. 2011;24(2):154–76.
52. Yao CK, Tan H-L, van Langenberg DR, Barrett JS, Rose R, Liels K, et al. Dietary sorbitol and mannitol: food content and distinct absorption patterns between healthy individuals and patients with irritable bowel syndrome. J Hum Nutr Diet. 2014;27 Suppl 2:263–75.
53. Monash University. Download the low FODMAP diet app for on-the-go IBS support [Internet]. 2017 [cited 2017 Apr 21]. Available from: http://www.med.monash.edu/cecs/gastro/fodmap/iphone-app.html
54. Tuck CJ, Muir JG, Barrett JS, Gibson PR. Fermentable oligosaccharides, disaccharides, monosaccharides and polyols: role in irritable bowel syndrome. Expert Rev Gastroenterol Hepatol. 2014;8(7):819–34.
55. Barrett JS. How to institute the low-FODMAP diet. J Gastroenterol Hepatol. 2017;32 Suppl 1:8–10.
56. Tuck C, Barrett J. Re-challenging FODMAPs: the low FODMAP diet phase two. J Gastroenterol Hepatol. 2017;32 Suppl 1:11–5.
57. McMeans AR, King KL, Chumpitazi BP. Low FODMAP dietary food lists are often discordant. Am J Gastroenterol. 2017;112(4):655–6.
58. Barrett JS. Extending our knowledge of fermentable, short-chain carbohydrates for managing gastrointestinal symptoms. Nutr Clin Pract. 2013;28(3):300–6.
59. Payne AN, Chassard C, Lacroix C. Gut microbial adaptation to dietary consumption of fructose, artificial sweeteners and sugar alcohols: implications for host-microbe interactions contributing to obesity. Obes Rev. 2012;13(9):799–809.
60. Staudacher HM. Nutritional, microbiological and psychosocial implications of the low FODMAP diet. J Gastroenterol Hepatol. 2017;32 Suppl 1:16–9.
61. Ostgaard H, Hausken T, Gundersen D, El-Salhy M. Diet and effects of diet management on quality of life and symptoms in patients with irritable bowel syndrome. Mol Med Rep. 2012;5(6):1382–90.
62. Staudacher HM, Lomer MCE, Farquharson FM, Louis P, Fava F, Franciosi E, et al. A diet low in FODMAPs reduces symptoms in patients with irritable bowel syndrome and a probiotic restores bifidobacterium species: a randomized controlled trial. Gastroenterology. 2017;153(4):936–47.
63. Prince AC, Myers CE, Joyce T, Irving P, Lomer M, Whelan K. Fermentable carbohydrate restriction (low FODMAP diet) in clinical practice improves functional gastrointestinal symptoms in patients with inflammatory bowel disease. Inflamm Bowel Dis. 2016;22(5):1129–36.
64. Moore JS, Gibson PR, Perry RE, Burgell RE. Endometriosis in patients with irritable bowel syndrome: specific symptomatic and demographic profile, and response to the low FODMAP diet. Aust N Z J Obstet Gynaecol. 2017;57(2):201–5.
65. Iacovou M, Mulcahy EC, Truby H, Barrett JS, Gibson PR, Muir JG. Reducing the maternal dietary intake of indigestible and slowly absorbed short-chain carbohydrates is associated with improved infantile colic: a proof-of-concept study. J Hum Nutr Diet. 2017;31(2):256–65.
66. Marum AP, Moreira C, Saraiva F, Tomas-Carus P, Sousa-Guerreiro C. A low fermentable oligo-di-mono saccharides and polyols (FODMAP) diet reduced pain and improved daily life in fibromyalgia patients. Scand J Pain. 2016;13:166–72.
67. Tan VP. The low-FODMAP diet in the management of functional dyspepsia in East and Southeast Asia. J Gastroenterol Hepatol. 2017;32 Suppl 1:46–52.
68. Shaukat A, Levitt MD, Taylor BC, MacDonald R, Shamliyan TA, Kane RL, et al. Systematic review: effective management strategies for lactose intolerance. Ann Intern Med. 2010;152(12):797–803.
69. Lomer MCE, Parkes GC, Sanderson JD. Review article: lactose intolerance in clinical practice – myths and realities. Aliment Pharmacol Ther. 2008;27(2):93–103.
70. Itan Y, Jones BL, Ingram CJ, Swallow DM, Thomas MG. A worldwide correlation of lactase persistence phenotype and genotypes. BMC Evol Biol. 2010;10:36.
71. Matthews SB, Waud JP, Roberts AG, Campbell AK. Systemic lactose intolerance: a new perspective on an old problem. Postgrad Med J. 2005;81(953):167–73.
72. Crittenden RG, Bennett LE. Cow’s milk allergy: a complex disorder. J Am Coll Nutr. 2005;24(6 Suppl):582S-91S.
73. Zhu Y, Zheng X, Cong Y, Chu H, Fried M, Dai N, et al. Bloating and distention in irritable bowel syndrome: the role of gas production and visceral sensation after lactose ingestion in a population with lactase deficiency. Am J Gastroenterol. 2013;108(9):1516–25.
74. World Gastroenterology Organisation. WGO handbook on diet and the gut. World Digestive Health Day WDHD — May 29, 2016 [Internet]. Makharia GK, Sanders DS, editors. Milwaukee, WI: World Gastroenterology Organisation and WGO Foundation; 2016 [cited 2017 Mar 24]. Available from: http://www.worldgastroenterology.org/UserFiles/file/WGOHandbookonDietandtheGut_2016_Final.pdf
75. O’Connell S, Walsh G. Physicochemical characteristics of commercial lactases relevant to their application in the alleviation of lactose intolerance. Appl Biochem Biotechnol. 2006;134(2):179–91.
76. Montalto M, Nucera G, Santoro L, Curigliano V, Vastola M, Covino M, et al. Effect of exogenous beta-galactosidase in patients with lactose malabsorption and intolerance: a crossover double-blind placebo-controlled study. Eur J Clin Nutr. 2005;59(4):489–93.
77. Lin MY, Dipalma JA, Martini MC, Gross CJ, Harlander SK, Savaiano DA. Comparative effects of exogenous lactase (beta-galactosidase) preparations on in vivo lactose digestion. Dig Dis Sci. 1993;38(11):2022–7.
78. Rosado JL, Solomons NW, Lisker R, Bourges H. Enzyme replacement therapy for primary adult lactase deficiency. Effective reduction of lactose malabsorption and milk intolerance by direct addition of beta-galactosidase to milk at mealtime. Gastroenterology. 1984;87(5):1072–82.
79. Barrett JS, Gibson PR. Fructose and lactose testing. Aust Fam Physician. 2012;41(5):293–6.
80. Yao CK, Tuck CJ, Barrett JS, Canale KE, Philpott HL, Gibson PR. Poor reproducibility of breath hydrogen testing: Implications for its application in functional bowel disorders. United Eur Gastroenterol J. 2017;5(2):284–92.
81. Marriott BP, Cole N, Lee E. National estimates of dietary fructose intake increased from 1977 to 2004 in the United States. J Nutr. 2009;139(6):1228S-1235S.
82. Staudacher HM, Whelan K, Irving PM, Lomer MCE. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. J Hum Nutr Diet. 2011;24(5):487–95.
83. Henström M, Diekmann L, Bonfiglio F, Hadizadeh F, Kuech E-M, von Köckritz-Blickwede M, et al. Functional variants in the sucrase–isomaltase gene associate with increased risk of irritable bowel syndrome. Gut. 2018;67:263–70.
84. Cohen SA. The clinical consequences of sucrase–isomaltase deficiency. Mol Cell Pediatr. 2016;3(1):5.
85. Puntis JWL, Zamvar V. Congenital sucrase-isomaltase deficiency: diagnostic challenges and response to enzyme replacement therapy. Arch Dis Child. 2015;100(9):869–71.
86. Harms H-K, Bertele-Harms R-M, Bruer-Kleis D. Enzyme-substitution therapy with the yeast Saccharomyces cerevisiae in congenital sucrase–isomaltase deficiency. N Engl J Med. 1987;316(21):1306–9.
87. Portincasa P, Bonfrate L, de Bari O, Lembo A, Ballou S. Irritable bowel syndrome and diet. Gastroenterol Rep. 2017;5(1):11–9.
88. Ford AC, Vandvik PO. Irritable bowel syndrome: dietary interventions. BMJ Clin Evid. 2015;2015:pii: 0410.
89. Bhat K, Harper A, Gorard DA. Perceived food and drug allergies in functional and organic gastrointestinal disorders. Aliment Pharmacol Ther. 2002;16(5):969–73.
90. Monsbakken KW, Vandvik PO, Farup PG. Perceived food intolerance in subjects with irritable bowel syndrome — etiology, prevalence and consequences. Eur J Clin Nutr. 2006;60(5):667–72.
91. Lacy BE. The science, evidence, and practice of dietary interventions in irritable bowel syndrome. Clin Gastroenterol Hepatol. 2015;13(11):1899–906.
92. Harvie RM, Chisholm AW, Bisanz JE, Burton JP, Herbison P, Schultz K, et al. Long-term irritable bowel syndrome symptom control with reintroduction of selected FODMAPs. World J Gastroenterol. 2017;23(25):4632–43.
93. World Gastroenterology Organisation. Global guidelines [Internet]. 2018 [cited 2018 May 19]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines
94. Quigley EMM, Fried M, Gwee K-A, Khalif I, Hungin APS, Lindberg G, et al. World Gastroenterology Organisation global guidelines. Irritable bowel syndrome: a global perspective. Update September 2015. J Clin Gastroenterol. 2016;50(9):704–13.
95. Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, et al. Non-celiac gluten sensitivity has narrowed the spectrum of irritable bowel syndrome: a double-blind randomized placebo-controlled trial. Nutrients. 2015;7(6):4542–54.
96. Eswaran S, Goel A, Chey WD. What role does wheat play in the symptoms of irritable bowel syndrome? Gastroenterol Hepatol. 2013;9(2):85–91.
97. Barmeyer C, Schumann M, Meyer T, Zielinski C, Zuberbier T, Siegmund B, et al. Long-term response to gluten-free diet as evidence for non-celiac wheat sensitivity in one third of patients with diarrhea-dominant and mixed-type irritable bowel syndrome. Int J Colorectal Dis. 2017;32(1):29–39.
98. Aziz I, Trott N, Briggs R, North JR, Hadjivassiliou M, Sanders DS. Efficacy of a gluten-free diet in subjects with irritable bowel syndrome–diarrhea unaware of their HLA-DQ2/8 genotype. Clin Gastroenterol Hepatol. 2016;14(5):696-703.e1.
99. Carroccio A, Mansueto P, Iacono G, Soresi M, D’Alcamo A, Cavataio F, et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol. 2012;107(12):1898–906.
100. Carroccio A, D’Alcamo A, Iacono G, Soresi M, Iacobucci R, Arini A, et al. Persistence of nonceliac wheat sensitivity, based on long-term follow-up. Gastroenterology. 2017;153(1):56-58.e3.
101. Skodje GI, Sarna VK, Minelle IH, Rolfsen KL, Muir JG, Gibson PR, et al. Fructan, rather than gluten, induces symptoms in patients with self-reported non-celiac gluten sensitivity. Gastroenterology. 2018;154(3):529-539.e2.
102. Gibson PR, Skodje GI, Lundin KEA. Non-coeliac gluten sensitivity. J Gastroenterol Hepatol. 2017;32 Suppl 1:86–9.
103. Molina-Infante J, Carroccio A. Suspected nonceliac gluten sensitivity confirmed in few patients after gluten challenge in double-blind, placebo-controlled trials. Clin Gastroenterol Hepatol. 2017;15(3):339–48.
104. Moayyedi P, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. The effect of dietary intervention on irritable bowel syndrome: a systematic review. Clin Transl Gastroenterol. 2015;6(8):e107.
105. World Health Organization. WHO guidelines on nutrition [Internet]. WHO. 2018 [cited 2017 Aug 19]. Available from: http://www.who.int/publications/guidelines/nutrition/en/
106. McClave SA, DiBaise JK, Mullin GE, Martindale RG. ACG clinical guideline: nutrition therapy in the adult hospitalized patient. Am J Gastroenterol. 2016;111(3):315–34.
107. Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014;63(8):1210–28.
108. National Institute for Health and Care Excellence (NICE). Diet, nutrition and obesity [Internet]. 2018 [cited 2018 May 19]. Available from: https://www.nice.org.uk/resources/lifestyle-and-wellbeing/diet--nutrition-and-obesity
109. North American Society for Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). Nutrition & obesity [Internet]. 2016 [cited 2018 May 19]. Available from: http://www.naspghan.org/content/55/en/Nutrition-and-Obesity