Prof. S. Winawer (chair, USA)
Prof. M. Classen (co-chair, Germany)
Prof. R. Lambert(co-chair, France)
Prof. M. Fried (Switzerland)
Prof. P. Dite (Czech Republic)
Prof. K.L. Goh (Malaysia)
Prof. F. Guarner (Spain)
Prof. D. Lieberman (USA)
Prof. R. Eliakim (Israel)
Prof. B. Levin (USA)
Prof. R. Saenz (Chile)
Prof. A.G. Khan (Pakistan)
Prof. I. Khalif (Russia)
Prof. A. Lanas (Spain)
Prof. G. Lindberg (Sweden)
Prof. M.J. O’Brien (USA)
Prof. G. Young (Australia)
Dr. J. Krabshuis (France)
Prof. R. Smith (USA)
Prof. W. Schmiegel (Germany)
Prof. D. Rex (USA)
Prof. N. Amrani (Morocco)
Prof. A. Zauber (USA)
1. 前言
结直肠癌(CRC)是一个全球性的问题,年发病率约 1,000,000,年死亡例数超过 500,000。在未来 20 年中,无论是发达国家还是发展中国家,人口数量的增长和 人口老龄化将使得该绝对值持续增加。
CRC 在男性和女性癌死亡率中均占第二位。多数 CRC 源自散发性腺瘤,少数是由遗传性息肉病或炎症性肠病(IBD)发展而来。 “息肉” 指的是凸入肠腔的孤立 肿块。结肠镜筛检资料显示,结直肠腺瘤性息肉的发病率约为 18–36%。
CRC 的患病风险在国家或地区之间甚至同一国家或地区内部存在差异。由于不 同的饮食习惯、生活方式以及遗传背景,该风险在不同个体之间也同样存在差异。
CRC 筛选中发现的肠内新生物多为腺瘤。对腺瘤切除后病人的随访应等同于已 经确诊或正在接受治疗的癌症病人。
本指南旨在筛选对腺瘤或癌症易感的无症状人群。筛选程序包括:初级预防筛 选(饮食习惯、生活方式);对初级预防筛选判为可疑的个体做及时的诊断性结 肠镜检和治疗(息肉切除、外科手术)。
在许多 CRC 高风险的国家中因 CRC 筛查的阳性率较低而备受争议。另外因涉 及诸多问题而显得复杂,比如需要病人的大力配合(大便潜血试验玻片、结肠镜 检的准备等等)、在某些检查(如结肠镜检)中可能需要麻醉和陪护等。 成功的 筛选有赖于多项步骤的完美配合,首先需要有初级保健医师的筛选意识及推荐、 病人接受程度、费用承担、风险分层、筛选试验,还要有及时诊断、及时治疗以 及合理随访。任何一方面的失误都可能导致筛选失败。
2. 方法学与文献综述
世界胃肠病组织(WGO)临床指南编写组基于新近发表的系统性综述、循证指 南及高质量临床试验报道,整合为 WGO-临床指南,使之尽可能中肯、易于接受 而适用于全球各地。通常,这意味着需根据当地的资源、文化、政策背景等采用 不同的方法来达到同一个目的。WGO 临床指南并非是对所有的现有证据及指南 进行简单整合,一个全球化的指南应能体现出不同资源、不同流行病学的地域性 差异,相应给出各种语言的译本以推进临床应用。
本指南是WGO-临床指南编写组就CRC筛选主题基于近年来的文献研究对 2002 年版(http://omge.org/globalguidelines/statement03/statement3.htm)的修订。
在各检索平台进行检索时,我们对检索词的要求是高精确而非高敏感。相关指 南的检索主要通过美国国立指南情报所(www.ngc.org)和主要的胃肠病学与肿 瘤学网站以及Medline 和 EMBASE 中 2003 年前的Dialog-Datastar 检索平台资料。 在 Cochrane图书馆共检索到 18 篇相关的系统评价和 12 部研究方案。编写组成员 依其专长而有不同分工,并在检索策略与详细资料方面得到了各组资料员的全力 支持。所有成员组的初稿均得到国际专家组的审阅并由编写组主席及资料员最终 编辑审定。
3. 结直肠癌的流行病学
3.1 CRC 要点
据国际癌症研究署 (IARC) Globocan 2002 数据库资料, 在全球范围内,男性约有 550,000 CRC 新发病例和约 278,000 死亡病例,女性相对应的数字分别为 473,000 和 255,000 。2002 年,CRC 占到全球男女性癌症发病的 9.4% ,尤其多见于北美、 澳大利亚、新西兰和部分欧洲国家。这使得 CRC 被认为是一种与西方生活方式 相关的疾病。
3.2 目前发病率与死亡率的动态变化
西方国家 CRC 年龄标化的死亡率在 20 世纪保持相对稳定,目前开始有下降趋势; 而在先前认为是 CRC 低风险的国家却发生了巨大变化。
在欧洲,东部和南部的 CRC 年龄标化死亡率不断增高而中部和北部则相对恒 定。女性患者死亡率在近年来趋向于高于男性。
在美国,流行病学与转归(SEER)监测体系显示:从 1973 到 1989 年, 男性结肠 癌年龄标化发病率白人增长了 11%,黑人增长了 39%,直肠癌则白人减少了 5%, 黑人增加了 27%。女性中结肠癌发病率白人减少了 3%,黑人增长了 26%,直肠 癌则白人减少了 7%,黑人减少了 10%。自 1990 年以来,结肠癌年龄标化发病率 持续降低,这至少部分归因于成功实施了息肉切除的预防措施。
在日本,CRC 年龄标化死亡率在 20 世纪中期处于较低水平,但是在 1955–74 和 1975–84 期间却增长了大约 3 倍。
随着全球人口的老龄化,预计 CRC 病例数可能会有显著增长。
3.3 CRC 的家族性遗传因素
图. 1 家族性危险因子与 CRC
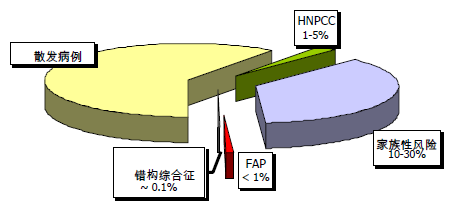
平均危险度 有家族史的个体 CRC 患病风险随年龄增长而增加,50 岁以前少发,然而其后则发病率激增。无家族史的个体被认为是一般危险人群。
非综合征性家族性风险 CRC 可能是人类癌肿中最具家族遗传性特征的一种。 约 5%~30%的 CRC 可归因于家族遗传。但是所有 CRC 中仅有 1–5%患有因已知 遗传缺陷导致的遗传综合征。10~30%的 CRC 病人具有家族病史但是不存在任 何已知的遗传性综合征。CRC 中家族聚集现象常见且能够提示患癌风险增加。 一级亲属中有 CRC 患者的个体较普通人群患癌风险高 2~3 倍。而且,患癌风险 尚与亲属中患癌人数、个体与患癌亲属的亲近程度正相关,亲属患癌年龄越轻, 个体患癌风险也会越大。另外,曾有 CRC 病史的个体亦将处于再次患癌的高风 险中。因此,具有非综合征性 CRC 家族史或亲属中有年龄不足 60 岁的腺瘤患者 的个体其 CRC 患癌风险增加(表 1)。
表 1 CRC 的家族性风险

RR:相对危险度; CI:可信区间。
引自: Burt RW (Gastroenterol Clin North Am 1996;25:793–803) 和 Johns LE, Houls—n RS (Am J Gastroenterol 2001;96:2992–3003).
综合征性家族性风险 家族性腺瘤性息肉病 (FAP). FAP 属常染色体显性遗传。 约 1/3 的新发病例源于新生突变。
遗传性非息肉性结直肠癌 (HNPCC,Lynch 综合征)。常染色体显性遗传性 HNPCC 是综合征性家族性 CRC 的最常见形式。表 2 是 HNPCC 表型的 Amsterdam II 标准。
表 2 HNPCC 的 Amsterdam II 标准

其他少见的家族性综合征有:
- 幼年性息肉病(JP, Juvenile polyposis)
- PJ 综合征 (Peutz–Jeghers syndrome)
- Cowden 综合征 (Cowden syndrome)
炎症性肠病(IBD)的临床危险因子 已经明确 IBD 的存在导致 CRC 患癌风险 增加。IBD 病程 8~10 年后 CRC 累积发病率增加,30 年时可达 15%。危险因子 包括疾病持续时间、病变范围、年轻时发病以及合并原发性硬化性胆管炎或狭窄。 药物治疗不当及缺乏有效的监测都可能是患癌风险增加的因素。
4. 筛选试验与证据,1:粪检,潜血和 DNA
CRC 病人粪便中可检出血液及其它癌组织成分,这远早于临床症状的出现。这 使得在无症状人群中筛查或早期发现癌症成为可能。最常用的方法是大便潜血试 验。在一些随机研究中显示,根据所用方法和检测频率的不同大便潜血试验可以 使得筛查人群 CRC 病死率降低 15–33%,依从者的 CRC 病死率降低 45%。
潜血试验: 愈创木脂涂片试验最为常用。该试验反映血红素过氧化物酶活性,但同时易受大便中其他过氧化物酶(如来自某些水果、蔬菜、红肉等)的影响。 为避免假阳性结果,宜于试验前进行饮食限制。
将大便潜血试验(FOBT) 纳入 CRC 筛选试验还存在一些问题:仅仅一次的 FOBT 敏感性只有 50–60%,但如果坚持每 1~2 年 一次长期持续 FOBT,则敏感 性可高达 90%。虽然通过再水和作用能够提高 FOBT 的敏感性,反应的变异性仍 将弱化其作为 CRC 筛选试验的功效。敏感性低会带来大量的假阴性结果。而被 FOBT 检出的相当部分病例可能是假阳性而被迫接受不必要的其他检查(通常是 结肠镜检)。另外,FOBT 的筛选功效尚有赖于长期反复检查,这将涉及到病人 的顺应性问题。
目前许多国家中愈创木脂法 FOBT 已被免疫化学试验 (FIT 或 IFOBT)所取代, 这是敏感性与特异性均高的检测血红蛋白的方法,而且检测前不需要进行饮食限 制。对被检者来说,免疫化学实验的优越性研究结论不一,病人对有些试验的依 从性极佳。免疫化学方法最佳敏感度的标准尚有待于进一步研究验证。
CRC 的大便 DNA 检测 在粪便标本中辨识异常 DNA 有可能成为一种早期检测 CRC 的方法。然而最佳分子标记的设定以及作为普通人群 CRC 筛选试验的可行 性仍有待深入探讨。一项研究对 2507 名受试者作了 21 个突变基因的检测同时行 愈创木脂法 FOBT,结果大便 DNA 检测诊断 CRC 的敏感性为 52%,愈创木脂法 FOBT 的敏感性仅为 13%,两者的特异性相似(94.4% vs. 95.2%)。
其他一些小规模实验研究显示大便 DNA 检测总的敏感性为 65%,特异性达 95%。一项新的研究中减少了待测突变基因数目而使敏感性提高到了 80%以上。
5. 筛选试验与证据,2:内镜与 CT 仿真结肠镜检查
本节着重探讨内镜与放射影像学检查在 CRC 筛选中的应用及证据。
5.1 内镜筛查方法
可曲性乙状结肠镜 可直接观察距肛 60cm 以 内的大肠内壁情况,可以检出结直肠 息肉或癌肿,同时也可行息肉切除以及对可疑病变进行活检。可曲性乙状结肠镜 检查具有多项优点:操作者可以是医师或非医师,较全结肠镜检查省时,肠道准 备简便快捷,如不行息肉切除则检查致死率低到可忽略不计,另外也无须麻醉。 当然,该检查具有明显的缺点,那就是仅仅局限于内镜可及的左半结肠。虽然此 方法具有极高的特异性(98–100%, 罕见假阳性),其对全结肠诊断的敏感性较低, 仅为 35% ~ 70% ,因为相当数量的右半结肠腺瘤会因无远端病变而被可曲性乙 状结肠镜漏诊。
乙状结肠镜已用于无症状人群早期癌肿的筛查和预防。病例–对照研究已明确 显示乙状结肠镜筛选能降低当地结肠癌病死率的 60–70%。重要并发症的发生率 约为 1/10,000。
结肠镜检查 可以发现和切除全结肠范围内的息肉,同时也可对癌肿病变进行 活检。对息肉或癌肿检出的敏感性和特异性均较高(对大息肉检出的敏感性和特 异性超过 95%)。背对背结肠镜检查的研究显示,直径小于 5 mm 腺瘤的漏诊率 约为 15–25%,对直径超 10 mm 的,漏诊率仅 0–6%。
目前尚无关于结肠镜检查对 CRC 发病率与病死率影响的前瞻性随机研究。但 是美国国家息肉研究组织应用数学模型对息肉切除术后病人长期随访,结果显示 CRC 的发病率与病死率下降了近 90%。
理想的筛查程序应该简单易行且费用低廉以适用于所有危险人群。虽然全结肠 镜检查并不符合上述标准,该项检查仍被视为 CRC 诊断的“ 金标准” ,其他筛 选试验(FOBT、乙状结肠镜检查、CT 仿真结肠镜检查)阳性的病人,如有条件,随即应接受全结肠镜检。在一些富有资源的国家,直接的全结肠镜检查已成为 CRC 筛选的最流行方案。全结肠镜检查重要并发症的发生率约为 1–2 ‰。
5.2 放射影像学筛查方法
双重对比钡灌肠法(DCBE) 虽然 DCBE 的检查范围可及全结肠,其敏感性与特异 性要较全结肠镜检或 CT 仿真结肠镜检查为低。即使是对较大的息肉或癌肿, DCBE 的灵敏度 (48%) 也远低于结肠镜检查,而且与结肠镜检查相比,DCBE 更 易于得出假阳性结果(误诊为息肉)。 钡剂灌肠异常的病人仍需后续结肠镜检查。 但是,DCBE 普及率高,而且对较大息肉近 50% 的检出率使得该项检查在资源 缺乏的地区仍不失为一项实用手段。
CT仿真结肠镜检查 (CTC) 薄层螺旋CT扫描腹腔和盆腔后利用计算机对图像 数据做数字加工和解读,重建肠腔表面二维或三维立体构像“ 虚拟结肠镜检查” 。 该操作需要扩张结肠,这就要求根据病人耐受程度对肠管尽可能注气(一般约注 入 2 L室内空气或CO2),而且需要病人做肠道准备。肠腔内粪便和液体可以被 口服对比剂标记,然后通过数字减影技术从计算机图像中去除。
一项荟萃分析显示 CTC 对直径超过 10 mm 的结肠息肉或癌肿具有高敏感性 (93%) 和高特异性(97%) 。但是,当涵盖中等大小息肉(6 mm 以上)时,平均敏感 性和特异性均降至 86%。如果评价 CTC 对所有大小的息肉的检出效果,则结论 极具异质性:敏感性为 45–97%,特异性为 26–97%。虽然 CTC 对癌肿和大息肉 的敏感度较高,但对 6–9-mm 大小息肉的敏感性却难以令人满意。CTC 的重要缺 陷是在对具高风险的病人进行筛查时会漏检平坦性病变。
将 CTC 作为筛选试验的另一个障碍在于病人在检查过程中将反复暴露于电离 辐射之中。虽然近年来多排 CT 的出现使得 CTC 在维持高空间分辨率的同时缩 短了扫描时间并减少了辐射剂量,但该问题仍不容忽视。为此,欧洲已经开始了 磁共振仿真结肠镜检查的研究。
另外,仅基于 CTC 影像上的息肉大小难以判断病人何时必需进行结肠镜检查, 而这又极大影响筛查成本。另一个局限在于 CTC 需要病人做全肠道准备,如果 病人还需进一步的结肠镜检查则需要再次准备肠道,除非同时具备同一天作此两 项检查的设备。最后,肠外发现会导致额外的放射学和外科学评估并增加相应费 用。CTC 罕见重大并发症。
6. 结直肠癌 筛选的费用—效益
各种针对一般风险人群的 CRC 筛选的标准检查均具良好的效/价比:其与早期胸 部肿瘤的 X 线透视筛选相似而优于其他多种医学筛查 (例如针对高血压病人的血 胆固醇水平检测)。在 CRC 病人一级亲属中自 40 岁开始进行有计划的全结肠镜 筛选被证明具有良好的经济效益。与晚期癌症的多重药物化疗相比,筛选可以明 显降低整体费用。
7. 结直肠癌筛选的级联方案
7.1 前言
本节综述了在 50 岁以上一般风险人群和高风险人群中的不同筛选策略。选择筛 选方案时应虑及结肠镜检查、可曲性乙状结肠镜检查、FOBT 以及钡灌肠方法的 可用性与利用率。如果可用于筛选的检验资源非常有限,最现实的选择可能是对 超过 50 岁的一般危险人群每一到两年实施 FOBT。
FOBT 的方法可以根据可供筛选的试验资源以及人群的饮食习惯作出选择。
在各种 FOBT 方法中,Hemoccult II 的阳性率较低,因此与敏感性高的 Hemoccult SENSA 相比,筛选后对全结肠镜检查的需求要小。最佳的 FOBT 是免疫化学法,该法的检测周期为 2 天而不是 3 天,而且检查前无需饮食限制,但是费用较高, 而这在经济能力差的地区也是一个值得考虑的问题。
诊断性检查可选全结肠镜检查或当无条件进行全结肠镜检查时选择钡剂灌肠。 因此,结肠镜设备的资源配置决定了是否对高风险个体进行特殊甄别。如果结肠 镜检的设备有限,则高风险人群也只能得到与一般风险人群同样的筛选策略。
7.2 CRC 筛选级联方案
推荐的 CRC 筛选级联方案根据资源水平的差异而各异,从 1 (资源最丰富)到 6 (资 源最贫乏)分为 6 个级别。.
1 级推荐. 下述建议适用于资源(经济、专家、设备)相对丰富且因 CRC 发病 率与病死率均高 (IARC data) 而受到高度重视的国家。
一般危险人群筛选建议: 自 50 岁开始,无论男性还是女性,直接进行全结肠 镜检查,如果不存在使其患癌风险增加的因素,每 10 年一次。
高危人群筛选建议:
- — 有 CRC 或腺瘤性息肉家族病史的
—一级亲属 (父母、同胞和子女)中有一人在 60 岁前被诊为结肠癌或腺瘤性 息肉的,或者一级亲属中有两人患结肠癌(不限年龄),建议 40 岁时或比 家族中最早确诊 CRC 的年龄提前 10 年开始做全结肠镜检筛选,每 5 年一次。
—一级亲属中有一人在 60 岁以后被诊为结肠癌或腺瘤性息肉,或者二级亲 属(祖父母、姑姨或叔舅)中有两人患 CRC,推荐 40 岁开始按一般危险人 群筛检。
—二级亲属或三级亲属(曾/外曾祖父母、表亲)中有一人患 CRC 的推荐按 一般危险人群筛检。
- 家族性腺瘤性息肉病(FAP). 基因诊断为 FAP,或者是 FAP 高危人群但未进 行或无条件进行基因检查的,应该自 10–12 岁开始每年接受乙状结肠镜检查 确定是否存在遗传异常表现。有高危亲属的 FAP 病人应做基因检查。遗传咨 询可对基因检查以及结肠造瘘手术与否作出指导。
- 遗传性非息肉病性结肠癌 (HNPCC). 基因或临床诊断为 HNPCC 者,或 HNPCC 高风险者应该自 20–25 岁开始或比家族中最早确诊结肠癌的年龄提 前 10 年开始每 1–2 年一次全结肠镜检查。已知有遗传性错配修复(MMR)基 因突变的个体的一级亲属均应接受 HNPCC 基因检查。即使家族性突变基因 不清但只要符合改良 Bethesda 标准前三条中之一条,也建议进行 HNPCC 基 因检查。
- 对曾患有炎症性肠病或腺瘤性息肉或 CRC 的个体应进行随访监测而不是筛 选(另有对此类病人的监测指南)。
2 级推荐. 适用于 结肠镜检查设备较缺乏地区,其他建议同 1 级推荐。
一般危险人群筛选建议: 50 岁时,无论男性还是女性,如果不存在使其患癌 风险增加的因素,直接进行一次全结肠镜检查。
高危人群筛选建议: 同 1 级推荐。
3 级推荐. 适用于结肠镜检查设备较为缺乏但是可以进行可曲式乙状结肠镜检 查的地区,其他建议同 1 级推荐。
一般危险人群筛选建议:无论男性还是女性,如果不存在使其患癌风险增加的 因素,自 50 岁开始,每 5 年一次可曲式乙状结肠镜检查筛选。对阳性病例做全 结肠镜检。
高危人群筛选建议: 同 1 级推荐。
4 级推荐. 基础方案同 3 级推荐,但仅仅适用于可曲式乙状结肠镜与结肠镜检 查设备均明显缺乏时。
一般危险人群筛选建议: 50 岁时,无论男性还是女性,如果不存在使其患癌 风险增加的因素,直接进行一次可曲式乙状结肠镜检查。是否对镜检阳性或进展 期肿瘤患者进行诊断性全结肠镜检查则取决于当地结肠镜设备资源。
高危人群筛选建议: 同 1 级推荐。
5 级推荐. 基础方案同 4 级推荐, 但仅适用于诊断性结肠镜检查设备严重缺乏 时。
一般危险人群筛选建议: 50 岁时直接进行一次可曲式乙状结肠镜检查。仅对 进展期肿瘤患者进行诊断性结肠镜检查。
高危人群筛选建议: 视当地结肠镜检查设备资源而定。
6 级推荐. 基础方案同 1 级推荐, 但仅仅适用于可曲式乙状结肠镜与结肠镜检查 设备均严重缺乏时。
一般危险人群筛选建议:如果不存在使其患癌风险增加的因素,50 岁开始每年 一次 FOBT。FOBT 方法与类型的选择取决于当地结肠镜检的设备资源以及人群 饮食习惯。诊断性检查如条件允许可选全结肠镜检查或当无条件进行全结肠镜检 查时选择钡剂灌肠。
高危人群筛选建议: 结肠镜设备的资源配置决定了是否对高风险个体进行特 殊甄别(见 1 级推荐)。如果结肠镜检的设备有限,则高风险人群可以随同一般风 险人群进行筛选。
7.3 前沿试验方法
CTC 和 DNA 检测仅限于一些资源丰富的国家而难以全球性应用。然而如果具备 进行 CTC 和 DNA 检测 的条件,亦可应用于那些不愿意接受其他的标准筛选方 案的一般风险人群中,初始检测年龄定于 50 岁。这或可增加这些国家人群接受 CRC 筛选的比例。
7.4 操作建议 — 计划执行
一般性操作建议:
- 针对公众、相关医生、医疗卫生保健机构以及卫生政策的制定者或领导人开 展有计划的宣教。应该以某种受欢迎的方式对每一位重要的参与者进行有效 的宣教。
- 制定高质量筛选的循证医学标准。
- 形成并推广一个既节约费用又易于应用的临床管理体系。
- 在全国或当地范围内提倡筛选。
- 推动将 CRC 筛选作为综合性临床预防方案之一。
程序设计操作建议—
设计:
- 首先应确定目标人群— 亦即无症状群体、年龄、危险因素(如家族史)等。
- 实施 CRC 筛选与否应基于筛选人群中 CRC 的相对负担。
- 筛选策略(试验、时间间隔、年龄范围)的选择应建立在医学证据 (指南)、资 源供应、风险水平和人群的文化水平等基础之上。
- 有必要获得知名专家、病患权益保护机构以及媒体的配合与支持。
- 评估筛选计划的可行性,包括资源(财政、人员、设备)的发展与配置。
- 评估人群中特殊的文化与语言需求。
实施:
- 甄别实施对象,确保与相关医师以及目标人群的沟通与联系(教育培训等) 。
- 尽可能以一种病人感觉友好且易于为当地文化所接受的方式完善并传播关 于 CRC 筛选、诊断、治疗以及监控的指南。
- 制定病人的入选与随访方案。
监控:
- 对筛选的参与率、再筛选率以及筛选试验阳性人群的随访率作细致、适时的 监控。
- 随访对监控方案的顺应性。
- 度量筛选程序的质量和定期评估。
- 结果分析,包括检出率、癌症分期、腺瘤检出、并发症以及最终对人群发病 率和病死率的影响。
8. 何处获取帮助
8.1 国际消化系肿瘤联合会 (IDCA)
- http://omge.org/?idca The International Digestive Cancer Alliance (IDCA)
IDCA 是一个国际化组织,旨在全球范围内推进消化系肿瘤的预防与诊治。
8.2 国际癌症研究署 (International Agency for Research on Cancer,IARC)
8.3 美国疾病预防与控制中心 United States Centers for Disease Control and Prevention (CDC)
8.4 美国癌症学会 American Cancer Society (ACS)
8.4 国际抗癌联盟 (Union Internationale Contre le Cancer/ International Union Against Cancer, UICC)
9. 部分参考网址、指南与文献
9.1 指南、共识意见与网站链接
缩写: ACG, American College of Gastroenterology; ACS, American Cancer Society; AGA, American Gastroenterological Association; ASCRS, American Society of Colorectal Surgeons; ASGE, American Society of Gastrointestinal Endoscopy; BSG, British Society of Gastroenterology; DGVS, German Society for Digestive and Metabolic Diseases; FMSD, Finnish Medical Society Duodecim; ICSI, Institute for Clinical Systems Improvement; NCCN, National Comprehensive Cancer Network; NICE, National Institute of Clinical Excellence; NZGG, New Zealand Guidelines Group; SIGN, Scottish Intercollegiate Guidelines Network; SMH, Singapore Ministry of Health; WGO, World Gastroenterology Organisation.
9.2 参考文献
- Lieberman DA, Weiss DG; Veterans Affairs Cooperative Study Group 380. One-time screening for colorectal cancer with combined fecal occult-blood testing and examination of the distal colon. N Engl J Med 2001;345:555–60 (PMID: 11529208).
- Barclay RL, Vicari JJ, Doughty AS, Johanson JF, Greenlaw RL. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy. N Engl J Med 2006;355:2533–41 (PMID: 17167136).
- Sonnenberg A, Delcò F, Inadomi JM. Cost-effectiveness of colonoscopy in screening for colorectal cancer. Ann Intern Med 2000;133:573–84 (PMID: 11033584).
- Burt R, Neklason DW. Genetic testing for inherited colon cancer. Gastroenterology 2005;128:1696–1716 (PMID: 15887160).
- Faivre J, Dancourt V, Lejeune C, Tazi MA, Lamour J, Gerard D, et al. Reduction in colorectal cancer mortality by fecal occult blood screening in a French controlled study. Gastroenterology 2004;126):1674–80 (PMID: 15188160).
- Imperiale TF, Ransohoff DF, Itzkowitz SH, Turnbull BA, Ross ME. Fecal DNA versus fecal occult blood for colorectal-cancer screening in an average-risk population. N Engl J Med 2004;351:2704–14 (PMID: 15616205).
- Kronborg O, Jorgensen OD, Fenger C, Rasmussen M. Randomized study of biennial screening with a fecal occult blood test: results after nine screening rounds. Scand J Gastroenterol 2004;39:846–51 (PMID: 15513382).
- Parkin DM, Whelan SL, Ferlay J, et al., editors. Cancer incidence in five continents, vol. 8. Lyons: International Agency for Research on Cancer, 2002 (IARC Scientific Publications, no. 155) (PMID: 12812229).
- Winawer S, Fletcher R, Rex D, Bond J, Burt R, Ferrucci J, et al. Colorectal cancer screening and surveillance: clinical guidelines and rationale — update based on new evidence. Gastroenterology 2003;124:544–60 (PMID: 12557158).
- Winawer SJ, Zauber AG, Fletcher RH, Stillman JS, O’Brien MJ, Levin B, et al. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology 2006;130:1872–85 (PMID: 16697750).
- Young GP, St. John DJ, Winawer SJ, Rozen P; WHO (World Health Organization) and OMED (World Organization for Digestive Endoscopy). Choice of fecal occult blood tests for colorectal cancer screening: recommendations based on performance characteristics in population studies: a WHO (World Health Organization) and OMED (World Organization for Digestive Endoscopy) report. Am J Gastroenterol 2002;97:2499–507 (PMID: 12385430).
- Hewitson P, Glasziou P, Irwig L, Towler B, Watson E. Screening for colorectal cancer using the faecal occult blood test, Hemoccult. Cochrane Database Syst Rev 2007;(1):CD001216 (PMID: 17253456).
- Regula J, Rupinski M, Kraszewska E, Polkowski M, Pachlewski J, Orlowska J, et al. Colonoscopy in colorectal-cancer screening for detection of advanced neoplasia. N Engl J Med 2006;355:1863–72 (PMID: 17079760).
- Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993;329:1977–81 (PMID: 8247072).
- Winawer SJ, Stewart ET, Zauber AG, Bond JH, Ansel H, Waye JD, et al. A comparison of colonoscopy and double-contrast barium enema for surveillance after polypectomy. National Polyp Study Work Group. N Engl J Med 2000;342:1766–72 (PMID 10852998).
- Winawer SJ, Zauber AG, Gerdes H, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Risk of colorectal cancer in the families of patients with adenomatous polyps. National Polyp Study Workgroup. N Engl J Med 1996;334:82–7 (PMID: 8531963).
- Itzkowitz-Steven-H, Jandorf-Lina, Brand-Randall, Rabeneck-Linda, Schroy-Paul-C-3rd, Sontag-Stephen, Johnson-David, Skoletsky-Joel, Durkee-Kris, Markowitz-Sanford, Shuber- Anthony. Improved fecal DNA test for colorectal cancer screening. Clinical gastroenterology and hepatology Jan 2007 08 Dec 2006 , vol. 5, no. 1, p.111-7 PMID: 17161655
- Kim-David-H, Pickhardt-Perry-J, Taylor-Andrew-J, Leung-Winifred-K, Winter-Thomas-C, Hinshaw-J-Louis, Gopal-Deepak-V, Reichelderfer-Mark, Hsu-Richard-H, Pfau-Patrick-R. CT colonography versus colonoscopy for the detection of advanced neoplasia. N Engl J Med, 4 Oct 2007, vol. 357, no. 14, p. 1403-12, PMID: 17914041
- Allison JE, Sakoda LC, Levin TR, Tucker JP, Tekawa IS, Cuff T, Pauly MP, Shlager L, Palitz AM, Zhao WK, Schwartz JS, Ransohoff DF, Selby JV. Screening for colorectal neoplasms with new fecal occult blood tests: update on performance characteristics. J Natl Cancer Inst. 2007 Oct 3;99(19):1462-70. PMID: 17895475
致谢 我们感谢国际癌症研究署 (IARC; www.iarc.fr) 提供的数据资料与图表;感谢肿瘤学 年鉴 (http://annonc.oxfordjournals.org/) 提供 Oslo 会议资料。
10. 疑问与反馈
临床指南编写组欢迎您的任何评论和疑问。您是否认为我们忽略了某些方面?您 是否感到有些操作具有额外的危险?告诉我们您的经验。您可以发送邮件到下面 的邮箱告诉我们您的观点。guidelines@worldgastroenterology.org







