1. Introduction
A l’occasion de la Journée Mondiale de la Santé Digestive, ces directives constituent la première revue à considérer quatre symptômes gastro-intestinaux clés comme point de départ: brûlures rétrosternales, douleurs/gêne abdominales, ballonnement et constipation. Son approche par cascades à quatre niveaux de soins fait qu’elle est également unique en son genre: auto-assistance et remèdes en vente libre; le point de vue du pharmacien, du médecin de premiers recours—là où les symptômes jouent un rôle primordial dans l’anamnèse du patient. Son but est de fournir des guidelines (directives) uniques et utiles dans le monde entier afin de faciliter la prise en charge de symptômes gastro-intestinaux courants, inquiétants mais pas pour autant handicapants. Les directives ont été mises au point par une équipe de spécialistes en gastro-entérologie et en médecine de premier recours, en collaboration avec la Fédération internationale de pharmacie (International Pharmaceutical Federation (FIP)).
Les symptômes gastro-intestinaux—sauf peut-être les brûlures rétrosternales—se présentent habituellement sous une forme chronique ou récidivante et sont attribués au pharynx, à l’oesophage, à l’estomac, aux voies biliaires, à l’intestin ou à la région anorectale. Il existe des données sur l’épidémiologie des symptômes pris individuellement, mais il y en a davantage sur les groupes de symptômes (« clusters ») gastro-intestinaux fonctionnels (FGIDs)—des troubles qui à ce jour ne peuvent pas être expliqués par des anomalies structurales ou biochimiques. Ces troubles touchent beaucoup de personnes et représentent une grande partie du travail en médecine de premiers recours et en gastro-entérologie. Une étude de consensus multinationale, utilisant des critères prédéfinis en matière de symptomatologie, a permis de catégoriser ces symptômes dans des troubles gastro-intestinaux fonctionnels distincts [1].
Il n’existe que relativement peu de données sur l’épidémiologie des symptômes pris individuellement (à l’exception de la constipation), alors qu’il existe pas mal de données sur les troubles gastro-intestinaux fonctionnels. Ces derniers sont souvent utilisés en lieu et place des symptômes individuels. Dans le cadre de ce guideline on parlera de maladie de reflux gastro-oesophagien (GERD) plutôt que de brûlures rétrosternales et de syndrome de l’intestin irritable (IBS) plutôt que de douleurs abdominales/ballonnement.
Lorsque, dans une communauté, on considère une affection particulière, il est important de distinguer dans le cas particulier entre les problèmes gastro-intestinaux déjà diagnostiqués ou non diagnostiqués. Il existe une grande tranche de la population qui souffre de tels problèmes mais qui n’ont pas reçu un diagnostic précis de la part de leur médecin [2]. Dans le cas de la dyspepsie, on estime que seulement 50% des personnes qui en souffrent consulte leur médecin [3]. Les raisons de consulter le médecin peuvent être déterminantes pour la prise en charge.
L’épidémiologie locale ou régionale d’une maladie est importante pour la prise en charge de ces problèmes gastro-intestinaux: la prévalence des maladies parasitaires, telles les vers, la giardiase et les virus, ainsi que l’incidence des affections malignes, doivent être prises en considération. Par exemple, la giardiase au Mexique ; les virus de l’hépatite en Asie du Sud-est; et dans le sud de la région des Andes, les cancers gastriques et de la vésicule biliaire doivent être pris en considération dans le diagnostic différentiel.
Des facteurs culturels et religieux peuvent également modifier la réponse du patient aux symptômes: par exemple les japonais sont connus pour leur tolérance élevée à la douleur; dans d’autres cultures, se montrer fort en résistant à la douleur ou à d’autres maladies peut être considéré comme une espèce de sacrifice qui pourrait être bénéfique à l’âme et dans la vie d’outre-tombe. Le fait de devoir affronter des stress environnementaux ou psychologiques tels la guerre, la migration, la famine, l’abus sexuel ou l’intimidation peut se révéler très important comme cause de maladie et de symptômes. Finalement, une nourriture très épicée peut constituer un véritable problème dans certaines cultures.
1.1 Epidémiologie des symptômes gastro-intestinaux fonctionnels
Les variations entre les pays sur la fréquence des symptômes abdominaux doivent être interprétées avec précaution car elles peuvent également refléter des différences culturelles, linguistiques ou dans la manière de les exprimer, ainsi que dans les méthodes utilisées pour l’étude [4].
Des différences culturelles peuvent être à l’origine de variations en matière de [5]:
- Perception des symptômes—différences dans les idées et les préoccupations Offre de soins (y compris l’accès à ceux-ci)
- Utilisation des médicaments
- Types et schémas de traitement préférés
- Attentes concernant la guérison
- Disponibilité ou non des médicaments en vente libre ou sur ordonnance
1.1.1 Amérique du Nord/Etats-Unis
En 1993, Drossman et al. [1] ont publié les données d’une étude menée dans les ménages aux Etats-Unis sur la prévalence de 20 affections gastro-intestinales fonctionnelles, remplissant les critères diagnostiques de Rome.
- 69% des patients faisait état d’au moins une des 20 affections gastro-intestinales fonctionnelles durant les trois mois précédents. Les symptômes ont été attribués à quatre régions anatomiques majeures, avec chevauchement considérable:
-- Intestins 44%
-- Oesophage: 42%
-- Gastro-duodénum: 26%
-- Ano-rectum: 26%
- Chez les femmes, la fréquence de la dysphagie, du syndrome de l’intestin irritable, de la constipation, des douleurs abdominales et biliaires était plus élevée que chez les hommes.
- Chez les hommes, la fréquence du ballonnement était plus élevée que chez les femmes.
- La mention de symptômes, à l’exception de l’incontinence, déclinait avec l’âge.
- Un statut socio-économique bas, un niveau d’études faible et un faible revenu étaient associés à une tendance plus élevée à rapporter des symptômes.
1.1.2 Europe/Pays occidentaux
- On estimé que, dans les pays occidentaux, jusqu’à 30% de la population adulte souffre de troubles gastro-intestinaux fonctionnels [6,7] et ceux-ci sont considérées comme une cause fréquente de douleurs abdominales. Seulement 20–50% de ces symptômes peuvent formellement être attribués au syndrome de l’intestin irritable [1,8].
- Les douleurs et/ou la gêne abdominales représentent le symptôme principal dans le syndrome de l’intestin irritable; parmi d’autres symptômes intestinaux il faut mentionner les modifications des habitudes intestinales, la prédominance de la constipation ou de la diarrhée ou une alternance des deux, ainsi que le ballonnement abdominal, la distension abdominale ou la flatulence [8,9].
- Le terme « syndrome de l’intestin irritable » semble n’être en grande partie utilisé que dans les pays anglo-saxons et est peut-être utilisé abusivement pour désigner plus librement des symptômes fonctionnels. Dans d’autres pays, les plaintes similaires sont plutôt décrites comme des crampes et des douleurs abdominales, une gêne abdominale ou une affection abdominale [4].
- La constipation chronique représente le symptôme gastro-intestinal fonctionnel le plus répandu en Europe, où un tel diagnostic est posé chez presque une personne sur cinq selon les critères diagnostiques utilisés. Il existe une controverse sur l’utilité d’appliquer les critères de Rome III très stricts pour diagnostiquer la constipation, ces critères ayant une validité de construction faible et un taux de faux-négatifs de 10% dans une série de patients [10]. Parmi les patients âgés ou vivants en institution, plus de 50% ont besoin de prendre des laxatifs [11].
- Les symptômes liés à la maladie du reflux gastro-oesophagien sont de plus en plus fréquents aux Etats-Unis, aussi bien que dans le reste du monde. Aux Etats- Unis, El-Serag [12] a fait état d’une augmentation annuelle de 4% dans la prévalence de symptômes de reflux gastro-oesophagien hebdomadaires. Une grande partie de cette augmentation peut être mise sur le compte du problème d’obésité grandissant et des changements observés dans d’autres facteurs liés au style de vie en Europe et en Amérique du Nord, particulièrement dans les populations des zones urbaines [13].
1.1.3 Asie
- Une étude récente dans une population urbaine adulte dans le nord de l’Inde a fait état d’une prévalence de 16% pour la maladie de reflux gastro-oesophagien, ce qui très similaire à celle trouvée dans d’autres pays industrialisés [14].
- Une étude au Pakistan a fait état d’une prévalence globale de symptômes de reflux gastro-oesophagien de 24%, avec une prévalence de 58% chez les hommes [15]. La prévalence du syndrome de l’intestin irritable, de la constipation fonctionnelle et de la diarrhée fonctionnelle était de 20%, 25% et 5%, respectivement, chez des étudiants chinois. Il a été observé que les étudiantes avaient une fréquence des selles inférieure à celle des étudiants (P < 0.01) [16]. Des études menées en Asie semblent indiquer que les infections gastro- intestinales, telle la giardiase, sont souvent à l’origine de douleurs abdominales récidivantes, mais que les douleurs abdominales fonctionnelles sont également fréquentes [17]. Les troubles gastro-intestinaux fonctionnels à prédominance de douleurs touchent 13% des enfants de 10–16 ans au Sri Lanka, ce qui représente un problème de santé significatif; parmi les 2180 enfants qui ont participé à l’étude, le syndrome de l’intestin irritable était présent chez 107 enfants (4.9%), la dyspepsie fonctionnelle chez 54 (2.5%), les douleurs abdominales fonctionnelles chez 96 (4.4%) et la migraine abdominale chez 21 (1.0%) [18]. Dans une autre étude au Sri Lanka, les troubles gastro-intestinaux fonctionnels étaient présents chez plus d’un quart des adolescents dans le groupe étudié, le trouble le plus fréquent étant le syndrome de l’intestin irritable [19]. Il existe un chevauchement fréquent entre la maladie de reflux gastro-oesophagien, la dyspepsie fonctionnelle et le syndrome de l’intestin irritable et ceci péjore la qualité de vie en matière de santé chez les asiatiques. Le symptôme retrouvé dans toutes ces affections est la pesanteur postprandiale [20,21]. Dans d’autres régions, telle la Turquie, une maladie coeliaque peut se rencontrer chez les patients souffrant de dyspepsie et est à exclure lors de la prise en charge [22].
- Dans une étude longitudinale chez les patients de 70 ans à Jérusalem, jusqu’à un tiers se plaignait de symptômes gastro-intestinaux hauts, le plus souvent de brûlures d’estomac, tandis que 10% faisait état de douleurs abdominales dans la semaine précédente, avec moins de 1% des douleurs situées dans le bas-ventre [23].
1.1.4 Amérique latine—symptômes gastro-intestinaux fonctionnels
- Dans une étude effectuée au Chile et utilisant les critères Rome II [24] chez des patients âgés de plus de 20 ans, les résultats suivants ont été observés:
o Symptômes digestifs 67%; critères pour le syndrome de l’intestin irritable 26% (ce qui représente une incidence élevée comparée à d’autres données latino-américaines); âge moyen à l’apparition des symptômes 41.3 ans (extrêmes 20–66 ans); âge moyen au début de la symptomatologie 26.5 ans.
o Patients symptomatiques se présentant chez un médecin: 43%.
o Davantage de cholécystectomies ont été rapportées dans le groupe de patients avec le syndrome de l’intestin irritable: 30.4% versus 13.7% dans le groupe sans intestin irritable (le Chili a une incidence élevée de cancer de la vésicule biliaire).
o Aucune différence n’a été trouvée en ce qui concerne le statut socio- économique, la région géographique ou une anamnèse familiale de l’intestin irritable.
- Madrid et al. [25] ont également rapporté qu’un test respiratoire à l’hydrogène positif après ingestion de lactose était plus fréquent chez les enfants avec des symptômes digestifs fonctionnels.
- Les sous-groupes de patients avec intestin irritable comprennent les diarrhées fonctionnelles 7%, la constipation fonctionnelle 9%, et le ballonnement fonctionnel 23%; il existe une incidence plus élevée chez les femmes que chez les hommes.
- Mâcher des feuilles de coca pourrait être un sujet d’inquiétude chez les populations des Andes en ce qui concerne les pathologies de l’oesophage et pourrait également avoir une relation avec les troubles coliques tels le mégacôlon ou la constipation.
1.1.5 Afrique—symptômes gastro-intestinaux fonctionnels
Les symptômes gastro-intestinaux fonctionnels existent également en Afrique, mais de toute évidence il y a des lacunes significatives dans les données existantes [26–28].
1.2 Algorithmes WGO/OMG
L’Organisation mondiale de gastro-entérologie (World Gastroenterology Organisation ; (WGO/OMG)) a mis au point des algorithmes tant diagnostiques que thérapeutiques pour la prise en charge des patients avec le but d’établir des recommandations selon les ressources à disposition plutôt que de se concentrer sur un « gold standard ». Cependant, pour ce guideline en particulier, une autre approche à été favorisée, basée sur l’endroit où les gens s’adressent pour bénéficier des soins: auto-assistance, conseils du pharmacien, médecin de premier recours/médecin de famille, ou un spécialiste en gastro-entérologie. Ici on ne mentionne pas d’instructions très poussées à l’attention du spécialiste en gastro-entérologie, des sources suffisantes étant à disposition sur internet ainsi que dans la littérature spécialisée; les références sont mentionnées partout dans ce guideline.
Les patients sous traitement devraient s’adresser à un pharmacien afin de savoir si les options d’auto-médication mentionnées dans ce document comportent des contre- indications ou des interactions connues en relation avec les autres médicaments qu’ils prennent. Dans certains pays, les médicaments en vente libre ne sont délivrés que par des pharmacies communautaires. Dans la majorité des pays du monde, les pharmaciens ne peuvent que recommander des médicaments en vente libre (ils n’ont pas le droit de les prescrire) dans le but d’aider les patients, tandis que dans d’autres pays il existe une gamme intermédiaire de médicaments qui ne sont délivrés que par un pharmacien. Distinguer entre les décisions sur la prise en charge qui sont basées sur la recommandation du pharmacien et ceux qui sont véritablement un choix d’auto- assistance représente donc souvent un défi. Afin de résoudre ce problème, les deux méthodes (auto-assistance vs. conseils du pharmacien) ainsi que la solution sont décrites ici (dans les deux cas, il s’agit de médicaments en vente libre).
Il faut cependant prendre en considération le fait que les pharmaciens étudient les médicaments de façon systématique, pour deux raisons:
- Afin de déterminer si les symptômes gastro-intestinaux peuvent être un effet secondaire d’un médicament
- Afin de déterminer si les médicaments utilisés pour traiter les symptômes gastro- intestinaux ont des interactions connues avec les autres médicaments que prend le patient.
Il existe de plus en plus d’évidence que des facteurs diététiques [29], du style de vie, cognitifs, émotionnels/comportementaux, ainsi que des facteurs psychosociaux peuvent tous jouer un rôle dans l’étiologie, le maintien et l’efficacité clinique des traitements pour les troubles gastro-intestinaux fonctionnels [30].
2. Diagnostic
Lors de l’évaluation des symptômes courants qui font l’objet de ce guideline, un diagnostic de trouble gastro-intestinal fonctionnel peut être posé si la symptomatologie du patient est compatible avec des critères diagnostiques déjà publiés concernant un trouble gastro-intestinal fonctionnel donné [31] en l’absence d’une anamnèse pouvant suggérer un diagnostic d’affection organique qui pourrait expliquer les symptômes (voir ci-dessous). L’âge et le sexe sont les variables cliniquement les plus significatives.
La responsabilité du diagnostic incombe habituellement uniquement au médecin et ceci exclut l’auto-assistance et l’intervention d’un pharmacien.
2.1 Symptômes gastro-intestinaux fonctionnels
La multitude des symptômes gastro-intestinaux fonctionnels peut être attribuée à quatre régions anatomiques majeures: oesophagienne, gastroduodénale, intestinale et anorectale:
o Douleurs thoraciques fonctionnelles
o Brûlures rétrosternales fonctionnelles
o Dysphagie fonctionnelle
- Symptômes gastroduodénaux:
o Dyspepsie fonctionnelle
• Dyspepsie de type ulcère
• Dyspepsie de type trouble de la motilité
• Dyspepsie non spécifique
o Aérophagie
o Syndrome de l’intestin irritable
o Constipation fonctionnelle
o Diarrhée fonctionnelle
o Ballonnement abdominal fonctionnel
o Douleurs abdominales chroniques
o Douleurs biliaires fonctionnelles
• Dyskinésie du sphincter d’Oddi
o Incontinence fonctionnelle
• Souillure fécale
• Incontinence fécale nette
o Douleurs anorectales fonctionnelles
• Syndrome des releveurs
• Proctalgie fugace
o Problèmes de défécation—dyschésie
Les sections suivantes (2.2 et 2.3) donnent des recommandations pour l’évaluation et le contrôle des quatre principaux symptômes traités dans ce guideline.
2.2 Types de plaintes—facteurs liés aux symptômes et aux patients
- Symptômes digestifs prédominant durant les épisodes—seuls ou en combinaison. Emplacement, description:
o Brûlures rétrosternales o Douleurs abdominales o Crampes abdominales o Gêne abdominale
• Ballonnement, distension, flatulence, autres plaintes en relation avec les gaz intestinaux
• Pesanteur abdominale, sentiment de tension, plénitude
o Troubles de la défécation
• Diarrhée
• Constipation
• Alternance de diarrhée et de constipation
• Selles avec excès de mucus
• Urgences
• Ténesme
o Autres
• Nausées
• Vomissements
• Selles noires avec un aspect de “goudron” (melaena)
• Sang frais sur les selles ou filets de sang et/ou mucus
- Facteurs concernant la durée
o Episode inaugural (début brutal)
o Durée de la symptomatologie—“ça se passe depuis combien de temps?”
o Durée des épisodes
o Fréquence (toujours, régulièrement, occasionnellement, par intermittence)
o Circonstances—en relation avec les repas, la posture, le moment de la journée, en relation avec la défécation, le cycle menstruel
- Caractéristiques des symptômes
o Sévérité—par exemple sur une échelle de 1 = basse à 10 = haute (1–4 légère, 5–7 modérée, 8–10 sévère)
o Niveau de souffrance (sur une échelle visuelle analogue)
o Effet sur:
• Les activités quotidiennes
• La vie sociale
• Le travail, la scolarité
• La possibilité de faire de l’exercice physique
• Les habitudes alimentaires
• Le sommeil
• La vie sexuelle
- Présence de symptômes non gastro-intestinaux, de comorbidités
o Maux de tête
o Fièvre
o Toux
o Perte de poids inexpliquée
o Relation avec des événements ne touchant pas le tractus digestif : la grossesse, la dysurie, la dyspareunie
o Autres symptômes non gastro-intestinaux et comorbidités psychologiques
- Facteurs en relation avec le patient
o Âge, sexe
o Style de vie—tabagisme, consommation d’alcool, nourriture/régime alimentaire, exercice physique, sommeil, stress, voyages
o Culture du patient, en ce qui concerne la nourriture et le régime alimentaire
o Savoir-faire du patient en matière de santé et comment ceci peut influencer son aptitude à l’auto-assistance
o Etat de santé—facteurs anamnestiques:
• Symptômes actuels et antérieurs, facteurs psychosociaux, anamnèse familiale
• Comorbidités—antérieures ou consécutives
• Médicaments sur ordonnance ou en vente libre, compléments alimentaires
- Mesures prises lors de la survenue des symptômes:
o Tentatives pour soulages les symptômes
o Automédication avec un ou plusieurs remèdes/médicaments
o Visite à une droguerie, un pharmacien, un magasin de diététique, un guérisseur ou un praticien en médecine complémentaire, un acupuncteur
o Consultation d’un médecin, d’un spécialiste
o Disponibilité ou non de médicaments en vente libre ou sur ordonnance
o Traitements non médicaux, non traditionnels, phytothérapie, acupuncture, etc.
o Attentes du patient
o Type de médicament(s) utilisés lors de la survenue de symptôme(s)
o Fréquence de la prise médicamenteuse, dosages
o Moment de la prise médicamenteuse—en tant que prévention, à la demande lors de la survenue des symptômes, ou de manière continue/»traitement de maintien »
o Efficacité et niveau de satisfaction, compte-rendu d’une modification de la symptomatologie, symptômes nouveaux, effets indésirables
o Durée des épisodes en présence ou en l’absence de prise médicamenteuse
o “Autre” prise médicamenteuse
- Compte-rendu de la symptomatologie
o Questionnaires Rome III à but diagnostique (cf. http://www.romecriteria.org/questionnaires)
o Manifestations comportementales (utilisation du comportement comme mode de communication—critères non relevants pour poser un diagnostic:
• Expression verbale ou non verbale des variations de l’intensité de la douleur
• Nécessité d’un rapport urgent lors de symptomatologie aigüe
• Minimisation ou déni d’un rôle de facteurs psychosociaux
• Demande de tests diagnostiques supplémentaires
• Focalisation sur une guérison totale
• Recherche fréquente de soins
• Faible prise de responsabilité personnelle en ce qui concerne l’autogestion
• Demande d’analgésiques de type narcotique
- Contexte médical épidémiologique
o Taux de base d’infections par Helicobacter pylori, cancer gastrique, oesophage de Barrett et adénocarcinome de l’oesophage
o Facilité d’accès aux moyens diagnostiques et thérapeutiques
2.3 Examens diagnostiques pour les symptômes gastro-intestinaux fonctionnels
- Examen physique
- Tests de laboratoires de base:
o Formule sanguine complète (FSC)
o Vitesse de sédimentation (VS) / protéine C-réactive (PCR)
o Examens biochimiques
o Sang occulte dans les selles (patient âgé de > 50 ans)
o Test de grossesse
o Tests hépatiques
o Calprotectin ou autre examen des selles afin de détecter une maladie inflammatoire de l’intestin (MICI) chez les patients avec un éventuel MICI, mais chez qui une telle maladie serait possible; se fait d’office dans beaucoup de cabinets de médecine de premier recours (au Royaume Uni)
o Sérologie pour la maladie coeliaque ; se fait d’office dans les régions à haute prévalence pour la maladie coeliaque
o Examen des selles pour oeufs et parasites
o Anomalies macroscopiques
o Biopsie, histologie
- pH-métrie de 24 heures (48–72 heures si utilisation de la capsule Bravo) pH oesophagien ou impédance pH-métrie de 24 heures: mesure de l’exposition à l’acide dans l’oesophage et évaluation de la relation dans le temps entre les symptômes de brûlures rétrosternales et les épisodes de reflux acide
- Manométrie
o Etude de la motilité oesophagienne, manométrie à haute résolution
o Manométrie anorectale
o Examen baryté gastro-intestinal—examen en double contraste, repas baryté, transit suivi, entéroclyse
o Lavement baryté en double-contraste
o Ultrasonographie abdominale
o Tomographie computérisée abdominale (CT scan abdominal), imagerie par résonnance magnétique de l’abdomen (IRM abdominal)
o Tests à l’hydrogène expiré (breath tests): au lactose, au glucose, au fructose [32]
o Elimination alimentaire, suivi d’un test de provocation avec des composants diététiques spécifiques ; peut être considéré comme test diagnostique
o Essai thérapeutique par suppression de l’acide (test avec inhibiteur de la pompe à protons (IPP)) chez des patients avec des brûlures rétrosternales ou d’autres symptômes pouvant être en relation avec un reflux d’acide
o Allergies ou intolérances alimentaires, intolérance au lactose, infiltrats à éosinophiles
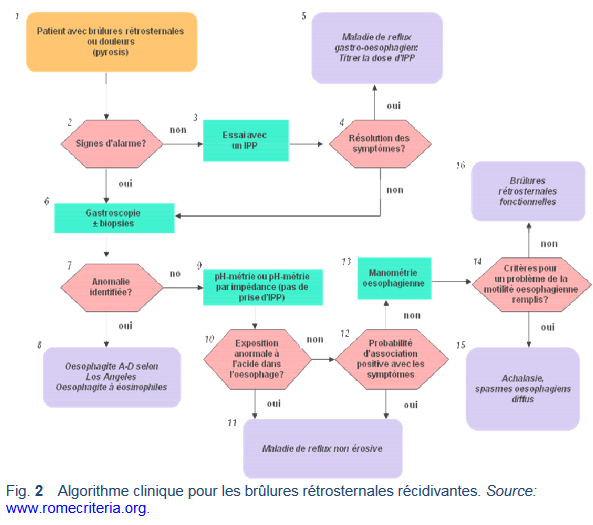
3. Brûlures rétrosternales
Il faut souligner que tous les symptômes gastro-intestinaux courants ne sont pas tous d’origine fonctionnelle. Ceci est particulièrement le cas pour les brûlures rétrosternales. La plupart des patients présentant des brûlures rétrosternales souffre d’une maladie de reflux gastro-oesophagien, avec ou sans lésions visibles de la muqueuse oesophagienne. Selon le consensus Rome III, même les patients sans lésion visible endoscopiquement mais avec des brûlures rétrosternales reçoivent un diagnostic de maladie de reflux pourvu qu’il existe des preuves qu’un reflux du contenu gastrique soit à l’origine de leur symptomatologie. On parle alors de maladie de reflux non érosive. Ces patients ne souffrent pas d’une maladie gastro-intestinale fonctionnelle. Ce n’est que lorsque les brûlures rétrosternales sont présentes en absence de lésion de la muqueuse, en absence d’une exposition anormale de l’oesophage à l’acidité, et en absence d’une association positive entre les symptômes et les épisodes de reflux lors d’un monitoring du reflux, et que les brûlures rétrosternales ne répondent pas à un traitement par un inhibiteur de l’acide et qu’un diagnostic de brûlures rétrosternales fonctionnelles peut être posé [33].
3.1 Définition et description
- Les brûlures rétrosternales (connues également sous le nom « pyrosis ») sont caractérisées par une sensation de brûlures ou de chaleur dans la région rétrosternale pouvant s’étendre vers le cou, la gorge et le visage
- Les brûlures rétrosternales peuvent également coexister avec d’autres symptômes du tractus gastro-intestinal haut.
- Elles peuvent s’accompagner par deS régurgitationS d’un liquide aigre/ayant un goût d’acide ou du contenu gastrique dans la bouche.
- Typiquement les symptômes sont intermittents et peuvent survenir:
o précocement pendant la période postprandiale
o pendant l’exercice physique
o en décubitus
o pendant la nuit
- Dans la pratique, il n’y a peut-être pas de différentiation franche entre les symptômes d’une maladie de reflux gastro-oesophagien et une “dyspepsie”—en effet, les données de l’étude Diamond [34] mettent en question la notion de brûlures rétrosternales et le reflux en tant que symptômes indicatifs d’une maladie de reflux gastro-oesophagien (GERD).
3.2 Epidémiologie
- Dans les pays occidentaux, plus d’un tiers de la population générale souffre de brûlures rétrosternales, environ un dixième de façon quotidienne.
- Aux Etats-Unis, il est estimé qu’environ 60 millions d’adultes souffrent de brûlures rétrosternales ou prennent un médicament afin de soulager de tels symptômes une fois par mois. Il est estimé qu’environ 15 millions d’adultes souffrent de brûlures rétrosternales de façon quotidienne.
- Il est généralement considéré que la maladie de reflux gastro-oesophagien (GERD) est moins fréquente en Asie que dans les pays occidentaux. Il existe cependant plusieurs études de population qui ont montré une prévalence de plus de 10% [35]. Dans des études comparatives, le taux de symptômes et la prévalence de l’oesophagite érosive sont plus élevés dans les pays occidentaux [36,37]. Il règne une certaine confusion en ce qui concerne l’interprétation des symptômes gastro-intestinaux hauts. Le terme “pyrosis” n’a aucun équivalent dans beaucoup de langues asiatiques—les patients asiatiques peuvent de ce fait percevoir et décrire les brûlures rétrosternales (pyrosis) comme étant des douleurs de la poitrine. Les “gaz”—désignant l’éructation ou la distension avec un sentiment de devoir roter—représentent la plainte principale de beaucoup de patients souffrant d’une maladie de reflux gastro-oesophagien aussi bien que d’autres « maladies » gastro-oesophagiennes hautes [35,38]. Un diagnostic basé uniquement sur les symptômes de reflux peut se révéler trompeur. Dans les populations avec une prévalence élevée d’infection à H. pylori, une partie appréciable des patients souffrant d’une maladie de reflux gastro-oesophagien souffre également d’une maladie ulcéreuse de l’estomac concomitante. Un traitement empirique basé uniquement sur des symptômes « typiques » de maladie de reflux gastro-oesophagien peut se révéler inadéquat [39]. La prévalence de la dyspepsie parmi les populations des pays orientaux est essentiellement la même que dans les pays occidentaux [40]. En ce qui concerne la gastroscopie, beaucoup de patients asiatiques sont rassurés (“plus satisfaisant”) par une endoscopie négative que par une stratégie de « traitement d’épreuve » pour une infection à H. pylori [41]. Une autre étude a montré cependant un niveau de satisfaction élevé avec un traitement empirique avec des inhibiteurs de la pompe à protons (IPP) [42]. Le modèle de présentation des affections digestives hautes est effectivement en train de se modifier en Asie, avec moins de maladie ulcéreuse et davantage d’oesophagite de reflux (mais cependant toujours avec une prévalence moindre qu’en Europe ou en Amérique du Nord) et également avec une diminution du taux de cancer gastrique [43,44].
3.3 Diagnostic/symptômes
- Il est important de déterminer si les symptômes de brûlures rétrosternales sont liés à l’acide ou non.
o Le moyen le plus simple est de définir la réponse à un traitement par antacides et inhibition de la sécrétion acide (ou aux alginates).
o Une pH-métrie de 24 heures (48–72 heures avec la capsule oesophagienne Bravo) ou une pH-métrie par impédance peuvent être effectuées afin d’évaluer la présence d’acide dans l’oesophage et de montrer une association dans le temps entre les brûlures rétrosternales et les épisodes de reflux.
- Les patients avec symptômes d’une maladie de reflux gastro-oesophagien qui ne montrent pas de réponse à un inhibiteur de la pompe à protons (IPP) et chez qui une endoscopie est négative, sans évidence pour un reflux d’acide à l’origine de leurs symptômes, devraient recevoir un diagnostic de brûlures rétrosternales fonctionnelles [45].
- Les critères Rome III pour diagnostiquer des brûlures rétrosternales fonctionnelles sont:
o Une gêne rétrosternale de type « brûlure » ou douleur
o Evidence qu’un reflux gastro-oesophagien n’est pas à l’origine de la symptomatologie
o Absence d’une maladie oesophagienne confirmée histologiquement
o Les critères sont remplis pendant les 3 mois précédents, avec un début de la symptomatologie au moins 6 mois avant le diagnostic
- Les douleurs ou une gêne épigastriques qui ne montent pas jusqu’à un niveau rétrosternal ne devraient pas s’appeler brûlures rétrosternales.
- Une infection à H. pylori ne joue aucun rôle causal dans les brûlures rétrosternales et la maladie de reflux gastro-oesophagien et il n’y a donc aucune indication à rechercher une telle infection.
- Des symptômes atypiques pour une maladie de reflux gastro-oesophagien peuvent survenir. Ces symptômes incluent des douleurs thoraciques, pouvant faire penser à une cardiopathie ischémique, de la toux ou autre symptôme respiratoire pouvant évoquer un asthme, des troubles laryngés, comme conséquence d’une aspiration bronchique de matériel ayant reflué dans l’oesophage ou d’un reflexe entre oesophage distal et poumons.
- Chez les patients ne répondant pas à un traitement d’IPP, il peut s’avérer utile d’effectuer une pH-métrie par impédance pour arriver à un diagnostic. Ceci peut également permettre de rechercher d’autres causes potentielles aux symptômes, telles une hypersensibilité oesophagienne qui pourrait ensuite être traitée convenablement.
3.4 Diagnostic différentiel
- Maladie de reflux gastro-oesophagien—oesophagite, œsophage de Barrett, maladie de reflux non érosive
- Achalasie
- Spasmes oesophagiens diffus
- Oesophagite à éosinophiles
- Autre pathologie thoracique
3.5 Signes d’alarme
- Dysphagie—difficultés à la déglutition
- Odynophagie—douleurs à la déglutition
- Symptômes bronchiques récidivants, pneumonie par aspiration
- Dysphonie, toux récidivante Hémorragie gastro-intestinale Existence d’une anémie ferriprive
- Perte de poids involontaire progressive
- Lymphadénopathie
- Masse épigastrique
- Début de brûlures rétrosternales à un âge > 50–55 ans
- Anamnèse familiale d’adénocarcinome oesophagien [46]
3.6 Brûlures rétrosternales—algorithme de la prise en charge
- Les brûlures rétrosternales occasionnelles/intermittente n’ont habituellement aucun impact durable.
- Les douleurs et la gêne occasionnées par les brûlures rétrosternales, si elles sont fréquentes, peuvent sévèrement limiter l’activité quotidienne, l’efficacité au travail, le sommeil et la qualité de vie.
- Une prise en charge efficace et un monitoring peuvent permettre de maîtriser la symptomatologie et ainsi éviter des complications (par exemple les sténoses peptiques) dans la majorité des cas.
- Les remèdes “anciens” plus simples peuvent s’avérer utiles:
o Un reflux occasionnel peut être traité convenablement avec des antacides.
o Les patients devraient éviter de consommer les aliments qui semblent déclencher les symptômes—par exemple le chocolat, le café, les aliments gras.
o Utiliser le chewing gum peut augmenter la production de salive et de ce fait neutraliser partiellement l’effet de l’acide.
o Elever la tête du lit à l’aide de livres ou de briques peut s’avérer utile pour les brûlures rétrosternales nocturnes.
o Les inhibiteurs des récepteurs H2 (anti-H2) représentent un traitement en vente libre efficace et utilisé à large échelle.
- Bien que très sûrs, il existe des études qui suggèrent des problèmes de sécurité à long-terme avec les IPP [47].
o La plupart des patients avec des brûlures rétrosternales occasionnelles n’ont pas besoin d’un traitement par IPP à vie et pour eux ces problèmes de sécurité à long-terme n’entrent donc pas en ligne de compte.
o Par contre, les patients qui nécessitent un traitement à long terme à haute dose devraient bénéficier d’un suivi.
o Les IPP faiblement dosés sont maintenant à disposition en vente libre dans beaucoup de pays.
- Abus d’IPP—chez les patients qui ont besoin d’une suppression d’acide à long terme, il est important de vérifier que l’indication à celle-ci est adéquate et l’utilisation à long terme devrait régulièrement faire l’objet d’une réévaluation.
- Chez les patients avec des brûlures rétrosternales fonctionnelles, la réponse à un traitement inhibiteur de l’acide est minime ou absente et ces patients risquent d’être adressés à un chirurgien afin de traiter leur maladie de reflux gastro- oesophagien. Il est donc nécessaire de pratiquer une pH-métrie de 24 heures chez ces patients afin d’exclure des brûlures rétrosternales fonctionnelles [45].
3.6.1 Auto-assistance pour les brûlures rétrosternales
Critères d’exclusion pour l’auto-assistance [48]:
o Brûlures rétrosternales sévères ou nocturnes depuis > 3 mois
o La symptomatologie persiste après un essai de traitement de 2 semaines avec un anti-H2 ou un IPP en vente libre
o La symptomatologie persiste même sous prise d’un anti-H2 ou d’un IPP sur ordonnance médicale
- Apparition soudaine de brûlures rétrosternales à un âge > 50–55 ans
- Dysphagie ou odynophagie
- Signes d’hémorragie gastro-intestinale: vomissements de sang frais ou « marc de café » ou selles noires (méléna), anémie, carence en fer
- Symptomatologie faisant suspecter une laryngite: enrouement, râles, toux ou étouffement
- Perte pondérale involontaire
- Nausées, vomissements, diarrhées en continu
- Symptomatologie faisant suspecter une douleur thoracique d’origine cardiaque: irradiation dans l’épaule, le bras, la nuque, la mâchoire, accompagnée d’un essoufflement, d’une transpiration
- Femmes enceintes ou allaitant
- Enfant de < 12 ans (antacides/anti-H2), de < 18 ans (IPP)
Prise en charge:
- Facteurs déclenchants—identifier les aliments ou les comportements qui servent le plus souvent comme facteur déclenchant; éviter ces facteurs déclenchants afin de diminuer le risque d’avoir des symptômes d’un reflux d’acide
- Style de vie:
o Perdre du poids en cas de surcharge pondérale; ceci représente la mesure la plus importante en ce qui concerne le style de vie
o Eviter le tabac, le café, l’alcool, les boissons gazeuses, le chocolat, la menthe, les aliments gras ou la friture, les agrumes ou leur jus, les produits à base de tomates, l’ail ou l’oignon, les mets épicés
o Petits repas fréquents
o Elever la tête du lit de 20–25 cm sur des briques ou des billes
o Eviter la prise d’aliments ou de liquides dans les 3 heures avant d’aller se coucher
- Options d’auto-assistance—la disponibilité peut varier entre les différents pays:
o Antacides—à recommander pour l’usage à court-terme ou par intermittence
• Les antacides simples permettent de neutraliser l’acide gastrique—par exemple, sels de sodium, calcium, magnésium et d’aluminium
• Les alginates, avec l’acide alcinique combiné à de petites doses d’antacides: effet tampon minime
o Diminution de la sécrétion gastrique acide
• Anti-H2—efficace jusqu’à 10 heures
• IPP—efficaces jusqu’à 24 heures
o Vidange gastrique—les procinétiques permettent de diminuer le reflux gastro-oesophagien, mais il n’existe que peu de médicaments pour une utilisation clinique et leur efficacité n’a été trouvée que modeste lors d’études cliniques. Eviter le métoclopramide.
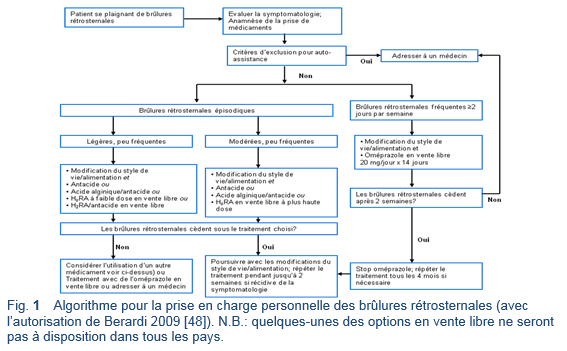
o Les buts de l’auto-médication sont de faire disparaître la symptomatologie et de rétablir une qualité de vie optimale, tout en utilisant le traitement le plus efficace en termes de coûts.
o En cas de soulagement insatisfaisant ou incomplet, les patients devraient s’adresser à un professionnel de la santé afin de subir une évaluation à but diagnostique.
3.6.2 Pharmacien
- Il faut rechercher d’éventuels médicaments pouvant provoquer des brûlures rétrosternales:
o Bisphosphonates, aspirine/anti-inflammatoires non stéroïdiens (AINS), fer, potassium, quinidine, tétracycline
o Zidovudine, agents anticholinergiques, antagonistes alpha-adrénergiques, barbituriques
o Agonistes β2-adrénergique, inhibiteurs calciques, benzodiazépines, dopamine
o Oestrogènes, analgésiques narcotiques, nitrates, progestérone, prostaglandines, théophylline
o Antidépresseurs tricycliques, chimiothérapie
o S’il existe une prise de tels médicaments, il faut suggérer au patient de s’adresser à un médecin généraliste/de famille
o Eviter les AINS, les suppléments en potassium, les bisphosphonates et autres médicaments potentiellement responsables.
o En plus des mesures de style de vie et diététiques, il faut également considérer un traitement de sels d’aluminium, de sels de magnésium, de sels de calcium, de sels d’aluminium et de magnésium en combinaison, d’alginates, ou d’antacides/anti-H2 ou IPP (au dosage disponible en vente libre).
- Signes d’alarme et suivi:
o Adresser le patient à un médecin s’il est âgé de > 60 ans ou s’il est âgé de 50–60 avec des facteurs de risque connus pour un cancer (par ex. tabac, alcool, obésité).
o En l’absence d’amélioration dans les deux semaines, adresser le patient à un médecin généraliste/médecin de famille.
3.6.3 Médecin de premier recours
o Anamnèse, status de santé, médicaments, âge
o Allergies, anamnèse familiale d’allergies alimentaires ou d’oesophagite à éosinophiles, d’angioedème héréditaire ; à distinguer des intolérances alimentaires
o Symptômes, durée, fréquence, situation, médicaments
o Signes d’alarme
o Evaluer la réponse à un traitement avec les IPP.
o Il n’existe pas de données qui suggèrent que le fait d’augmenter la dose des IPP pourrait être utile en présence d’une réponse inadéquate à la dose standard. Prendre l’IPP 2 x par jour 30 minutes avant les repas peut cependant augmenter la réponse au traitement chez certains patients. Les augmentations “aveugles” des doses d’IPP contribuent grandement à l’augmentation des coûts de la santé.
o Toute consommation de nourriture ou de boisson après le dernier repas du jour est à déconseiller—pas de boisson avant le coucher.
o Si le traitement s’avère efficace, réduire la dose au niveau qui est toujours efficace.
o Si le traitement échoue, penser à effectuer une endoscopie.
o Prélever des biopsies en présence de lésion macroscopique, si le patient présente une dysphagie, ou si une infection à H. pylori ou une oesophagite à
éosinophiles entrent en considération.
o Proposer un contrôle annuel aux patients nécessitant un traitement à long terme pour leurs symptômes.
o En l’absence de signes d’alarme, il n’est pas nécessaire de faire une endoscopie de routine ; par contre, chez les patients de >55 ans présentant une dyspepsie inexpliquée, persistante ou à début brutal, une endoscopie d’urgence s’impose.
o Dans les régions avec une incidence élevée de cancer gastrique, il faut envisager d’effectuer une endoscopie précoce.
3.6.4 Spécialiste
Ce guideline n’entre pas en matière en ce qui concerne la prise en charge des brûlures rétrosternales par un spécialiste et le lecteur peut s’informer en consultant les derniers guidelines sur la prise en charge de la maladie de reflux gastro-oesophagien [49,50].
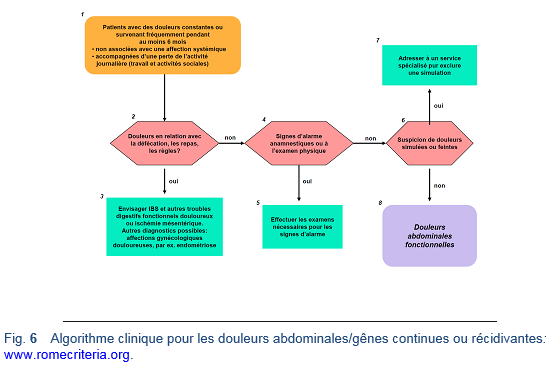
4. Douleur / gêne abdominales
4.1 Définition et description
- Une douleur ou une gêne désagréable localisée ou diffuse dans l’abdomen.
- La dyspepsie (ou indigestion) consiste en une douleur chronique ou récidivante dans l’abdomen supérieur, accompagnée d’une sensation de réplétion et une satiété précoce en mangeant. Elle peut s’accompagner de ballonnement, d’éructations, de nausée ou de brûlures rétrosternales. La dyspepsie est fréquemment associée avec la maladie de reflux gastro-oesophagien et peut représenter le premier symptôme d’une malade ulcéreuse et occasionnellement d’un cancer gastrique.
4.2 Epidémiologie
- Plusieurs études ont fait état d’une prévalence de douleurs/crampes abdominales de 10–46% dans la population générale [4].
- La prévalence est plus élevée chez les femmes que chez les hommes, et cela dans tous les groupes d’âge.
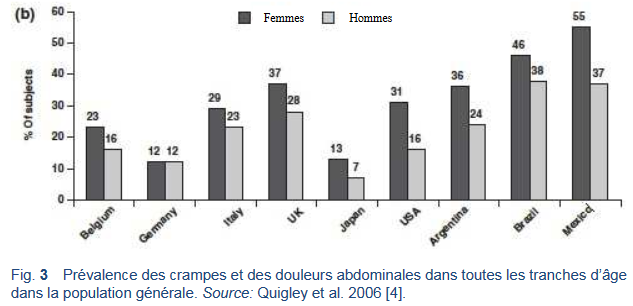
- Il existe des différences culturelles considérables dans la manière de percevoir le concept du syndrome de l’intestin irritable et dans les termes utilisés pour décrire les symptômes qui surviennent pendant une crise/un épisode. Bien que les douleurs/crampes abdominales—et à un degré moindre le ballonnement, la diarrhée et la constipation—sont typiquement perçus comme les symptômes les plus gênants, les taux de prévalence pour ces symptômes varient considérablement entre les différents pays. Ces variations peuvent également refléter des différences dans la culture, la langue ou l’expression, ce qui rend leur interprétation problématique. En particulier, la prévalence de crampes/douleurs abdominales, et la prise médicamenteuse et l’utilisation de médicaments en vente libre et d’antispasmodiques en particulier sont toujours hautes dans la population générale dans différents pays. D’autre part, il existe des variations considérables au sein des mêmes pays dans la nomenclature utilisée pour décrire les symptômes, aussi bien que pour la fréquence, la sévérité, l’impact sur le patient et sa réponse aux mêmes symptômes [4].
4.3 Diagnostic/symptômes
- Les douleurs abdominales accompagnées de troubles de la défécation sont habituellement appelées syndrome de l’intestin irritable [51,52].
- Les critères de diagnostic Rome III pour les douleurs abdominales fonctionnelles sont:
o Douleurs abdominales continues ou presque continues.
o Aucune relation ou seulement occasionnellement entre la douleur et les évenèments physiologiques (par exemple, l’alimentation, la défécation, les règles).
o Une certaine diminution dans les activités de tous les jours.
o La douleur n’est pas simulée.
o Il n’existe trop peu de symptômes pour remplir les critères diagnostiques pour une autre affection gastro-intestinale fonctionnelle qui pourrait expliquer la douleur.
o Les critères ont été remplis pendant les 3 mois précédents, avec un début de la symptomatologie au moins 6 mois avant de poser le diagnostic.
4.4 Diagnostic différentiel
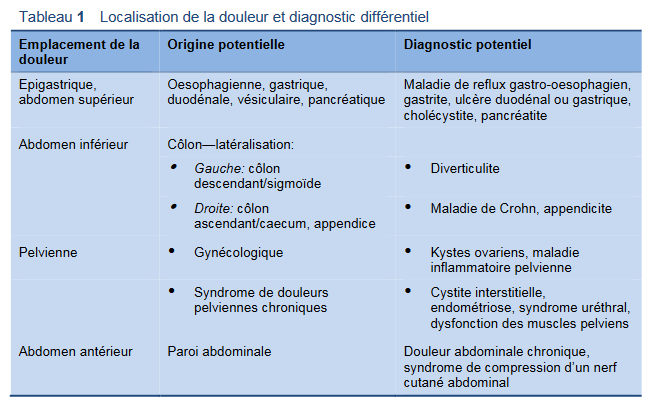
- Les causes de douleurs abdominales sont multiples. Nous allons nous concentrer ici sur les causes fréquentes des douleurs abdominales chroniques avec la douleur/la gêne comme caractéristique principale. Il faut cependant garder à l’esprit qu’il existe des maladies gastro-intestinales spécifiques qui peuvent être à l’origine de douleurs abdominales aiguës sévères: par exemple l’appendicite, un ulcère peptique perforé, une hernie étranglée, une diverticulite, une obstruction du grêle et du côlon, une thrombose de l’artère mésentérique supérieure, une pancréatite et une cholécystite.
- Syndrome de l’intestin irritable (IBS)—les douleurs abdominales sont associées avec la défécation et entraînent des selles fréquentes molles ou des selles dures peu fréquentes avec un soulagement à la défécation.
- Infections gastro-intestinales—diarrhées et vomissements sont les symptômes principaux ; la douleur, typiquement sous forme de crampes, peut également être présente.
- Intolérances alimentaires spécifique—FODMAP, lactose [32,53,54]. Les FODMAP sont des glucides et des monosaccharides peu absorbés et comprennent également fructans, galactans, fructose et polyols; l’acronyme FODMAP signifie: F: fermentissibles; O: oligosaccharides; D: disaccharides; M: monosaccharides; A: and; P: polyols.
- Dyspepsie fonctionnelle ou douleurs épigastriques (EPD): la douleur, intermittente, est localisée dans l’épigastre et ne remplit pas les critères d’une maladie de la vésicule biliaire ou d’une dysfonction du sphincter d’Oddi.
- Ulcère peptique: les taux restent élevés dans de nombreux pays à cause de l’infection par H. pylori et de l’utilisation de l’acide acétylsalicylique (ASA) et des AINS.
- Constipation non reconnue. Maladie coeliaque.
- Congestion/tuméfaction hépatique de toute nature—par exemple, insuffisance
- cardiaque droite, stéatose, hépatite.
- Maladie inflammatoire intestinale, en particulier maladie de Crohn.
- Ischémie mésentérique chronique (chez les patients plus âgés): la douleur est aggravée par la prise de nourriture (angor intestinal) et est disproportionnée par rapport aux constations de l’examen physique; un début brutal chez les patients plus âgés, une anamnèse de maladie vasculaire, une symptomatologie de nausées, vomissements et perte pondérale importante ; une diarrhée peut également être présente.
- Maladie gynécologique—douleurs associées aux règles et aggravées par celles-ci; il faut garder en mémoire que le syndrome de l’intestin irritable est souvent aggravé par les règles. Les causes gynécologiques de douleurs/gênes abdominales chroniques récidivantes sont: une endométriose, des ménometrorragies fonctionnelles, une maladie inflammatoire du plancher pelvien et un cancer ovarien (peut simuler une IBS ou une dyspepsie et peut être difficile à détecter). Une rupture de kyste ovarien ou une grossesse ectopique peuvent se présenter sous forme de douleurs abdominales aiguës. Un examen gynécologique s’impose et éventuellement un ultrason pelvien et/ou un contrôle chez le gynécologue.

4.5 Signes d’alarme
- Anomalie à l’examen physique
- Perte pondérale involontaire progressive Âge au début de la symptomatologie Hémorragie gastro-intestinale
- Anamnèse familiale de cancer abdominal
- Examens de laboratoire pathologiques: anémie, hypoalbuminémie, tests hépatiques pathologiques, vitesse de sédimentation ou protéine C-réactive élevées, sang occulte dans les selles
- Symptomatologie inaugurale sans facteur déclenchant
4.6 Douleurs/gêne abdominales—algorithme de prise en charge
- La prévalence, la sévérité, le recours aux soins et la prise de médicaments en relation avec les crampes/douleurs abdominales sont élevés, mais varient considérablement entre les différents pays [4]. Aux Etats-Unis et en Amérique latine, l’utilisation de médicaments pour les douleurs abdominales est plus importante qu’en Europe (90% versus 72%). Les traitements les plus utilisés en Amérique Latine et en Italie sont les antispasmodiques, et en Allemagne et au Royaume Uni, les antacides. La prise de médicaments a permis de diminuer la durée des épisodes (par jusqu’à 81% au Brésil).
- Le plus souvent, un médicament est utilisé à la demande pour soulager un épisode de douleurs. Dans un rapport sur les attentes en ce qui concerne les traitements, “un soulagement rapide” a été désigné comme le facteur le plus important, suivi de “hautement efficace” et “bien toléré.” La choix du médicament était le plus souvent déterminé par un médecin (dans environ 50% des cas), suivi par les conseils d’amis, de parents ou d’autres malades. La publicité pour les médicaments ne semblait jouer qu’un rôle mineur (0–6%), sauf aux Etats-Unis (18%) [5].
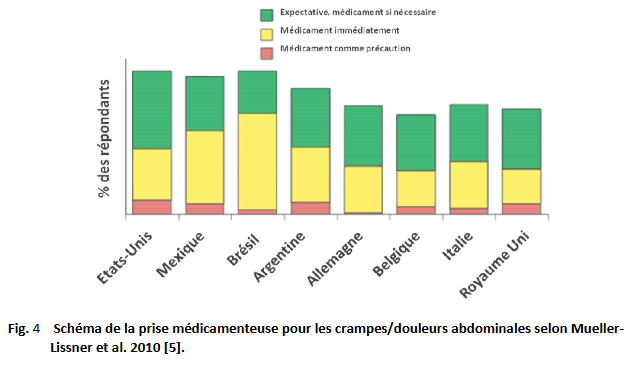
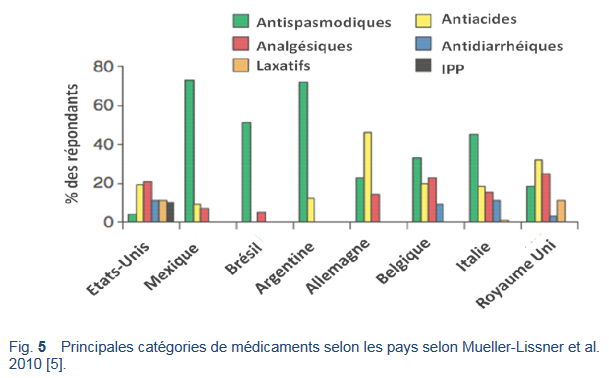
- Il est inquiétant de noter que pendant les dix ans de la période 1997–2008, les prescriptions d’opioïdes pour les douleurs abdominales chroniques ont plus que doublé aux Etats-Unis [55]. Aucune étude n’a démontré que les opioïdes sont efficaces dans le traitement des douleurs abdominales chroniques; de plus, l’utilisation à long terme d’opioïdes peut provoquer une aggravation d’autres symptômes gastro-intestinaux, en particulier la constipation, les nausées et les vomissements, et peut entraîner une dépendance.
4.6.1 Auto-assistance pour les douleurs/la gêne abdominales
- Signes d’alarme nécessitant une prise en charge médicale plutôt qu’une auto-assistance:
o Persistance de la symptomatologie malgré un traitement complet par des médicaments sur ordonnance ou en vente libre
o Vomissements
o Perte pondérale involontaire
o Augmentation de la symptomatologie, interferant avec l’activité quotidienne du patient
- Consulter un médecin immédiatement en cas de:
o Douleurs tout d’abord dans l’ensemble de l’abdomen mais qui se localisent dans un endroit précis, surtout dans le quadrant inférieur droit
o Douleurs accompagnées par une fièvre de >38.3 °C ou >101 °F
o Douleurs associées à une impossibilité d’uriner, d’aller à selle ou d’évacuer les gaz
o Douleurs sévères, évanouissement, impossibilité de se déplacer
o Douleurs qui semblent avoir leur origine au niveau des testicules
o Douleurs thoraciques irradiant dans le cou, la mâchoire, les bras, accompagnées d’essoufflement, de faiblesse, d’un pouls irrégulier ou de
sudations
o Nausées, vomissements ou diarrhées en continu
o Malaise/douleurs extrêmes dans l’abdomen
o Vomissement de sang ou de « marc de café »
o Selles noires ou sanglantes
- Auto-médication/auto-assistance
o Pour les diarrhées ou la constipation, prise de médicaments en vente libre si nécessaire
- Changements dans le style de vie et des habitudes alimentaires
4.6.2 Pharmacien
o Le traitement standard actuel pour le syndrome de l’intestin irritable consiste en général à traiter les symptômes avec des médicaments pour soulager les douleurs, la constipation et/ou les diarrhées [51,52].
o Les dernières données à disposition tendent à suggérer qu’une recherche d’intolérances alimentaires spécifiques serait utile [32,53,54].
o D’autres stratégies diététiques peuvent également s’avérer bénéfiques, telles une augmentation de l’apport de fibres dans l’alimentation en présence d’une constipation ou la prise d’un probiotique connu pour son efficacité dans le traitement du syndrome de l’intestin irritable.
o Les antacides et les IPP sont probablement inappropriés pour le traitement de crampes/douleurs abdominales [5]—bien que les laxatifs puissent provoquer des crampes, ils sont efficaces afin de diminuer les douleurs chez les patients avec une constipation opiniâtre.
4.6.3 Médecin de premier recours
o Adresser les patients âgés de >50 ans avec des signes d’alarme pour une endoscopie haute et/ou basse (selon les circonstances): perte pondérale, anémie, hématémèse, méléna, sang rouge sur les selles
o Anamnèse du patient
o Examen physique—palpation légère et profonde, auscultation, percussion, examen rectal ou pelvien, du pénis et des testicules, chercher les signes de déshydratation et d’ictère
o Evaluation psychosociale—anamnèse de syndrome de stress post- traumatique (PTSD), maltraitance physique ou psychosociale, somatisation, anxiété, dépression, relations familiales et de son mode de fonctionnement
o Tests de laboratoire standard—formule sanguine complète à la recherche d’une anémie ou d’une infection, électrolytes sanguins, créatinine et urée à la recherche d’une origine métabolique; tests hépatiques, lipase et amylase, en particulier chez les patients avec des douleurs abdominales hautes; marqueurs de l’inflammation; analyse urinaire et culture urinaire afin d’exclure une infection du tractus urinaire et une cystite interstitielle; sang occulte dans les selles (patient > 50 ans); sérologie pour une maladie coeliaque; calprotectine
o Examens complémentaires—cultures de selles, œufs et parasites et sérologie pour Giardia afin de pouvoir identifier toute cause bactériologique, parasitaire ou protozoaire; test de grossesse dans l’urine et dans le sang; recherche d’une infection par H. pylori chez les patients avec des symptômes gastro-intestinaux hauts (selon la prévalence et la disponibilité des moyens de test—par exemple, test respiratoire à l’urée, antigène fécal ou sérologie); dans certains cas en présence de douleurs pelviennes et abdominales basses: prélèvement vaginal, frottis, hormone chorionique gonadotrope humaine (hCG), antigène prostatique spécifique (PSA), et cytologie urinaire
o Traitement symptomatique:
• Anti-muscariniques
• Menthe
• Changements diététiques—FODMAPs, régimes sans lactose/fructose
• Autres médicaments: antidépresseurs tricycliques (TCAs) ou inhibiteurs sélectifs de la recapture de la sérotonine (SSRI)
o Chez les patients avec des douleurs abdominales fonctionnelles (FAPD) utilisation de narcotiques peut conduire au développement d’un syndrome du côlon dû aux stupéfiants (narcotic bowel syndrome)—caractérisé par l’utilisation en augmentation des stupéfiants pour le soulagement de la douleur et, paradoxalement, par le développement d’une hyperalgésie
o Réévaluation après un traitement symptomatique de 3–6 semaines
o Penser à utiliser le questionnaire Rome III Psychosocial Alarm
Questionnaire for Functional Gastrointestinal Disorders afin de pouvoir
identifier d’éventuelles marqueurs de troubles psychosociaux graves [56]
o Autres examens diagnostiques—tests de laboratoire et radiologiques
o Adresser le patient à un gastro-entérologue [57], à une consultation de la douleur
4.6.4 Specialiste
5. Ballonnement
5.1 Définition et description
- Le ballonnement, la plénitude postprandiale et la distension sont des entités imprécises et difficiles à définir ; le ballonnement est décrit comme « un sentiment de pression intra-abdominale augmentée ».
- Questions de langue:
o En anglais, le ballonnement et la distension sont différenciés l’un de l’autre: le ballonnement est considéré comme un symptôme tandis que la distension représente une distension observable et mesurable de l’abdomen. Dans plusieurs autres langues, telle l’espagnol, il n’est pas possible de faire une telle différentiation.
o Dans les pays occidentaux, « satiété précoce » se réfère à un sentiment de trop-plein très vite après avoir commencé à manger, disproportionné par rapport à la quantité de nourriture ingérée. En revanche, « ballonnement » fait allusion à un sentiment de plénitude sans aucune relation avec une prise alimentaire pouvant expliquer une telle sensation.
- Les patients ont souvent de la peine à décrire ce qu’ils veulent dire exactement par le terme de “ballonnement” et ils peuvent utiliser divers termes: “besoin de desserrer les vêtements,” “distension visible de l’abdomen,” “sentiment inconfortable de trop-plein.”
- Symptômes associés pouvant être présents chez certains patients—excès de flatulences, rots fréquents (éructations), et gargouillements (borborygmes).
- Dans les maladies gastro-intestinales fonctionnelles, le ballonnement est typiquement diurne (pas de ballonnement au réveil, péjoration en fin de journée) et peut presque être considéré comme facteur diagnostic d’affection gastro- intestinale fonctionnelle (FGID), tandis que lorsque qu’il est constant il devrait être considéré comme un signe d’alarme—pouvant, par exemple, faire penser à un cancer ovarien ou à une ascite.
- Son étiologie est complexe et peut comporter plusieurs éléments: accumulation de gaz, mouvements anormaux du diaphragme et de la paroi intestinale, hypersensibilité viscérale, etc. Le tour de taille du patient peut être augmenté ou non (i.e., une vraie distension), même si le patient le ressent ainsi et en est convaincu. Parfois le/la patient(e) peut même ressentir le besoin de desserrer son pantalon ou sa jupe en raison de la distension.
- Le ballonnement peut être très ennuyeux et peut entraver la vie quotidienne et la distension peut constituer une gêne si elle survient fréquemment.
- Les gaz dans le tractus digestif supérieur sont le plus souvent le résultat d’une aérophagie ou de l’air contenu dans les aliments ou les boissons; les gaz dans le tractus digestif inférieur peuvent également être le résultat d’une fermentation (H2 et CO2).
5.2 Epidémiologie
- Le ballonnement abdominal est un symptôme très courant qui affecte 10–30% de la population adulte générale.
- Dans une étude menée dans les ménages aux Etats-Unis, 16% de la population faisait état de ballonnement ou de distension, et les trois-quarts les estimaient comme modérés à sévères. Près de la moitié des personnes (43%) mentionnaient une prise de médicament pour soulager la symptomatologie [1]. Dans une étude menée en Iran la population générale faisait état d’une prévalence de 2–9% pour le ballonnement, 96% des patients avec un syndrome de l’intestin irritable décrivaient un ballonnement et 60% le considéraient comme le symptôme le plus gênant. Deux études faisaient état d’une prévalence de ballonnement de 2% et de 10% selon les critères Rome III et Rome II, respectivement [58].
- Dans une étude menée au Canada, 5% de la population (2.3% des hommes et 7.9% des femmes) faisaient état de un ou plusieurs symptômes gastro-intestinaux bas—les personnes avec uniquement des douleurs abdominales étant exclues. Dans l’ensemble, 78% des participants faisaient état de deux symptômes ou plus. Le ballonnement représentait le symptôme le plus fréquent (75%), les douleurs abdominales étant le symptôme le plus gênant et le plus sévère [59].
5.3 Diagnostic/symptômes : remarques
- L’imagerie n’est pas d’une très grande utilité pour poser le diagnostic de ballonnement, mais peut cependant permettre d’exclure la présence d’une obstruction ou d’une maladie qui pourrait prédisposer le patient à une colonisation bactérienne de l’intestin grêle (SIBO).
- Les symptômes de ballonnement et de distension peuvent faire craindre aux professionnels de la santé la présence d’une colonisation bactérienne de l’intestin grêle et peuvent les amener à instaurer un traitement empirique; le rôle de SIBO dans ce contexte demeure controversé.
- Le ballonnement est le plus souvent de nature bénigne, mais peut être à l’origine de difficultés importantes dans la capacité de travailler et de prendre part à des activités sociales ou récréatives. Il est également à l’origine d’une augmentation des congés maladie, des visites chez le médecin et de la prise de médicaments. Le fait de paraître enceinte pourrait gêner les femmes.
- Les critères de Rome III (http://www.romecriteria.org/education/clin_algorithms.cfm) pour le ballonnement fonctionnel devraient comprendre les deux éléments suivants :
o Une impression de ballonnement récidivante ou une distension apparente au moins 3 jours par mois pendant les 3 mois précédents
o L’absence de critères suffisants pour permettre de poser un diagnostic de dyspepsie fonctionnelle, de syndrome de l’intestin irritable ou d’une autre maladie gastro-intestinale fonctionnelle
- Les critères devront être remplis pour les 3 mois précédents, avec début de la symptomatologie au moins 6 mois avant le diagnostic.
5.4 Diagnostic différentiel
- Origines gastro-intestinales ou causes associées avec un ballonnement [60]:
o “Physiologiques”: voyage en avion, modification du régime alimentaire en voyage—par exemple, celles-ci peuvent conduire à un ballonnement transitoire et/ou flatulence
o Syndrome de l’intestin irritable
o Aérophagie
o Anorexie et boulimie
o Gastroparésie
o Obstruction gastrique, sténose pylorique
o Dyspepsie fonctionnelle
o Facteurs diététiques:
• Intolérance au lactose ou au fructose
• Consommation de fructose, de sorbitol, ou d’autres sucres non absorbables
• Consommation importante d’hydrates de carbone
• Sensibilité au gluten
o Maladie coeliaque
o Constipation chronique
o Colonisation bactérienne de l’intestin grêle
o Trouble de la motilité de l’intestin grêle (par exemple, sclérodermie)
o Diverticulose de l’intestin grêle
o Transit intestinal perturbé
- Maladies non gastro-intestinales associées au ballonnement ou à la distension
- Ascite—par exemple, en relation avec une insuffisance cardiaque, une cirrhose, un cancer
- Distension en relation avec la grossesse, les tumeurs, etc.
- Ballonnement en relation avec le cycle menstruel
5.5 Signes d’alarme
- Âge
- Anémie
- Signes cliniques suggérant la présence de liquide dans l’abdomen ou d’une masse
- Distension visible durable
- Perte pondérale involontaire progressive
- Coexistence de nausées, de vomissements, de diarrhées
- Saignement gastro-intestinal
5.6 Ballonnement—algorithme de la prise en charge
5.6.1 Auto-assistance pour le ballonnement
o Partager la prise alimentaire en trois repas par jour plus deux collations. Il serait plus judicieux d’augmenter la fréquence et de diminuer la quantité d’aliments à chaque prise (manger moins à chaque repas plutôt que de prendre un grand repas). Prendre un petit en-cas avant de se coucher est déconseillé.
o Limiter la consommation d’hydrates de carbone qui sont difficiles à digérer tels les haricots, les légumes secs, les brocolis, les choux, les choux-fleurs et les choux de Bruxelles. Préférer plutôt les hydrates de carbone qui sont faciles à digérer telles les pommes de terre, le riz, la laitue, les bananes, les raisins et le yaourt.
o Eviter les boissons contenant de la caféine.
o Diminuer la consommation d’aliments et de boissons contenant des gaz, tels le soda ou la bière.
o Augmenter progressivement la quantité de fibres alimentaires dans le régime sur une période de quelques semaines plutôt que sur quelques jours afin de permettre à l’organisme de s’adapter.
o Consommer des produits laitiers fermentés, riches en probiotiques connus pour leur effet bénéfique sur le ballonnement.
o Limiter la consommation d’aliments contenant du polyol—par exemple, les édulcorants tels le maltitol, le sorbitol, le xylitol et l’isomaltose.
o Diminuer la consommation d’aliments riches en graisse animale ainsi que d’aliments gras ou de friture.
o Eviter de trop manger; prenez le temps de manger lentement et de bien mâcher la nourriture.
o Maintenir un indice de masse corporelle (IMC) sain—essayer d’atteindre un poids optimal.
o Eviter les aliments qui fermentent dans l’estomac (ce qui peut provoquer un ballonnement) ainsi que les féculents, le choux, le lait et les boissons alcooliques—garder à l’esprit que le régime alimentaire devrait être varié.
o Préférer les protéines: un régime fait de protéines et de produits laitiers, associé à une diminution des sucres et les graisses, peut améliorer le ballonnement de façon significative.
- Style de vie—augmenter l’exercice physique et améliorer la posture.
- Médicaments—les médicaments en vente libre contenant la simethicone et le charbon actif sont toujours utilisés pour soulager les symptômes de flatulences et de ballonnement, mais leur utilité est discutable. Des études sur la prise de probiotiques contenant des bactéries telles Lactobacillus et Bifidobacterium ont fait état d’une amélioration du ballonnement et de la flatulence [61].
5.6.2 Pharmacien
- Toute prise de médicament devrait être associée à des changements de style de vie et de régime alimentaire:
o Associer les médicaments aux changements de régime alimentaire.
o La phytothérapie, l’homéopathie et l’aromathérapie sont parfois conseillées afin d’améliorer les symptômes, mais il n’existe aucunes preuves de leur efficacité.
- Adresser le patient à un médecin:
o Si le ballonnement dure plusieurs semaines ou s’aggrave.
o En présence d’autres symptômes, tels les diarrhées ou la constipation, les douleurs abdominales, les vomissements, les hémoptysies, la perte pondérale involontaire, etc.
o En association avec une perte pondérale involontaire, des diarrhées, des douleurs abdominales, particulièrement après les repas, le ballonnement peut constituer une indice pour une maladie plus grave, en particulier si une masse abdominale est palpable.
o En présence d’une absence totale de passage de gaz intestinaux et de selles, et en présence de douleurs abdominales sévères, il faut adresser le patient pour une consultation d’urgence.
5.6.3 Médecin de premier recours
- Prise en charge en l’absence de cause apparente:
o Régime alimentaire—essai avec un traitement d’exclusion du lactose puis de réintroduction, régime FODMAP (régime évitant oligosaccharides, disaccharides, monosaccharides, fermentescibles [32], éviction de certains aliments ; probiotiques. Il faut cependant effectuer un seul changement à la fois.
o Thérapies psychologiques—il a été démontré que l’hypnose peut être bénéfique pour améliorer le ballonnement chez les patients avec le syndrome de l’intestin irritable; des mesures comportementales peuvent être utiles pour les patients souffrant d’aérophagie.
5.6.4 Spécialiste
- Exclure toute maladie organique suggérée par les symptômes comorbides.
- Aborder le régime alimentaire—aliments pouvant être à l’origine de flatulences, boissons gazeuses.
- Améliorer la posture si nécessaire.
- Faire un essai avec les probiotiques.
- Individualiser le traitement du patient.
- Exclure une colonisation bactérienne en effectuant les examens appropriés. En présence d’une constipation, donner un laxatif.
- Envisager un essai thérapeutique avec un antidépresseur tricyclique à faible dose [62].
- Envisager un traitement par hypnose. Envisager un traitement de néostigmine [63].
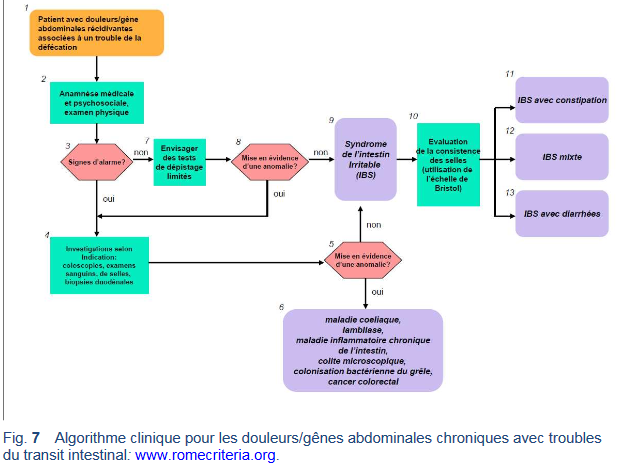
6. Constipation
6.1 Définition et description
Nous nous focalisons ici sur la constipation fonctionnelle plutôt que sur le syndrome de l’intestin irritable—douleurs abdominales associées à un trouble de la défécation. En pratique clinique, les termes « constipation fonctionnelle » et « constipation chronique » sont souvent utilisées de façon interchangeable et reconnaissent la nature chronique des symptômes tout en excluant le syndrome de côlon irritable (IBS). La présence de douleurs abdominales basses comme symptôme dominant est le plus souvent utilisée pour faire la distinction entre le syndrome de l’intestin irritable et la constipation, mais dans la pratique il peut être difficile de faire une telle distinction.
- La constipation est tantôt aiguë tantôt chronique avec une diminution de la fréquence de l’émission de selles ou par l’émission de selles dures, sèches, douloureuses ou difficiles à expulser, ou associées à un sentiment d’exonération incomplète ou prolongée—synonymes: dyschésie; obstipation; constipation rectale; constipation à transit lent.
- L’impaction fécale se réfère à un amas de selles dures, sèches dans le côlon ou le rectum.
- Les symptômes de la constipation comprennent:
o Efforts et/ou gêne à la défécation
o Selles moins fréquentes
o Selles plus dures, sèches ou davantage en morceaux que d’habitude
o Crampes abdominales ou ballonnement
o Gêne ou douleurs dans le bas du dos ou dans l’estomac
o Sentiment d’exonération incomplète des selles
o Nausées, irritabilité, diminution de l’appétit
o Lassitude / fatigue
6.2 Epidémiologie
Dans une étude menée au Canada, 5% de la population (2% des hommes et 8% des femmes) présentaient un ou plusieurs symptômes gastro-intestinaux bas; 51% de ces patients souffraient de constipation [59].
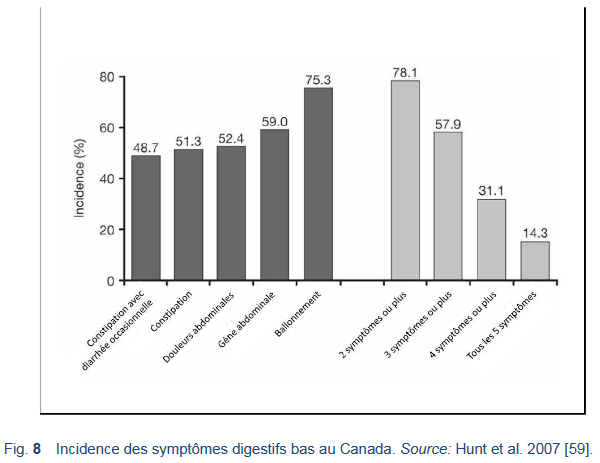
- Dans une étude effectuée au Mexique (où les entretiens avec les patients ont été menés par des médecins utilisant les questionnaires Rome II/health- care/medication questionnaires ainsi que l’échelle du Center for Epidemiological Studies of Depression), les maladies gastro-intestinales fonctionnelles les plus répandues étaient IBS, 16% (95% CI, 12.9 à 19.5); ballonnement fonctionnel, 11% (95% CI, 8.2 à 13.9); maladie intestinale fonctionnelle non spécifique, 11% (95% CI, 8.0 à 13.6); et constipation fonctionnelle, 7% (95% CI, 5.3 à 10.1). Les brûlures rétrosternales non investiguées étaient aussi très fréquentes 20% (95% CI, 16.2 à 23.4) [64].
- La prévalence de la constipation aux Etats-Unis est estimée en générale à environ 15% [65].
- La constipation fonctionnelle selon les critères de Rome affecte environ 8% de la population [66].
6.3 Diagnostic/symptômes
- Les critères Rome III (deux ou plus sont nécessaires) pour la constipation fonctionnelle sont:
o Efforts lors d’au moins 25% des défécations
o Selles dures ou en boulettes lors d’au moins 25% des défécations
o Sensation d’exonération incomplète lors d’au moins 25% des défécations
o Sensation d’obstruction/blocage anorectal lors d’au moins 25% des défécations
o Manoeuvres digitales lors d’au moins 25% des défécations (par exemple, évacuation digitale, pression sur le plancher pelvien)
o Moins de trois défécations par semaine
o Selles molles rarement présentes sans l’utilisation de laxatif
o Critères insuffisamment remplis pour un syndrome de l’intestin irritable
o Critères remplis pendant les 3 mois précédents, avec début de la symptomatologie au moins 6 mois avant le diagnostic
6.4 Diagnostic différentiel
- Syndrome de l’intestin irritable avec une prédominance de la constipation (IBS- C) devrait être suspecté dans les cas de constipation chronique avec douleurs abdominales.
- Constipation d’origine médicamenteuse.
- Il existe des anomalies anatomiques qui peuvent être associées à une défécation difficile, telles un rectocèle, une intussusception et un entérocèle; celles-ci sont cependant le plus souvent secondaires à la constipation plutôt qu’à l’origine du problème.
- Hypothyroïdie—lassitude, prise pondérale, intolérance au froid.
6.5 Signes d’alarme
- Modification du transit intestinal d’apparition récente
- Perte pondérale
- Rectorragie
- Age > 50 ans
- Anamnèse familiale de cancer colorectal
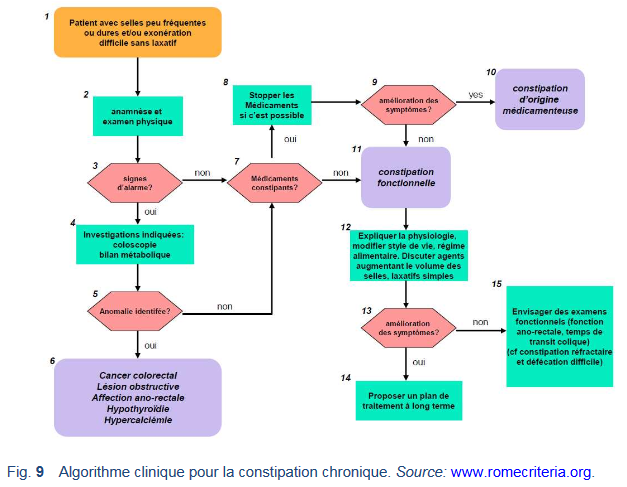
6.6 Constipation—algorithme de la prise en charge
6.6.1 Auto-assistance pour la constipation
- Autodiagnostic—le transit intestinal est modifié selon la nourriture et ainsi l’endroit où se trouve le patient et son appartenance ethnique peuvent jouer un rôle, mais on peut dire qu’il existe une constipation chez un adulte en l’absence de défécation pendant 3 jours ou chez un enfant en l’absence de défécation pendant 4 jours. La fréquence de la défécation en soi est cependant souvent un paramètre inadéquat pour le problème du patient, qui peut plutôt être plus en relation à des difficultés à la défécation elle-même ou un sentiment d’exonération incomplète.
- Signes d’alarme—consulter un médecin si:
o Modification subite de la défécation—en particulier si âge > 40
o Douleurs à la défécation
o Sang sur les selles ou selles noires et avec un aspect de goudron
o Nécessité d’utiliser régulièrement des laxatifs (tous les 2–3 jours ou plus)
o Constipation survenant avec de la fatigue ou un malaise, des vomissements, une perte pondérale involontaire, des maux de tête, de la fièvre
o Constipation pendant > 7 jours sans cause apparente
o Fuites de selles liquides ou molles depuis l’anus
Stratégies d’auto-assistance:
o Régime alimentaire:
• Encourager les patients souffrant de constipation à ne pas manquer de prendre un petit-déjeuner, moment de la journée où le réflexe gastrocolique est à son apogée.
• Incorporer les aliments riches en fibres dans le régime alimentaire—par exemple, fruits et légumes, légumes secs, céréales complètes et graines.
• Augmenter de façon graduelle la quantité de fibres dans le régime alimentaire dans le but d’éviter le ballonnement ou le passage de gaz— au cas où le patient trouve que l’ingestion de fibres péjore la symptomatologie (comme cela peut être le cas dans le syndrome de l’intestin irritable ou dans le transit lent) ; il convient d’éviter l’abus fibres.
• Préférer les fruits riches en pectine, telles pommes, fraises, lychees ou poires, afin d’augmenter le volume des selles et ainsi faciliter la défécation.
• Consommer des produits laitiers fermentés contenant des probiotiques pour leur effet bénéfique sur la constipation.
• Boire environ 2 litres d’eau par jour—diminuer la prise de boissons contenant de la caféïne, de l’alcool ou riches en sucre.
• Diminuer l’ingestion d’aliments riches en graisses animales, d’aliments gras et de friture.
• Limiter l’ingestion de sucres raffinés—par exemple, bonbons et desserts très riches.
• Régulariser l’heure des repas et les habitudes alimentaires.
o Exercice physique et stress:
• Essayer de pratiquer un exercice physique modéré pendant au moins 30 minutes par jour.
• Apprendre et utiliser les techniques de relaxation afin de diminuer le stress.
• Mener une vie saine—avec exercice physique régulièr et s’abstenir de fumer.
• Eviter le stress—apprendre à se relaxer, améliorer le sommeil, faire de l’exercice physique régulièrement, respirer profondément et apprendre à mieux gérer le temps.
o Défécation:
• Ne pas réprimer l’envie d’aller à selle.
• Favoriser une bonne position lors de la défécation—se pencher bien en avant, avec le dos droit et un support sous les pieds.
• Prévoir d’aller à selle régulièrement tous les 1–2 jours.
o Demander conseil à un médecin/un pharmacien—dans le cas où une maladie ou un médicament pourrait être à l’origine d’une constipation.
o Essayer de diminuer l’utilisation de médicaments et se focaliser à long terme sur des modifications du régime alimentaire et du style de vie.
o Utiliser des agents augmentant le volume des selles—suppléments de fibres tels ispaghula, guar gum, psyllium, sterculia avec un apport suffisant de liquides.
o Laxatifs émollients—docusate, poloxalkol; ce sont des laxatifs légers qui sont largement utilisés et qui peuvent s’avérer utiles chez les enfants, bien qu’il n’existe que peu de données sur leur efficacité.
o Suppositoires de glycérine—utiles en présence de difficultés d’exonération rectale.
6.6.2 Pharmacien
o Identifier une éventuelle constipation en association avec une prise médicamenteuse—opiacés, traitement par le fer, antacides à base de calcium, antidépresseurs tricycliques, antipsychotiques, chimiothérapie, médicaments anticholinergiques, médicaments anti-parkinson, médicaments antidiarrhéiques pouvant ralentir le transit intestinal, argile ou silicates.
o Les laxatifs traditionnels en vente libre constituent le traitement de première intention, mais ils sont associés à un taux d’insatisfaction élevé [67].
o Les laxatifs de contact (stimulants), tels le séné, et les laxatifs osmotiques, tels le lactulose, peuvent provoquer des douleurs abdominales ainsi que des selles liquides suivies de quelques jours sans défécation, imitant ainsi une constipation et conduisant à des prises de laxatifs supplémentaires et excessives.
o Suppositoires de glycérine.
o Avec un bon entraînement, il est possible de gérer la constipation sans prise de médicaments la plupart du temps.
6.6.3 Médecin de premier recours
o En l’absence de signes d’alarme, des examens de laboratoire de routine ne sont pas indiqués chez tous les patients souffrant de constipation.
o En présence d’un ou plusieurs signes d’alarme, il y a indication à une coloscopie; la coloscopie n’est pas à considérer comme un examen à but diagnostic en l’absence de signe d’alarme.
o Anamnèse et examen physique
o Description du type de défécation—fréquence des selles, forme (Bristol Stool Form Scale, BSFS)
o Mesures déjà prises afin d’améliorer la constipation et les résultats de celles- ci
o Formule sanguine complète, vitesse de sédimentation, protéine C-réactive afin d’exclure une perte de sang occulte ou une inflammation
o Modification du régime alimentaire et du style de vie
o Produits visant à augmenter le volume des selles, laxatifs simples
o Adresser le patient à un gastro-entérologue si aucune amélioration de la constipation
o Proposer des techniques de biofeedback afin de corriger toute dyssynergie du plancher pelvien
6.6.4 Spécialiste
Voir les guides de l’OMG (WGO) sur la constipation (http://www.worldgastroenterology.org/constipation.html).
Notes:
• De nouveaux médicaments vont probablement remplacer les actuels.
• Prescription de médicaments chez les patients avec persistance des symptômes et qui ont essayé les médicaments en vente libre : le linaclotide a été approuvé aux USA et en Europe pour le traitement de la constipation chronique idiopathique et du syndrome du côlon irritable avec constipation chez l’adulte. Le prucalopride a été approuvé en Europe et certains pays asiatiques et de l’Amérique latine pour le traitement de la constipation chronique et le lubiprostone a été approuvé aux USA aussi bien pour la constipation chronique que le syndrome de l’intestin irritable avec constipation (IBS-C).
• Il existe quelque nouvelles approches : le biofeedback pour la dyssynergie et la stimulation sacrée pour l’inertie. La chirurgie ne devrait être envisagée que très, très rarement et que dans des centres expérimentés.
Références
- Drossman DA, Li Z, Andruzzi E, et al. U.S. householder survey of functional gastrointestinal disorders. Prevalence, sociodemography, and health impact. Dig Dis Sci 1993;38:1569–80.
- Hungin AP, Whorwell PJ, Tack J, Mearin F. The prevalence, patterns and impact of irritable bowel syndrome: an international survey of 40,000 subjects. Aliment Pharmacol Ther 2003;17:643–50.
- Kennedy TM, Jones RH, Hungin AP, O’Flanagan H, Kelly P. Irritable bowel syndrome, gastrooesophageal reflux, and bronchial hyper-responsiveness in the general population. Gut 1998;43:770–4.
- Quigley EM, Locke GR, Mueller-Lissner S, et al. Prevalence and management of abdominal cramping and pain: a multinational survey. Aliment Pharmacol Ther 2006;24:411–9.
- Mueller-Lissner S, Quigley EM, Helfrich I, Schaefer E. Drug treatment of chronic-intermittent abdominal cramping and pain: a multi-national survey on usage and attitudes. Aliment Pharmacol Ther 2010;32:472–7.
- Bommelaer G, Poynard T, Le Pen C, et al. Prevalence of irritable bowel syndrome (IBS) and variability of diagnostic criteria. Gastroenterol Clin Biol 2004;28:554–61.
- Sandler RS, Stewart WF, Liberman JN, Ricci JA, Zorich NL. Abdominal pain, bloating, and diarrhea in the United States: prevalence and impact. Dig Dis Sci 2000;45:1166-71.
- Kruis W, Thieme C, Weinzierl M, Schüssler P, Holl J, Paulus W. A diagnostic score for the irritable bowel syndrome. Its value in the exclusion of organic disease. Gastroenterology 1984;87:1–7.
- Weber FH, McCallum RW. Clinical approaches to irritable bowel syndrome. Lancet 1992; 340: 1447–52.
- Digesu GA, Panayi D, Kundi N, Tekkis P, Fernando R, Khullar V. Validity of the Rome III Criteria in assessing constipation in women. Int Urogynecol J 2010;21:1185–93.
- Bouras EP, Tangalos EG. Chronic constipation in the elderly. Gastroenterol Clin North Am 2009;38:463–80.
- El-Serag HB. Time trends of gastroesophageal reflux disease: a systematic review. Clin Gastroenterol Hepatol 2007;5:17–26.
- Corley DA, Kubo A. Body mass index and gastroesophageal reflux disease: a systematic review and meta-analysis. Am J Gastroenterol 2006;101:2619–28.
- Sharma PK, Ahuja V, Madan K, Gupta S, Raizada A, Sharma MP. Prevalence, severity, and risk factors of symptomatic gastroesophageal reflux disease among employees of a large hospital in northern India. Indian J Gastroenterol 2011;30:128–34.
- Jafri N, Jafri W, Yakoob J, Islam M, Manzoor S, Jalil A, Hashmi F. Perception of gastroesophageal reflux disease in urban population in Pakistan. J Coll Physicians Surg Pak 2005;15:532–4.
- Zhou H, Yao M, Cheng GY, Chen YP, Li DG. Prevalence and associated factors of functional gastrointestinal disorders and bowel habits in Chinese adolescents: a school-based study. J Pediatr Gastroenterol Nutr 2011;53:168–73.
- Bremner AR, Sandhu BK. Recurrent abdominal pain in childhood: the functional element. Indian Pediatr 2009;46:375–9.
- Devanarayana NM, Mettananda S, Liyanarachchi C, et al. Abdominal pain-predominant functional gastrointestinal diseases in children and adolescents: prevalence, symptomatology, and association with emotional stress. J Pediatr Gastroenterol Nutr 2011;53:659–65.
- Devanarayana NM, Adhikari C, Pannala W, Rajindrajith S. Prevalence of functional gastrointestinal diseases in a cohort of Sri Lankan adolescents: comparison between Rome II and Rome III criteria. J Trop Pediatr 2011;57:34–9.
- Wang A, Liao X, Xiong L, et al. The clinical overlap between functional dyspepsia and irritable bowel syndrome based on Rome III criteria. BMC Gastroenterol 2008;8:43.
- Kaji M, Fujiwara Y, Shiba M, et al. Prevalence of overlaps between GERD, FD and IBS and impact on health-related quality of life. J Gastroenterol Hepatol 2010;25:1151–6.
- Altintaş E, Senli MS, Sezgin O. Prevalence of celiac disease among dyspeptic patients: a community-based case–control study. Turk J Gastroenterol 2008;19:81–4.
- Eliakim R, Cohen A, Ginsberg G, Hammerman-Rozenberg R, Stessman J. The Jerusalem 70 year olds longitudinal study: gastrointestinal findings. Isr J Med Sci 1996;32:634–8.
- Madrid AM, Quera R, Defillippi CL, Defillippi C. Prevalence of IBS in the Chilean population. Gastroenterol Latinoam 2005;16:392.
- Madrid AM, Landskron G, Klapp G, Reyes A, Pizarro C, Defilippi C. Lactulose hydrogen breath test and functional symptoms in pediatric patients. Dig Dis Sci 2012;57:1330–5.
- Quigley EM, Abdel-Hamid H, Barbara G, et al. A global perspective on irritable bowel syndrome. A consensus statement of the World Gastroenterology Organisation Summit Task Force on irritable bowel syndrome. J Clin Gastroenterol 2012;46:356–66.
- Okeke EN, Ladep NG, Adah S, Bupwatda PW, Agaba EI, Malu AO. Prevalence of irritable bowel syndrome: a community survey in an African population. Ann Afr Med 2009;8:177–80.
- Olubuyide IO, Olawuyi F, Fasanmade AA. A study of irritable bowel syndrome diagnosed by Manning criteria in an African population. Dig Dis Sci 1995;40:983–5.
- Gibson PR, Shepherd SJ. Food choice as a key management strategy for functional gastrointestinal symptoms. Am J Gastroenterol 2012;107: 657–66.
- Kehar M, Yadav SP, Sachdeva A. Constipation in children. J Int Med Sci Acad 2012;25:31–3.
- Drossman DA, Funch-Jensen P, Janssens J, Talley NJ, Thompson WG, Whitehead WE. Identification of subgroups of functional bowel disorders. Gastroenterol Int 1990;3:159–72.
- Gibson PR, Shepherd SJ. Evidence-based dietary management of functional gastrointestinal symptoms: The FODMAP approach. J Gastroenterol Hepatol 2010;25:252–8.
- Galmiche JP, Clouse RE, Bálint A, et al. Functional esophageal disorders. Gastroenterology 2006;130:1459–65.
- Dent J, Vakil N, Jones R, et al. Accuracy of the diagnosis of GORD by questionnaire, physicians and a trial of proton pump inhibitor treatment: the Diamond Study. Gut 2010;59:714–21.
- Goh KL. Gastroesophageal reflux disease in Asia: A historical perspective and present challenges. J Gastroenterol Hepatol 2011;26 Suppl 1:2–10.
- Mahadeva S, Raman MC, Ford AC, et al. Gastro-oesophageal reflux is more prevalent in Western dyspeptics: a prospective comparison of British and South-East Asian patients with dyspepsia. Aliment Pharmacol Ther 2005;21:1483–90.
- Kang JY, Ho KY. Different prevalences of reflux oesophagitis and hiatus hernia among dyspeptic patients in England and Singapore. Eur J Gastroenterol Hepatol 1999;11:845–50.
- Ho KY, Ng WL, Kang JY, Yeoh KG. Gastroesophageal reflux disease is a common cause of noncardiac chest pain in a country with a low prevalence of reflux esophagitis. Dig Dis Sci 1998;43:1991–7.
- Wu JC, Chan FK, Ching JY, Leung WK, Lee YT, Sung JJ. Empirical treatment based on “typical” reflux symptoms is inappropriate in a population with a high prevalence of Helicobacter pylori infection. Gastrointest Endosc 2002;55:461–5.
- Goh KL. Clinical and epidemiological perspectives of dyspepsia in a multiracial Malaysian population. J Gastroenterol Hepatol 2011;26 Suppl 3:35–8.
- Mahadeva S, Chia YC, Vinothini A, Mohazmi M, Goh KL. Cost-effectiveness of and satisfaction with a Helicobacter pylori “test and treat” strategy compared with prompt endoscopy in young Asians with dyspepsia. Gut 2008;57:1214–20.
- Ho KY, Gwee KA, Khor CJ, Selamat DS, Wai CT, Yeoh KG. Empirical treatment for the management of patients presenting with uninvestigated reflux symptoms: a prospective study in an Asian primary care population. Aliment Pharmacol Ther 2005;21:1313–20.
- Goh KL, Wong HT, Lim CH, Rosaida MS. Time trends in peptic ulcer, erosive reflux oesophagitis, gastric and oesophageal cancers in a multiracial Asian population. Aliment Pharmacol Ther 2009;29:774–80.
- Goh KL. Changing trends in gastrointestinal disease in the Asia-Pacific region. J Dig Dis 2007;8:179–85.
- Thomas V, Rangan K, Kumar S. Occurrence of functional heartburn in patients with symptoms of gastroesophageal reflux disease (GERD) not responding to proton pump inhibitors (PPI) [abstract]. Am J Gastroenterol 2011;106 Suppl 2:S25.
- Gao Y, Hu N, Han X, et al. Family history of cancer and risk for esophageal and gastric cancer in Shanxi, China. BMC Cancer 2009;9:269.
- Sheen E, Triadafilopoulos G. Adverse effects of long-term proton pump inhibitor therapy. Dig Dis Sci 2011;56:931–50.
- Berardi RR, ed. Handbook of nonprescription drugs: an interactive approach to self-care. 16th ed. Washington, DC: American Pharmacists Association, 2009.
- Kahrilas PJ, Shaheen NJ, Vaezi MF. American Gastroenterological Association medical position statement on the management of gastroesophageal reflux disease. Gastroenterology 2008;135:1383–91. Available at: http://www.gastrojournal.org/article/S0016-5085(08)01606-5/fulltext.
- Smith L. Updated ACG guidelines for diagnosis and treatment of GERD. Am Fam Physician 2005;71:2376–82. Available at: http://www.aafp.org/afp/2005/0615/p2376.html.
- Gupta V, Moshiree B, Verne GN. Treatment of pain symptoms in irritable bowel syndrome patients. Drugs Today (Barc) 2004;40:829–36.
- Mertz HR. Irritable bowel syndrome. N Engl J Med 2003;349:2136–46.
- Gibson PR. Food intolerance in functional bowel disorders. J Gastroenterol Hepatol 2011;26 Suppl 3:128–31.
- Staudacher HM, Whelan K, Irving PM, Lomer MC. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. J Hum Nutr Diet 2011;24:487–95.
- Dorn SD, Meek PD, Shah ND. Increasing frequency of opioid prescriptions for chronic abdominal pain in US outpatient clinics. Clin Gastroenterol Hepatol 2011;9:1078–85.
- Rome Foundation. Appendix D: Rome III psychosocial alarm questionnaire for the functional GI disorders. In: Drossman DA, ed. Rome III: the functional gastrointestinal disorders. 3rd ed. MacLean, VA: Degnon Associates, 2006: 953–9. Available at: http://www.romecriteria.org/pdfs/PsychoAlarmQ.pdf.
- World Gastroenterology Organisation. World Gastroenterology Organisation Global Guidelines. Irritable bowel syndrome: a global perspective. April 2009. Available at: http://www.worldgastroenterology.org/irritable-bowel-syndrome.html.
- Daneshpajouhnejad P, Keshteli AH, Sadeghpour S, Ardestani SK, Adibi P. Bloating in Iran: SEPAHAN systematic review no. 4. Int J Prev Med 2012;3(Suppl 1):S26–33.
- Hunt RH, Dhaliwal S, Tougas G, et al. Prevalence, impact and attitudes toward lower gastrointestinal dysmotility and sensory symptoms, and their treatment in Canada: A descriptive study. Can J Gastroenterol 2007;21:31–7.
- Lacy BE, Gabbard SL, Crowell MD. Pathophysiology, evaluation, and treatment of bloating: hope, hype, or hot air? Gastroenterol Hepatol (N Y) 2011;7:729–39.
- World Gastroenterology Organisation. World Gastroenterology Organisation Global Guidelines. Probiotics and prebiotics. October 2011. Available at: http://www.worldgastroenterology.org/probiotics-prebiotics.html.
- Drossman DA, Toner BB, Whitehead WE, et al. Cognitive-behavioral therapy versus education and desipramine versus placebo for moderate to severe functional bowel disorders. Gastroenterology 2003;125:19–31.
- Accarino A, Perez F, Azpiroz F, Quiroga S, Malagelada JR. Intestinal gas and bloating: effect of prokinetic stimulation. Am J Gastroenterol 2008;103:2036–42.
- López-Colombo A, Morgan D, Bravo-González D, Montiel-Jarquín A, Méndez-Martínez S, Schmulson M. The epidemiology of functional gastrointestinal disorders in Mexico: a population-based study. Gastroenterol Res Pract 2012;2012:606174.
- Higgins PD, Johanson JF. Epidemiology of constipation in North America: a systematic review. Am J Gastroenterol 2004;99:750–9.
- Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology 2006;130:1480–91.
- Johanson JF, Kralstein J. Chronic constipation: a survey of the patient perspective. Aliment Pharmacol Ther 2007;25:599–608.















