1. Introducción
“La diarrea que ataca a una persona afectada por tisis constituye un síntoma mortal”.
— Hipócrates, Aforismos 5.14
“Es imposible diagnosticar la tuberculosis abdominal con algún grado de certeza, ya que la enfermedad emula a muchas otras afecciones abdominales y la confirmación histológica puede ser equívoca.”
— Joseph Walsh, Transactions of the National Association for the Study and Prevention of Tuberculosis 1909;5:217–22
La tuberculosis (TB) es una enfermedad infecciosa causada por Mycobacterium tuberculosis; habitualmente provoca la forma pulmonar. En frecuencia, la TB es la novena causa de muerte en todo el mundo y es la principal a causa de un único agente infeccioso, situándose por encima del virus de la inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA).
En 2017, 10 millones de personas desarrollaron tuberculosis y 1,6 millones murieron a causa de ella, entre quienes se incluyen 0,3 millones de personas con VIH. La tuberculosis es la principal causa de muerte de las personas con serología positiva al VIH [1].
- Aproximadamente una cuarta parte de la población mundial tiene TB0 latente.
- El riesgo de las personas infectadas con el bacilo de la tuberculosis de presentar la enfermadad a lo largo de su vida va del 5 al 15%. Sin embargo, el riesgo de enfermar es mucho mayor en los individuos con compromiso inmunitario, como quienes viven con el VIH, padecen desnutrición o diabetes, fumadores o personas que reciben medicación inmunosupresora.
- La tuberculosis multirresistente (TB-MR) sigue siendo un problema de salud pública y una amenaza para la seguridad sanitaria. La Organización Mundial de la Salud (OMS) calcula que aparecieron 558.000 nuevos pacientes con resistencia a la rifampicina -el fármaco de primera línea más eficaz; 82% de ellos tenía TB-MR.
- A nivel mundial, la incidencia de tuberculosis está disminuyendo a un ritmo del 2% anual.
- Se estima que entre 2000 y 2019 se salvaron 60 millones de vidas gracias al diagnóstico y tratamiento de la tuberculosis [1].
En Estados Unidos la tuberculosis abdominal es poco frecuente en comparación con la pulmonar. La TB gastrointestinal constituye el 2,5% de los casos extrapulmonares [2].
- El compromiso de los ganglios linfáticos es la presentación más común de la TB extrapulmonar (TBEP), tanto en individuos con infección por el VIH como en pacientes seronegativos.
- La TB pleural representa aproximadamente el 20% de todos los casos de TBEP.
- La TB genitourinaria representa el 10-15% de todos los casos de TBEP en los Estados Unidos.
El diagnóstico temprano sigue siendo difícil debido a la inespecificidad de la presentación clínica de la tuberculosis, que puede imitar a otras enfermedades gastrointestinales y en zonas en las que la tuberculosis es endémica puede presentarse tanto como un cuadro agudo de abdomen como uno crónico. Si bien algunos pacientes pueden beneficiarse del tratamiento antituberculoso, otros pueden presentar problemas quirúrgicos como estenosis, obstrucción, fístulas o perforaciones, que pueden requerir una intervención quirúrgica.
La infección por VIH es un factor de riesgo importante para el desarrollo de la tuberculosis, y la tuberculosis peritoneal es un verdadero reto médico en los pacientes inmunodeprimidos, ya que sus síntomas son insidiosos e inespecíficos.
Si bien cualquier zona del intestino puede estar comprometida, las zonas del tubo digestivo afectadas con mayor frecuencia son la zona ileocecal, el íleon y el colon. La zona ileocecal es la más afectada por la tuberculosis. Esto se explica por la alta densidad de tejido linfoide, la ralentización del tránsito intestinal y la baja concentración de ácidos biliares a ese nivel [3].
La peritonitis tuberculosa debe considerarse en todos los casos de ascitis exudativa inexplicable. Otras localizaciones de la infección tuberculosa abdominal son: bazo, hígado y ganglios linfáticos [3–6].
1.1 Acerca de las cascadas de la WGO
Cascadas de la WGO: Se trata de un conjunto jerárquico de opciones diagnósticas, terapéuticas y de manejo aplicadas para lidiar con el riesgo y la enfermedad, clasificadas según los recursos disponibles.
Las directrices y cascadas de la Organización Mundial de Gastroenterología (WGO) pretenden poner de relieve las opciones de tratamiento apropiadas, sensibles al contexto y a los recursos para todas las zonas geográficas, independientemente de que sean “en desarrollo”, “semidesarrolladas” o “desarrolladas”. Las cascadas de la WGO son sensibles al contexto, y éste no se define necesariamente sólo por la disponibilidad de recursos.
Las opciones de cascada que se presentan aquí, tanto para el diagnóstico como para el tratamiento de la tuberculosis gastrointestinal, son fundamentales y representan la parte más importante de este documento. Se hace especial hincapié en las categorías “patrón oro”, es decir, el tratamiento óptimo de referencia, de recursos medios y recursos bajos.
En la Sección 3.1 se presentan las “Cascadas para el diagnóstico de la tuberculosis gastrointestinal”.
1.2 Definiciones
- TB abdominal: TB del tracto gastrointestinal y de cualquier otro órgano dentro de la cavidad abdominal (se incluye la tuberculosis esofágica).
- TB intestinal: TB del tracto gastrointestinal no peritoneal.
- TB peritoneal: tuberculosis del peritoneo.
1.3 Epidemiología
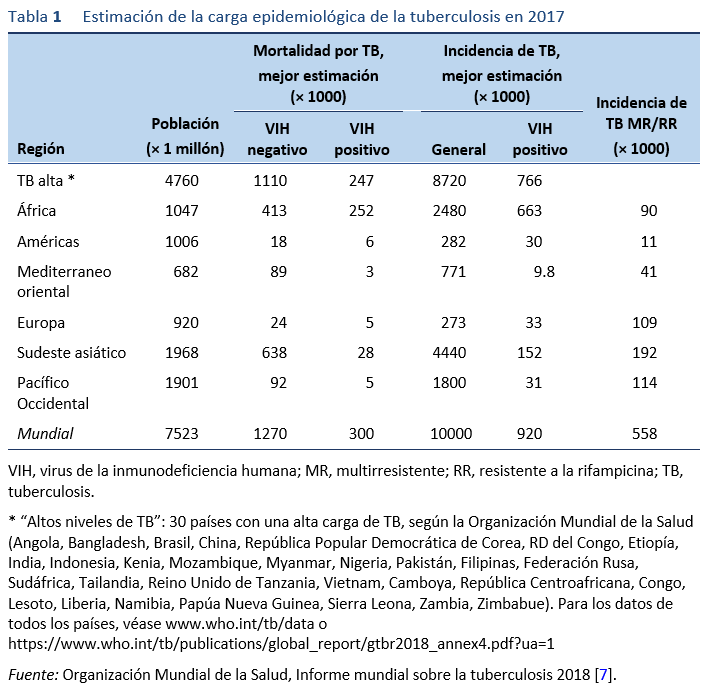
1.3.1 Informe mundial sobre la tuberculosis 2018 de la OMS [1,7]
- La tuberculosis se encuentra presente en todo el mundo. En 2017, la mayor cantidad de nuevos casos de tuberculosis se produjo en las regiones de Asia Sudoriental y el Pacífico Occidental, con el 62% de los nuevos casos, seguidas de África, con el 25% de los casos nuevos.
- Hubo casos en todos los países y grupos de edad, pero en términos generales 90% de los pacientes eran adultos (≥ 15 años) y 9% eran personas que vivían con el VIH (72% de ellos en África).
- En 2017, 87% de los nuevos casos de tuberculosis se produjeron en los 30 países que tienen una alta carga de tuberculosis, y dos tercios se dieron en ocho países: India (27%), China (9%), Indonesia (8%), Filipinas (6%), Pakistán (5%), Nigeria (4%), Bangladesh (4%) y Sudáfrica (3%).
- Sólo 6% de los casos mundiales se dieron en la Región Europa de la OMS (3%) y en la Región de las Américas de la OMS (3%).
- La gravedad de las epidemias nacionales varía mucho entre los países. En 2017, hubo menos de 10 casos nuevos por cada 100.000 habitantes en la mayoría de los países de ingresos altos, entre 150 y 400 en la mayoría de los 30 países con una alta carga de TB, y más de 500 en unos pocos países, como Mozambique, Filipinas y Sudáfrica.
- La tuberculosis resistente a los medicamentos sigue siendo una crisis de salud pública. Tres países dan cuenta de casi la mitad de los casos mundiales de tuberculosis multirresistente/resistente a la rifampicina (MR/RR): India (24%), China (13%) y la Federación de Rusia (10%).
- A nivel mundial, 3,5% de los nuevos pacientes con TB y el 18% de los pacientes previamente tratados tenían TB MR/RR. Las proporciones más elevadas (>50% en pacientes previamente tratados) se dan en los países de la antigua Unión Soviética. Entre los pacientes con TB-MR en 2017, se estimó que 8,5% (intervalo de confianza del 95%, 6,2% a 11%) tenía TB extremadamente resistente a los medicamentos (TB-ER).
- La geografía de la enfermedad está cambiando, en los países occidentales principalmente debido a la inmigración, el VIH y la aparición de cepas de TB multirresistentes [8].
- En algunos países occidentales, la tuberculosis abdominal suele ser “importada”, más que “autóctona”.
- Las directrices de la Organización Europea de Crohn y Colitis (ECCO) señalan que el mero hecho de pasar una temporada en un país con una alta incidencia de TB también aumenta el riesgo de los individuos [9].
La incidencia de la tuberculosis intestinal (TBI) ha aumentado paralelamente al incremento general de la prevalencia de la tuberculosis. Uno de cada cinco pacientes con tuberculosis en la Unión Europea tiene tuberculosis extrapulmonar [10]. La incidencia de la enfermedad de Crohn (EC) también ha aumentado en las últimas décadas en todo el mundo, incluso en aquellas zonas en las que la enfermedad se consideraba rara. [11].
La tuberculosis florece donde hay pobreza y hacinamiento; se calcula que entre el 5 y el 15% de los 1.700 millones de personas infectadas por M. tuberculosis (MTB) desarrollarán una enfermedad tuberculosa clínica manifiesta a lo largo de su vida [12].
La probabilidad de desarrollar tuberculosis como enfermedad es mucho mayor entre las personas infectadas por el VIH, y entre las personas afectadas por factores de riesgo [13] como los enumerados a continuación:
- Otras causas de inmunosupresión: terapia con corticosteroides, tratamiento inmunosupresor o quimioterapia, tras el tratamiento con agentes contra el factor de necrosis tumoral (TNF) u otro tratamiento biológico, y pacientes sometidos a diálisis peritoneal ambulatoria continua.
- Enfermedades debilitantes crónicas: diabetes mellitus, enfermedades hematológicas y enfermedades pulmonares crónicas, especialmente la silicosis.
- Desnutrición, neoplasias de base, cirrosis, alcoholismo.
- Pacientes de edad avanzada.
- Personas privadas de su libertad y personas institucionalizadas con riesgo de tuberculosis.
- Personas que viajan a países con alta incidencia de TB.
La enfermedad extrapulmonar es más común en pacientes con VIH:
- En 2016, a nivel mundial, 57% de los pacientes de TB declarados tenían serología positiva de VIH documentada, en comparación con 55% en 2015. En la Región de África de la OMS, donde la carga de tuberculosis asociada al VIH es mayor, 82% de los pacientes con tuberculosis tenían un resultado positivo documentado de la prueba del VIH (frente al 81% en 2015) [12].
- El diagnóstico de tuberculosis puede preceder en varios meses al diagnóstico de SIDA; en los pacientes con SIDA es frecuente que la tuberculosis se disemine, progrese rápidamente y tenga una alta tasa de mortalidad [14].
La tuberculosis abdominal puede ocurrir debido a:
- Reactivación de un foco gastrointestinal primario quiescente:
—Originada por diseminación hematógena desde un foco pulmonar adquirido durante la primoinfección en la infancia.
—O puede ocurrir que los macrófagos transporten bacilos deglutidos por vía linfática hasta los ganglios linfáticos mesentéricos, donde permanecen latentes.
- Ingestión de bacilos de un foco pulmonar activo.
- Propagación hematógena desde una tuberculosis activa en otros órganos.
- Extensión directa desde órganos adyacentes.
- Ingestión de leche infectada:
— La práctica de beber leche sin pasteurizar, caso que se da especialmente en niños que trabajan como pastores en algunas partes del mundo, como en la región de las tierras altas de Pakistán y otras regiones de Asia Central, es una causa de tuberculosis abdominal.
— En los países occidentales esta causa es poco frecuente, gracias a que la tuberculosis bovina ha desaparecido, a la pasteurización de la leche y a la práctica de hervir la leche antes de consumirla en los países en desarrollo.
Un foco de tuberculosis latente puede reactivarse por la supresión inmunitaria debida a la edad avanzada, infección por VIH/SIDA, terapia anti-TNF, desnutrición, pérdida de peso, alcoholismo, diabetes, insuficiencia renal crónica y otras afecciones [12,14,15].
2. Características clínicas
2.1 Localizaciones
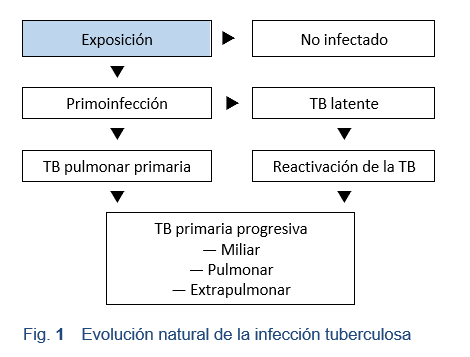
TB pulmonar. La mayoría de los casos de TB son pulmonares (Fig. 1). Entre los pacientes con TB extrapulmonar, sólo el 15-20% tiene tuberculosis pulmonar activa concomitante [8]. La tuberculosis pulmonar no está contemplada en esta directriz.
TB extrapulmonar. La tuberculosis extrapulmonar puede encontrarse en las siguientes localizaciones: laringe, ganglios linfáticos, pleura, cerebro, riñones, huesos y articulaciones, peritoneo e intestino, meninges, piel y pericardio. Los clínicos seguirán viendo casos, debido al resurgimiento de la tuberculosis que ha tenido lugar desde mediados de los años 80 en muchos países. La tuberculosis extrapulmonar se encuentra con más frecuencia en personas infectadas por el VIH u otros inmunodeprimidos, y en niños pequeños. La tuberculosis abdominal es la única tuberculosis extrapulmonar cubierta en esta directriz.
TB miliar. Una tercera forma de tuberculosis, aunque poco frecuente, es la tuberculosis miliar, una forma de la enfermedad en la que las partículas tuberculosas son diseminadas por todo el organismo a través del torrente sanguíneo. La tuberculosis miliar no está contemplada en esta directriz.
TB abdominal. La tuberculosis puede afectar a cualquier parte del tracto gastrointestinal, desde la boca hasta el ano (49%), el peritoneo (42%), los ganglios linfáticos mesentéricos (4%) y las vísceras sólidas, incluidos el hígado y el sistema pancreático-biliar (5%)[13,16]. La localización más frecuentemente afectada en la TB intestinal es la región ileocecal, seguida por el colon y el yeyuno.
- La TB abdominal es una enfermedad predominantemente de adultos jóvenes.
- En una amplia serie de casos, la tuberculosis del tubo digestivo se localizó en el tracto gastrointestinal alto (8,5% de los casos), en el intestino delgado (33,8%), en el intestino grueso (22,3%), en el peritoneo (30,7%) y en el hígado (14,6%) [17].
2.2 Síntomas y signos físicos
Los síntomas y signos de la tuberculosis gastrointestinal y peritoneal son inespecíficos, y el hecho que el diagnóstico pueda pasar desapercibido o demorarse aumenta la morbimortalidad.
La mayoría de los pacientes con tuberculosis abdominal se presentan con síntomas que llevan entre 1 mes y 1 año. Estos pacientes pueden quejarse de dolor abdominal, emaciación, pérdida de peso en general, pérdida de apetito, fiebre, diarrea, estreñimiento, hemorragia rectal y edema [18]. Los síntomas suelen ser de intensidad moderada.
La coexistencia con una TB pulmonar aumenta significativamente la frecuencia de la fiebre y los sudores nocturnos, el adelgazamiento y los síntomas pulmonares.
La TB puede estar asociada a una serie de manifestaciones de mediación inmunitaria como eritema nodoso, eritema indurado, artritis reactiva (enfermedad de Poncet) y uveítis, que pueden emular las manifestaciones extraintestinales de la enfermedad de Crohn [19–22].

El examen físico puede revelar palidez, ascitis o abdomen pastoso y dolor exquisito generalizado a la palpación abdominal, especialmente en la fosa ilíaca derecha. Los pacientes pueden presentar hepatomegalia y tumoraciones abdominales debido a compromiso hepático, adenomegalias, adherencias de asas intestinales o un absceso frío [13].
Los síntomas y signos de la TB abdominal son inespecíficos y pueden confundirse con los de la EC y otras patologías gastrointestinales. La TB puede confundirse con cánceres de las zonas correspondientes. Se han descrito casos de TB intestinal en pacientes asintomáticos que se someten a colonoscopias por otros motivos.
El dolor es la presentación más frecuente; está presente en cerca del 85%; hay pérdida de peso en 66%, fiebre en el 35-50% y diarrea en el 20% de los pacientes.
- El 30% de los pacientes puede presentar manifestaciones sistémicas como febrícula, aumento de la temperatura por la noche, letargo, malestar, sudores nocturnos y pérdida de peso. Esto se observa con mayor frecuencia en la peritonitis tuberculosa de tipo ascítico y en las lesiones ulcerosas del intestino.
- En la mayoría de los pacientes se encuentra sensibilidad abdominal, y entre 25 y 50% de ellos se puede apreciar una tumoración abdominal, generalmente en el cuadrante inferior derecho.
- Puede haber malabsorción en el 21-75% de los casos [4].
- Abdomen agudo: en los países en desarrollo, la tuberculosis extrapulmonar (abdominal) a menudo aparece como cuadros agudos de abdomen que representan verdaderas emergencias quirúrgicas, como perforaciones y obstrucciones intestinales [4].
- La presencia de ascitis puede deberse a una tuberculosis peritoneal, a neoplasias o a enfermedades hepáticas, cardíacas, renales o como otras enfermedades infecciosas [23].
- La TB peritoneal con ascitis puede presentar menos sensibilidad y defensa que la peritonitis piógena con perforación.
- El abdomen en capullo es una forma infrecuente de tuberculosis abdominal, caracterizada por la formación de un saco fibroso parecido a una membrana que envuelve las asas del intestino delgado. Algunos pacientes responden bien al tratamiento conservador con terapia antituberculosa (TAT), pero los pacientes que no responden requieren cirugía [24].
- La TB anorrectal puede presentarse como estenosis, fístulas o fisuras anales.
- La TB gástrica puede simular una úlcera péptica o un carcinoma, o puede presentarse con perforación u obstrucción del tracto de salida gástrico. Lo más frecuente es que aparezca como fístulas en la mucosa antral, más que en la del cuerpo del estómago, y es bastante frecuente que produzca estenosis pilórica.
- TB duodenal: los pacientes suelen relatar síntomas de obstrucción debido a la estenosis luminal [25], y pueden tener antecedentes de dispepsia. Sin embargo, se produce una infiltración submucosa sin una clara necrosis de los ganglios linfáticos (NGL).
- TB esofágica: rara; síntomas constitucionales, disfagia, odinofagia, molestia retroesternal, dolor [18]; puede confundirse con los cánceres de las áreas correspondientes.
- La TB ileocecal y del intestino delgado puede debutar con una complicación como obstrucción intestinal, a veces fístulas del colon o de la vejiga, perforación o malabsorción, especialmente en presencia de una estenosis.
- TB rectal: la hematoquecia es el síntoma más común, seguido de los síntomas constitucionales y el estreñimiento; el tacto rectal puede revelar una estenosis anular, con áreas focales de ulceración profunda.
- La TB hepática suele ser insidiosa y a menudo es inespecífica. El paciente puede presentarse con una enfermedad arrastrada, frecuentemente asociada a fiebre, malestar, pérdida de peso, ictericia, dolor abdominal y hepatomegalia. La afectación hepática puede ser en forma de enfermedad granulomatosa, o una parte de una tuberculosis miliar, o una enfermedad hepática que se presenta como un absceso localizado. El compromiso de las vías biliares puede deberse a un aumento de tamaño de los ganglios linfáticos tuberculosos o a estenosis inflamatoria, y puede causar ictericia obstructiva.
— El hígado no suele ser doloroso a la percusión o a la palpación.
— En algunos casos puede haber esplenomegalia.
— Estos pacientes suelen presentar anemia.
— Puede haber una ictericia leve, que luego puede agravarse.
- La TB pancreática es más frecuente en mujeres.
— Se presenta con dolor epigástrico, fiebre y pérdida de peso; puede haber ictericia, pero no necesariamente.
—Otras presentaciones clínicas son la pancreatitis aguda o crónica y la hemorragia gastrointestinal secundaria a una trombosis esplénica o de la vena porta.
—Debe sospecharse en pacientes jóvenes que presentan una tumoración pancreática o ganglios linfáticos hipodensos en la región peripancreática, especialmente si se presentan con fiebre, sin ictericia, viven en una zona endémica de tuberculosis o han estado expuestos a la tuberculosis en el pasado.
La tuberculosis debe considerarse siempre como diagnóstico diferencial de cuadros gastrointestinales inusuales, especialmente en las zonas altamente endémicas de tuberculosis.
Fuentes: [4,17,18,23] y otras referencias mencionadas en el texto anterior.
3. Diagnóstico
3.1 Cascadas para el diagnóstico de la tuberculosis gastrointestinal
Cascadas de opciones o alternativas sensibles al contexto y a los recursos para países y regiones con diferentes niveles de recursos y acceso, y con diferentes culturas y epidemiología.

En la actualidad no existe una prueba estándar para el diagnóstico de la infección tuberculosa latente y la detección temprana de la tuberculosis activa; por ende, no hay ninguna prueba que sea adecuada para el diagnóstico de la tuberculosis abdominal en todos los pacientes. La tuberculosis abdominal en pacientes no infectados por el VIH sigue siendo un dilema diagnóstico que requiere un alto índice de sospecha clínica [16].
La tuberculosis abdominal debe considerarse siempre como uno de los diagnósticos diferenciales de un abdomen agudo o crónico en zonas endémicas [4] y en ciertas situaciones particulares en países desarrollados, como en pacientes con VIH y en pacientes que reciben tratamiento con fármacos inmunosupresores o biológicos.
Se puede hacer un diagnóstico definitivo de tuberculosis gastrointestinal si se da alguno de los cuatro criterios siguientes [26]:
Cultivo de tejido (biopsia de colon, ganglios linfáticos) positivo para M. tuberculosis
Demostración histológica de bacilos ácido-resistentes típicos (BAR)
Evidencia histológica de granuloma caseoso
Prueba de rifampicina (RIF) MTB GeneXpert/reacción en cadena de la polimerasa (PCR) realizada en una pieza de biopsia
El diagnóstico de TB peritoneal es uno de los diagnósticos diferenciales de la ascitis exudativa (proteína > 2,5 g/dl) con predominio linfocítico y/o un gradiente de albúmina sérica-ascítica de < 1,1 mg/dl. Los niveles de adenosina deaminasa están elevados. La confirmación microbiológica o patológica sigue siendo el patrón oro para el diagnóstico [27].
Un diagnóstico de TB intestinal [28] debe basarse en:
Al menos ocho biopsias realizadas durante la colonoscopía para evaluación histopatológica.
La prueba tisular del bacilo ácido-resistente (BAR) y la positividad del cultivo en cualquier resultado es diagnóstica; sin embargo, un resultado negativo no descarta el diagnóstico de tuberculosis intestinal.
Se recomienda la evaluación de la PCR tisular; un resultado positivo es significativo.
—Se puede realizar las pruebas en muestras antiguas de forma retrospectiva.
— Un resultado negativo no descarta el diagnóstico de tuberculosis.
Una prueba positiva de derivado proteico purificado (PPD) y una prueba positiva de liberación de interferón-gamma (IGRA).
— en los países en desarrollo es frecuente encontrar pruebas PPD positivas, incluso en la enfermedad de Crohn y otras causas de ascitis.
— Las pruebas de PPD o IGRA se utilizan en los países de altos recursos para diagnosticar la exposición previa a la tuberculosis.
— Las pruebas de PPD o IGRA no pueden utilizarse para confirmar un diagnóstico de tuberculosis abdominal, especialmente en los países en desarrollo, donde existe una elevada exposición a la tuberculosis y a donde se vacuna con la BCG (bacilo de Calmette-Guérin).
3.2 Estudios
A pesar de los avances en los métodos de diagnóstico, una proporción considerable de los casos de tuberculosis notificados a la Organización Mundial de la Salud siguen diagnosticándose clínicamente en lugar de confirmarse bacteriológicamente, debido a la falta de fondos o a la falta de conocimientos a nivel local. En 2016, menos del 60% de los casos pulmonares notificados a la OMS tuvieron confirmación bacteriológica [12].
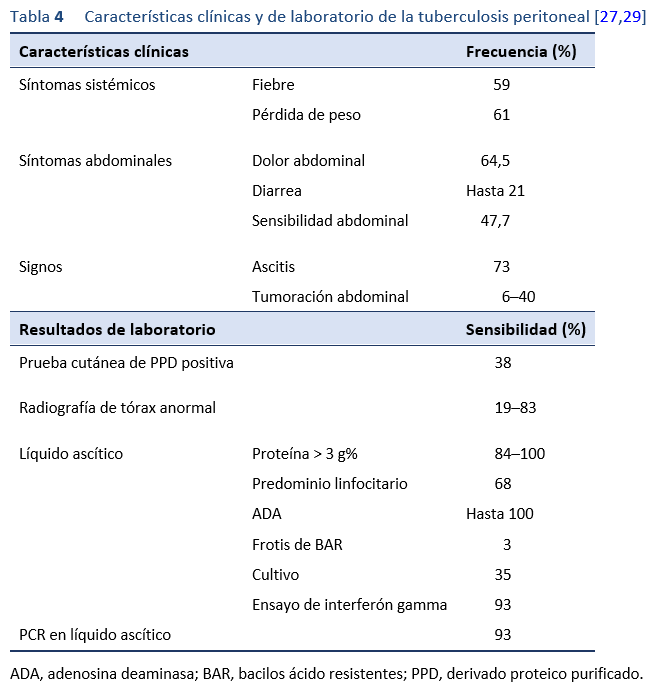
3.2.1 Pruebas de laboratorio de rutina
Las pruebas de laboratorio de rutina revelan una anemia leve y un aumento de la velocidad de eritrosedimentación en el 50-80% de los pacientes. El recuento de glóbulos blancos suele ser normal [18].
3.2.2 Radiología
La tomografía computarizada (TC) con contraste por vía oral es la modalidad de imagen más útil para evaluar la patología intraluminal y extraluminal. Puede mostrar la localización y la extensión del proceso inflamatorio y la afectación de intestino, mesenterio, peritoneo, ganglios linfáticos y órganos sólidos, así como compromiso retroperitoneal [17,18,30]. Puede discriminar entre ascitis carcinomatosa y tuberculosis peritoneal. La presencia de adenopatías necróticas es diagnóstica de tuberculosis peritoneal. Si procede, la enterografía por TC puede detectar y cartografiar el intestino delgado afectado.
Ultrasonido. La ultrasonografía endoscópica (USE) puede ayudar a obtener imágenes de diversas lesiones cercanas a la luz gastrointestinal; las lesiones también se pueden aspirar o biopsiar mediante aspiración con aguja fina guiada por USE o biopsia. Se pueden tomar biopsias específicas de los ganglios linfáticos, el hígado y el páncreas [32]. La ecografía es útil para obtener imágenes de la tuberculosis peritoneal [18].
La resonancia magnética (RM) no puede detectar pequeñas calcificaciones dentro de los ganglios o tumoraciones y no resulta de utilidad para distinguir entre la enfermedad de Crohn y la tuberculosis intestinal.
Radiografía de tórax. Una radiografía de tórax negativa no excluye la TB abdominal.
3.2.3 Endoscopía
La endoscopia con biopsia puede ser útil para diagnosticar la tuberculosis intestinal si la zona del intestino afectada está al alcance de un endoscopio flexible. No es infrecuente que no se haya considerado la enfermedad hasta el momento de la cirugía [8]. La enteroscopía de doble balón puede ser útil para obtener biopsias. En caso de infiltrado duodenal sin úlceras claras, para obtener mejores biopsias puede ser útil realizar una polipectomía tras un banding [25].
- Se puede hacer el diagnóstico de tuberculosis intestinal rápidamente si se observan bacilos ácido-resistentes o granulomas caseosos en el tejido de biopsia.
- En caso de tuberculosis peritoneal, debe realizarse una endoscopia para descartar un cáncer primario de origen digestivo (ascitis carcinomatosa).
- Se puede recurrir a la enteroscopia y la cápsula endoscópica para estudiar patología del intestino delgado. En pacientes en los que se sospecha estenosis debe evitarse el uso de la cápsula endoscópica.
3.2.4 Laparoscopia
La laparoscopia con biopsia se utiliza para diagnosticar la TB peritoneal, pero su papel es menos claro en la TB intestinal [17]. La laparoscopia con biopsia dirigida permite un diagnóstico rápido y específico [8].
- Los hallazgos de la laparoscopia diagnóstica pueden incluir: peritoneo engrosado, ascitis, nódulos blanquecinos, ganglios linfáticos, adherencias fibróticas y hepatomegalia.
- La envoltura de grasa intestinal es inusual en la TB intestinal [33,34] y estaría a favor del diagnóstico de enfermedad de Crohn.
3.2.5 Patología
En caso de TB, las biopsias muestran bacilos ácido-resistentes o granulomas caseosos, pero la tinción para bacilos ácido-resistentes carece de sensibilidad y especificidad. El diagnóstico diferencial entre la enfermedad de Crohn (EC) y la TB nunca es del todo sencillo y, pese a que es raro que ambas coexistan, es una posibilidad, especialmente en pacientes que reciben terapias biológicas.
Es difícil hacer el diagnóstico de tuberculosis intestinal por medio de biopsia endoscópica de la mucosa; arroja poca información porque la enfermedad es submucosa (demostración de BAR, PCR de tuberculosis positiva, granulomas caseificantes o cultivo de tuberculosis positivo). Pulimood y otros han descrito una serie de características histológicas en las muestras de biopsia de la mucosa que permiten hacer el diagnóstico de tuberculosis intestinal aun en ausencia de bacilos ácido-resistentes y de inflamación granulomatosa caseificante [35–37]. Entre esos elementos que permiten el diagnóstico se incluyen los granulomas confluentes, la presencia de múltiples granulomas en un lugar de biopsia determinado, el gran tamaño de los granulomas, las bandas de histiocitos epitelioides que revisten las úlceras, los granulomas submucosos y una inflamación submucosa desproporcionada, es decir, inflamación submucosa que supera significativamente la inflamación de la mucosa.
Los hallazgos histopatológicos pueden incluir cambios inflamatorios inespecíficos:
- Se puede obtener tejido para histología a partir de cirugía, colonoscopia, biopsia guiada por ecografía o TC, laparoscopia y endoscopia del tracto digestivo superior.
- La tuberculosis es una enfermedad inflamatoria granulomatosa crónica, pero eso no quiere decir que necesariamente en todas las muestras haya granulomas.
- Las lesiones intestinales pueden ser ulcerosas (60%), hipertróficas (10%) y ulcerohipertróficas (30%) [13].
- Si hay una alta sospecha de tuberculosis, debe enviarse material para análisis microbiológico [31] y pruebas moleculares.
El estudio microscópico de un frotis con tinción ácido resistente comprende el examen bacteriológico de fluidos biológicos en pacientes con sospecha de tuberculosis abdominal.
- La mayoría de los estudios comunican una alta tasa de negatividad en las muestras de esputo, orina y ascitis. La probabilidad de que un frotis con tinción ácido-resistente dé positivo puede aumentar si se muestrea un mayor número de sitios [4].
- La técnica que se desarrolló hace más de 100 años consistía en examinar las muestras de esputo al microscopio para detectar la presencia de bacterias. En las definiciones de casos recomendadas actualmente por la OMS se exige un resultado positivo para el diagnóstico de tuberculosis pulmonar con frotis positivo.
- No se recomienda tratar de detectar la presencia de BAR en heces, ya que las micobacterias comensales no tuberculosas pueden dar un falso positivo, sin que haya tuberculosis intestinal.
3.2.6 Microbiología
Métodos basados en cultivos. Son el estándar de referencia actual. Requieren una capacidad de laboratorio más desarrollada; el cultivo de las biopsias para detectar MTB lleva mucho tiempo (de 3 a 8 semanas hasta 12 semanas) [12], y los resultados son frecuentemente negativos (con una precisión que oscila entre el 25% y el 35% [17] e incluso más baja en otros estudios).
3.2.7 Resultados de las pruebas serológicas
Pruebas moleculares rápidas. La única prueba rápida para diagnosticar la tuberculosis recomendada actualmente por la OMS es el ensayo Xpert® MTB/RIF (Cepheid, Sunnyvale, California, EE. UU.).
- Se puede tener los resultados en 2 horas, y se la recomendó inicialmente (en 2010) para el diagnóstico de la tuberculosis pulmonar en adultos. Desde 2013, también se recomienda su uso en niños y para diagnosticar formas específicas de tuberculosis extrapulmonar. La prueba tiene una exactitud mucho mayor que la microscopía de frotis de esputo [12].
- Para el diagnóstico de la tuberculosis abdominal, un artículo de revisión indio menciona un estudio realizado en Delhi en pacientes con tuberculosis intestinal que mostró una baja sensibilidad para el diagnóstico de la tuberculosis intestinal: sólo tres de los 37 pacientes (8%) dieron positivo con Xpert. En cuanto a la tuberculosis peritoneal, dos informes sugieren que la sensibilidad de Xpert también es baja, ya que solo 12 de 67 casos sospechosos (17,9%) en una serie y cuatro de 21 (19%) casos en otra serie dieron positivos con Xpert [38].
- Un metaanálisis de 2015 en el que se incluyeron 36 estudios concluyó que Xpert tiene un alta especificidad pero una sensibilidad limitada para detectar la tuberculosis extrapulmonar (TBEP). Los resultados positivos de la prueba Xpert pueden servir para identificar los casos de TBEP rápidamente, pero si la prueba es negativa no se puede descartar la enfermedad con tanta certeza [39].
- Un estudio de 2018 que analizó GeneXpert MTB/RIF para el diagnóstico de la tuberculosis abdominal (datos de 21 pacientes) encontró que la sensibilidad de GeneXpert fue del 28,57%, con una especificidad del 0%. Los autores concluyeron que en su estudio GeneXpert mostró mala sensibilidad y especificidad para detectar tuberculosis abdominal a partir de muestras de líquido de ascitis.
Ensayos de liberación de interferón gamma (IGRA). Las pruebas IGRA se basan en la estimulación de una respuesta inmunitaria celular mediante los antígenos inmunodominantes ESAT-6 y CFP10 específicos de MTB, y ofrece una alternativa diagnóstica a la prueba cutánea de la tuberculina.
Las opciones de la prueba IGRA incluyen:
- La prueba QuantiFERON-TB Gold In-Tube (QFT, Qiagen, Hilden, Alemania), basada en sangre total. Su exactitud disminuye en pacientes que reciben agentes inmunosupresores [40].
- Prueba T-SPOT.TB (enzyme-linked immunospot/ELISPOT, Oxford Immunotec, Abingdon, Reino Unido), basada en células mononucleares de sangre periférica purificada.
Varios estudios han confirmado el valor informativo de estas pruebas en el diagnóstico de la tuberculosis, y la aparición de las pruebas IGRA puede mejorar la identificación de una infección tuberculosa latente (ITBL) [41].
Las ventajas principales de estas pruebas son:
- No se ven afectadas por la vacunación previa con BCG.
- No hay reacción cruzada con la mayoría de las micobacterias no tuberculosas.
- Se puede completar en una única consulta.
He aquí las desventajas:
- El costo de las pruebas, de 100 dólares o más, puede dificultar su recomendación en países de bajos ingresos.
- Requieren un laboratorio especialmente equipado, personal capacitado y procedimientos invasivos.
- La prueba IGRA no distingue entre infecciones tuberculosas activas y latentes.
- Una prueba IGRA negativa no descarta una ITBL.
- Las pruebas no pueden predecir la evolución de la tuberculosis latente [11].
Aunque sigue siendo difícil determinar la superioridad entre IGRA y la prueba cutánea de la tuberculina o de Mantoux (TST, por sus siglas en inglés), ambas pruebas se ven negativamente afectadas por el tratamiento inmunosupresor. Por lo tanto, debe considerarse la posibilidad de realizar los estudios de detección antes de iniciar el tratamiento inmunosupresor. Es imprescindible que todos los pacientes se sometan a pruebas de tamizaje antes de iniciar el tratamiento con anti-TNF [40].
La prueba IGRA puede utilizarse como parte de la evaluación global del riesgo para identificar a los individuos que deben recibir un tratamiento preventivo (por ejemplo, las personas inmunodeprimidas, los niños, los contactos cercanos y los individuos expuestos recientemente) [42], pero debido a las desventajas mencionadas, las pruebas IGRA no sirven para los estudios de tamizaje a gran escala, especialmente en poblaciones infantiles.
La determinación de los niveles de interferón-gamma en el líquido de ascitis puede ser una técnica con aplicación futura en el diagnóstico de la TB peritoneal [27].
El Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC) ha publicado la siguiente guía sobre el uso de ensayos de liberación de interferón-gamma para apoyar el diagnóstico de TB [42]:
- Las pruebas IGRA no deben sustituir a los métodos de diagnóstico estándar (a saber, la microbiología, las pruebas moleculares y la evaluación clínica y radiológica) para el diagnóstico de TB activa.
- Las pruebas IGRA no añaden ningún valor en la mayoría de las situaciones clínicas cuando se combinan con los métodos estándar para el diagnóstico de la TB activa.
- Sin embargo, basándose en evidencias limitadas, en determinadas situaciones clínicas (por ejemplo, pacientes con tuberculosis extrapulmonar, pacientes con pruebas negativas para bacilos ácido-alcohol resistentes en el esputo y/o negativas para M. tuberculosis en el cultivo, diagnóstico de tuberculosis en niños, o en el diagnóstico diferencial de la infección por micobacterias no tuberculosas), las pruebas IGRA pueden aportar información complementaria que aporta a la valoración diagnóstica. Una prueba IGRA negativa no descarta la tuberculosis activa.
- Sobre la base de los resultados disponibles para el valor predictivo positivo (VPP) para evaluar la evolución, y teniendo en cuenta la escasa potencia estadística y el pequeño número de estudios, las pruebas IGRA pueden utilizarse como parte de la evaluación global del riesgo para identificar a los individuos que deben recibir tratamiento preventivo (por ejemplo, personas inmunodeprimidas, niños, contactos cercanos e individuos expuestos recientemente).
- Del mismo modo, a pesar de las limitaciones de los estudios disponibles, el alto valor predictivo negativo (VPN) de las pruebas IGRA para evaluar la progresión indica que en el momento de la prueba y en el contexto de una evaluación global del riesgo, en individuos sanos e inmunocompetentes con una prueba IGRA negativa la progresión a la tuberculosis activa es muy poco probable. Por lo tanto, las pruebas IGRA pueden utilizarse en este contexto.
- Debe tenerse en cuenta que, especialmente en grupos de riesgo y situaciones específicas, una IGRA negativa no descarta la ITBL.
3.2.8 Prueba de reacción en cadena de la polimerasa
PCR. Se ha comprobado que el ensayo de PCR para MTB en muestras de biopsia endoscópica o quirúrgica de pacientes con TBI tiene un alto nivel de exactitud para diagnosticar la TBI, con una especificidad de hasta el 95% y una precisión del 82,6% [17].
- Un metaanálisis realizado en 2017 concluyó que la PCR para MTB es un método de diagnóstico prometedor y altamente específico para distinguir entre TBI y EC. Sin embargo, los resultados negativos no pueden descartar la TBI, debido a la baja sensibilidad de la prueba [43].
- La prueba de PCR en el líquido de ascitis puede ser útil en la tuberculosis peritoneal [29].
3.2.9 Prueba cutánea de la tuberculina
PPD. El derivado proteico purificado (PPD) es una versión avanzada de la prueba cutánea de tuberculina (TST). Se basa en componentes proteicos de filtrados de cultivos de MTB y se utiliza para diagnosticar la infección de tuberculosis (latente).
- La reacción a la inyección intradérmica de 0,1 ml de PPD debe leerse pasadas las 48-72 horas.
- Si la primera prueba es negativa, se la puede repetir al cabo de 1 a 3 semanas.
- La prueba de PPD es positiva en aproximadamente 70% de los pacientes, pero un resultado negativo no excluye la enfermedad.
Un falso negativo de PPD puede deberse a:
- Citoquinas iniciadas durante la enfermedad activa.
- Anergia debida a otra afección que comprometa el sistema inmunológico, como el VIH y otras infecciones virales.
- Tuberculosis grave, es decir, diseminada.
- Cualquier tratamiento inmunosupresor.
- Mala nutrición.
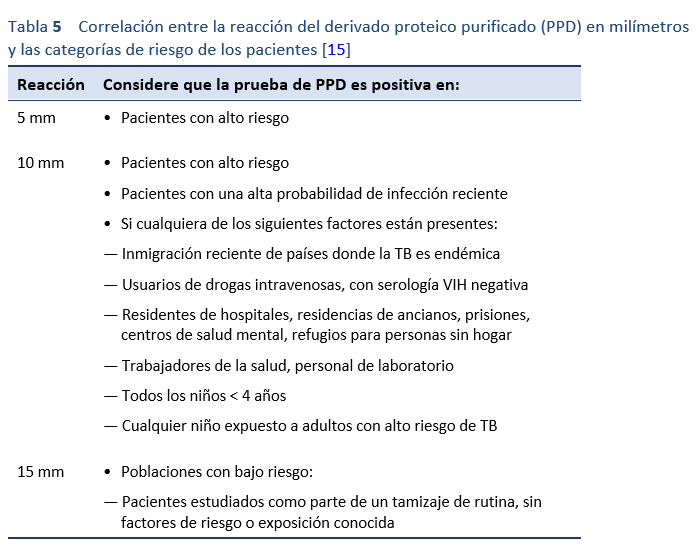
No es seguro cuál es el valor diagnóstico de la prueba cutánea de PPD para la TBI, y los resultados dependen de la prevalencia de TB en la población estudiada [13,15,17]:
- En una comunidad de alta prevalencia (> 20 por 100.000/año) es más probable que una prueba positiva indique una verdadera infección tuberculosa, mientras que puede ser un falso positivo en una comunidad de baja prevalencia (< 10 por 100.000/año).
- En las zonas del mundo en las que todavía se vacuna con BCG, la tasa de falsos positivos de esa prueba cutánea es muy elevada.
El valor diagnóstico también es limitado en pacientes que al momento de la lectura de la PPD tengan una respuesta inmunitaria debilitada. Esto puede deberse a
— infección por VIH
— TB primaria y diseminada
— Uso de corticoides o medicación inmunomoduladora
3.2.10 Adenosina deaminasa
La adenosina deaminasa (ADA) es un marcador enzimático fiable de ascitis tuberculosa. Un valor de corte de ADA entre 36 y 40 UI/l tiene una alta sensibilidad (100%) y especificidad (97%) para diagnosticar una tuberculosis peritoneal [23,44].
- La evaluación de la actividad de ADA en líquido de ascitis es una prueba relativamente sensible y específica para el diagnóstico de peritonitis tuberculosa: las cifras agrupadas de sensibilidad y especificidad para el diagnóstico de peritonitis tuberculosa fueron 0,93 (IC del 95%, 0,89 a 0,95) y 0,96 (IC del 95%, 0,94 a 0,97), respectivamente, en un metaanálisis de 16 estudios [45], y de 0,93 y 0,94, respectivamente, en un estudio con datos de 17 estudios que incluían a 1797 pacientes [46].
- En los países occidentales, especialmente en los grupos de pacientes de alto riesgo, este procedimiento de prueba también puede sustituir a los estudios invasivos.
- Es posible que los centros médicos en general no dispongan de una prueba de actividad ADA.
- Especialmente en las zonas subdesarrolladas, donde la laparoscopia puede no estar disponible y la tuberculosis es endémica, la medición de los niveles de adenosina deaminasa (ADA) en la ascitis constituye una herramienta importante para el diagnóstico de la peritonitis tuberculosa [8].
3.2.11 Tecnologías de diagnóstico de la tuberculosis aprobadas por la OMS
Detección molecular de la tuberculosis y de la resistencia a los medicamentos
- Xpert MTB/RIF Ultra para detectar la tuberculosis y la resistencia a la rifampicina en muestras pulmonares, extrapulmonares y pediátricas (Cepheid, Sunnyvale, California, EE.UU.)
- Ensayos con sondas en línea para la detección de Mycobacterium tuberculosis (MTB), resistencia a la isoniazida y resistencia a la rifampicina en cultivos de esputo o MTB con bacilos ácido-resistentes (FL-LPA) (Hain Lifescience GmbH, Nehren, Alemania y Nipro, Osaka, Japón)
- Ensayos con sondas en línea para detectar la resistencia a las fluoroquinolonas y a los agentes inyectables de segunda línea (SL-LPA) (Hain Lifescience GmbH)
- TB LAMP para detección de la tuberculosis (Eiken Chemical Co., Ltd., Tokio, Japón)
Tecnologías no moleculares
- Alere Determine TB-LAM (Alere International Ltd., Galway, Irlanda) - para detectar la tuberculosis en personas con enfermedad de VIH grave
- Ensayo de liberación de interferón-gamma (IGRA) para el diagnóstico de la infección tuberculosa latente (ITBL) (Oxford Immunotec, Abingdon, Reino Unido; Qiagen, Germantown, Maryland, Estados Unidos)
Tecnologías basadas en cultivos
- Sistemas comerciales de cultivo líquido y especiación rápida
- Pruebas fenotípicas de sensibilidad a los medicamentos (DST, por sus siglas en inglés) basadas en el cultivos, utilizando una proporción crítica del 1% en medios LJ,7H10,7H11 y tubo indicador de proliferación de micobacterias (MGIT)
Microscopía
- Microscopio de luz y microscopio de diodos emisores de luz (diagnóstico y seguimiento del tratamiento) [12]
3.3 Diagnóstico diferencial
3.3.1 Tuberculosis peritoneal
Diagnóstico diferencial basado en el tipo de lesión [14]:
Ascitis: causas de ascitis exudativa - por ejemplo, ascitis carcinomatosa, síndrome de Budd-Chiari
Tubérculos: carcinomatosis

3.3.2 Tuberculosis intestinal
Diagnóstico diferencial basado en el tipo de lesión [14]:
- Ulcerosa: Enfermedad de Crohn, yeyunitis ulcerosa (enfermedad celíaca refractaria tipo 2), esprúe tropical, enfermedad inmunoproliferativa del intestino delgado
- Estenosis: Enfermedad de Crohn, enfermedad maligna (adenocarcinoma y linfoma), isquémica
- Hipertrófica: carcinoma del ciego, bulto apendicular, granuloma amebiano, actinomicosis, enfermedad de Crohn
- Perforaciones: tifoidea, enfermedad de Crohn
- Fístulas: Enfermedad de Crohn
3.3.3 TB y enfermedad de Crohn
La enfermedad de Crohn (EC) es una enfermedad inflamatoria idiopática con un trasfondo genético bien definido y modificado por múltiples factores ambientales [17]. El diagnóstico de la EC se basa en una combinación de características clínicas, endoscópicas e histológicas [26].
Junto con la incidencia de la tuberculosis, también ha aumentado la incidencia de la EC en zonas endémicas de tuberculosis [17,48,49].
- Según un estudio realizado en Arabia Saudí, la incidencia media anual de EC durante dos décadas aumentó de 0,32/100.000 a 1,66/100.000; se encontraron resultados similares en la población pediátrica de la misma zona.
- En un estudio libanés que abarcó los años 2000-2004, la incidencia media anual fue de 1,4/100.000; también se observaron resultados similares en Irán, Asia y Sudáfrica.
- En un estudio epidemiológico a gran escala sobre la enfermedad de Crohn y colitis en Asia-Pacífico, basado en la población de ocho países de Asia y en Australia, se comunicaron los siguiente valores brutos de incidencia global anual para los individuos:
—Para Asia: 1,37/100.000 para la enfermedad inflamatoria intestinal (EII), 0,76/100.000 para la colitis ulcerosa (CU), 0,54/100.000 para la EC y 0,07/100.000 para EII indeterminada.
—En Australia: 23,67/100.000 para la EII, 7,33/100.000 para la CU, 14,00/100.000 para la EC y 2,33/100.000 para la EII indeterminada.
—China tenía la mayor incidencia de EII de Asia, con 3,44/100.000.
—La relación entre la CU y la EC fue de 2,0 en Asia y de 0,5 en Australia. [48].

La EII es un importante diagnóstico diferencial tanto en los países desarrollados como en los países en desarrollo. En los países en vías de desarrollo con tuberculosis endémica con altas tasas de infección latente, no es apropiado realizar pruebas de “exposición” a individuos por lo demás sanos.
3.3.4 Otros diagnósticos a considerar
- Pseudomixoma peritoneal
- Linfomatosis peritoneal
- Leiomiomatosis peritoneal difusa
- Esplenosis benigna
4. Tratamiento
4.1 Tratamiento farmacológico de la TB extrapulmonar
Los pacientes con TB abdominal deben recibir una serie completa de tratamiento antituberculoso.
En la actualidad se recomienda tratar la TBI no complicada durante 2 meses, tal como se detalla en la Tabla 8. Debe evitarse un tratamiento más prolongado, ya que suele asociarse con un mal cumplimiento y un mayor riesgo de efectos secundarios de los fármacos potencialmente tóxicos.

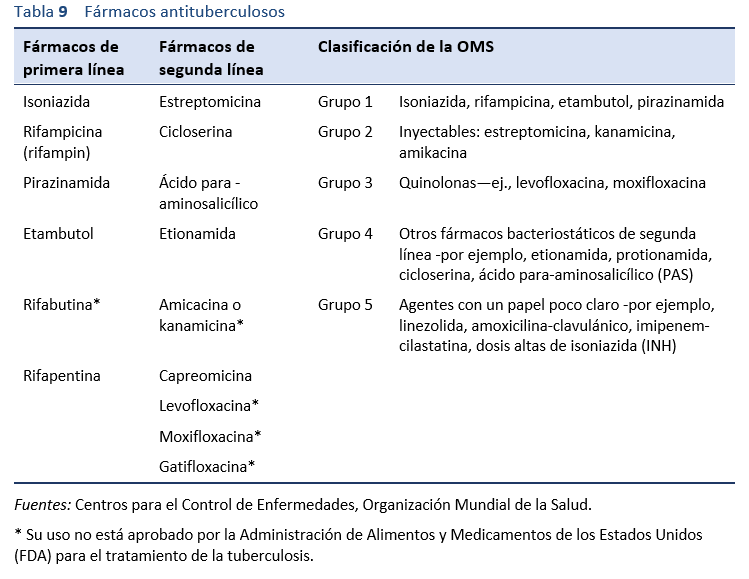
Notas [5,8]
• La tuberculosis extrapulmonar debe tratarse con los mismos regímenes farmacológicos antituberculosos que la tuberculosis pulmonar. Todos los regímenes - de 6, 9 y 18-24 meses - son eficaces para la tuberculosis extrapulmonar.
- Una revisión de Cochrane no encontró evidencia que sugiera que los regímenes de tratamiento de 6 meses son inadecuados para tratar a las personas que tienen tuberculosis intestinal y peritoneal, pero las cifras son pequeñas [5].
• El tratamiento antituberculoso debe iniciarse inmediatamente (independientemente del recuento de CD4 en caso de coinfección por VIH y TB).
• La terapia estándar de al menos 9 meses de duración también es eficaz en la mayoría de los pacientes con SIDA que inician un tratamiento adecuado en el momento oportuno y que cumplen con las indicaciones.
• Hay que tener en cuenta el potencial de resistencia a múltiples fármacos.
•. El tratamiento de la tuberculosis en los pacientes con SIDA es el mismo que en los pacientes sin infección por el VIH, pero la tuberculosis multirresistente es más frecuente en los pacientes con SIDA.
4.2 Efectos colaterales
Puede haber hepatotoxicidad provocada por la isoniazida (INH), la rifampicina (RIF) o la pirazinamida (PZA)
- La hepatitis inducida por fármacos puede ser sintomática o asintomática [15].
- Se define en pacientes asintomáticos como un nivel de aspartato transaminasa sérica (AST) cinco veces superior al límite superior de la normalidad.
- En los pacientes sintomáticos (que suelen presentarse con dolor abdominal, náuseas y vómitos) se define como una AST tres veces superior al límite superior de la normalidad.
- Si un paciente acude al servicio de urgencias con una elevación importante de la AST, debe suspenderse la medicación.
Vigilancia para la detección de hepatotoxicidad medicamentosa (DIH, por sus siglas en inglés) o de lesión hepática medicamentosa (DILI, por sus siglas en inglés). [11]
- Los pacientes que reciben tratamiento antituberculoso con fármacos de primera línea deben hacerse una medición inicial de las enzimas hepáticas (transaminasas, bilirrubina y fosfatasa alcalina).
- En pacientes con factores de riesgo epidemiológico se debe descartar la hepatitis viral aguda mediante pruebas de hepatitis B y C.
- En las siguientes situaciones se recomiendan repetir las mediciones de las enzimas hepáticas -cada 2 semanas durante los primeros 3 meses, y luego mensualmente- (no es necesario para los pacientes con resultados basales normales):
— Resultados basales anormales
— Sospecha de reacción de hepatotoxicidad medicamentosa (DIH)
— Enfermedad hepática (por ejemplo, hepatitis B o C, abuso de alcohol)
— Embarazo y mujeres en los primeros 3 meses después del parto
— Tratamiento combinado con pirazinamida en la fase de continuación
- Los síntomas de toxicidad hepática incluyen: anorexia, náuseas, vómitos, orina oscura, ictericia, erupción cutánea, prurito, fatiga, fiebre, molestias abdominales (especialmente en el cuadrante superior derecho), hematomas o hemorragias fáciles y artralgias.
— Se les debe explicar los síntomas a los pacientes.
— En las consultas mensuales se debe preguntar al paciente directamente sobre estos síntomas.
— Los pacientes deben comunicar inmediatamente la aparición de cualquier signo o síntoma que se produzca en el intervalo entre las visitas mensuales.
- Predictores positivos de DIH:
— > 35 años (el riesgo de desarrollar DILI por tratamiento contra la tuberculosis es cuatro veces mayor)
— Sexo femenino
— Hepatitis B (el riesgo en los portadores de HBsAg es cuatro veces mayor que en los no portadores)
— Hepatitis C (el riesgo se multiplica por cinco)
— Consumo de alcohol
— Cirrosis
— Nutrición: perímetro braquial medio < 20 cm, hipoalbuminemia basal
— Polimorfismo genético (no se lo utiliza para detectar el riesgo de hepatotoxicidad en los países en desarrollo)
Otros efectos colaterales de la medicación son los síntomas gastrointestinales, las erupciones cutáneas y las interacciones entre medicamentos.
4.3 Resistencia antibacteriana
Se ha observado multi resistencia (MDR) en el 2,4-13,2% de las cepas de MTB aisladas de pacientes con TB pulmonar recién diagnosticada y en el 17,4-25,5% de los pacientes previamente tratados. La farmacorresistencia extensiva (XDR) se encuentra casi exclusivamente en pacientes previamente tratados y representa alrededor del 6% de la TB-MR.
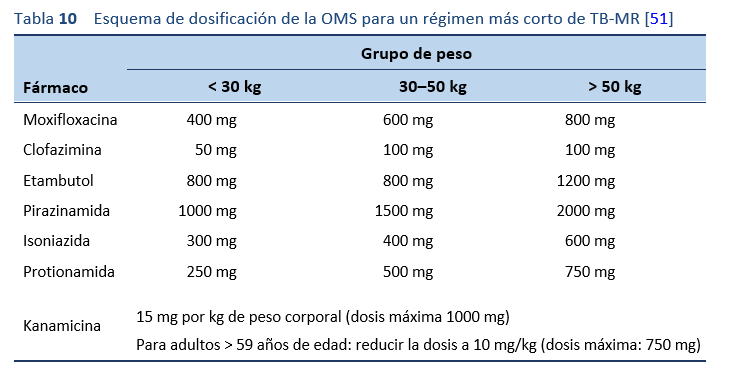
Régimen más corto de la OMS para la tuberculosis multirresistente:
- Kanamicina (agente inyectable), moxifloxacina, protionamida, clofazimina, isoniazida, pirazinamida y etambutol, administrados conjuntamente en una fase inicial de 4 meses (con la opción de ampliarla a 6 meses si el paciente sigue siendo positivo en un frotis de esputo al final del mes 4).
- A continuación, se indica una fase intensiva de 5 meses de tratamiento con cuatro de los medicamentos (moxifloxacino, clofazimina, pirazinamida y etambutol).
- Los medicamentos se toman una vez al día, todos los días de la semana.
- Si la fase intensiva se prolonga, el agente inyectable sólo se administra tres veces por semana a partir del cuarto mes.
4.4 Tratamiento empírico
El tratamiento farmacológico antituberculoso empírico durante 2-3 meses puede considerarse apropiado en países con una alta prevalencia de TB abdominal que presenten características clínicas compatibles -es decir, los datos clínicos, radiográficos y endoscópicos son compatibles con el diagnóstico de TB abdominal- y si se pueden descartar adecuadamente otras enfermedades frecuentes como el cáncer, la enfermedad inflamatoria intestinal inespecífica y otras infecciones específicas [13].
El diagnóstico de enteritis tuberculosa puede considerarse como altamente probable si el paciente responde al tratamiento y si no se producen recaídas al final del seguimiento [8].
El seguimiento de la respuesta debe realizarse semanalmente durante 4-6 semanas:
- Resolución de síntomas
- Aumento de peso
- La mejora de la hemoglobina y el descenso de los niveles de proteína C reactiva (PCR) son más sensibles que el descenso de la velocidad de eritrosedimentación (VES) para determinar la respuesta al tratamiento de la tuberculosis [52].
Sin embargo, se recomienda establecer el diagnóstico de tuberculosis antes de iniciar el tratamiento, por las siguientes razones [11,17]:
- La respuesta parcial al tratamiento antituberculoso en pacientes con enfermedad de Crohn y la aparición de tuberculosis MR restringe la utilidad de la respuesta al tratamiento antituberculoso como forma de establecer el diagnóstico de tuberculosis.
- El tratamiento antituberculoso puede tener importantes efectos colaterales y morbilidad.
- Los pacientes con EC que son tratados con inmunosupresores son más propensos a adquirir infecciones, como tuberculosis, lo que puede llevar a una comorbilidad.
Cuando no se dispone la laparoscopia o ésta no es asequible, y si los pacientes no son operables, las pruebas de ADA del líquido de ascitis pueden ser cruciales para obtener un diagnóstico rápido de la tuberculosis peritoneal, lo que a su vez permite iniciar medicación antituberculosa empírica.
En los pacientes con un alto índice de sospecha de tuberculosis peritoneal y ADA > 30 UI, se puede iniciar el tratamiento antituberculoso.
4.5 TB y enfermedad de Crohn
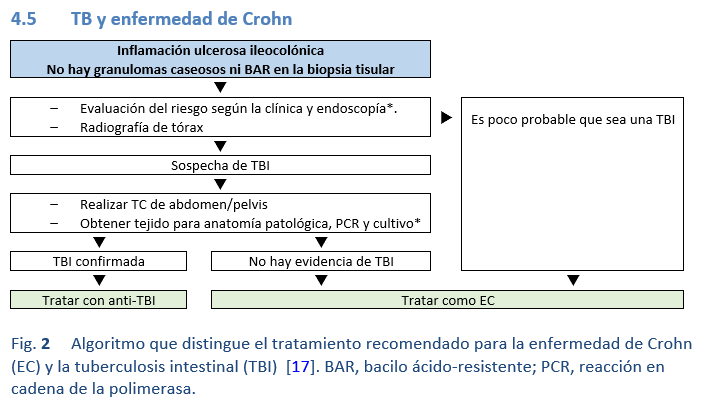
Notas:
• Si no se cuenta con PCR, considerar la terapia antituberculosa empírica.
• Si el cultivo es positivo, continuar el tratamiento; si es negativo considerar la enfermedad de Crohn
* La evaluación del riesgo clínico incluye la consideración de antecedentes de tuberculosis previa, si el paciente es originario de un área de alta prevalencia y presenta fiebre alta oscilante, en ausencia de un absceso intraabdominal.
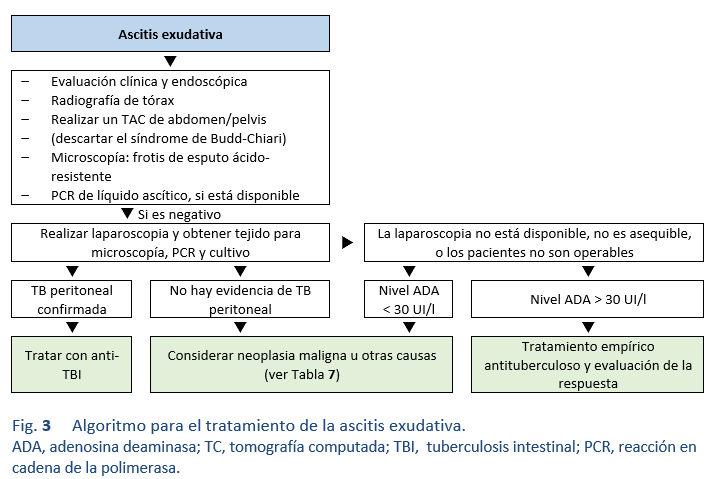
Notas:
• Si no se cuenta con la PCR y no hay evidencia de tuberculosis peritoneal en una biopsia, considerar la terapia antituberculosa empírica y esperar los resultados del cultivo.
• Si el cultivo es positivo, continuar el tratamiento; si es negativo, considerar la enfermedad de Crohn (aunque la ascitis es mucho menos frecuente en la EC o en cualquier otra causa de ascitis).
• La actividad de la adenosina deaminasa (ADA) aumenta en la tuberculosis, en hepatopatías y en ciertas enfermedades malignas (entre otras).
4.6 Tratamiento quirúrgico
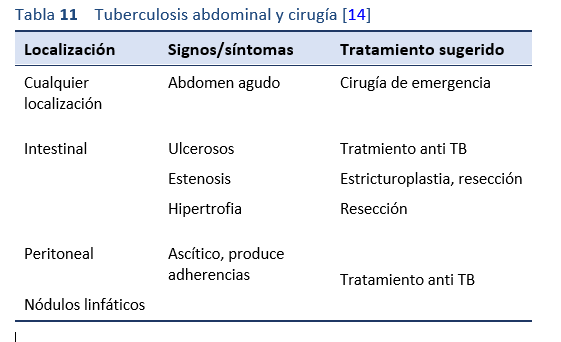
La intervención quirúrgica se reserva para las complicaciones -fibrosis, estenosis y abdomen agudo- o cuando hay incertidumbre en el diagnóstico.
5. Apéndice
6.1 Abreviaciones

5.2 Directrices sobre la tuberculosis y las enfermedades gastrointestinales
- European Centre for Disease Prevention and Control. Use of interferon-gamma release assays in support of TB diagnosis. Stockholm: ECDC; 2011. doi: 10.2900/38588. Available from: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/1103_GUI_IGRA.pdf [42].
- [Diagnostic guideline of intestinal tuberculosis]. [In Korean.] Kim YS, Kim Y-H, Lee K-M, Kim JS, Park YS, IBD Study Group of the Korean Association of the Study of Intestinal Diseases. Korean J Gastroenterol. 2009;53(3):177–86 [53].
- The diagnostic work-up in patients with ascites: current guidelines and future prospects. Oey RC, van Buuren HR, de Man RA. Neth J Med. 2016;74(8):330–5 [23].
- Index-TB guidelines: guidelines on extrapulmonary tuberculosis for India. Sharma SK, Ryan H, Khaparde S, Sachdeva KS, Singh AD, Mohan A, et al. Indian J Med Res. 2017;145(4):448–63. Available from: https://www.ijmr.org.in/article.asp?issn=0971-5916;year=2017;volume=145;issue=4;spage=448;epage=463;aulast=Sharma;type=2 [54].
- Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. J Crohns Colitis. 2014;8(6):443–68. Available at https://academic.oup.com/ecco-jcc/article/8/6/443/ 421810 [9].
5.3 Referencias
1. World Health Organization. Tuberculosis: key facts [Internet]. Geneva: World Health Organization; 2020 [cited 2021 Mar 31]. Available from: https://www.who.int/news-room/fact-sheets/detail/tuberculosis
2. Raviglione MC. Tuberculosis. In: Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J, editors. Harrison’s Principles of Internal Medicine. 20th ed. New York: McGraw-Hill Education; 2018. p. 1236–58.
3. Epstein D, Mistry K, Whitelaw A, Watermeyer G, Pettengell KE. The effect of physiological concentrations of bile acids on in vitro growth of Mycobacterium tuberculosis. S Afr Med J. 2012;102(6):522–4.
4. Pattanayak S, Behuria S. Is abdominal tuberculosis a surgical problem? Ann R Coll Surg Engl. 2015;97(6):414–9.
5. Jullien S, Jain S, Ryan H, Ahuja V. Six-month therapy for abdominal tuberculosis. Cochrane Database Syst Rev. 2016;11:CD012163.
6. Noomene R, Ouakaa A, Jouini R, Maamer AB, Cherif A. What remains to surgeons in the management of abdominal tuberculosis? A 10 years experience in an endemic area. Indian J Tuberc. 2017;64(3):167–72.
7. World Health Organization. Global tuberculosis report 2018 [Internet]. Geneva: World Health Organization; 2018. Available from: https://apps.who.int/iris/handle/10665/274453
8. Marshall JB. Tuberculosis of the gastrointestinal tract and peritoneum. Am J Gastroenterol. 1993;88(7):989–99.
9. Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 2014;8(6):443–68.
10. European Centre for Disease Prevention and Control. Extrapulmonary tuberculosis — a challenging diagnosis [video] [Internet]. European Centre for Disease Prevention and Control. 2013 [cited 2018 Sep 24]. Available from: http://ecdc.europa.eu/en/publications-data/extrapulmonary-tuberculosis-challenging-diagnosis
11. Sood A, Midha V, Singh A. Differential diagnosis of Crohn’s disease versus ileal tuberculosis. Curr Gastroenterol Rep. 2014;16(11):418.
12. World Health Organization. Global tuberculosis report 2017 [Internet]. Geneva: World Health Organization; 2017 [cited 2018 Jul 26]. Available from: http://www.who.int/tb/publications/global_report/en/
13. Abbas Z. Abdominal tuberculosis. In: Hasan M, Akbar MF, Al-Mahtab M, editors. Textbook of Hepato-Gastroenterology. New Delhi: Jaypee Brothers Medical Pub; 2015. p. 68–76.
14. Kapoor VK. Abdominal tuberculosis. Postgrad Med J. 1998;74(874):459–67.
15. Wang E, Sohoni A. Tuberculosis: a primer for the emergency physician. Emerg Med Rep [Internet]. 2006 Dec 24 [cited 2018 Jul 28]; Available from: https://www.reliasmedia.com/articles/100438-tuberculosis-a-primer-for-the-emergency-physician
16. Khan R, Abid S, Jafri W, Abbas Z, Hameed K, Ahmad Z. Diagnostic dilemma of abdominal tuberculosis in non-HIV patients: an ongoing challenge for physicians. World J Gastroenterol. 2006;12(39):6371–5.
17. Almadi MA, Ghosh S, Aljebreen AM. Differentiating intestinal tuberculosis from Crohn’s disease: a diagnostic challenge. Am J Gastroenterol. 2009;104(4):1003.
18. Rathi P, Gambhire P. Abdominal tuberculosis. J Assoc Physicians India. 2016;64(2):38–47.
19. Kroot EJA, Hazes JMW, Colin EM, Dolhain RJEM. Poncet’s disease: reactive arthritis accompanying tuberculosis. Two case reports and a review of the literature. Rheumatol Oxf Engl. 2007;46(3):484–9.
20. Umapathy KC, Begum R, Ravichandran G, Rahman F, Paramasivan CN, Ramanathan VD. Comprehensive findings on clinical, bacteriological, histopathological and therapeutic aspects of cutaneous tuberculosis. Trop Med Int Health. 2006;11(10):1521–8.
21. Kurup SK, Chan CC. Mycobacterium-related ocular inflammatory disease: diagnosis and management. Ann Acad Med Singapore. 2006 Mar;35(3):203–9.
22. Figueira L, Fonseca S, Ladeira I, Duarte R. Ocular tuberculosis: position paper on diagnosis and treatment management. Rev Port Pneumol. 2017;23(1):31–8.
23. Oey RC, van Buuren HR, de Man RA. The diagnostic work-up in patients with ascites: current guidelines and future prospects. Neth J Med. 2016;74(8):330–5.
24. Sharma V, Singh H, Mandavdhare HS. Tubercular abdominal cocoon: systematic review of an uncommon form of tuberculosis. Surg Infect. 2017;18(6):736–41.
25. Puri AS, Sachdeva S, Mittal VV, Gupta N, Banka A, Sakhuja P, et al. Endoscopic diagnosis, management and outcome of gastroduodenal tuberculosis. Indian J Gastroenterol. 2012;31(3):125–9.
26. Moka P, Ahuja V, Makharia G. Endoscopic features of gastrointestinal tuberculosis and Crohn’s disease. J Dig Endosc. 2017;8(1):1–11.
27. Vaid U, Kane GC. Tuberculous peritonitis. Microbiol Spectr. 2017;5(1).
28. Yönal O, Hamzaoğlu HO. What is the most accurate method for the diagnosis of intestinal tuberculosis? Turk J Gastroenterol. 2010;21(1):91–6.
29. Portillo-Gómez L, Morris SL, Panduro A. Rapid and efficient detection of extra-pulmonary Mycobacterium tuberculosis by PCR analysis. Int J Tuberc Lung Dis. 2000;4(4):361–70.
30. Mao R, Liao W, He Y, Ouyang C, Zhu Z, Yu C, et al. Computed tomographic enterography adds value to colonoscopy in differentiating Crohn’s disease from intestinal tuberculosis: a potential diagnostic algorithm. Endoscopy. 2015;47(4):322–9.
31. Sharma V, Rana SS, Ahmed SU, Guleria S, Sharma R, Gupta R. Endoscopic ultrasound-guided fine-needle aspiration from ascites and peritoneal nodules: A scoping review. Endosc Ultrasound. 2017;6(6):382–8.
32. Vafa H, Arvanitakis M, Matos C, Demetter P, Eisendrath P, Toussaint E, et al. Pancreatic tuberculosis diagnosed by EUS: one disease, many faces. JOP J Pancreas. 2013;14(3):256–60.
33. Pulimood AB. Differentiation of Crohn’s disease from intestinal tuberculosis in India in 2010. World J Gastroenterol. 2011;17(4):433–43.
34. Ko JK, Lee HL, Kim JO, Song SY, Lee KN, Jun DW, et al. Visceral fat as a useful parameter in the differential diagnosis of Crohn’s disease and intestinal tuberculosis. Intest Res. 2014 Jan;12(1):42–7.
35. Kirsch R. Role of colonoscopic biopsy in distinguishing between Crohn’s disease and intestinal tuberculosis. J Clin Pathol. 2006;59(8):840–4.
36. Pulimood AB, Peter S, Ramakrishna B, Chacko A, Jeyamani R, Jeyaseelan L, et al. Segmental colonoscopic biopsies in the differentiation of ileocolic tuberculosis from Crohn’s disease. J Gastroenterol Hepatol. 2005;20(5):688–96.
37. Pulimood AB, Ramakrishna BS, Kurian G, Peter S, Patra S, Mathan VI, et al. Endoscopic mucosal biopsies are useful in distinguishing granulomatous colitis due to Crohn’s disease from tuberculosis. Gut. 1999;45(4):537–41.
38. Dawra S, Mandavdhare HS, Singh H, Sharma V. Abdominal tuberculosis: diagnosis and management in 2018. J Indian Acad Clin Med. 2017;18(4):271–4.
39. Penz E, Boffa J, Roberts DJ, Fisher D, Cooper R, Ronksley PE, et al. Diagnostic accuracy of the Xpert® MTB/RIF assay for extra-pulmonary tuberculosis: a meta-analysis. Int J Tuberc Lung Dis. 2015;19(3):278–84, i–iii.
40. Shahidi N, Fu Y-TN, Qian H, Bressler B. Performance of interferon-gamma release assays in patients with inflammatory bowel disease: A systematic review and meta-analysis. Inflamm Bowel Dis. 2012;18(11):2034–42.
41. Starshinova A, Zhuravlev V, Dovgaluk I, Panteleev A, Manina V, Zinchenko U, et al. A comparison of intradermal test with recombinant tuberculosis allergen (Diaskintest) with other immunologic tests in the diagnosis of tuberculosis infection. Int J Mycobacteriology. 2018;7(1):32–9.
42. European Centre for Disease Prevention and Control. Use of interferon-gamma release assays in support of TB diagnosis: ad hoc scientific panel opinion [Internet]. Stockholm: European Centre for Disease Prevention and Control; 2011. (ECDC guidance). Available from: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/1103_GUI_IGRA.pdf
43. Jin T, Fei B, Zhang Y, He X. The diagnostic value of polymerase chain reaction for Mycobacterium tuberculosis to distinguish intestinal tuberculosis from Crohn’s disease: a meta-analysis. Saudi J Gastroenterol. 2017;23(1):3–10.
44. Riquelme A, Calvo M, Salech F, Valderrama S, Pattillo A, Arellano M, et al. Value of adenosine deaminase (ADA) in ascitic fluid for the diagnosis of tuberculous peritonitis: a meta-analysis. J Clin Gastroenterol. 2006;40(8):705–10.
45. Shen Y, Wang T, Chen L, Yang T, Wan C, Hu Q, et al. Diagnostic accuracy of adenosine deaminase for tuberculous peritonitis: a meta-analysis. Arch Med Sci. 2013;9(4):601–7.
46. Tao L, Ning H-J, Nie H-M, Guo X-Y, Qin S-Y, Jiang H-X. Diagnostic value of adenosine deaminase in ascites for tuberculosis ascites: a meta-analysis. Diagn Microbiol Infect Dis. 2014;79(1):102–7.
47. Garcia-Tsao G. Ascites. In: Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M, editors. Sherlock’s diseases of the liver and biliary system. 13th ed. Hoboken, NJ: Wiley; 2018. p. 127–50.
48. Ng SC, Tang W, Ching JY, Wong M, Chow CM, Hui AJ, et al. Incidence and phenotype of inflammatory bowel disease based on results from the Asia–Pacific Crohn’s and Colitis Epidemiology Study. Gastroenterology. 2013;145(1):158-165.e2.
49. Kaplan GG. The global burden of IBD: from 2015 to 2025. Nat Rev Gastroenterol Hepatol. 2015;12(12):720–7.
50. He Y, Zhu Z, Chen Y, Chen F, Wang Y, Ouyang C, et al. Development and validation of a novel diagnostic nomogram to differentiate between intestinal tuberculosis and Crohn’s disease: a 6-year prospective multicenter study. Am J Gastroenterol. 2019;114(3):490–9.
51. World Health Organization. WHO consolidated guidelines on drug-resistant tuberculosis treatment [Internet]. Geneva: World Health Organization; 2018 [cited 2021 Mar 30]. Available from: https://www.who.int/tb/publications/2019/consolidated-guidelines-drug-resistant-TB-treatment/en/
52. Lawn SD, Obeng J, Acheampong JW, Griffin GE. Resolution of the acute-phase response in West African patients receiving treatment for pulmonary tuberculosis. Int J Tuberc Lung Dis. 2000;4(4):340–4.
53. Kim YS, Kim Y-H, Lee K-M, Kim JS, Park YS, IBD Study Group of the Korean Association of the Study of Intestinal Diseases. [Diagnostic guideline of intestinal tuberculosis]. Korean J Gastroenterol. 2009;53(3):177–86.
54. Sharma SK, Ryan H, Khaparde S, Sachdeva KS, Singh AD, Mohan A, et al. Index-TB guidelines: guidelines on extrapulmonary tuberculosis for India. Indian J Med Res. 2017;145(4):448–63.


















