Esta diretriz da Organização Mundial de Gastroenterologia (WGO) sobre “Desinfecção de endoscópios” foi concebida para pessoal da saúde e profissionais que utilizam, limpam ou intervêm na manutenção de endoscópios, e visa apoiar sociedades nacionais, organismos oficiais e serviços de endoscopia na elaboração de normas e protocolos locais para o reprocessamento de endoscópios.
As diretrizes da WGO são o resultado de um processo de desenvolvimento sistemático pelo qual peritos analisam literatura médica e científica, bem como diretrizes existentes e normas de melhores práticas (regionais), e chegam a um consenso. Esta atualização aborda os recentes surtos infecciosos produzidos por microrganismos multirresistentes (MMR) decorrentes de procedimentos endoscópicos e propõe medidas para reduzir os riscos de ocorrência de novos surtos. As recomendações têm por base as conclusões consensuais de um grupo de trabalho multidisciplinar internacional com experiência em microbiologia, biofilme, reprocessamento de endoscópios, enfermagem e gastroenterologia, e com vasta experiência na elaboração de diretrizes nacionais e internacionais de reprocessamento.
1.1 Diretrizes ou normas
A prestação de serviços endoscópicos seguros e eficazes é regido por normas nacionais e internacionais que têm muitos pontos em comum, como as normas relativas à concepção das instalações e contratação de pessoal, reprocessadores automáticos de endoscópios flexíveis, desinfetantes, qualidade da água e armários de secagem.
A aplicação de normas adequadas para o reprocessamento deve respeitar os princípios gerais das boas práticas de fabricação (BPF). As BPF são um conjunto de regulamentos, códigos e diretrizes aplicáveis aos processos de fabricação —neste caso, ao reprocessamento de endoscópios— para conseguir uma desinfecção de alto nível; abrange o processo e o controle de qualidade. As BPF são reconhecidas a nível mundial no controle e gestão da fabricação, em testes de controle de qualidade de produtos farmacêuticos, e evoluiu nos últimos 60 anos em resposta a vários problemas de conhecimento público ocorridos na indústria farmacêutica [1].
As instruções de reprocessamento frequentemente chamadas de “diretrizes” são, de fato, uma norma técnica que estabelece a prática mínima aceitável do reprocessamento, para conseguir uma desinfecção de alto nível dos endoscópios. Em geral, as diretrizes médicas abordam uma questão clínica limitada usando dados de base populacional; utilizam frequentemente dados provenientes de ensaios randomizados a fim de dirigir a atenção para um paciente determinado. Os ensaios randomizados são realizados em populações específicas, e os médicos devem decidir se as diretrizes são aplicáveis ao seu paciente [2].
As normas têm uma aplicação mais ampla e estabelecem especificações e procedimentos que são concebidos para garantir que os produtos, serviços e sistemas sejam seguros e confiáveis, e que funcionem uniformemente tal como foram desenhados. A evidência de suporte para uma norma é baseada na ciência, tecnologia e experiência. Os ensaios randomizados são raramente realizados numa população específica. As normas que regem o reprocessamento têm base científica e são às vezes validadas por medições de eficiência em modelos que utilizam sujidade artificial ou um conhecido inóculo de bactérias. A ciência da limpeza, desinfecção, secagem e microbiologia constitui a base das normas de reprocessamento pertinentes em todos os países.
As normas estabelecem a prática mínima aceitável
Os termos “diretrizes” e “normas” são ambos utilizados para descrever as instruções para o reprocessamento do endoscópio [3,4].
1.2 Princípios gerais do reprocessamento de endoscópios
O passo mais importante no reprocessamento de endoscópios é a limpeza manual minuciosa antes da desinfecção. Se ela for inadequada, a desinfecção vai falhar. [5–7].
A limpeza manual deve ser feita por uma pessoa familiarizada com a estrutura do endoscópio e treinada em técnicas de limpeza. A limpeza deve começar imediatamente após o endoscópio ser utilizado, para que o material biológico não seque e endureça. Devem ser utilizados detergentes e equipamento de limpeza adequados e, em particular, escovas com o diâmetro adequado para cada canal. A limpeza deve ser seguida de uma lavagem cuidadosa para assegurar que todos os detritos e detergentes sejam removidos antes da desinfecção.
1.2.1 Limpeza manual
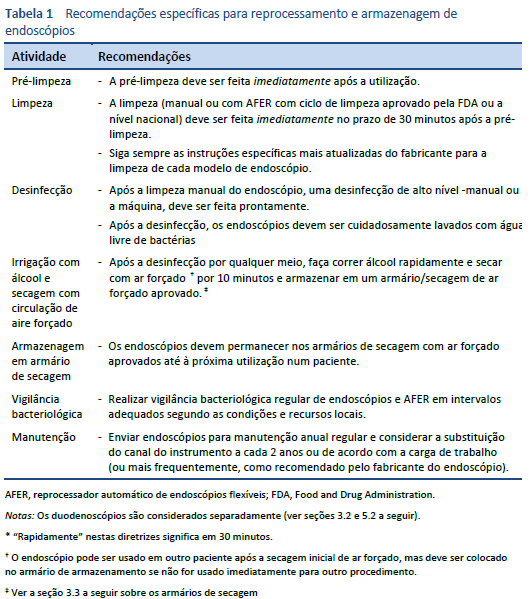
Pré-limpeza: imediatamente após cada procedimento, com o aparelho conectado na fonte de luz, limpar o tubo de inserção com um pano macio sem fiapos. Colocar a extremidade distal numa solução de detergente para uso médico de baixa espuma e aspirar o detergente através de todos os canais, incluindo o canal de sucção/biópsia. Lavar os canais de ar/água com detergente. Irrigar todos os canais, incluindo o canal para jato, se houver, primeiro com água e seguidamente com ar, conforme as instruções do fabricante. A lavagem dos canais ar/água com detergente pode exigir a utilização de uma válvula específica.
Retirar o aparelho da fonte elétrica e levar para a área de limpeza em recipiente fechado que evite a contaminação ambiental por gotejamento ou derramamento e que indique claramente que o endoscópio no interior está contaminado.
É essencial não deixar secar o endoscópio antes da limpeza, pois isso tornará a remoção da matéria orgânica difícil ou impossível. Os endoscópios devem ser processados sem demora, no prazo de 30 minutos.
Para verificar a integridade de todos os canais antes do processamento posterior, devem ser feitos testes de vazamento. Remover todas as válvulas e botões e testar o instrumento conforme as instruções do fabricante.
Escovar e limpar botões e válvulas, prestando especial atenção às superfícies internas, e realizar alto nível de desinfecção ou esterilização, conforme as instruções do fabricante do equipamento original.
Colocar o endoscópio numa solução detergente num lavatório na secção “suja” da área de descontaminação e lavar a superfície exterior. Na diluição adequada, deve ser utilizado um detergente para uso médico de baixa espuma, conforme as instruções do fabricante. Escovar todas as seções acessíveis do canal de biópsia/sucção, conforme as instruções de uso do fabricante. Cada canal deve ser escovado até que todos os detritos sejam removidos. Escovar a ponta e alças e limpar os assentos das válvulas. Ajustar os adaptadores de limpeza e lavar os canais de limpeza com detergente fresco durante o tempo especificado para esse produto.
O endoscópio deve ser enxaguado drenando o detergente do lavatório, lavando a superfície exterior com água fria da torneira e, em seguida, enchendo o lavatório com água e purgando os canais com água corrente, utilizando os adaptadores de limpeza conforme as instruções do fabricante. Purgar os canais com ar para remover a água de lavagem.
1.2.2 Desinfecção
A desinfecção de alto nível é realizada por um reprocessador de endoscópios flexíveis automático (AFER), que deve cumprir com a norma nacional pertinente ou ser aprovado pela U.S. Food and Drug Administration (FDA). O AFER pode ter ou não um ciclo de limpeza automatizada, além de um ciclo de desinfecção. Todos os conectores utilizados devem ser especificamente concebidos para cada modelo de endoscópio, e todos os canais devem estar conectados no início e no final do ciclo. Os componentes desmontáveis, como válvulas de ar/água e sucção, podem ser esterilizados a vapor ou reprocessados com o endoscópio se a capacidade do AFER de limpar e/ou desinfetar estes componentes for validada pelo fabricante.
Após uma desinfecção de alto nível, o endoscópio é lavado no AFER com água sem bactérias produzida por filtros submicrônicos. A qualidade da água deve ser regularmente controlada.
A desinfecção manual de alto nível é uma alternativa eficaz quando realizada por pessoal de reprocessamento especializado, bem treinado e com equipamento de proteção individual adequado. Imergir o endoscópio em desinfetante e preencher todos os canais com essa solução desinfetante. Imergir os botões e válvulas no desinfetante. Imergir o instrumento durante o tempo necessário à temperatura e concentração exigidas, conforme o fabricante do desinfetante.
Purgar o desinfetante de todos os canais com ar, lavar o exterior do endoscópio e lavar os canais com água sem bactérias, utilizando o volume necessário para o desinfetante específico utilizado, para remover quaisquer vestígios de desinfetante.
1.2.3 Secagem
Os endoscópios devem ser secos após cada procedimento, purgando a água dos canais com ar forçado, depois realizar rinsagem com álcool nos canais, seguido de secagem por ar forçado. A lavagem com álcool facilita a secagem e constitui um complemento útil da desinfecção por seus efeitos bactericidas [8].
O uso de álcool pode não ser permitido em alguns países (França, Reino Unido) devido a preocupações sobre a variante Creutzfeldt–doença de Jakob (DCJ).
O endoscópio é então armazenado em armário de secagem com circulação forçada de ar para completar a secagem.
Se o endoscópio for utilizado raramente, é sensato guardá-lo separado, pendurado na vertical em armário especialmente concebido, em vez de armário de armazenamento/secagem com circulação forçada de ar, e depois reprocessar o endoscópio antes de uso no próximo paciente. Os endoscópios devem ser secos completamente antes de ser pendurados.
1.2.4 Acessórios
O frasco de água deve ser trocado após cada sessão de endoscopia e esterilizado a vapor. Deve ser preenchido com água estéril imediatamente antes de ser utilizado.
1.2.5 Documentação
Todos os passos essenciais do reprocessamento do endoscópio devem ser documentados para garantia da qualidade e para rastreamento do paciente, se necessário.
Durante os surtos de MMR após a endoscopia, os pacientes podem se tornar colonizados com bactérias e não apresentar inicialmente sintomas clínicos, e desenvolver infecções sistêmicas graves semanas ou meses depois, com taxas de mortalidade relatadas de até 40% [36,52].
Muitas vezes, uma única espécie da EPC é transmitida a partir de um endoscópio em várias ocasiões, apesar do reprocessamento. Esta epidemiologia pode ser explicada pela formação de um biofilme no endoscópio que protege as bactérias da limpeza e da desinfecção e age como um reservatório para a transmissão da infecção.
5.1 Biofilme
O relatório de 1999 dos Centros de Controle e Prevenção de Doenças (CDC) sobre um surto de Pseudomona aeruginosa produtora de carbapenemase após broncoscopia, entendeu que o biofilme formado nos canais estreitos dos endoscópios difíceis de limpar contribuiu para o surto [53]. Uma pesquisa posterior examinou as superfícies dos canais do endoscópio usando microscopia eletrônica de varredura e confirmou a presença de biofilme depositado em defeitos da superfície [32]. Outros estudos acharam também biofilme em canais endoscópicos [54–56] e em endoscópios indicados como responsáveis nos relatórios de surtos [57–59].
O biofilme é uma comunidade de bactérias fixadas a uma superfície e umas às outras por uma matriz de polissacarídeos extracelulares. As bactérias que vivem no biofilme têm propriedades diferentes das bactérias flutuantes (planctônicas) da mesma espécie. As bactérias incorporadas nos biofilmes são resistentes aos desinfetantes usados nas concentrações recomendadas [60]. As EPCs planctônicas morrem em menos de 1 minuto com desinfetantes padrão, fornecendo vasta margem de segurança para eliminar essas bactérias planctônicas [61]. Contudo, a presença de uma matriz de biofilme limita a difusão do desinfetante, e é difícil para o desinfetante penetrar nas múltiplas camadas de células e na matriz do biofilme [62]. As concentrações padrão de desinfetantes não eliminam de forma fiável as mesmas bactérias no biofilme [63]. As bactérias no biofilme buildup (BBF) acumuladas nos defeitos das superfícies do canal do endoscópio também estão protegidas por detritos orgânicos e proteínas reticuladas, difíceis de eliminar com reprocessamento padrão [31,55]. Os parâmetros de reprocessamento atuais são baseados em dados de modelos que usam sujeiras artificiais e bactérias planctônicas em vez de modelos que incorporam bactérias em biofilme ou BBF.
O biofilme age como reservatório de bactérias aderidas à superfície dos canais do endoscópio e, em condições favoráveis, as bactérias podem se multiplicar nos biofilmes, separar, retomar seu estado planctônico e ser transmitidas aos pacientes durante a endoscopia [31]. A umidade e os nutrientes facilitam o crescimento do biofilme e a liberação de bactérias planctônicas.
O papel da umidade na facilitação do crescimento do biofilme durante o armazenamento, e a importância da secagem completa após o reprocessamento, foram subestimados no passado. A evidência atual indica que 95% dos endoscópios tinham ainda umidade visível nos canais após a descarga de álcool com AFER, um ciclo de secagem de 3 minutos e armazenamento noturno em um armário regular [64]. Manter o endoscópio isento de umidade, particularmente os canais, durante o armazenamento, deve ser uma prioridade.
O biofilme se forma facilmente nos defeitos dos endoscópios, muitas vezes marcas de desgaste longitudinal nos canais de biópsia, difícil ou impossível de remover com reprocessamento padrão [31,32,55,65]. Um estudo multicêntrico de 45 endoscópios prontos para utilizar em pacientes encontrou defeitos em todos os endoscópios examinados [66]. A inspeção de canais com um boroscópio geralmente identifica defeitos de superfície ocultos [66–68]. Os endoscópios devem ter manutenção regular para identificar e consertar defeitos macroscópicos e substituir os canais de rotina para reduzir a prevalência de defeitos ocultos e ajudar a manter superfícies dos canais lisas e limpáveis [6,37]. A investigação de Verfallie e col. do duodenoscópio responsável dum surto revelou que os anéis de vedação do duodenoscópio eram uma área importante de preocupação; estes devem ser substituídos anualmente, juntamente com os canais [36]. Outros endoscópios podem exigir a substituição menos frequente de canais, talvez 1–2-anual, dependendo da carga de trabalho.
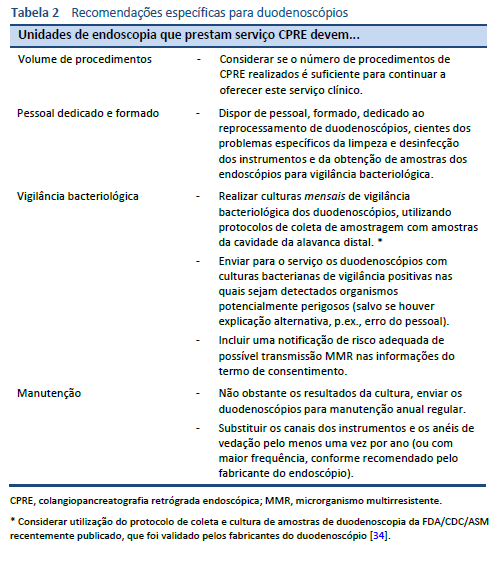
5.2 Duodenoscópios
Os duodenoscópios são difíceis de limpar e desinfetar. Além do seu design complexo, fatores como as características dos pacientes encaminhados para CPRE e as intervenções realizadas também contribuem para o risco de colonização e posterior infecção por bactérias transmitidas durante o procedimento.
A taxa de contaminação dos duodenoscópios, avaliada pelas culturas de vigilância positivas, é semelhante às taxas de contaminação dos gastroscópios e colonoscópios [18–21]. Assim, as características do paciente e as intervenções realizadas são os principais fatores na maior incidência de surtos após o CPRE.
Os riscos de surtos podem ser abordados por meio de alterações específicas que melhorem a limpeza e desinfecção dos duodenoscópios, bem como otimização do reprocessamento de todos os endoscópios. Os protocolos de limpeza atualizados dos fabricantes são um avanço importante no reprocessamento do duodenoscópio. Uma revisão de uma base de dados de garantia de qualidade de 4.307 culturas duodenoscópicas descobriu que a implementação dos novos protocolos de limpeza reduziu significativamente a taxa de culturas positivas [69].
5.3 Secagem
A fase de reprocessamento da secagem, muitas vezes ignorada ou realizada de forma incompleta, é propensa a erros humanos [37]. Um estudo realizado nos EUA sobre o reprocessamento em 249 unidades de endoscopia realizando CPRE constatou que 52% dos centros não cumpriam as diretrizes de várias sociedades e não utilizavam ar forçado para secar os endoscópios [70]. As diretrizes são incompatíveis entre si e nem sempre especificam os parâmetros para uma secagem adequada [71]. Estudos recentes encontraram fluidos residuais em até 95% dos canais dos endoscópio após reprocessamento e secagem, sugerindo que é preciso melhorar as diretrizes de secagem [55,64].
Os biofilmes precisam de umidade para crescer. Alfa e Sitter, em um artigo fundamental, demonstraram que se os duodenoscópios ficavam úmidos após o reprocessamento, havia um rápida proliferação das espécies de Pseudomonas e Acinetobacter [72]. A secagem durante 10 minutos com ar forçado impediu este crescimento excessivo em todos os duodenoscópios estudados. A implantação de uma descarga de álcool seguida de secagem com ar forçado terminou com os surtos de infecções por Pseudomonas após CPRE na década de 1980 [73]. Estudos mais recentes confirmaram que a irrigação com álcool seguida de 10 minutos de secagem por ar forçado foi mais eficaz do que a irrigação com álcool seguida de um tempo mais curto e variável de secagem por ar forçado [66,74].
As diretrizes da Associação de Enfermeiros Perioperatórios Registrados (AORN) [4] recomendam guardar os endoscópios em um armário de secagem e indicam que: “A evidência coletiva mostra que o armazenamento ideal de endoscópios flexíveis facilita a secagem, diminui o potencial de contaminação e protege contra contaminantes ambientais.”
Esta recomendação é apoiada por uma revisão das culturas de vigilância de endoscópios prontos para serem utilizados (duodenoscópios, gastroscópios, colonoscópios, ecoendoscópios) que descobriram que a introdução de armários de secagem reduziu significativamente o risco de contaminação por endoscópios [75]. Em uma comparação direta, um armário de secagem por ar forçado secou os endoscópios mais rapidamente e reduziu significativamente a proliferação microbiana em relação a um armário de armazenamento padrão [76].
5.4 Simeticona
A simeticona é um polímero à base de silicone utilizado na endoscopia para melhorar a visibilidade. Ensaios clínicos randomizados confirmam diminuição do número de bolhas e melhoria da visibilidade. No entanto, a simeticona não é solúvel em água e, em 2009, a Olympus alertou que a substancia era difícil de remover com o reprocessamento padrão [77]. Em 2016, van Stiphout e col. relataram que adicionar simeticona à água injetada, através do canal de jato de água do colonoscópio, provocava a formação de depósitos de cristal no conector e no canal de jato de água [78]. Um estudo mais recente confirmou que a irrigação do canal de biópsia sucção com várias concentrações de simeticona forma um resíduo que não é bem removido pelo reprocessamento padrão [79]. A simeticona residual pode interferir com a secagem e aumentar o risco de formação de biofilme, o que pode resultar em micróbios sobrevivendo à desinfecção e esterilização de alto nível. Em junho de 2018, a Olympus recomendou não utilizar simeticona e outras substâncias não hidrossolúveis [80]. Um editorial recente observa que Pentax e Fujifilm também recomendam não usar simeticona com seus endoscópios. Os autores aconselham seguir as instruções dos fabricantes de endoscópios [81].
5.5 Infecções tropicais
Há muito pouca evidência disponível sobre o risco de transmissão de infecções parasitárias causadas pela endoscopia gastrointestinal. Para infectar, a maioria dos agentes parasitários precisam progredir em um ciclo de vida que leva tempo, portanto eles não são infecciosos imediatamente. A maioria dos parasitas potencialmente infectantes não sobreviveria ao reprocessamento do endoscópio.
Em geral, não existe risco em relação aos helmintos, nematoides, platelmintos, Anisakis ou parasitas hepáticos como a Fasciola hepatica, mas existe um relatório de quatro casos de esofagite por Strongyloides relacionados com um único gastroscópio [82]. Contudo, preocupa o risco de transmissão de Giardia lambliasis, espécies Criptosporidium e amebas.
5.6 Conclusão
A ciência do reprocessamento está a evoluir. Estão agora a ser publicadas novas pesquisas básicas e clínicas bem como ensaios randomizados realizados em resposta a relatórios de surtos de ECP publicados. Os fabricantes de endoscópio continuam a melhorar a concepção do endoscópio e a validar novas instruções de reprocessamento. Novas tecnologias de secagem e limpeza estão surgindo no mercado. As sociedades profissionais estão produzindo versões atualizadas das diretrizes de reprocessamento em reação à torrente de informações.
Esta diretriz, juntamente com outras orientações recentes, recomenda que os hospitais nomeiem um comitê multidisciplinar com integrantes com diversos interesses e conhecimentos especializados para avaliar as novas informações assim que publicadas e para desenvolver, implementar e, o mais importante, atualizar regularmente as diretrizes de reprocessamento que resultarem adequadas para os recursos do hospital e o perfil dos pacientes.
Um reprocessamento eficaz é fundamental para a segurança do paciente na endoscopia
1. Patel KT, Chotai NP. Pharmaceutical GMP: past, present, and future—a review. Pharmazie. 2008;63(4):251–5.
2. Evidence-Based Medicine Working Group. Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 1992;268(17):2420–5.
3. Society of Gastroenterology Nurses and Associates (SGNA). Standards and position statements [Internet] [Internet]. Chicago, IL: Society of Gastroenterology Nurses and Associates (SGNA); 2019 [cited 2018 Jan 18]. Available from: https://www.sgna.org/Practice/Standards-Practice-Guidelines
4. Association for periOperative Registered Nurses (AORN). Guidelines for perioperative practice [Internet]. Denver, CO: AORN, Inc.; 2019. Available from: https://www.aornbookstore.org/Product/Detail/MAN019
5. Gastroenterological Society of Australia (GESA). Infection control in endoscopy [Internet] [Internet]. Melbourne: Gastroenterological Society of Australia (GESA); 2010 [cited 2018 Jan 18]. Available from: http://www.gesa.org.au/resources/infection-control-in-endoscopy/
6. Kenters N, Huijskens E, Meier C, Voss A. Infectious diseases linked to cross-contamination of flexible endoscopes. Endosc Int Open. 2015;3(4):E259–65.
7. Alfa MJ. Current issues result in a paradigm shift in reprocessing medical and surgical instruments. Am J Infect Control. 2016 May;44(5):e41–5.
8. Kovacs BJ, Chen YK, Kettering JD, Aprecio RM, Roy I. High-level disinfection of gastrointestinal endoscopes: are current guidelines adequate? Am J Gastroenterol. 1999;94(6):1546–50.
9. Hayes, Inc. FDA Advisory Panel offers recommendations on procedures for reprocessing duodenoscopes [press release] [Internet]. Dallas, TX: Hayes, Inc.; 2015 [cited 2018 Feb 7]. Available from: https://www.hayesinc.com/hayes/resource-center/news-service/HNS-20150420-49/
10. U.S. Food and Drug Administration (FDA). Division of Industry and Consumer Education (DICE). Infections associated with reprocessed flexible bronchoscopes: FDA safety communication [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Feb 9]. Available from: http://wayback.archive-it.org/7993/20170722213119/https://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm462949.htm
11. Naas T, Cuzon G, Babics A, Fortineau N, Boytchev I, Gayral F, et al. Endoscopy-associated transmission of carbapenem-resistant Klebsiella pneumoniae producing KPC-2 beta-lactamase. J Antimicrob Chemother. 2010;65(6):1305–6.
12. Bajolet O, Ciocan D, Vallet C, de Champs C, Vernet-Garnier V, Guillard T, et al. Gastroscopy-associated transmission of extended-spectrum beta-lactamase-producing Pseudomonas aeruginosa. J Hosp Infect. 2013 Apr;83(4):341–3.
13. Orsi GB, García-Fernández A, Giordano A, Venditti C, Bencardino A, Gianfreda R, et al. Risk factors and clinical significance of ertapenem-resistant Klebsiella pneumoniae in hospitalised patients. J Hosp Infect. 2011;78(1):54–8.
14. Koo VSW, O’Neill P, Elves A. Multidrug-resistant NDM-1 Klebsiella outbreak and infection control in endoscopic urology. BJU Int. 2012;110(11 Pt C):E922-926.
15. Tumbarello M, Spanu T, Sanguinetti M, Citton R, Montuori E, Leone F, et al. Bloodstream infections caused by extended-spectrum-beta-lactamase-producing Klebsiella pneumoniae: risk factors, molecular epidemiology, and clinical outcome. Antimicrob Agents Chemother. 2006;50(2):498–504.
16. Orsi GB, Bencardino A, Vena A, Carattoli A, Venditti C, Falcone M, et al. Patient risk factors for outer membrane permeability and KPC-producing carbapenem-resistant Klebsiella pneumoniae isolation: results of a double case-control study. Infection. 2013;41(1):61–7.
17. Voor In ’t Holt AF, Severin JA, Hagenaars MBH, de Goeij I, Gommers D, Vos MC. VIM-positive Pseudomonas aeruginosa in a large tertiary care hospital: matched case-control studies and a network analysis. Antimicrob Resist Infect Control. 2018;7:32.
18. Bisset L, Cossart YE, Selby W, West R, Catterson D, O’Hara K, et al. A prospective study of the efficacy of routine decontamination for gastrointestinal endoscopes and the risk factors for failure. Am J Infect Control. 2006;34(5):274–80.
19. Brandabur JJ, Leggett JE, Wang L, Bartles RL, Baxter L, Diaz GA, et al. Surveillance of guideline practices for duodenoscope and linear echoendoscope reprocessing in a large healthcare system. Gastrointest Endosc. 2016;84(3):392-399.e3.
20. Saliou P, Héry-Arnaud G, Le Bars H, Payan C, Narbonne V, Cholet F, et al. Evaluation of current cleaning and disinfection procedures of GI endoscopes. Gastrointest Endosc. 2016;84(6):1077.
21. Jones D. [Australia’s microbiological surveillance experience.]. In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 14, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2019 May 31]. p. 142–5. Available from: https://wayback.archive-it.org/7993/20170113091355/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451164.pdf
22. Kelly CR, Kahn S, Kashyap P, Laine L, Rubin D, Atreja A, et al. Update on fecal microbiota transplantation 2015: indications, methodologies, mechanisms, and outlook. Gastroenterology. 2015;149(1):223–37.
23. Cammarota G, Ianiro G, Tilg H, Rajilić-Stojanović M, Kump P, Satokari R, et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017;66(4):569–80.
24. Rutala WA. ERCP scopes: a need to shift from disinfection to sterilization? In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 15, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Mar 6]. p. 307–18. Available from: https://wayback.archive-it.org/7993/20170113091400/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451165.pdf
25. U.S. Food and Drug Administration (FDA). Gastroenterology-Urology Devices Panel. 2015 materials of the Gastroenterology-Urology Devices Panel [Internet] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Feb 9]. Available from: https://wayback.archive-it.org/7993/20170112002249/http:/www.fda.gov/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/ucm445590.htm
26. Petersen BT, Cohen J, Hambrick RD, Buttar N, Greenwald DA, Buscaglia JM, et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2016 update. Gastrointest Endosc. 2017;85(2):282-294.e1.
27. Snyder GM, Wright SB, Smithey A, Mizrahi M, Sheppard M, Hirsch EB, et al. Randomized comparison of 3 high-Level disinfection and sterilization procedures for duodenoscopes. Gastroenterology. 2017;153(4):1018–25.
28. U.S. Food and Drug Administration (FDA). Division of Industry and Consumer Education (DICE). Supplemental measures to enhance duodenoscope reprocessing: FDA safety communication [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Feb 9]. Available from: http://wayback.archive-it.org/7993/20170722150658/https://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm454766.htm
29. Thaker AM, Kim S, Sedarat A, Watson RR, Muthusamy VR. Inspection of endoscope instrument channels after reprocessing using a prototype borescope. Gastrointest Endosc. 2018;88(4):612–9.
30. Bartles RL, Leggett JE, Hove S, Kashork CD, Wang L, Oethinger M, et al. A randomized trial of single versus double high-level disinfection of duodenoscopes and linear echoendoscopes using standard automated reprocessing. Gastrointest Endosc. 2018;88(2):306–313.e2.
31. Alfa MJ, Ribeiro MM, da Costa Luciano C, Franca R, Olson N, DeGagne P, et al. A novel polytetrafluoroethylene-channel model, which simulates low levels of culturable bacteria in buildup biofilm after repeated endoscope reprocessing. Gastrointest Endosc. 2017 Sep;86(3):442-451.e1.
32. Pajkos A, Vickery K, Cossart Y. Is biofilm accumulation on endoscope tubing a contributor to the failure of cleaning and decontamination? J Hosp Infect. 2004;58(3):224–9.
33. Roberts CG. The role of biofilms in reprocessing medical devices. Am J Infect Control. 2013;41(5 Suppl):S77-80.
34. U.S. Food and Drug Administration, Centers for Disease Control and Prevention (CDC), American Society for Microbiology (ASM). Duodenoscope surveillance. Sampling and culturing: reducing the risks of infection [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2018 [cited 2018 Mar 7]. 58 p. Available from: https://www.fda.gov/downloads/medicaldevices/productsandmedicalprocedures/reprocessingofreusablemedicaldevices/ucm597949.pdf
35. Weingarten RA, Johnson RC, Conlan S, Ramsburg AM, Dekker JP, Lau AF, et al. Genomic analysis of hospital plumbing reveals diverse reservoir of bacterial plasmids conferring carbapenem resistance. mBio. 2018;9(1):e02011-17.
36. Verfaillie CJ, Bruno MJ, Voor in ’t Holt AF, Buijs JG, Poley J-W, Loeve AJ, et al. Withdrawal of a novel-design duodenoscope ends outbreak of a VIM-2-producing Pseudomonas aeruginosa. Endoscopy. 2015;47(6):493–502.
37. Jung M, Beilenhoff U. Hygiene: the looming Achilles heel in endoscopy. Visc Med. 2016;32(1):21–8.
38. Ling ML, Ching P, Widitaputra A, Stewart A, Sirijindadirat N, Thu LTA. APSIC guidelines for disinfection and sterilization of instruments in health care facilities. Antimicrob Resist Infect Control. 2018;7:25.
39. Murdani A, Kumar A, Chiu H-M, Goh K-L, Jang BI, Khor CJL, et al. WEO position statement on hygiene in digestive endoscopy: focus on endoscopy units in Asia and the Middle East. Dig Endosc. 2017;29(1):3–15.
40. Beilenhoff U, Neumann C, Rey J, Biering H, Blum R, Schmidt V. ESGE-ESGENA guideline for quality assurance in reprocessing: Microbiological surveillance testing in endoscopy. Endoscopy. 2007;39(02):175–81.
41. Chinese Society of Digestive Endoscopy. Consensus of experts on the safe operation of digestive endoscopy centers in China. J Dig Dis. 2016;17(12):790–9.
42. Roberts G, Roberts C, Jamieson A, Grimes C, Conn G, Bleichrodt R. Surgery and obstetric care are highly cost-effective interventions in a sub-Saharan African district hospital: a three-month single-institution study of surgical costs and outcomes. World J Surg. 2016;40(1):14–20.
43. Rennert-May E, Conly J, Leal J, Smith S, Manns B. Economic evaluations and their use in infection prevention and control: a narrative review. Antimicrob Resist Infect Control. 2018;7:31.
44. Bartsch SM, McKinnell JA, Mueller LE, Miller LG, Gohil SK, Huang SS, et al. Potential economic burden of carbapenem-resistant Enterobacteriaceae (CRE) in the United States. Clin Microbiol Infect. 2017;23(1):48.e9-48.e16.
45. Bardossy AC, Zervos J, Zervos M. Preventing hospital-acquired infections in low-income and middle-income countries. Infect Dis Clin North Am. 2016 Sep;30(3):805–18.
46. Association for the Advancement of Medical Instrumentation (AAMI). ANSI/AAMI ST91:2015 Comprehensive guide to flexible and semi-rigid endoscope processing in health care facilities [Internet]. Arlington, VA: Association for the Advancement of Medical Instrumentation; 2015. Available from: https://www.aami.org/productspublications/ProductDetail.aspx?ItemNumber=2477
47. Association for the Advancement of Medical Instrumentation (AAMI). Preventing device-related healthcare-associated infections: issues and outcomes from the September 2016 forum, Medical Technology and HAIs [Internet]. Arlington, VA: Association for the Advancement of Medical Instrumentation (AAMI); 2016 [cited 2018 Feb 7]. 19 p. Available from: https://s3.amazonaws.com/rdcms-aami/files/production/public/FileDownloads/Summits/161227_AAMI_HAI_Forum_Report.pdf
48. International Organization for Standardization (ISO). ISO 9000:2015(en). Quality management systems — fundamentals and vocabulary [Internet]. Geneva: International Organization for Standardization (ISO); 2015 [cited 2018 Jan 18]. Available from: https://www.iso.org/obp/ui/#iso:std:iso:9000:ed-4:v1:en
49. International Organization for Standardization (ISO). ISO 9001:2015. Quality management systems — requirements [Internet]. Geneva: International Organization for Standardization (ISO); 2015 [cited 2018 Jan 18]. Available from: https://www.iso.org/standard/62085.html
50. International Organization for Standardization (ISO). ISO 13485:2016. Medical devices — quality management systems — requirements for regulatory purposes [Internet]. Geneva: International Organization for Standardization (ISO); 2016 [cited 2018 Jan 18]. Available from: https://www.iso.org/standard/59752.html
51. Beilenhoff U, Biering H, Blum R, Brljak J, Cimbro M, Dumonceau J-M, et al. Prevention of multidrug-resistant infections from contaminated duodenoscopes: position statement of the European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastroenterology Nurses and Associates (ESGENA). Endoscopy. 2017;49(11):1098–106.
52. Kallen AJ. CDC outbreak investigation. In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 14, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Jun 3]. p. 199–210. Available from: https://wayback.archive-it.org/7993/20170113091355/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451164.pdf
53. Centers for Disease Control and Prevention (CDC). Bronchoscopy-related infections and pseudoinfections—New York, 1996 and 1998. MMWR Morb Mortal Wkly Rep. 1999;48(26):557–60.
54. Wu R-P, Xi H-J, Qi K, Wang D, Nie X, Li Z-S. Correlation between the growth of bacterial biofilm in flexible endoscopes and endoscope reprocessing methods. Am J Infect Control. 2014;42(11):1203–6.
55. Hervé RC, Keevil CW. Persistent residual contamination in endoscope channels; a fluorescence epimicroscopy study. Endoscopy. 2016;48(7):609–16.
56. Herrmann IF, Heeg P, Matteja B, Strahl HM, Werner H-P, Boyce W, et al. Risques et dangers cachés de l’endoscopie, conduite à tenir. Acta Endosc. 2008;38(5):493–502.
57. Buss A, Been M, Borgers R, Stokroos I, Melchers W, Peters F, et al. Endoscope disinfection and its pitfalls — requirement for retrograde surveillance cultures. Endoscopy. 2008;40(04):327–32.
58. Kovaleva J, Meessen N, Peters F, Been M, Arends J, Borgers R, et al. Is bacteriologic surveillance in endoscope reprocessing stringent enough? Endoscopy. 2009;41(10):913–6.
59. Johani K, Hu H, Santos L, Schiller S, Deva AK, Whiteley G, et al. Determination of bacterial species present in biofilm contaminating the channels of clinical endoscopes. Infect Dis Health. 2018;23(4):189–96.
60. Otter JA, Vickery K, Walker JT, deLancey Pulcini E, Stoodley P, Goldenberg SD, et al. Surface-attached cells, biofilms and biocide susceptibility: implications for hospital cleaning and disinfection. J Hosp Infect. 2015;89(1):16–27.
61. Olson J. Medivators. In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 14, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Jun 3]. p. 69–77. Available from: https://wayback.archive-it.org/7993/20170113091355/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451164.pdf
62. Bridier A, Briandet R, Thomas V, Dubois-Brissonnet F. Resistance of bacterial biofilms to disinfectants: a review. Biofouling. 2011;27(9):1017–32.
63. Akinbobola AB, Sherry L, Mckay WG, Ramage G, Williams C. Tolerance of Pseudomonas aeruginosa in in-vitro biofilms to high-level peracetic acid disinfection. J Hosp Infect. 2017 Oct;97(2):162–8.
64. Ofstead CL, Wetzler HP, Johnson EA, Heymann OL, Maust TJ, Shaw MJ. Simethicone residue remains inside gastrointestinal endoscopes despite reprocessing. Am J Infect Control. 2016;44(11):1237–40.
65. da Costa Luciano C, Olson N, Tipple AFV, Alfa M. Evaluation of the ability of different detergents and disinfectants to remove and kill organisms in traditional biofilm. Am J Infect Control. 2016;44(11):e243–9.
66. Ofstead CL, Heymann OL, Quick MR, Eiland JE, Wetzler HP. Residual moisture and waterborne pathogens inside flexible endoscopes: Evidence from a multisite study of endoscope drying effectiveness. Am J Infect Control. 2018;46(6):689–96.
67. Ofstead CL, Doyle EM, Eiland JE, Amelang MR, Wetzler HP, England DM, et al. Practical toolkit for monitoring endoscope reprocessing effectiveness: identification of viable bacteria on gastroscopes, colonoscopes, and bronchoscopes. Am J Infect Control. 2016;44(7):815–9.
68. Ofstead CL, Wetzler HP, Eiland JE, Heymann OL, Held SB, Shaw MJ. Assessing residual contamination and damage inside flexible endoscopes over time. Am J Infect Control. 2016;44(12):1675–7.
69. Higa JT, Choe J, Tombs D, Gluck M, Ross AS. Optimizing duodenoscope reprocessing: rigorous assessment of a culture and quarantine protocol. Gastrointest Endosc. 2018;88(2):223–9.
70. Thaker AM, Muthusamy VR, Sedarat A, Watson RR, Kochman ML, Ross AS, et al. Duodenoscope reprocessing practice patterns in U.S. endoscopy centers: a survey study. Gastrointest Endosc. 2018;88(2):316-322.e2.
71. Kovaleva J. Endoscope drying and its pitfalls. J Hosp Infect. 2017;97(4):319–28.
72. Alfa MJ, Sitter DL. In-hospital evaluation of contamination of duodenoscopes: a quantitative assessment of the effect of drying. J Hosp Infect. 1991 Oct;19(2):89–98.
73. Petersen BT. Duodenoscope reprocessing: risk and options coming into view. Gastrointest Endosc. 2015;82(3):484–7.
74. Barakat MT, Huang RJ, Banerjee S. Comparison of automated and manual drying in the eliminating residual endoscope working channel fluid after reprocessing (with video). Gastrointest Endosc. 2018 Aug 24;
75. Saliou P, Le Bars H, Payan C, Narbonne V, Cholet F, Jézéquel J, et al. Measures to improve microbial quality surveillance of gastrointestinal endoscopes. Endoscopy. 2016;48(8):704–10.
76. Perumpail RB, Marya NB, McGinty BL, Muthusamy VR. Endoscope reprocessing: comparison of drying effectiveness and microbial levels with an automated drying and storage cabinet with forced filtered air and a standard storage cabinet [Epub ahead of print]. Am J Infect Control. 2019 Apr 6;
77. Catalone BJ, Olympus America Inc. Simethicone [letter to customers] [Internet]. 2009 Jun 9 [cited 2019 May 31]; Available from: https://medical.olympusamerica.com/sites/default/files/pdf/SimethiconeCustomerLetter.pdf
78. van Stiphout S, Laros I, van Wezel R, Gilissen L. Crystallization in the waterjet channel in colonoscopes due to simethicone. Endoscopy. 2016;48(S 01):E394–5.
79. Barakat MT, Huang RJ, Banerjee S. Simethicone is retained in endoscopes despite reprocessing: impact of its use on working channel fluid retention and adenosine triphosphate bioluminescence values (with video). Gastrointest Endosc. 2019;89(1):115–23.
80. ECRI Institute. Olympus—flexible endoscopes: manufacturer recommends against use of simethicone/non-water soluble additives — Alert [Internet]. Plymouth Meeting, PA: ECRI Institute; 2018 [cited 2019 Mar 1]. Available from: https://www.ecri.org/Components/Alerts/Pages/login.aspx?Page=AlertDisplay&AId=1635719
81. Visrodia K, Petersen BT. Borescope examination: Is there value in visual assessment of endoscope channels? Gastrointest Endosc. 2018;88(4):620–3.
82. Mandelstam P, Sugawa C, Silvis SE, Nebel OT, Rogers BH. Complications associated with esophagogastroduodenoscopy and with esophageal dilation. Gastrointest Endosc. 1976;23(1):16–9.