Las várices esofágicas son colaterales porto-sistémicas — es decir, canales vasculares que unen la circulación venosa portal con la sistémica. Se forman preferentemente en la submucosa del esófago inferior como consecuencia de la hipertensión portal (una complicación progresiva de la cirrosis). La ruptura y el sangrado de las várices son complicaciones mayores de la hipertensión portal y se asocian con tasa elevada de mortalidad. El sangrado varicoso es responsable de entre 10 y 30% de todos los casos de sangrado gastrointestinal alto.
1.1 Cascadas de la WGO – enfoque según la disponibilidad de recursos
En las regiones y los países en los que se dispone de todas las opciones diagnósticas y terapéuticas para el manejo de las várices esofágicas se puede aplicar un enfoque de “patrón oro”. Sin embargo, son muchos los países en los que esos recursos no se encuentran disponibles. Con sus Cascadas Diagnósticas y Terapéuticas, las Guías de la WGO brindan un enfoque sensible a los recursos.
Cascada: conjunto jerárquico de opciones alternativas diagnósticas, terapéuticas y de gestión para lidiar con el riesgo y la patología – calificados según los recursos disponibles.
1.2 Epidemiología
Si bien las várices se pueden formar a cualquier nivel a lo largo del tubo digestivo, lo más frecuente es que aparezcan en los últimos centímetros distales del esófago. Aproximadamente 50% de los pacientes con cirrosis presentan várices gastroesofágicas. Las várices gástricas se encuentran presentes en 5–33% de los pacientes con hipertensión portal.
La frecuencia de várices esofágicas varía entre 30% y 70% de los pacientes con cirrosis (Tabla 1), y 9–36% de los pacientes presentan lo que se conoce como várices de “alto riesgo”. En los pacientes con cirrosis, las várices esofágicas aparecen a una tasa anual de 5–8%, pero tienen un tamaño suficiente como para plantear riesgo de sangrado solo en 1–2% de los casos. Aproximadamente 4–30% de los pacientes con várices pequeñas pasarán a tener várices de gran tamaño cada año, por lo que estarán en riesgo de sangrado.
Tabla 1 Epidemiología de las várices esofágicas y correlación con la enfermedad hepática

La presencia de várices gastroesofágicas se correlaciona con la gravedad de la enfermedad del hígado. La gravedad de la cirrosis puede clasificarse usando el sistema de clasificación de Child–Pugh (Tabla 2).
Tabla 2 Clasificación de Child-Pugh de la gravedad de la cirrosis
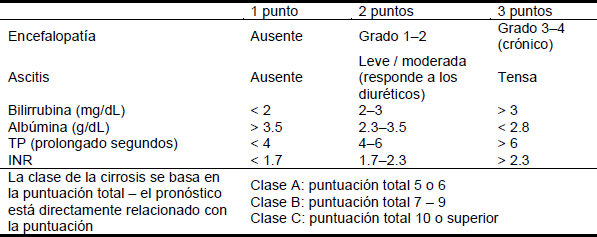
INR, relación internacional normalizada; TP, tiempo de protrombina.
1.3 Historia natural
Si un paciente con cirrosis no presenta várices es porque todavía no ha desarrollado hipertensión portal, o porque su presión portal todavía no es suficientemente alta como para desarrollar várices. A medida que la presión portal aumenta, pueden aparecer várices pequeñas. Con el tiempo, y a medida que la circulación hiperdinámica aumenta, el flujo de sangre por las várices también aumenta, elevando así la tensión sobre la pared. La hemorragia varicosa producida por la ruptura ocurre cuando la fuerza en expansión supera la tensión parietal máxima. Si no se modifica la tensión parietal, aumenta el riesgo de recurrencia.
Tabla 3 – Pronóstico en pacientes con várices esofágicas

Figura 1 – Historia natural de várices y hemorragia en pacientes con cirrosis2
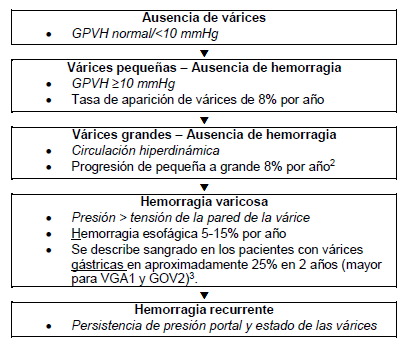
GPVH = gradiente de presión venosa hepática; VGA = várices gástricas aisladas en ausencia de várices esofágicas en el fondo gástrico; GOV2 = várices gastroesofágicas que se extienden a lo largo de la curvatura mayor hacia el fondo gástrico
1.4 Factores de riesgo
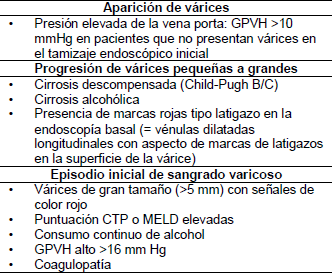
Una relación internacional normalizada (INR) > 1.5, un diámetro de la vena porta > 13 mm, y la presencia de trombocitopenia han probado ser predictivos de la probabilidad de que un cirrótico presente várices. Se estima que según se cumplan ninguna, una, dos o las tres condiciones, las probabilidades de que los pacientes presenten várices serán < 10%, 20–50%, 40–60%, y > 90%, respectivamente. La presencia de una o más de esas condiciones representa una indicación de endoscopía, para buscar várices y realizar profilaxis primaria contra el sangrado en los pacientes cirróticos (Tabla 4).
Tabla 4 – Factores de riesgo para várices esofágicas y hemorragia
La esofagogastroduodenoscopía es el patrón oro para el diagnóstico de várices esofágicas. Si no se cuenta con el patrón oro, se puede proceder a otros pasos diagnósticos, como ecografía con Doppler de la circulación sanguínea (no ecoendoscopía). Si bien ésta no es una buena opción, es cierto que puede mostrar la presencia de várices. Otras alternativas posibles son la radiografía baritada del esófago y estómago, y la angiografía de la vena porta y manometría.
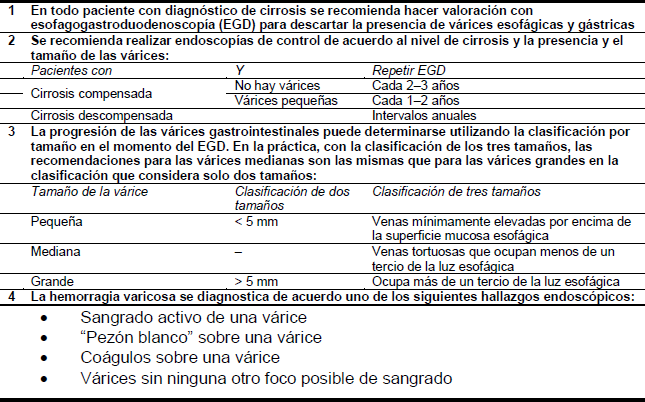
Es importante valorar la ubicación (esófago o estómago) y el tamaño de las várices, signos de inminencia de un primer sangrado agudo, o de su recurrencia, y (si corresponde) considerar la causa y la gravedad de la enfermedad hepática.
Tabla 5 – Guías para el diagnóstico de várices esofágicas
2.1 Diagnóstico diferencial de las várices esofágicas/hemorragia
El diagnóstico diferencial de la hemorragia varicosa incluye todas las etiologías de sangrado gastrointestinal (alto). Las úlceras pépticas son también más frecuentes en los individuos cirróticos.
Tabla 6 – Diagnóstico diferencial de várices esofágicas/hemorragia

Nota: todas estas patologías llevan a la aparición de várices esofágicas como resultado de la hipertensión portal.
2.2 Ejemplo de África — várices esofágicas provocadas por esquistosomiasis
La esquistosomiasis es la causa más común de várices en los países en desarrollo — en Egipto o Sudán, por ejemplo. En cifras absolutas, puede ser una causa más frecuente que la cirrosis hepática. En Sudan hay aldeas en las que más del 30% de la población tiene várices. Su función hepática se mantiene en buenas condiciones. Rara vez se descompensan y no desarrolla carcinoma hepatocelular (CHC). El sangrado varicoso es la principal causa de muerte en estos pacientes. Si se erradican las várices los pacientes pueden sobrevivir más de 25 años.
2.3 Otras consideraciones
Tabla 7 - Consideraciones sobre diagnóstico, prevención y manejo de las várices esofágicas y las hemorragias varicosas
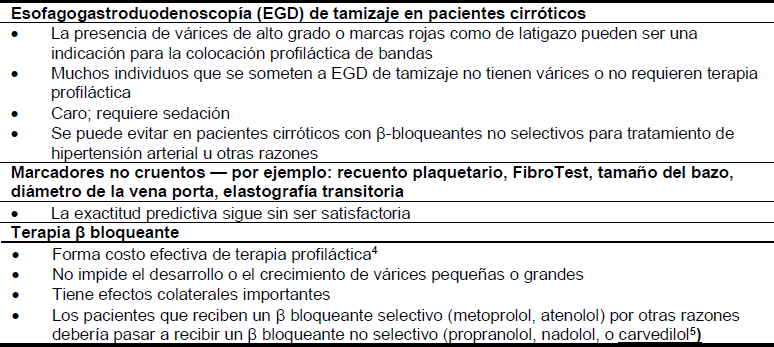
Las siguientes opciones de tratamiento están disponibles en el manejo de las várices esofágicas y la hemorragia (Tablas 8 y 9). Si bien son efectivas para detener el sangrado, ninguna de las medidas, excepto la terapia endoscópica, ha demostrado afectar la mortalidad.
Tabla 8 – Terapia farmacológica
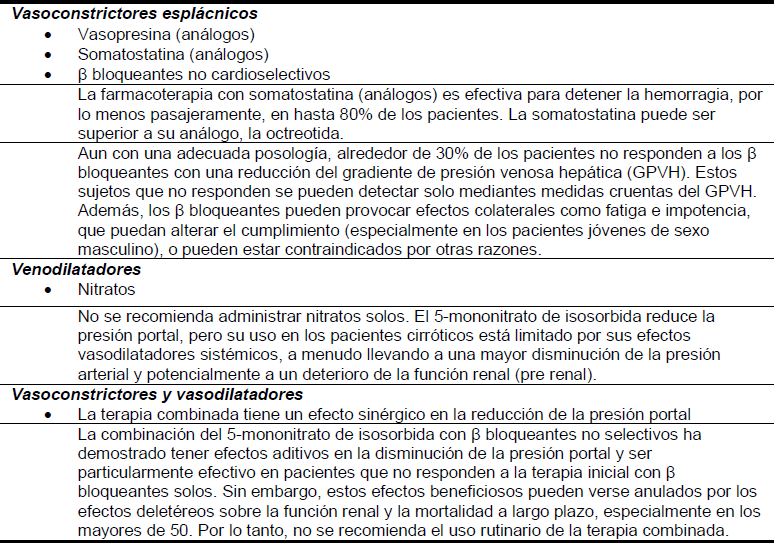
- El uso de fármacos vasoactivos puede ser seguro y efectivo cuando no se dispone fácilmente de terapia endoscópica y se asocia con menos eventos adversos que la escleroterapia de emergencia.6
Tabla 9 – Terapia endoscópica

- La escleroterapia endoscópica y la ligadura de las várices con bandas son medidas eficaces para detener el sangrado en hasta 90% de los pacientes. La LEV es más efectiva que la escleroterapia varicosa endoscópica (EVS), ofreciendo un mayor control de la hemorragia, poca repetición del sangrado, y eventos adversos menores pero sin diferencias en la mortalidad.7, 8 Sin embargo, la ligadura endoscópica con bandas puede ser más difícil de aplicar que la escleroterapia en pacientes con sangrado activo severo
- Una derivación portosistémica intrahepática transyugular (DPIT) es una buena alternativa cuando fracasan el tratamiento endoscópico y la farmacoterapia.
- El uso del taponamiento con balón disminuye, ya que existe un alto riesgo de repetición del sangrado después de desinflar el globo y un riesgo de complicaciones mayores. Sin embargo, el taponamiento con balón es eficaz para detener la hemorragia por lo menos temporariamente, y se lo puede utilizar en regiones del mundo en las que es difícil conseguir EGD y DPIT. Puede ayudar a estabilizar al paciente para ganar tiempo hasta que se pueda hacer EGD y/o DPIT. El tratamiento combinado endoscópico y farmacológico ha demostrado lograr un mejor control del sangrado agudo que el tratamiento endoscópico solo.9
3.1 Práctica clínica
En las siguientes figuras se presenta el enfoque para los pacientes con cirrosis y diferentes etapas de las várices o la hemorragia.
Figura 2 - Pacientes con cirrosis pero sin várices. EGD, esofagogastroduodenoscopía

Figura 3 - Pacientes con cirrosis y várices pequeñas, pero sin hemorragia.
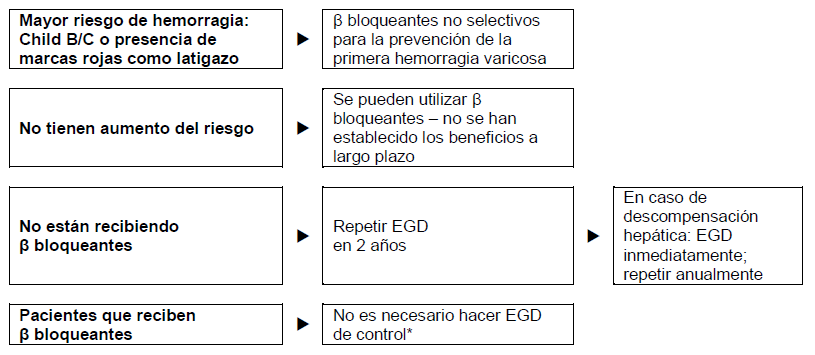
*Dado que muchos pacientes no responden al tratamiento con β bloqueantes o a la profilaxis del sangrado, se recomienda repetir el EGD tras 2 años (como en los que no reciben β bloqueantes).
β bloqueantes no cardioselectivos (propranolol, nadolol, o carvedilol), comenzando a dosis bajas, de ser necesario aumentando la dosis paso por paso hasta que la frecuencia cardíaca de reposo se reduzca 25%, pero no menos de 55 latidos/min. En comparación con los β bloqueantes, la ligadura endoscópica de las várices dio muestras de reducir de forma importante los episodios de sangrado y los eventos adversos severos, pero no tuvo ningún efecto sobre la tasa de mortalidad.
Figura 5 – Pacientes con cirrosis y hemorragia varicosa aguda.

EGD, esofagogastroduodenoscopía; LEV, ligadura endoscópica de las várices; IV, intravenoso; DPIT, derivación portosistémica intrahepática transyugular; HV, hemorragia varicosa.
La terlipresina se encuentra actualmente disponible en gran parte de Europa, India, Australia, y los E.A.U., pero no en Estados Unidos de América o Canadá.
- La hemorragia varicosa aguda a menudo se asocia con infección bacteriana debida a una translocación intestinal y trastornos de la motilidad. La antibioticoterapia profiláctica ha demostrado reducir las infecciones bacterianas y la repetición del sangrado varicoso12, y aumentar la tasa de supervivencia13.
- En el sangrado varicoso agudo o masivo, la intubación traqueal puede ser de extrema utilidad para evitar la aspiración de la sangre.
- En los pacientes con hemorragia varicosa en el fondo gástrico se prefiere hacer una obliteración endoscópica de las várices utilizando adhesivos tisulares (como cianoacrilato); la segunda opción es LEV.
- Debe considerarse el uso de DPIT en casos de sangrado incontrolable de várices en el fondo gástrico o si hay recurrencia pese a la terapia combinada farmacológica y endoscópica.
- La escleroterapia de emergencia no es mejor que la terapia farmacológica para los casos de sangrado agudo de várices en individuos con cirrosis.
- La terlipresina reduce la imposibilidad de controlar el sangrado y la mortalidad,14 y debería ser la primera elección para terapia farmacológica cuando esté disponible. Si no se dispone de terlipresina, se puede usar somatostatina, octreotida, y vapreotida.
- Si bien tratar el sangrado esofágico con análogos de somatostatina no parece reducir las muertes, puede sí reducir la necesidad de transfusiones de sangre.
Figura 6 – Pacientes con cirrosis que se han recuperado de una hemorragia varicosa aguda.
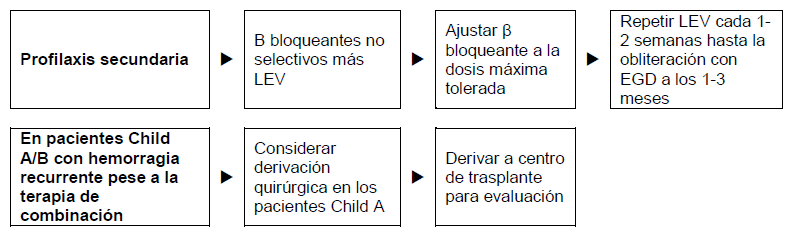
- El control endoscópico a largo plazo y la colocación de bandas o escleroterapia de las várices recurrentes cada 3–6 meses (en muchos lugares del mundo en desarrollo solo se dispone de escleroterapia). Si no se puede hacer ligadura endoscópica con bandas o si esa técnica está contraindicada, se puede administrar β bloqueantes no cardioselectivos (propranolol, nadolol, o carvedilol) comenzando con una posología baja, y de ser necesario aumentando la dosis poco a poco hasta que la frecuencia cardíaca de reposo se reduzca 25%, pero no llegando a menos de 55 latidos/min.
- En pacientes más jóvenes con una cirrosis menos avanzada (Child–Pugh A), se puede considerar el agregado de 5-mononitrato de isosorbida (comenzando a 2 × 20 mg al día y aumentando a 2 × 40 mg al día) si fracasan la escleroterapia o la farmacoterapia. Debe considerarse el uso de DPIT, especialmente en candidatos a trasplante de hígado. En casos seleccionados (pacientes con función hepática preservada, enfermedad hepática estable), se puede considerar un injerto en H calibrado o una derivación esplenorrenal distal (derivación de Warren).
- Las derivaciones portosistémicas presentan menores tasas de repetición del sangrado varicoso comparado con la escleroterapia/banding, pero aumentan la incidencia de encefalopatía hepática.15
- En pacientes con un grado B o C de la clasificación de Child–Pugh siempre se debe considerar el trasplante.
Recomendaciones para el manejo de primera línea de pacientes cirróticos en cada etapa de la historia natural de las várices (Fig. 7)
Figura 7 – Recomendaciones para el manejo de primera línea.
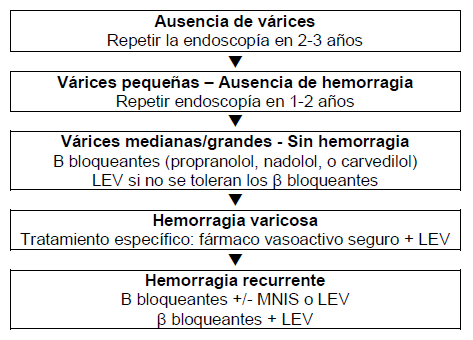
LEV, ligadura endoscópica de las várices; MNIS, 5-mononitrato de isosorbida.
3.2 Cascada de tratamiento
Una cascada es un conjunto jerárquico de técnicas diagnósticas o terapéuticas para la misma patología, catalogadas según los recursos disponibles.
Tal como se subrayara más arriba, varias opciones terapéuticas son efectivas en la mayoría de las situaciones clínicas que involucran hemorragias varicosas agudas, así como en la profilaxis secundaria y primaria y su prevención. La terapia óptima en condiciones individuales depende mucho de la facilidad relativa de la disponibilidad local de estos métodos y técnicas. Es probable que varíe ampliamente en diferentes partes del mundo.
En caso de sospecha de sangrado de várices, si resultara difícil realizar una endoscopía se debe recurrir a la farmacoterapia — por ejemplo: en pacientes con hematemesis y signos de cirrosis. De similar manera, la terapia farmacológica podría administrarse en circunstancias como profilaxis primaria en un paciente cirrótico con signos de hipertensión portal (esplenomegalia, trombocitopenia) y/o con función hepática alterada, y como profilaxis secundaria en un paciente cirrótico con antecedentes de sangrado gastrointestinal alto.
Si tampoco se dispone de farmacoterapia y se sospecha sangrado varicoso, se debe recurrir a medidas de reanimación general y transportar al paciente lo antes posible a una institución en la que se disponga de los medios diagnósticos y terapéuticos necesarios; el taponamiento con balón podría ser extremadamente útil en dicha situación.
Figura 8 – Cascada para el tratamiento de la hemorragia aguda de várices esofágicas.

V, intravenoso.
Nota: La combinación de la ligadura con bandas y escleroterapia no se utiliza de rutina excepto cuando el sangrado es demasiado profuso e impide identificar el vaso para colocar las bandas. En tales casos, se puede realizar la escleroterapia para controlar el sangrado y despejar el campo lo suficiente como para poder luego colocar las bandas.
Advertencia: Hay muchas afecciones que pueden provocar várices esofágicas. También hay muchas opciones de tratamiento, dependiendo de los recursos disponibles. Por un enfoque terapéutico sensible a los recursos en África, por ejemplo, se puede consultar a Fedail (2002).
3.3 Ejemplo de África — várices esofágicas y esquistosomiasis
Tabla 10 – Tratamiento de las várices esofágicas provocadas por esquistosomiasis

Nota: la terapia con fármacos vasoactivos no es realista en la mayoría de los países en desarrollo. En Sudán, por ejemplo, 1 mg de terlipresina (Glypressin) cuesta el equivalente de 25% del salario de un médico de familia y alrededor del mismo como un salario de un año para un empleado de gobierno.





















