J. Feld (Canada) and H.L.A. Janssen (Canada/Pays-Bas)
Z. Abbas (Pakistan)
A. Elewaut (Belgique)
P. Ferenci (Autriche)
V. Isakov (Russie)
A.G. Khan (Pakistan)
S.G. Lim (Singapour)
S. Locarnini (Australie)
S.K. Ono (Brésil)
J. Sollano (Philippines)
C.W. Spearman (Afrique du Sud)
C.T. Yeh (Taiwan)
M.F. Yuen (Hong Kong)
A.W. LeMair (Pas-Bas)
J.-J. Gonvers (Suisse)
1. Introduction
Le virus de l’hépatite B (VHB) peut être à l’origine de maladies hépatiques aiguës et chroniques et existe à l’état endémique dans beaucoup de régions du monde. La transmission du virus se produit par le contact avec le sang ou d’autres fluides corporels d’une personne infectée.
- Quand la transmission se produit verticalement (de mère à enfant) ou horizontalement aux jeunes enfants (pendant des jeux, par contacts dans le cadre de l’entourage, etc.), l’infection devient habituellement chronique.
- Par contraste, quand la transmission se produit chez des adolescents/adultes— d’ordinaire par relation sexuelle, par des aiguilles contaminés et moins souvent par des transfusions de produits sanguins—l’infection se résout sauf si l’individu est immunocompromis (par exemple, infecté par le VIH).
- Indiquer comment éviter un comportement à risque peut jouer un rôle important dans la prévention de l’infection par le VHB.
- Le personnel de santé est un groupe à haut risque d’infection par le VHB.
- Un vaccin sûr et efficace contre le VHB existe depuis 1982 et son efficacité est de 95% pour prévenir toute nouvelle infection.
Tout individu porteur d’une infection à VHB chronique (HBC) peut représenter une occasion pour prévenir la propagation du virus à d’autres personnes. Il est important de prendre le temps nécessaire pour éduquer les patients et pour leur expliquer le risque que l’infection fait courir à eux-mêmes et aux autres.
- La vaccination contre l’hépatite B est très efficace et une vaccination universelle en bas âge—de préférence à la naissance dans les pays à haute endémicité—est souhaitable.
- Au minimum, la vaccination devrait être propose à tous les individus à risque.
- Chez les femmes enceintes, on doit faire un dépistage avant l’accouchement, car cela permet d’éviter une autre génération de personnes infectées de manière chronique.
Quoique la plupart des patients avec une infection chronique à VHB ne développent pas de complications hépatiques, tout individu infecté court un risque plus élevé de développer une fibrose hépatique progressive, ce qui peut conduire à une cirrhose et finalement à une décompensation hépatique et/ou un cancer hépatocellulaire (CHC). – Fort heureusement, une prise en charge efficace permet de réduire le risque de complications liées à l’hépatite B.
1.1 Algorithmes OMG (WGO)
Ce guideline de l’OMG comprend une série d’algorithmes afin d’offrir des options tenant compte des ressources à disposition pour le diagnostic et la prise en charge de l’hépatite B. Ces algorithmes OMG sont destinés à complémenter, plutôt qu’à remplacer, les guidelines de référence (“gold standard”) émis par European Association for the Study of the Liver (EASL), the American Association for the Study of Liver Diseases (AASLD), the Asian–Pacific Association for the Study of the Liver (APASL), and the National Institute for Care and Health Excellence (NICE) [1–4].
1.2 Epidémiologie et transmission de l’hépatite B
Parmi les nombreuses causes virales de maladie chez l’homme, il n’en existe que très peu qui ont une importance plus élevée à l’échelon mondial que le virus de l’hépatite B [5]:
- Plus de 2 milliards de personnes dans le monde présentent actuellement une évidence sérologique d’une infection par le VHB en cours ou passée.
- 250 millions de personnes sont infectées de manière chronique et risquent de développer des pathologies hépatiques en rapport avec le VHB [6].
- Environ 15–40% des patients infectés de manière chronique développeront une cirrhose, progressant vers une insuffisance hépatique et/ou un carcinome hépatocellulaire.
- Chaque année il y a plus de 4 millions de cas cliniques aigus d’infection par le VHB.
- Il est estimé que l’infection par VHB et ses complications (cirrhose, carcinome hépatique primaire) fait un million de morts chaque année [7].
- En 2010, il a été estimé qu’il y avait 786'000 morts annuellement en relation avec le VHB [8].
La prévalence du VHB varie significativement selon les différentes régions du monde (Fig. 1). Dans la littérature, une distinction est faite habituellement entre les régions d’endémie haute, moyenne, basse et très basse.
- Dans les régions d’endémie haute [5], environ 70–90% de la population est infectée par le VHB avant l’âge de 40 ans et 8–20% de personnes développent une infection chronique avec persistance du virus [9].
- La prévalence de l’infection chronique varie à plus de 10% de la population en Asie du Sud-est, en Chine, dans la région amazonienne et l’Afrique sub saharienne à moins de 1% en Europe occidentale et en Amérique du Nord.
- Globalement, approximativement 45% de la population globale vit dans des régions de haute endémie. Avec le processus de globalisation de nombreux individus avec le VHB migrent dans des régions où le taux d’infection chronique par VHB est bas, et cela peut facilement échapper à l’attention.
Fig. 1 Distribution géographique des génotypes des virus de l’hépatite B dans le monde (reproduit avec la permission de [10, 11].
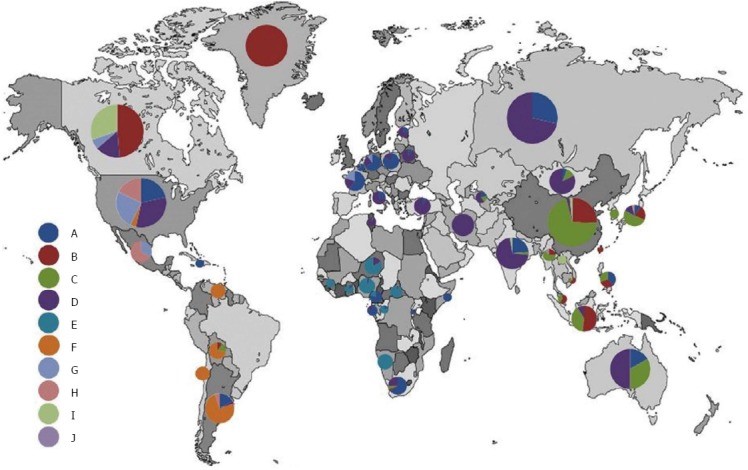
Notes: Des données publiées récemment [12,13] montrent la distribution suivante pour la Russie : génotype D, 85%; genotype A, 10.7%; génotype C, 3.2%; tous les autres génotypes, 1.1%. Au Venezuela, VHB génotype F est le plus fréquent dans la population générale (comme en Colombie et au Pérou) [14]; la prévalence dans la population urbaine est approximativement de 80% [15], tandis que chez les “Amerindians” elle est presque de 100% [16].
Le large éventail des chiffres de prévalence de l’hépatite B chronique dépend largement de l’âge auquel l’infection s’est déclarée.
- Le risque que l’infection aiguë devienne chronique est de 70–90% si elle est acquise de manière périnatale (transmission verticale) et de 20–50% si elle est acquise dans la petite enfance c’est-à-dire avant 5 ans (transmission horizontale).
- Le risque de développer une hépatite B chronique varie de 1–3% si cette infection est acquise à l’âge adulte chez des patients immunocompétents, avec des taux plus élevés chez les individus immunosupprimés.
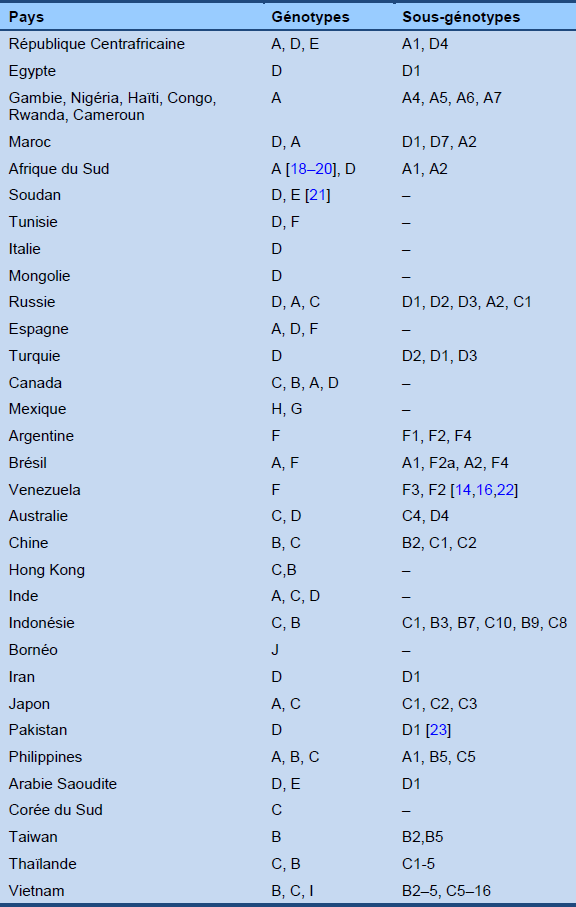
- Huit [17] (et possiblement jusqu’à 10) génotypes du virus de l’hépatite B ont été identifiés (A–H), et leur distribution géographique varie ainsi que leur potentiel d’affecter l’évolution clinique de la maladie (Table 1). La prévalence des génotypes du virus de l’hépatite B dépend actuellement très fortement des tendances en matière d’immigration.
Tableau 1 Distribution géographique des génotypes et sous-génotypes de l’infection par le virus de l’hépatite B [10]
Un nombre de plus en plus important de patients avec infection chronique développent des variants du VHB qui n’expriment que peu ou pas l’antigène e du virus de l’hépatite B (HBeAg); cette hépatite B HBeAg-négative peut nécessiter un traitement au long terme pour réduire le risque de la progression de l’affection hépatique avec rechute à l’arrêt du traitement. Une distinction doit être faite entre une mutation précore, où la production du HBeAg est éliminée complètement par une « stop mutation » dans le gène précore, et une mutation du promoteur du core (BCP) qui peut affecter le promoteur et ainsi réduire mais ne pas éliminer la production du HBeAg. La prévalence des mutations précore est la plus élevée dans les pays méditerranéens où le génotype D est le plus prévalent, alors que les mutations du promoteur du core se trouvent surtout dans le génotype C (en Asie de l’Est et du Sud-Est).
2. Evolution clinique de l’infection par le virus de l’hépatite B
L’évolution d’une infection par le VHB dépend largement de l’interaction hôte virus, avec médiation de la réponse immunitaire adaptée. La réponse des cellules T spécifiques au virus est un des éléments clés de la pathogénèse de l’infection par le VHB. Des variations virales peuvent influencer le cours et l’issue de la maladie. L’effet des facteurs de l’hôte dans la progression de la maladie est mal connu. C’est seulement très rarement (quand il y a une suppression immunitaire profonde) que le virus de l’hépatite B devient directement cytopathogène.
2.1 Histoire naturelle
L’histoire naturelle de l’infection par le VHB est variable et l’infection peut se manifester sous la forme d’une infection aiguë (spontanément résolutive), d’une insuffisance hépatique fulminante, d’un état de porteur inactif et d’une hépatite chronique avec un risque de progression vers la cirrhose et le carcinome hépatocellulaire [24,25].
2.2 Infection chronique par le VHB
Dans l’infection aiguë par le virus de l’hépatite B, le risque de chronicité est lié à l’âge au moment de l’infection primaire. Chez les adultes qui ont été chroniquement infectés dans l’enfance, le risque de mortalité dû à une cirrhose en relation avec le VHB ou à un carcinome hépatique est de 15–25% ; ce risque est sensiblement plus élevé chez les hommes que chez les femmes [26].
Tableau 2 Risque de chronicité et âge lors de l’infection primaire

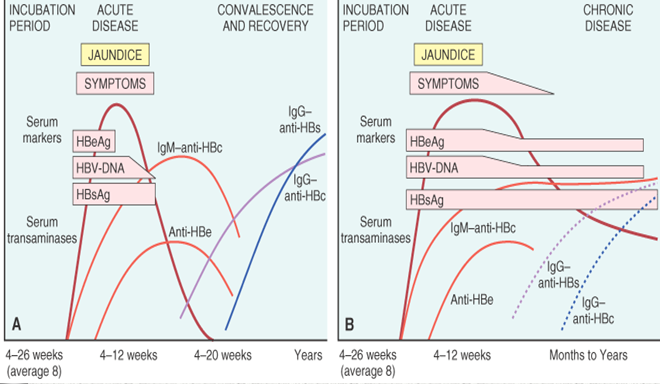
Fig. 2 Séquence des marqueurs sérologiques dans l’hépatite B aiguë (reproduit avec l’autorisation de [27] : A : résolution de l’infection active ; B : progression vers l’infection chronique.
2.3 Evolution de l’hépatite B chronique
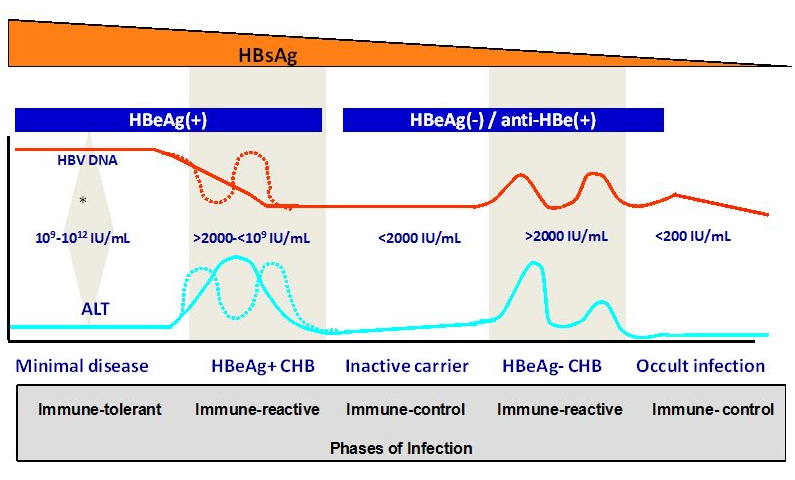
L’hépatite B chronique est une affection dynamique qui fluctue au fil du temps, probablement à cause des interactions entre le virus et le système immunitaire de l’hôte. Les cinq phases décrites ci-dessous—qui ne sont pas forcément séquentielles—peuvent être mises en évidence lors d’une infection chronique par le virus de l’hépatite B.
- Phase d’immuno-tolérance:
- Caractérisée par un niveau élevé de HBV DNA sérique, un HBeAg positif, des transaminases ALT normales et une absence de nécro inflammation hépatique.
- Chez les patients qui demeurent dans cette phase, la progression de la maladie est minime [28].
- Lors de cette phase, les patients sont hautement contagieux.
- Phase immuno-réactive (hépatite B chronique HBeAg-positive):
- Le moment où les patients entrent dans cette phase peut varier, en relation avec l’âge auquel l’infection s’est produite.
- Le système immunitaire devient plus actif et s’attaque aux hépatocytes infectés.
- Cette phase est caractérisée par des niveaux de HBV-DNA hautement fluctuants mais qui ont tendance à diminuer progressivement, des ALT élevées et une nécro inflammation hépatique (HBC HBeAg-positive).
- Une phase immuno-active prolongée avec de multiples poussées d’ALT peut se traduire par une fibrose hépatique progressive conduisant à une cirrhose.
- Phase de contrôle immunitaire (état de porteur inactif):
- La transition vers cette phase en tant que résultat de la phase immune-active se caractérise par une séroconversion de HBeAg à anti- HBeAg.
- Cette phase est caractérisée par des niveaux de HBV DNA sérique bas (< 2000 IU/mL) voire indétectable, des ALT normales et la disparition de la nécro inflammation hépatique.
- Phase de réactivation (hépatite B chronique HBeAg-négative):
- Malgré une séroconversion HBe, une réactivation de la réplication de VHB peut se produire en raison de la sélection de mutants du VHB HBeAg-déficients.
- Cette phase est caractérisée par des niveaux d’anticorps anti-HBe positifs, un VHB ADN et des ALT fluctuants accompagnée d’un risque élevé de progression vers une fibrose hépatique sévère (HBC HBeAg-négative).
- Il peut s’avérer difficile de distinguer entre HBC HBeAg-négative et une affection inactive en raison des poussées périodiques d’ALT avec normalisation entre-temps et il est important de poursuivre le suivi des patients avec ALT normales et ADN VHB bas avant de les désigner comme porteurs inactifs.
- De nouvelles données suggèrent qu’un taux de VHB ADN bas (< 2000 IU/mL) accompagné d’un titre bas de l’antigène de surface de l’hépatite B (HBsAg) (< 1000 IU/mL) peut aider à identifier les porteurs inactifs, en particulier ceux avec une infection par le génotype D [29].
- Phase HBsAg-négative:
- Après la perte de HBsAg, un taux bas de réplication du VHB peut persister avec un VHB ADN détectable dans le foie mais rarement dans le sérum [30].
- Chez les patienbts avec une infection à VHB “occulte”, la persistence d’un contrôle immunologique effectif du VHB a été démontré [31].
- Une immunosuppression significative peut entraîner une réactivation du VHB avec réapparition de l’HBsAg, phénomène appelé réactivation du VHB (reverse seroconversion).
Fig. 3 Marqueurs et histoire naturelle de l’hépatite B chronique
2.4 Progression de l’hépatite B chronique
L’hépatite B chronique a une évolution très variable, allant d’une infection subclinique silencieuse à une hépatite persistante avec une fibrose progressive pouvant conduire à une cirrhose, une insuffisance hépatique et/ou un cancer hépatique. Les déterminants de cette évolution ne sont pas totalement compris, mais ils comprennent des facteurs viraux, de l’hôte et de l’environnement (Tableau 3), qui agissent entre eux. Pour le pronostic, la signification des déterminants viraux varie selon le stade de la maladie. Par exemple, les titres sériques de HBV DNA sont le plus élevés dans la phase d’immunotolérance malgré l’absence d’inflammation hépatique ou de fibrose progressive à ce stade de la maladie. Par contre, dans l’hépatite B chronique HBeAg- négative, plus le niveau de HBV ADN est élevé, plus le risque de progression de la maladie et de CHC est élevé. Les taux de progression vers la cirrhose et le CHC et les taux de mortalité associés sont décrits dans la Fig. 4.
Tableau 3 Facteurs impliqués dans l’issue clinique de l’hépatite B chronique
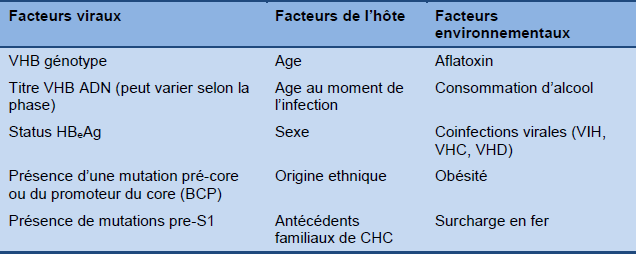
BCP, basal core promoter; HBeAg, hépatite B antigène; VHB, virus hépatite B; CHC, carcinome hépatocellulaire; VHC, virus hépatite C; VHD, virus hépatite D; VIH, virus de l’immunodéficience humaine.
Fig. 4 Risque de progression chez les patients avec une cirrhose en relation avec le virus de l’hépatite B
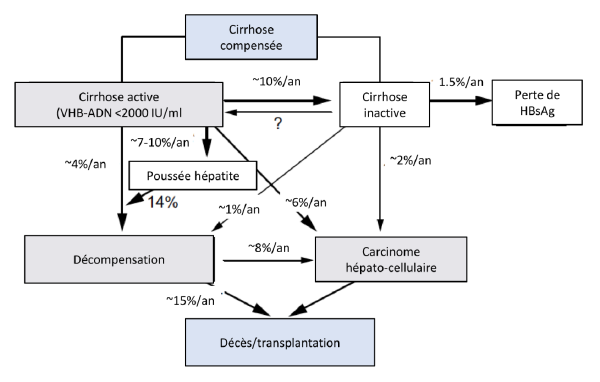
3. Diagnostic et surveillance de l’hépatite B
3.1 Algorithme—hépatite B aiguë
Le diagnostic de l’hépatite B aiguë est basé sur la détection de HBsAg et d’anti-HBc (immunoglobuline M).
- Durant la phase initiale de l’infection, les marqueurs de la réplication du VHB—HBeAg and VHB ADN—sont également présents.
- La guérison est accompagnée par la clearance de l’ADN VHB détectable, la séroconversion de HBeAg en anti-HBe et ultérieurement l’élimination de HBsAg avec séroconversion en anti-HBs et apparition d’anti-HBc (IgG).
- L’évolution de l’hépatite B aiguë devrait avoir lieu dans les trois mois qui suivent le diagnostic—l’infection chronique par VHB est caractérisée par la persistance dans le plasma de HBsAg pendant plus de 6 mois.
Les patients se présentent rarement pendant la période fenêtre alors que l’ HBsAg est déjà devenu négatif mais que l’anti-HBs n’est pas encore positif. Dans ce cas, qui se rencontre le plus fréquemment chez les patients avec une hépatite B fulminante chez qui la clearance virale tend à être plus rapide, l’immunoglobuline M (IgM) anti-HBc est le seul marqueur d’une infection aiguë par VHB.
Algorithme 1 Tests de diagnostic de l’hépatite B aiguë

Le diagnostic différentiel de l’hépatite aiguë HBsAg-positive inclut des exacerbations de l’hépatite B chronique, qui peuvent se produire à n’importe quel moment chez n’importe quel individu chroniquement infecté (dans ces conditions on peut assister à une réversion à l’anti-HBc IgM). Une hépatite aiguë peut survenir après arrêt d’un traitement immunosuppresseur ou par surinfection d’une personne chroniquement infectée par l’hépatite B par les virus de l’hépatite C et/ou D, ou par virus de l’hépatite A. Une hépatite aiguë surajoutée, due aux médicaments ou autres toxines administrés à une personne avec hépatite B chronique “silencieuse” peut aussi se présenter comme une hépatite aiguë. Un facteur précipitant n’est parfois pas identifié.
3.2 Résolution de l’infection à VHB
Une infection antérieure par VHB est caractérisée par la présence d’anti-HBs et IgG anti-HBc. Anti-HBs devient quelquefois indétectable après plusieurs années. (Anti- HBs est souvent indétectable si l’infection VHB survient pendant l’enfance, comme on peut le constater en Afrique subsaharienne). Il est à noter que malgré le fait que ces personnes sont décrites comme ayant une « infection VHB résolue », des quantités infimes de VHB ADN demeurent dans leur foie pendant des années et même parfois pendant toute leur vie. Le contrôle immunitaire empêche une expansion virale, mais en présence d’une immunosuppression sévère (par exemple, en présence d’une coïnfection VIH, d’une transplantation de moelle osseuse, d’un traitement par rituximab, etc.), HBsAg peut réapparaître (reverse seroconversion) ou une réplication virale peut être détectée dans le foie même sans réapparition de VHB ADN sérique. Une immunité contre l’infection VHB après vaccination est caractérisée par la présence d’anti-HBs uniquement.
3.3 Infection à VHB chronique
Le diagnostic de l’infection chronique par VHB est défini par la persistance de HBsAg pendant plus de 6 mois.
- On doit établir tout d’abord si l’individu est dans la phase HBeAg-positive ou la phase HBeAg-négative de l’infection (Tableau 4).
- Des tests additionnels pour les marqueurs de la réplication du VHB—HBeAg et des dosages répétés du VHB ADN sérique, en plus de l’ALT—devraient être effectués.
- Ceci déterminera en partie si le patient doit recevoir un traitement pour VHB.
- Les patients HBeAg-positifs aussi bien que les patients HBeAg-négatifs, même s’ils ont des ALT sériques normales (femmes < 20 IU/L et hommes < 30 IU/L) et/ou un VHB ADN indétectable, ont besoin d’être contrôlés toute leur vie, car la maladie peut évoluer avec le temps, même s’ils restent asymptomatiques.
- Parmi les patients avec persistance de l’HBsAg, ceux avec des ALT élevées devraient être suivis plus étroitement, de préférence avec des mesures répétés du VHB ADN.
- Il est important de connaître la limite inférieure de détection de la méthode utilisée pour le dosage du VHB ADN, dans la mesure où des valeurs qui restent supérieures à ≥ 2000 IU/mL peuvent inciter à un traitement antiviral.
- La décision d’initier un traitement dépend de multiples facteurs (par exemple, pas seulement le niveau du VHB ADN et/ou des ALT). Si l’atteinte hépatique parait se développer (à en juger par une biopsie du foie ou des marqueurs non invasifs de l’inflammation et de la fibrose telle l’élastographie (fibroscan), le traitement doit être envisagé.
- Des tests additionnels pour l’hépatite C et l’hépatite D doivent aussi être effectués afin d’exclure une surinfection par d’autres virus de l’hépatite, particulièrement chez les patients avec une ALT élevée mais un VHB ADN bas ou indétectable.
- On doit également envisager la possibilité d’une lésion hépatique due à des médicaments (suppléments), à une stéatohépatite non alcoolique (NASH) et à une surcharge en fer.
Tableau 4 Différentiation des phases de l’hépatite B chronique
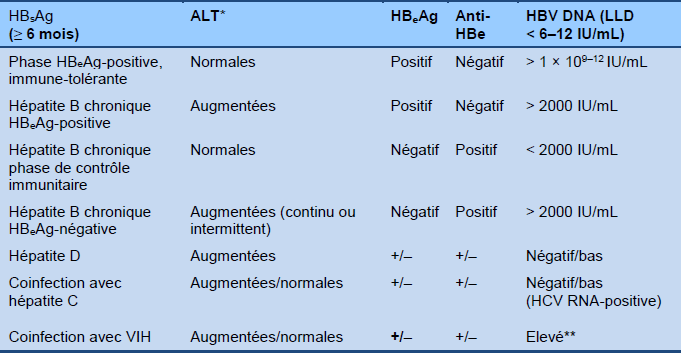
HBC, hépatite B chronique B; HBeAg, antigène e; HBsAg, antigène de surface de l’hépatite B; VHB, virus hépatite B; VIH, virus de l’immunodéficience humaine; LLD, limite inférieure de détection.
*Valeur normale < 20 IU/L chez les femmes, < 30 IU/L chez les hommes.
** Peut être variable, dépendant du mode et de l’âge d’acquisition de VHB, coinfection VIH/VHB et du taux de CD4..
Différents taux de VHB ADN sont utilisés afin de décider de commencer un traitement pour une infection HBeAg-positive et HBeAg-negative, selon le génotype prévalent dans les différentes régions. En règle générale (et comme il n’est pas possible d’identifier le génotype de tous les patients), le niveau recommandé par l’EASL peut être utilisé pour les patients caucasiens: 2 × 103 IU/mL (et âge > 30 ans); et celui recommandé par l’APASL/AASLD peut être utilisé pour les patients asiatiques: 2 × 104 IU/mL (et âge > 40 y).
3.4 Evaluation initiale des patients avec une infection chronique par le VHB
Les individus chez qui une infection chronique par le VHB a été récemment découverte doivent comprendre qu’une surveillance à long terme est nécessaire pour surveiller le développement d’une hépatite chronique, d’une cirrhose et d’un carcinome hépatocellulaire via une série d’examens cliniques et de tests de laboratoire, même s’ils sont asymptomatiques. Il est important de vérifier le stade de l’hépatite B chronique et de décider la fréquence des examens de suivi nécessaires.
- Une infection chronique par le VHB ne s’accompagne pas forcément d’une maladie hépatique progressive nécessitant un traitement antivirale.
- Une évaluation minutieuse de tout porteur HBsAg-positif est nécessaire est nécessaire afin d’identifier [33]:
- La phase de l’infection
- Le degré d’inflammation hépatique
- Le degré de la fibrose hépatique
- D’autres causes de maladie hépatique
- La nécessité d’un traitement
- La présence de cofacteurs pouvant augmenter le risque de progression vers une cirrhose ou un CHC: coïnfections avec le virus de l’hépatite D (VHD), le virus de l’hépatite C (VHC) et le VIH ainsi que des comorbidités comme l’alcoolisme, une maladie auto-immune ou une maladie hépatique métabolique
L’examen initial doit inclure les points suivants :
- Anamnèse et examen physique, comprenant l’examen de la peau et de l’abdomen.
- Marqueurs de l’infection par VHB, y compris HBeAg/anti-HBe et VHB ADN pour identifier la phase de l’hépatite B chronique, aussi bien que le génotype du VHB si on prévoit un traitement antiviral par l’interféron.
- Marqueurs d’autres infections virales y compris VHC et VHD, en particulier si les ALT sont élevées, mais le VHB ADN est bas ou indétectable.
- Avant la mise en route d’un traitement antiviral oral, tous les patients doivent subir un test de détection du VIH.
- Examen complet du foie (ALT/AST pour identifier une inflammation active et taux de bilirubine, de prothrombine et d’albumine pour vérifier la fonction de synthèse du foie).
- Bilan sanguin complet, en particulier numération plaquettaire comme marqueur indirect de l’hypertension portale.
- Ultrasonographie abdominale de base pour dépistage du carcinome hépatocellulaire—l’alpha foetoproteïne peut être utilisé dans les régions avec une haute endémicité du VHB et du HCC mal différencié, tout comme dans les régions sans accès facile à l’ultrasonographie de qualité.
- Mesure de la fibrose hépatique par test sérologique, ainsi que par FibroScan (élastographie transitoire) ou par biopsie du foie.
Tableau 5 Facteurs de risque dépendants de l’hôte et du virus associés avec la progression de l’hépatite B chronique
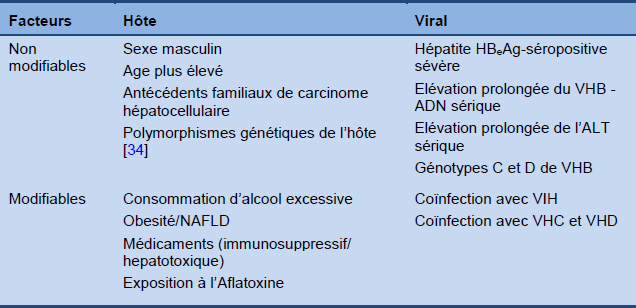
ALT, alanine aminotransférase; HBeAg, antigène e de l’hépatite B; VHB, virus de l’hépatite B; CHC, carcinome hépatocellulaire; VHD, virus de l’hépatite D; VIH, virus de l’immunodéficience humaine; NAFLD, stéatose hépatique non alcoolique.
3.5 VHB occulte
Une infection occulte par le VHB peut se définir comme la persistance de VHB ADN dans le tissu hépatique (et parfois dans le sérum) chez des individus chez qui l’antigène de surface de l’hépatite B (HBsAg) n’est pas détectable dans le sang, généralement avec un anti-HBc positif.
L’infection occulte VHB existe partout dans le monde, mais sa fréquence est liée à la prévalence de l’infection par VHB déclarée dans une zone géographique spécifique. L’infection occulte par VHB est transmissible par les transfusions sanguines et les transplantations d’organes.
- Les produits sanguins doivent faire l’objet d’un dépistage de HBsAg, anti-HBc et idéalement de VHB ADN.
- Les organes provenant de donneurs avec un anti-HBc et/ou un anti-HBs devraient de préférence être utilisés pour les receveurs testés positifs pour anti-HBs ou HBsAg.
Bien que la vraie relevance de l’infection occulte par le VHB n’est pas connue, elle peut se révéler un facteur de risque supplémentaire de carcinome hépatocellulaire chez les patients anti-HCV–positifs et les individus infectés par le VIH. Elle peut aussi être associée avec la progression d’une pathologie hépatique chronique due à d’autres causes que le VHB.
3.6 Réactivation du VHB
La réplication du VHB est contrôlée par le système immunitaire de l’hôte. Toute immunosuppression qu’elle qu’elle soit peut conduire à une perte du contrôle immunitaire et par voie de conséquence à une réactivation du VHB, avec comme résultat toute une gamme de conséquences, allant d’une augmentation subclinique du VHB ADN à une maladie ictérique et même à une maladie fulminante et/ou une décompensation hépatique mortelle. La réactivation du VHB est le plus fréquemment associée à une chimiothérapie anticancéreuse mais peut survenir également avec d’autres thérapies immunosuppressives ou immunomodulatrices (par exemple immunothérapie ciblée). L’adjonction de corticostéroïdes systémiques (SCS) à des corticostéroïdes inhalés augmente le risque de réactivation du VHB, en particulier quand les SCS sont administrés de façon chronique ou à haute dose [35].
Un traitement préventif avec un analogue nucléosidique/nucléotidique est recommandé chez les patients HBsAg-positifs qui vont recevoir des médicaments anticancéreux ou immunosuppresseurs. Un tel traitement devrait se poursuivre tout au long de l’immunosuppression et pendant les 6–12 mois suivants, avec une surveillance pour s’assurer que des poussées ne se produisent pas à l’arrêt du traitement antiviral.
Une réactivation peut également se produire chez les patients HBsAg-negatifs mais anti-HBc-positifs (avec ou sans VHB ADN), mais une immunosuppression plus importante est nécessaire. La réapparition de HBsAg est appelée séroconversion inverse. Le risque paraît être augmenté lors de la prise de rituximab ou d’une autre chimiothérapie anti-CD20, probablement en raison de la déplétion durable des cellules B. Le VHB ADN peut augmenter même avant que le HBsAg réapparaisse dans le sérum. Un traitement préventif avec un analogue nucléosidique/nucléotidique peut diminuer le risque de réactivation du VHB, mais n’est pas forcément nécessaire chez tous les patients [36]. Les patients qui ne reçoivent pas un traitement préventif devraient être surveillés par des dosages répétés d’HBsAg, ALT, et si possible du VHB ADN avec l’instauration d’un traitement antiviral si l’HBsAg réapparaît ou si leVHB ADN augmente.
En résumé:
- Un dépistage de l’HBsAg et de l’anti-HBc est nécessaire avant d’entreprendre une chimiothérapie ou une thérapie immunosuppressive/immunomodulatrice.
- Chez les patients HBsAg-positifs un traitement antiviral préventif devrait être instauré pendant la chimiothérapie et pendant les 6–12 mois qui suivent.
- Les bénéfices d’un traitement préventif sur une réactivation occulte du VHB restent incertains à l’heure actuelle.
- Chez les patients avec une évidence d’infection antérieure par le VHB, confirmée par des anti-HBc positifs avec ou sans anti-HBs, des contrôles répétés des marqueurs liés au VHB sont recommandés pendant et après un traitement immunosuppresseur.
- Les patients qui reçoivent une chimiothérapie ou une immunosuppression doivent suivre les recommandations de l’American Association for the Study of Liver Diseases (AASLD) et de l’Asian-Pacific Association for the Study of the Liver (APASL) (Fig. 5).
Fig. 5 Algorithmes de l’APASL pour tous les candidats à une chimiothérapie (Source : Asian-Pacific Association for the Study of the Liver)
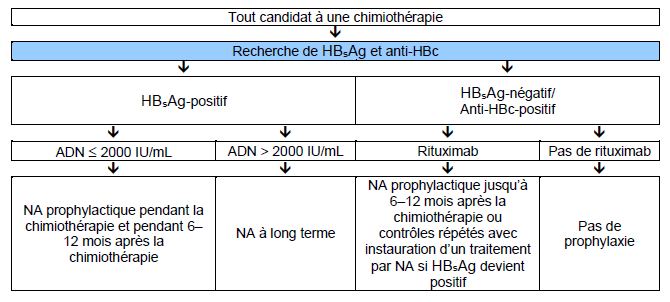
NA : analogue nucléosidique
3.7 Dépistage du carcinome hépatocellulaire (CHC)
Le but est de détecter des tumeurs dont le diamètre est inférieur à 3 cm voire même moins de 2 cm, afin de proposer une possibilité de traitement curatif. Le dépistage du carcinome hépatocellulaire est conseillé chez tous les patients cirrhotiques, car ils sont à un risque très élevé de développer un CHC. Cependant en Afrique et en Asie du Sud- Est, où l’infection par VHB est acquise tôt dans la vie, le CHC peut se développer sur un foie non cirrhotique.
L’AASLD recommande une surveillance chez les types suivants de patients atteints d’hépatite B chronique:
- Tous les hommes asiatiques de plus de 40 ans et toutes les femmes asiatiques de plus de 50 ans
- Tous les patients avec une cirrhose, quel que soit leur âge
- Les patients avec des antécédents familiaux de CHC, quel que soit leur âge
- Les africains de plus de 20 ans
- Tous les individus avec coïnfection VHB/VIH
L’étude de Singal et al. a montré que, dans un milieu clinique du « monde réel », une combinaison ultrasonographie et d’alpha foetoprotéine (AFP) représente la stratégie la plus efficace pour la détection d’un CHC à un stade précoce avec une amélioration significative de la sensibilité à 90%, avec une perte minime de la spécificité (83%). L’AFP seule peut se révéler meilleure que l’ultrasonographie seule car la fiabilité de l’ultrasonographie dépend très fortement de l’habileté et l’expérience de celui qui pratique l’examen [37].
Pour les porteurs d’hépatite B non inclus dans cette liste, le risque de CHC dépend de la sévérité de l’atteinte hépatique sous-jacente et de l’activité inflammatoire hépatique présente ou passée. Ceux avec de hautes concentrations de VHB ADN et une activité inflammatoire hépatique en cours (mise en évidence par des valeurs d’ALT élevées) ont un risque augmenté de CHC et il faudrait envisager d’instaurer une surveillance. Une infection par le génotype C et la présence de BCP et des mutations pre-S1 sont également associées à un risque plus élevé de CHC.
4. Traitement de l’hépatite B chronique
Avant de commencer toute forme de traitement du VHB, et de manière optimale, au moment de la première présentation, on doit fournir au patient toute l’information nécessaire concernant l’hépatite B chronique et son traitement. Cette information devrait impérativement comprendre les points suivants:
- L’évolution clinique de l’hépatite B chronique.
- La plupart des infections demeurent initialement entièrement asymptomatiques, même dans le cas d’une maladie sévère.
- La nécessité d’une surveillance régulière tout au long de la vie.
- La possibilité d’une transmission aux proches—la famille et les connaissances devraient subir un dépistage HBV et ceux qui ne sont pas immunisés contre l’HBV devraient être vaccinés tandis que ceux qui sont HBsAg-positifs devraient être faire l’objet d’une évaluation clinique.
- Quand instaurer un traitement.
- La nécessité d’une compliance absolue avec potentiellement un traitement à long terme.
- La nécessité d’une compliance absolue avec des examens de suivi pendant ou en dehors du traitement.
- L’importance d’une abstinence de l’alcool et d’une attention aux médicaments potentiellement hépatotoxiques ou dangereux chez les patients avec une maladie hépatique avancée (en soulignant par exemple les AINS).
- Les patients non immuns contre l’hépatite A devraient recevoir deux doses du vaccin contre l’hépatite A à un intervalle de 6–18 mois.
Toutes ces informations doivent être expliquées et discutées avec le patient. Chez les femmes en âge de procréer, on doit préférer les médicaments qui sont considérés comme sûrs pendant la grossesse, car dès qu’un nucléoside ou un nucléotide a été prescrit, il ne doit pas être arrêté chez les personnes qui restent HBeAg-positives. Le patient doit comprendre que l’arrêt du traitement peut précipiter une hépatite sévère qui pourrait, rarement, conduire à une insuffisance hépatique aiguë fulminante, même en l’absence de cirrhose.
Le stade de l’hépatite B chronique peut être déterminé par un profil sérologique et virologique—chaque type est caractérisé par une évolution naturelle, un pronostic et des indications au traitement [1,2,38]
1 Porteur immunotolérant:
- Pas d’indication à un traitement.
- Un suivi longitudinal approprié est crucial.
- Mesure de l’ALT tous les 3–6 mois.
2 Porteur inactif:
- Pas d’indication à un traitement.
- Un suivi longitudinal approprié est crucial.
- Evaluer les taux d’ALT et de VHB ADN tous les 3 mois pendant la première année puis tous les 6 mois par la suite.
- Si le VHB ADN sérique est à < 2000 IU/mL et que le taux de HBsAg est < 1000 IU/mL, la probabilité d’une réactivation de la maladie est basse et une surveillance moins étroite peut se justifier.
3 Hépatite B chronique active (HBC active):
- HBC HBeAg-positive.
- HBC HBeAg-négative.
Le pronostic et la prise en charge de l’hépatite B chronique dépendent de la phase de la maladie et du stade de la fibrose hépatique et par conséquent du risque de développer une cirrhose. La surveillance des porteurs HBC HBsAg-positifs devrait comprendre:
- Poursuite du bilan diagnostique.
- Evaluation de la sévérité de la maladie hépatique.
- Tests de laboratoire pour l’inflammation (ALT), la fonction hépatique (bilirubine, albumine, facteurs de la coagulation) et la charge virale (VHB ADN), si à disposition.
- Ultrasonographie hépatique.
- Mesures non invasives du degré de fibrose (examens sériques, fibroscan).
- Biopsie hépatique utile afin de déterminer le degré de nécro-inflammation et le stade de fibrose.
- Biopsie hépatique permet d’exclure d’autres causes coexistantes de maladie hépatique et afin de clarifier le diagnostic quand les taux d’ALT et de VHB ADN sont discordants.
Les recommandations actuelles pour décider d’un traitement pour l’hépatite B chronique sont exposées dans les Figures 6 et 7. Les algorithmes mentionnent les options de traitement tenant compte des ressources à disposition.
Fig. 6 Traitement de l’hépatite B chronique HBeAg-positive.
La surveillance pour le CHC devrait être pratiquée si indiquée (dépend de l’âge, du sexe, de la sévérité de l’affection hépatique et de l’anamnèse familiale (d’après Lok et McMahon [39].
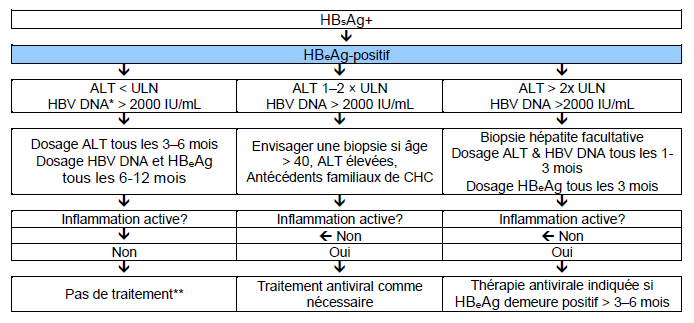
ULN : limite supérieure de la norme
* Des niveaux élevés de VHB ADN sont souvent observés chez les patients asiatiques—la plupart du temps chez des patients avec une transmission périnatale de l’infection. Il n’est pas certain que ces patients doivent bénéficier d’une thérapie antivirale avec des analogues nucléosidiques/nucléotidiques. Le taux de VHB ADN est en corrélation avec le risque de CHC pendant le suivi, mais il n’est pas clair si une suppression virale réduit ce risque.
** Les patients cirrhotiques avec un VHB ADN détectable doivent être traités sans tenir compte du taux d’ALT et du taux de VHB ADN.
Fig. 7 Traitement de l’hépatite B chronique HBeAg-négative.
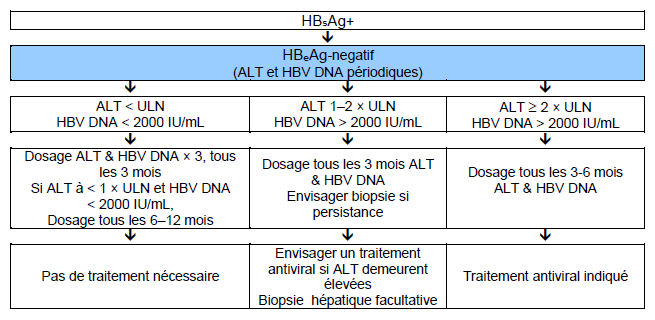
ULN : limite supérieure de la norme
NB: Surveillance pour CHC à effectuer si indiquée (selon l’âge, le sexe, la sévérité de la pathologie hépatique et les antécédents familiaux).
La limite supérieure de la norme (ULN) pour l’ALT est de 20 IU/L chez les femmes et de 30 IU/L chez les hommes.
La surveillance du VHB ADN tous les 3 mois chez les patients avec ALT 1-2 x la limite supérieure de la norme peut s’avérer très couteuse et n’est peut-être pas envisageable si les moyens économiques sont limités—les alternatives sont décrites dans les algorithmes qui suivent.
4.1 Algorithmes pour le traitement de l’hépatite B chronique—une approche tenant compte des ressources à disposition
Une approche « standard » n’est possible que si tous les tests diagnostiques et toutes les options thérapeutiques sont à disposition. De telles ressources ne sont pas forcément suffisamment à disposition partout dans le monde. Avec leurs algorithmes diagnostiques et thérapeutiques, les guidelines de la World Gastroenterology Organisation représentent une approche tenant compte des ressources à disposition.
- Une évaluation du taux de base du VHB ADN, VHD et VIH est conseillée à tous les niveaux de ressources avant d’instaurer un traitement quelconque.
- Une recherche d’hépatocarcinome (CHC) par ultrasonographie devrait être pratiquée dans tous les cas partout où c’est possible. Le dosage de l’alpha fetoprotéine a toujours un rôle à jouer dans le suivi dans les régions à ressources limitées avec une haute endémicité pour VHB, des hépatocarcinomes mal différenciés et un accès limité à une ultrasonographie de qualité.
Algorithme 2 Monitoring de la phase d’immunotolérance (pas de traitement)
Algorithme 3 Surveillance de la phase immunoactive (hors traitement)
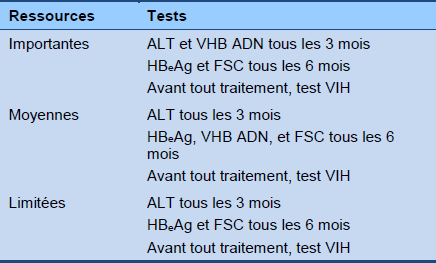
FSC : formule sanguine complète
Algorithme 4 Surveillance de la phase de contrôle immunitaire HBeAg-négative (hors traitement)
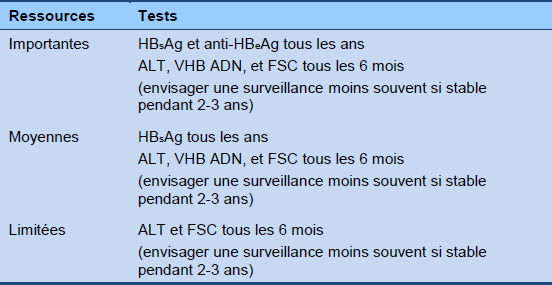
FSC : formule sanguine complète
Algorithme 5 Surveillance de la phase de réactivation, HBeAg-négative (hors traitement)
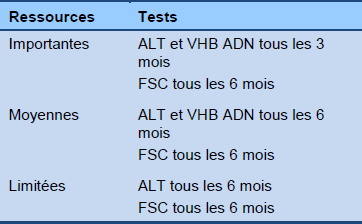
FSC : formule sanguine complète
Algorithme 6 Surveillance de la phase Immunoactive, HBeAg-positive (traitement basé sur IFN)

FSC : formule sanguine complète
* Titre HBsAg à la semaine 12—Semaine 12 : « stopping rule » de l’interféron
Algorithme 7 Surveillance de la phase immunoactive, HBeAg-positive (sous traitement par inhibiteurs nucléosidiques/nucléotidiques)

FSC : formule sanguine complète
* A tous les niveaux de ressources si le patient reçoit du tenofovir la fréquence du dosage de la créatinine dépend de la fonction rénale.
** Dosage du phosphate seulement chez les patients recevant du tenofovir.
Algorithme 8 Phase de réactivation, HBeAg-négative (sous analogues nucléosidiques, NAS)

FSC : formule sanguine complète
* A tous les niveaux de ressources si le patient reçoit du tenofovir la fréquence du dosage de la créatinine dépend de la fonction rénale.
** Dosage du phosphate seulement chez les patients recevant du tenofovir.
4.2 Traitement de l’hépatite B chronique
Médicaments approuvés
Tableau 6 Médicaments approuvés pour le traitement de l’hépatite B chronique
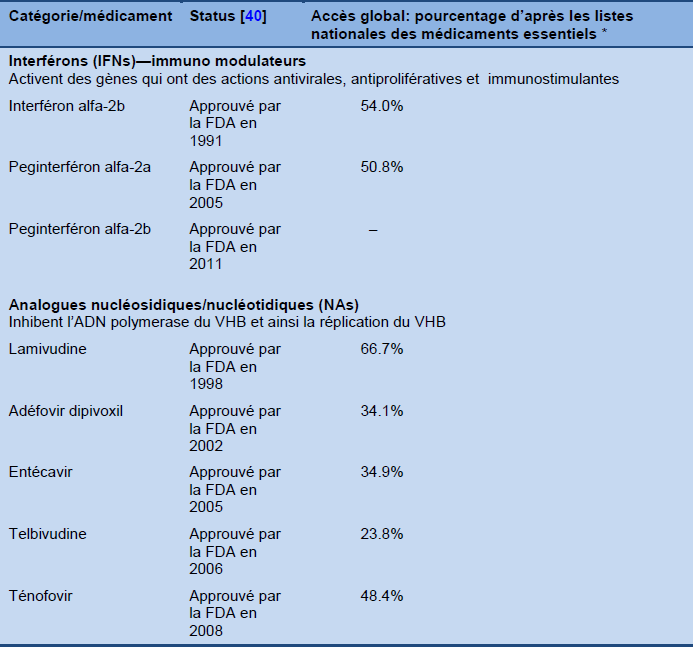
* Pourcentages rapports par les états membres de l’OMS qui ont une liste de médicaments essentiels pour l’hépatite B ou qui subventionnent ces médicaments [41].
Le tableau 7 montre les résultats des grandes études sur le traitement de l’hépatite B chronique HBeAg-négative et HBeAg-positive 6 mois après avoir terminé un traitement de 12 mois (48 semaines) avec l’interféron pegylé alpha (PEG-IFN) et après un traitement de 12 mois (48 ou 52 semaines) avec un analogue nucléosidique/nucléotidique.
Tableau 7 Traitement de l’hépatite B chronique HBeAg-négatives et de l’hépatite B HBeAg- positives
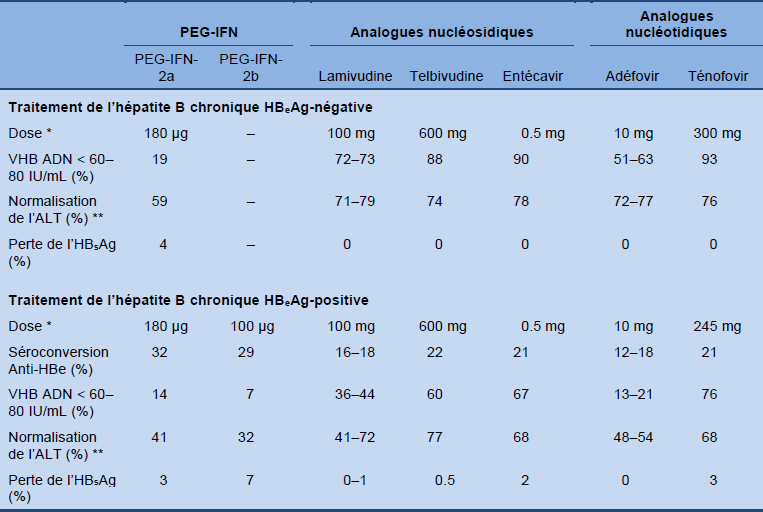
ALT, alanine aminotransferase; VHB, virus hépatite B; HBsAg, antigène de surface de l’hépatite B; PEG-IFN, peginterferon. Adapted from the 2012 EASL guideline [2]; for further references, the source should be consulted.
* Administration du PEG-IFN: par injections percutanées 1 x/semaine; analogues nucléosidiques/nucléotidiques: comprimés oraux 1 x/jour.
** La définition d’une normalisation des ALT varie selon les différentes études (par exemple, avec une diminution à 1.25 fois la limite supérieure de la norme dans l’étude avec entecavir et 1.3 x la limite supérieure de la norme dans l’étude telbivudine).
Pour une discussion détaillée du traitement de référence de l’hépatite B chronique se référer au dernier guideline de 2012 de l’EASL [2] (www.easl.eu).
Résistance aux médicaments
S’il n’y a pas de réponse au traitement ou s’il se produit un échappement viral (défini comme une augmentation du taux de VHB ADN de plus de 1 log10 IU/mL par rapport au niveau du nadir (valeur la plus basse) de VHB ADN en cours de traitement et avec une compliance confirmée, un autre médicament disposant d’un profil de résistance optimal—(c’est-à-dire tenofovir ou entecavir)—devrait être substitué ou ajouté.
Les stratégies suivantes peuvent être utilisées pour prévenir une résistance:
- En traitement de première intention, choisir un médicament antiviral puissant et/ou un avec une faible incidence de résistance (haute barrière génétique) à terme (entecavir/tenofovir).
- Insister auprès du patient sur la nécessité d’une compliance absolue au traitement.
- Le taux de VHB ADN doit être surveillé fréquemment lorsque l’on utilise des médicaments offrant une faible barrière à la résistance (tous les 3–6 mois), et un test de résistance (génotypage) doit être pratiqué en cas d’échappement virologique ou de suppression virale sous optimale, afin de permettre une détection de résistance génotypique avant que les conséquences cliniques ne se développent.
- On n’a pas décrit de résistance à l’interféron, quoique certains individus ne répondent pas au traitement, auquel cas le traitement doit être arrêté. Si à disposition, le taux d’HBsAg peut être utilisé dans le but de guider le traitement par interféron (voir ci-dessous).
Hépatite HBeAg-positive
Recommandations. Un traitement devrait être envisagé pour les patients HBeAg- positifs avec de manière persistante ALT ≥ 2 × au-dessus de la limite de la normale et VHB ADN ≥ 2000 IU/mL.
- Il est impératif de rechercher une éventuelle coïnfection par VIH avant d’instaurer un traitement, car tous les analogues des nucléosides/nucléotides approuvés actuellement sont actifs contre VIH et peuvent rapidement conduire à un VIH résistant au traitement si utilisés en monothérapie.
- Un test VHD devrait être obligatoirement effectué dans les pays avec une haute prévalence d’infection par l’hépatite D (Roumanie, Moldavie, anciennes républiques soviétiques d’Asie centrale, Russie).
- Chez les patients qui ont eu une biopsie hépatique, un traitement doit être instauré chez ceux qui ont une inflammation modérée à sévère ou une fibrose significative (≥ F2).
- Un traitement doit être instauré chez ceux qui ont une cirrhose avec VHB ADN détectable, même chez ceux avec un taux de VHB ADN bas, quel que soit le taux d’ALT.
- N’importe lequel des traitements approuvés peut être choisi, et la décision du choix du traitement devrait inclure les critères tels qu’efficacité, sécurité barrière génétique à la résistance. Entecavir et tenofovir représentent le traitement de choix pour un traitement par analogues nucléosidiques/nucléotidiques afin d’éviter toute résistance. Il est important de s’assurer que les patients disposent d’une source sûre de financement de leur traitement sur le long terme avant d’instaurer un traitement afin d’éviter tout arrêt brutal du traitement, ce qui pourrait être dangereux.
- Les patients doivent être surveillés régulièrement pendant le traitement à des intervalles de 3–6 mois ou plus fréquemment s’ils reçoivent un traitement d’interféron afin de contrôler l’efficacité, la sécurité et les premiers signes de résistance (seulement s’ils reçoivent des analogues nucléosidiques/nucléotidiques).
- Idéalement, on devrait surveiller chez les patients l’ALT, HBeAg, anti-HBe, et VHB ADN, mais cela peut ne pas s’avérer possible dans les pays où ces tests ne sont pas disponibles ou s’ils sont trop coûteux, auquel cas l’ALT devra suffire.
- Echappement viral (viral breakthrough) : augmentation du VHB ADN > 1 log au- dessus du nadir lors de la poursuite du traitement après réponse initiale (analogues nucléosidiques/nucléotidiques). Avant de conclure à une résistance, il faut discuter avec le patient de la compliance. Un accroissement persistant du taux HBV DNA suggère une résistance chez un patient compliant.
- Chez les patients avec résistance, il faudrait envisager un traitement de secours avec des nucléosides/nucléotides qui ne présentent pas un profil de résistance identique (lamivudine, telbivudine, et entecavir ont le même profil, donc il faudrait préférer une substitution par tenofovir—ou si il n’est pas disponible ajouter l’adefovir au traitement).
- Les traitements oraux devraient être continués pendant au moins 12 mois après la séroconversion de HBeAg dans les cas d’hépatites HBeAg-positives, et il pourrait s’avérer préférable de continuer le traitement jusqu’à la perte de HBsAg en raison du risque élevé de réactivation après arrêt du traitement. Une surveillance étroite est recommandée après l’arrêt d’un traitement oral ou le retrait de celui-ci, en raison du risque de flambée après l’arrêt du traitement.
- Les traitements basés sur le peginterféron présentent l’avantage d’une durée de traitement fixe. La séroconversion HBeAg peut se produire jusqu’à 6 mois après l’arrêt de l’interféron. La perte de HBeAg ainsi que la séroconversion paraissent être beaucoup plus durables quand celles-ci sont induites par interféron par comparaison avec les analogues nucléoside/nucléotide. L’interféron se montre le plus efficace chez les patients avec une infection de génotype A et le moins efficace chez ceux avec les génotypes D et C.
- Si à disposition, les titres d’HBsAg peuvent être utilisés pour guider un traitement basé sur l’interféron. Il est indiqué d’arrêter le traitement par interféron chez tous les patients avec HBsAg > 20,000 IU/mL à la semaine 24, indépendamment du génotype VHB [42]. Alternativement, les patients qui ne présentent pas de baisse du titre HBsAg à 12 semaines devraient également cesser tout traitement. Les règles d’arrêt du traitement améliorent coûts-efficacité du traitement par interféron [43].
Hépatite HBeAg-négative
L’hépatite B chronique HBeAg-négative représente une phase tardive dans l’évolution de l’infection par VHB chronique.
- Envisager un traitement chez un patient si:
- HBV DNA ≥ 20,000 IU/mL et ALT sérique > 2 × ULN (limite supérieure de la norme)
- Envisager une biopsie du foie ou toute autre forme d’évaluation du degré de fibrose hépatique chez les patients avec:
- HBV DNA ≥ 20,000 IU/mL et ALT sérique < 2 × ULN (limite supérieure de la norme)
- HBV DNA ≥ 2000 IU/mL et/ou ALT sérique > ULN (limite supérieure de la norme)
- Traiter si la biopsie du foie montre une nécro inflammation modérée/sévère ou une fibrose significative (≥ F2)
- Traiter tout patient cirrhotique avec VHB ADN détectable.
Recommandations pour le traitement:
- Avant de commencer un traitement avec des analogues nucléosidiques/nucléotidiques, faire impérativement un test de VIH, car tous les analogues nucléosides/nucléotides approuvés actuellement ont une activité contre VIH et peuvent rapidement conduire à un VIH résistant au traitement si utilisés en monothérapie.
- Le traitement peut consister en interféron conventionnel, en peginterféron alpha ou en un analogue nucléosidique/nucléotidique. Un traitement basé sur l’interféron ne devrait pas être utilisé en présence d’une décompensation hépatique.
- Chez les patients avec contrindications à l’interféron comme par exemple une cirrhose décompensée ou une maladie auto-immune, des analogues oraux nucléosidiques/nucléotidiques sont recommandés.
- La durée du traitement par interféron ou peginterféron est de un an. Si à la semaine 12 HBsAg n’a pas diminué, en association avec une diminution de VHB ADN de moins de 2 log, le traitement d’interféron devrait être arrêté car une réponse est peu probable [42,44].
- Dans le cas d’un traitement antiviral oral, on préférera les agents avec un faible taux de résistance, tels entecavir ou tenofovir, particulièrement chez les patients cirrhotiques. Cependant là où des contraintes économiques doivent être prises en compte, on peut commencer un traitement avec la lamivudine (ou telbivudine), en ajoutant rapidement du tenofovir ou en changeant pour le tenofovir dès qu’on détecte une résistance aux médicaments ou si VHB ADN reste à ≥ 2000 IU/mL à la semaine 24 de traitement.
- La durée optimale du traitement antiviral pour une hépatite B chronique HBeAg- négative n’est pas connue, mais un traitement à long terme est indiqué— possiblement pour toute la vie ou jusqu’à perte de HBsAg.
- Surveiller à la fois la biochimie et VHB ADN tous les 3–6 mois pour s’assurer de la réponse au traitement et pour détecter rapidement une résistance aux médicaments.
- Un médicament avec un profil de résistance différent devrait être ajouté (adefovir pour résistance à la lamivudine) en cas de détection d’une résistance.
- Si ALT est élevé et le taux de VHB ADN est bas (< 2000 IU/mL), il convient d’exclure d’autres causes possibles de l’inflammation (foie stéatosique, médicaments, coïnfection VHD et VHC). VHD inhibe la réplication de VHB et les patients avec une coïnfection VHD sont donc typiquement HBeAg-négatifs, avec des taux bas voire même indétectables de VHB ADN mais des taux élevés persistants d’ALT, très souvent avec mise en évidence d’une fibrose/cirrhose avancée.
4.3 Coïnfection
VHB–VHD
Le virus de l’hépatite D (VHD) est un virus défectif avec un génome RNA circulaire et une protéine à structure simple, l’antigène de l’hépatite delta. Le virus requiert l’antigène de surface du VHB pour servir d’enveloppe à son antigène delta. Cette fonction du VHB est nécessaire pour assembler le VHD et le propager.
- Jusqu’à 5% de la population mondiale est infectée par le VHB et probablement 5% de ceux qui sont infectés de manière chronique par le VHB ont une infection par le VHD.
- Cependant, quelques régions endémiques dans les pays en voie de développement peuvent avoir des taux beaucoup plus élevés (Corne de l’Afrique, Europe de l’Est, bassin Amazonien). Le virus coïnfecte simultanément avec le VHB ou surinfecte celui qui est déjà infecté de manière chronique par le VHB.
- La coïnfection évolue vers un caractère chronique dans seulement 2% des cas, mais est associée à un risque plus élevé d’infection aiguë fulminante, alors que la surinfection conduit à une maladie progressive et à la cirrhose dans plus de 80% des cas.
- La cirrhose se développe à un âge plus jeune que chez les patients avec mono infection chronique par VHB.
Recommandations:
- La vaccination universelle VHB doit être implémentée pour prévenir l’infection par VHD dans l’ensemble de la communauté et donc diminuer sa prévalence.
- Les patients HBsAg-positifs doivent être évalués pour exclure une infection VHD particulièrement en cas d’hépatite avec réplication virale VHB faible ou absente (c’est-à-dire VHB ADN bas) ou s’ils viennent d’une région à endémicité VHD haute et s’ils ont acquis l’infection VHB par le biais d’une toxicomanie i.v.
- L’infection VHD peut être diagnostiquée par détection du VHD RNA dans le sérum par PCR ou indirectement par détection des anticorps contre l’antigène de l’hépatite D (anti-VHD) des classes IgG et IgM.
- L’hépatite D chronique doit être traitée par interféron (de préférence l’interféron pegylé) pendant au moins 12 mois, mais les résultats du traitement sont suboptimaux. Les patients avec une réplication active VHB malgré une coïnfection VHD peuvent bénéficier d’un traitement par analogues nucléosidiques/nucléotidiques (NAs) en combinaison avec le peginterféron.
VHB–VHC
Une infection avec le VHB et le VHC peut survenir car les deux virus présentent des facteurs de risque similaires et quelques modes de transmission identiques. La coïnfection est plus fréquente dans les régions à haute endémicité pour les deux virus et chez les individus qui ont acquis l’infection par le biais d’une toxicomanie i.v.— puisque, au contraire du VHB, le VHC n’est pas facilement transmis par la voie sexuelle ou verticale. Pour les mêmes raisons, la coïnfection VHB et VHC—voire même les triples-infections VHB, VHC et VIH et potentiellement les quadruples-infections (avec l’adjonction de VHD)—peuvent s’observer dans les populations à haut risque.
- Les interférons (et les interférons pegylé) sont des agents thérapeutiques bien connus à la fois pour le VHB et le VHC et représentent le traitement de choix pour les patients coinfectés (en l’absence de VIH).
- Quand le VHC prédomine (VHC RNA détectable et VHB ADN bas ou indétectable), le traitement du VHC, qui évolue rapidement, devrait être préféré. Un traitement basé sur IFN pour VHC peut être préférable pour contrôller également le VHB, mais il n’existe pas de données solides sur cette approche actuellement. De nouveaux traitements sans interféron pour le VHC sont très efficaces et devraient être prise en compte pour le traitement des patients coinfectés VHB/VHC. L’approche optimale pour cette population est actuellement en cours d’évaluation.
- Quand le VHB prédomine (niveaux VHB ADN élevés), l’hépatite C a souvent été éliminée (c’est-à-dire VHC RNA indétectable). Dans de tels cas, les décisions quant au traitement du VHB devraient être prises indépendamment de la présence d’une infection VHC antérieure.
- Une surveillance régulière d’ALT et du VHC RNA et VHB ADN pendant et après le traitememnt est nécessaire, car la suppression du virus dominant par thérapie antivirale peut résulter en une réactivation du virus précédemment supprimé.
VHB–VIH
On estime à 36 millions de personnes la population infectée par le VIH à travers le monde. Une coïnfection chronique par VHB peut exister en raison du mode commun de transmission des virus—parentéral, vertical, et sexuel.
- La prévalence de l’hépatite B chronique dans la population infectée par le VIH peut être dix fois supérieure ou plus à celle de la population générale.
- L’infection chronique par VHB se produit chez 5–10% des personnes infectées par VIH en Europe occidentale et aux Etats-Unis [45]
- La progression de l’hépatite B chronique vers la cirrhose, vers une maladie hépatique en phase terminale et/ou un carcinome hépatocellulaire est plus rapide chez les patients infectés par le VIH que chez les personnes avec uniquement une hépatite B chronique [46].
L’absence d’études contrôlées et la double activité de quelques agents compliquent le traitement de l’infection par l’hépatite B chronique chez les patients avec une coïnfection par VIH. Les traitements dépendent des statuts cliniques à la fois du VIH et du VHB.
- Beaucoup d’analogues nucléosidiques/nucléotidiques approuvés actifs contre VHB peuvent également supprimer le VIH et il est donc essentiel d’éviter une monothérapie avec un agent oral approuvé contre VHB, car une résistance contre VIH et possiblement contre VHB surviendra rapidement. En présence d’une indication à un traitement, il faut préférer un traitement basé sur le tenofovir, en combinaison avec d’autres agents hautement actifs contre VIH.
- Il faut effectuer un test pour une coinfection par le VIH chez tous les patients avec une hépatite B chronique avant d’initier un traitement antiviral.
Les objectifs principaux du traitement anti VHB sont d’arrêter ou ralentir la progression de la maladie hépatique et de prévenir une cirrhose ou un carcinome hépatocellulaire.
- La suppression prolongée de la réplication du VHB entraîne une amélioration histologique, une baisse significative ou une normalisation des aminotransférases et la prévention de la progression vers une cirrhose et le stade terminal de la maladie hépatique.
- Un contrôle viral soutenu requiert le maintien d’un traitement à long terme.
- L’arrêt du traitement peut en particulier être associé avec une réactivation du VHB et des poussées d’ALT.
- L’inconvénient d’un traitement à long terme est le risque de résistance du VHB. Pour réduire la résistance aux médicaments, la plupart des patients coïnfectés devront bénéficier d’un traitement combiné.
4.4 Grossesse
Les recommandations suivantes sont également basées sur les guidelines 2012 de l’EASL [2]:
- Toute femme enceinte devrait subir un dépistage pour HBsAg.
- Avant d’instaurer un traitement de VHB, le risque pour le fœtus en cas de grossesse et le planning familial devraient être discutés.
- Un traitement d’interféron (pegylé) est contrindiqué pendant la grossesse.
- Le tenofovir a un meilleur profil de résistance et il existe davantage de données sur la sécurité chez les femmes enceintes VHB-positives que pour la telbivudine (les deux appartiennent à la catégorie B quant à la grossesse : pas de risque dans les études sur les animaux, mais risques inconnus chez les humains) [47]. Les données concernant les femmes enceintes VIH-positives suggèrent que l’usage de la lamivudine, de l’emtricitabine et du tenofovir est sans risque [48,49].
- La transmission périnatale de VHB survient le plus souvent à l’accouchement et la prévention se focalise sur l’immunisation passive et active avec des immunoglobulines HBIg ainsi que la vaccination VHB, toutes deux devant être administrées dans les premières 12 heures après la naissance.
- Dans une méta-analyse sur l’utilité de donner des immunoglobulines HBIg aux nouveau-nés afin de prévenir la transmission mère-enfant de VHB, les immunoglobulines HBIg et un vaccin dérivé de plasma contenant HBsAg ont diminué la transmission de 20% à 10% par rapport au vaccin seul (RR 0.49; 95% CI, 0.32 à 0.74); avec HBIg et un vaccin recombinant la transmission a été diminuée de 30.8% à 18.9% (RR 0.61; 95% CI, 0.41 to 0.92) [50].
- Les femmes chez qui il existe une concentration élevée de VHB ADN (VHB ADN sérique > 106–7 IU/mL, et le plus souvent un HBeAg-positif) peuvent cependant courir un risque élevé de transmission mère-enfant malgré une vaccination appropriée et il faut envisager un traitement de lamivudine, de telbivudine ou de tenofovir pendant le dernier trimestre de la grossesse, en plus de la vaccination passive et active HBIg et VHB.
- Dans une méta-analyse d’études randomisées contrôlées, la lamivudine a permis de réduire la transmission VHB de 25.4% à 12% par rapport au placébo lorsqu’elle est administrée en fin de grossesse. Par rapport aux patientes qui ont reçu HBIg, la lamivudine a permis de réduire la transmission de 20.4% à 6.3% [51]. Dans une méta-analyse sur l’utilisation de la telbivudine pendant la grossesse, les résultats combinés étaient comparables à ceux obtenus avec lamivudine, mais l’analyse ne comportait que deux études randomisées contrôlées et trois études non randomisées et non contrôlées [52].
- Tout traitement avec analogues nucléosidiques/nucléotidiques (NA) administré uniquement pour la prévention d’une transmission périnatale peut être arrêté pendant les trois premiers mois après l’accouchement.
- Les femmes infectées par VHB devraient bénéficier d’une surveillance étroite après l’accouchement car des exacerbations peuvent survenir [53].
5. Vaccination contre l’hépatite B
Un programme de vaccination universelle de tous les nouveau-nés est un élément clé pour un contrôle efficace de l’infection par VHB à travers le monde. La vaccination contre l’hépatite B a un excellent rapport coût-efficacité. Elle prévient l’infection avec le VHB et donc réduit l’incidence d’hépatite chronique, de cirrhose et de carcinome hépatocellulaire dans la population vaccinée, ainsi que la transmission en limitant le nombre d’individus susceptibles.
5.1 Vaccination active avec vaccin contre l’hépatite B
L’HBsAg est l’antigène utilisé dans l’élaboration du vaccin contre l’hépatite B. Il est produit à partir de levure avec la technologie d’ADN recombinant. Il est disponible comme agent isolé ou combiné avec d’autres vaccins.
5.2 Vaccination passive avec immunoglobulines contre l’hépatite B
Les immunoglobulines contre l’hépatite B (HBIg) sont préparées à partir de plasma d’individus qui ont une concentration élevée d’anti-HBs. La dose standard d’HBIg est de 0.06 mL/kg chez l’adulte ou de 200 IU chez l’enfant. Les doses standard fournissent une protection temporaire (c’est-à-dire pour environ 3–6 mois) contre l’infection VHB. L’HBIg est administré par injection intramusculaire, de préférence dans le deltoïde ou le muscle fessier. Si administré avec le vaccin contre l’hépatite B, alors les immunoglobulines doivent être administrées dans un endroit différent.
5.3 Prophylaxie préexposition
Une stratégie globale pour éliminer la transmission du VHB doit commencer par un programme de vaccination de pré exposition. Ceci doit inclure:
- Vaccination universelle de tous les enfants à la naissance ; obligatoire pour les enfants nés de mères testées positives pour l’antigène de surface de l’hépatite B pendant leur grossesse (HBsAg).
- Immunoprophylaxie après exposition pour les enfants nés de mère dont le statut HBsAg n’est pas connu.
- Rattrapage de vaccination pour tous les enfants ou adolescents qui n’ont pas été précédemment vaccinés.
- Vaccination de tous les adultes non vaccinés exposés au risque d’infection VHB (cependant, typiquement les individus “à haut risque” ne fréquentent pas les centres de santé ou n’informent pas les centres de santé, d’où ce besoin de vaccination universelle chez l’enfant).
- Vaccination de ceux qui sont à risque pour une infection plus sévère—par exemple, chez les patients avec une maladie hépatique chronique.
5.4 Calendrier des vaccinations
La combinaison de la prévalence, de la voie de transmission et des facteurs viraux a des répercussions sur la stratégie de vaccination—vaccination des groupes à risque, vaccination, des enfants ou vaccination des adolescents.
Le vaccin est administré par injection intramusculaire dans le deltoïde (et pas dans le grand fessier) chez les adultes ou dans la face antérolatérale de la cuisse chez les nouveaux nés.
- Des études suggèrent que la vaccination universelle à la naissance à un bon rapport coût efficacité dans les pays avec une prévalence haute ou modérée.
- Le taux d’incidence est très bas en Europe et en Amérique du Nord et ces pays ont instauré soit une vaccination de routine chez les petits enfants ou une vaccination chez les nouveaux nés dont la mère a été testée positive pour HBsAg.
- La vaccination de routine chez les adolescents à l’âge de 10 ans et une vaccination de rattrapage chez les adultes à risque (il peut s’avérer problématique d’identifier et/ou de pouvoir accéder à ceux qui sont “à risque”) a été conseillée dans certains pays mais ceci ne peut qu’avoir peu d’effet sur le taux d’infection chronique.
Recommandations pour les vaccinations
- Première vaccination consistant en trois doses intramusculaires ou plus, de vaccin contre l’hépatite B, administrées à 0, 1 et 6 mois, produit une réponse anticorps positive après la première dose chez 30–55% des adultes âgés de ≤ 40 ans, chez 75% après la seconde dose et chez > 90% après la troisième dose. Ces taux de réponse baissent quand le vaccin est administré à des individus plus âgés (par exemple, < 90% de réponse chez les personnes de > 40 ans, 75% chez celles de >60 ans).
- D’autres calendriers de vaccination innovants (par exemple, 0, 1 et 4 mois ou 0, 2 et 4 mois ou 0, 1 et 2 mois) peuvent entraîner des taux de protection dose- spécifiques identiques à ceux obtenus avec le schéma 0, 1, 6-mois, et se révéler plus pratiques chez le nouveau-né.
- Les programmes accélérés de vaccination pour la prophylaxie post exposition chez les adultes permettent souvent une meilleure compliance avec le schéma de vaccination.
- Les nouveaux-nés de mère HBsAg-positive devraient recevoir la première dose du vaccin dans les 12 heures suivant la naissance.
- Des facteurs dépendants de l’hôte (par exemple, le tabagisme, l’obésité, la cirrhose, des facteurs génétiques, une suppression immunitaire, une insuffisance rénale, etc.) sont connus pour résulter en une moins bonne réponse au vaccin.
- Les individus qui ne montrent pas de réponse anti-HBs (≥ 10 mIU/mL) au programme de vaccination primaire devraient recevoir une vaccination de rappel de trois doses (à 0, 1 et 2 mois). Celle-ci entraîne des taux d’anticorps protecteurs chez 44–100% des individus. Il faut envisager une nouvelle vaccination chez les individus qui ne développent pas des taux protecteurs d’anti-HBs après revaccination (0, 1 et 2 mois, avec un rappel à 6 mois) en utilisant une double dose du vaccin standard.
- Chez les personnes de ≥ 18 ans qui ne vivent pas en région endémique d’hépatite A, un vaccin combiné hépatite A–hépatite B (Twinrix) existe.
5.5 Prophylaxie post exposition
Une prophylaxie post exposition doit être envisagée chez les individus qui ont eu une exposition récente (parentérale ou sexuelle) à du sang ou d’autres fluides corporels, si cela peut être fait à temps.
- L’évaluation du statut HBsAg de la source infectieuse et le statut anti-HBs de la personne exposée doivent être effectués avant l’administration du vaccin.
- Dans les pays avec un taux élevé d’endémicité VHB, l’HBsAg chez la personne exposée devrait également être vérifié.
- Les individus sans vaccination antérieure doivent recevoir à la fois les immmunoglobulines HBIg et le vaccin contre l’hépatite B rapidement après exposition (de préférence dans les 24 heures). Le vaccin contre l’hépatite B et l’injection d’immunoglobulines HBIg doivent être faits à des sites d’injection différents s’ils sont faits en même temps.
- Le schéma de vaccination contre l’hépatite B sera de 0, 1 et 6 mois ou 0, 1 et 2 mois.
Les personnes en cours de vaccination (mais qui n’ont pas reçu toutes les injections) doivent recevoir une dose appropriée d’immunoglobulines HBIg et on leur conseillera de terminer la série d’injections contre l’hépatite B.
Les personnes qui répondent au vaccin peuvent conserver une protection anti-HBs pendant des périodes de temps variables. Les individus qui répondent à la vaccination contre l’hépatite B sont protégés pendant au moins 20 ans (peut-être pour toute leur vie), même si chez eux l’anti-HBs n’est pas détectable lors d’une exposition récente. Une infection VHB aiguë asymptomatique peut survenir chez les répondeurs au vaccin à la suite d’une baisse du taux d’anti-HBs, mais cette infection est habituellement limitée. Une infection VHB occulte a été décrite chez certains patients vaccinés, mais la signification de celle-ci est peu claire [54].
Ainsi, les personnes immunocompétentes connues pour avoir dépondu à la vaccination contre l’hépatite B avec des concentrations d’anti-HBs de ≥ 10 mIU/mL n’ont pas besoin d’autres immunisations passives ou actives après exposition au VHB. En outre, elles n’ont pas besoin de subir ultérieurement des tests périodiques pour contrôler les concentrations anti-HBs. Cependant si la concentration antérieure d’anti- HBs n’est pas connue (pas évaluée de routine) ou si celle-ci est < 10 mIU/mL, les immunoglobulines HBIg et le vaccin contre l’hépatite B devrait être administrés. Si l’individu exposé est connu en tant que non répondeur, deux doses d’immunoglobulines HBIg devraient être administrées, à un mois d’intervalle.
Des doses de rappel ne sont pas recommandées systématiquement chez les individus immunocompétents, s’ils ont reçu la vaccination étant enfants, adolescents ou adultes. De la même façon, les tests sérologiques pour vérifier les concentrations en anticorps à quelque âge que ce soit ne sont pas recommandés, excepté peut-être chez les individus à haut risque d’infection car vivant dans l’entourage de personnes infectées ou chez les personnels de santé—par exemple. Une dose de rappel doit être administrée chez eux quand le taux d’anti-HBs est de < 10 mIU/mL. Il est prudent de recommander des doses de rappel chez les individus avec un risque évident et durable d’infection VHB (par exemple, quand le partenaire sexuel est HBsAg-positif ou chez les personnels de santé).
5.6 Grossesse et vaccination contre l’hépatite B
Il n’y a pas de risques tératogènes ou autres pour le fœtus si le vaccin contre l’hépatite B est administré aux femmes enceintes. Il n’y a pas de contrindication pour la vaccination contre l’hépatite B ou l’administration d’HBIg chez les femmes enceintes ou qui allaitent.
6. Annexe
6.1 Abbréviations
|
AASLD
|
American Association for the Study of Liver Diseases
|
|
AFP
|
Alpha foetoprotéine
|
|
AINS
|
Anti-inflammatoires non stéroïdiens
|
|
ALT
|
Alanine aminotransférase
|
|
AST
|
Aspartate aminotransférase
|
|
APASL
|
Asian–Pacific Association for the Study of the Liver
|
|
BCP
|
Basal core promoter
|
|
CHC
|
Carcinome hépatocellulaire
|
|
CI
|
Intervalle de confiance
|
|
EASL
|
European Association for the Study of the Liver
|
|
FDA
|
Food and Drug Administration (United States)
|
|
FSC
|
Formule sanguine complète
|
|
HBc
|
Hépatite B antigèe core
|
|
HBeAg
|
Hépatite B antigène e
|
|
HBC
|
Hépatite B chronique
|
|
HBIg
|
Hépatite B immunoglobulines
|
|
HBsAg
|
Hépatite B antigène de surface
|
|
HCC
|
Carcinome hépatocellulaire
|
|
HIV
|
Virus d’immunodéficience humaine
|
|
IFN
|
Interferon
|
|
IgG
|
Immunoglobulines G
|
|
IgM
|
Immunoglobulines M
|
|
INR
|
International normalized ratio
|
|
IU/mL
|
International units per millilitre (the WHO standard for HBV DNA concentrations)
|
|
LLD
|
Limite inférieure de détection
|
|
NA
|
Nucleoside analogue
|
|
NAFLD
|
Stéatose hépatique non alcoolique
|
|
NASH
|
Stéatohépatite non alcoolique
|
|
NICE
|
National Institute for Care and Health Excellence
|
|
PCR
|
Réaction en chaîne par polymérase
|
|
PEG-IFN
|
Peginterferon
|
|
RCT
|
Etude contrôlée randomisée
|
|
RR
|
Risque relatif
|
|
SCS
|
Corticostéroïdes par voie systémique
|
|
ULN
|
Limite supérieure de la norme
|
|
VHA
|
Virus hépatite A
|
|
VHB
|
Virus hépatite B
|
|
VHB ADN
|
Taux d’ADN du virus de l’hépatite B
|
|
VHC
|
Virus hépatite C
|
|
VHD
|
Virus hépatite D
|
|
VIH
|
Virus d’immunodéficience humaine
|
|
WGO
|
World Gastroenterology Organisation
|
|
WHO
|
World Health Organization
|
For a definition of frequently used terms, reference may be made to page 533 of the 2012 APASL guideline [4].
6.2 Références
- Lok ASF, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology 2009;50:661–2.
- European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection. J Hepatol 2012;57:167–85.
- National Institute for Health and Care Excellence (NICE). Hepatitis B (chronic): diagnosis and management of chronic hepatitis B in children, young people and adults [Internet]. London: NICE; 2013. Available from: http://www.nice.org.uk/guidance/cg165/resources/guidance-hepatitis-b-chronic-pdf
- Liaw YF, Kao JH, Piratvisuth T, Chan HLY, Chien RN, Liu CJ, et al. Asian–Pacific consensus statement on the management of chronic hepatitis B: a 2012 update. Hepatol Int 2012;6:531–61.
- World Health Organization. Global Alert and Response (GAR): Hepatitis [Internet]. Geneva: World Health Organization [cited 2015 Mar 31]. Available from: http://www.who.int/csr/disease/hepatitis/en/.
- Ott JJ, Stevens GA, Groeger J, Wiersma ST. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity. Vaccine 2012;30:2212–9.
- Hepatitis B Foundation. Hepatitis B Foundation [Internet]. Doylestown, PA. Available from: http://www.hepb.org/.
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;380:2095–128.
- Hollinger F, Liang T. Hepatitis B virus. In: Knipe DM, Howley PM, editors. Fields’ virology. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2001. p. 2971–3036.
- Sunbul M. Hepatitis B virus genotypes: global distribution and clinical importance. World J Gastroenterol 2014;20:5427.
- Shi W, Zhang Z, Ling C, Zheng W, Zhu C, Carr MJ, et al. Hepatitis B virus subgenotyping: history, effects of recombination, misclassifications, and corrections. Infect Genet Evol 2013;16:355–61.
- Chulanov V, Neverov A, Karandashova I, Dolgin V, Mikhailovskaya G, Lebedeva E, et al. Molecular epidemiology of HBV in Russia [abstract C.222]. Abstracts of the 14th International Symposium on Viral Hepatitis and Liver Disease. China, Shanghai, 2012.
- Deterding K, Constantinescu I, Nedelcu FD, Gervain J, Nemecek V, Srtunecky O, et al. Prevalence of HBV genotypes in Central and Eastern Europe. J Med Virol 2008;80:1707–11.
- Devesa M, Loureiro CL, Rivas Y, Monsalve F, Cardona N, Duarte MC, et al. Subgenotype diversity of hepatitis B virus American genotype F in Amerindians from Venezuela and the general population of Colombia. J Med Virol 2008;80:20–6.
- Blitz L, Pujol FH, Swenson PD, Porto L, Atencio R, Araujo M, et al. Antigenic diversity of hepatitis B virus strains of genotype F in Amerindians and other population groups from Venezuela. J Clin Microbiol 1998;36:648–51.
- Cardona NE, Loureiro CL, Garzaro DJ, Duarte MC, García DM, Pacheco MC, et al. Unusual presentation of hepatitis B serological markers in an Amerindian community of Venezuela with a majority of occult cases. Virol J 2011;8:527.
- Pujol FH, Navas MC, Hainaut P, Chemin I. Worldwide genetic diversity of HBV genotypes and risk of hepatocellular carcinoma. Cancer Lett 2009;286:80–8.
- Kramvis A, Kew M, François G. Hepatitis B virus genotypes. Vaccine 2005;23:2409–23.
- Kimbi GC, Kramvis A, Kew MC. Distinctive sequence characteristics of subgenotype A1 isolates of hepatitis B virus from South Africa. J Gen Virol 2004;85:1211–20.
- Kramvis A, Kew MC. Epidemiology of hepatitis B virus in Africa, its genotypes and clinical associations of genotypes. Hepatol Res 2007;37(s1):S9–S19.
- Yousif M, Mudawi H, Bakhiet S, Glebe D, Kramvis A. Molecular characterization of hepatitis B virus in liver disease patients and asymptomatic carriers of the virus in Sudan. BMC Infect Dis 2013;13:328.
- Devesa M, Pujol FH. Hepatitis B virus genetic diversity in Latin America. Virus Res 2007;127:177–84.
- Ahmed CS, Wang Z, Bin Z, Chen J, Kamal M, Hou J. Hepatitis B virus genotypes, subgenotypes, precore, and basal core promoter mutations in the two largest provinces of Pakistan. J Gastroenterol Hepatol 2009;24:569–73.
- De Franchis R, Hadengue A, Lau G, Lavanchy D, Lok A, McIntyre N, et al. EASL International Consensus Conference on Hepatitis B. 13–14 September, 2002 Geneva, Switzerland. Consensus statement (long version). J Hepatol 2003;39 Suppl 1:S3–25.
- 2McMahon BJ. Epidemiology and natural history of hepatitis B. Semin Liver Dis 2005;25 Suppl 1:3–8.
- World Health Organization. Hepatitis B. WHO fact sheet no. 204 [Internet]. Geneva: World Health Organization; 2015. Available from: http://www.who.int/mediacentre/factsheets/fs204/en/.
- Santantonio T, Fasano M. Current concepts on management of chronic hepatitis B. In: Serviddio G, editor. Practical management of chronic viral hepatitis [Internet]. InTech; 2013 [cited 2015 Mar 31]. Available from: http://www.intechopen.com/books/practical-management-of-chronic-viral-hepatitis/current-concepts-on-management-of-chronic-hepatitis-b.
- Hui CK, Leung N, Yuen ST, Zhang HY, Leung KW, Lu L, et al. Natural history and disease progression in Chinese chronic hepatitis B patients in immune-tolerant phase. Hepatology 2007;46:395–401.
- Brunetto MR, Oliveri F, Colombatto P, Moriconi F, Ciccorossi P, Coco B, et al. Hepatitis B surface antigen serum levels help to distinguish active from inactive hepatitis B virus genotype D carriers. Gastroenterology 2010;139:483–90.
- Raimondo G, Allain JP, Brunetto MR, Buendia MA, Chen DS, Colombo M, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol 2008;49:652–7.
- Zerbini A, Pilli M, Boni C, Fisicaro P, Penna A, Di Vincenzo P, et al. The characteristics of the cell-mediated immune response identify different profiles of occult hepatitis B virus infection. Gastroenterology 2008;134:1470–81.
- Peng CY, Chien RN, Liaw YF. Hepatitis B virus-related decompensated liver cirrhosis: benefits of antiviral therapy. J Hepatol 2012;57:442–50.
- Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors. J Hepatol 2008;48:335–52.
- Lee IC, Lin CH, Huang YH, Huo TI, Su CW, Hou MC, et al. IL28B polymorphism correlates with active hepatitis in patients with HBeAg-negative chronic hepatitis B. PloS One 2013;8:e58071.
- Kim TW, Kim MN, Kwon JW, Kim KM, Kim SH, Kim W, et al. Risk of hepatitis B virus reactivation in patients with asthma or chronic obstructive pulmonary disease treated with corticosteroids. Respirology 2010;15:1092–7.
- Huang YH, Hsiao LT, Hong YC, Chiou TJ, Yu YB, Gau JP, et al. Randomized controlled trial of entecavir prophylaxis for rituximab-associated hepatitis B virus reactivation in patients with lymphoma and resolved hepatitis B. J Clin Oncol 2013;31:2765–72.
- Singal AG, Conjeevaram HS, Volk ML, Fu S, Fontana RJ, Askari F, et al. Effectiveness of hepatocellular carcinoma surveillance in patients with cirrhosis. Cancer Epidemiol Biomark Prev 2012;21:793–9.
- Liaw YF, Leung N, Kao JH, Piratvisuth T, Gane E, Han KH, et al. Asian–Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int 2008;2:263–83.
- Lok ASF, McMahon BJ. Chronic hepatitis B. Hepatology 2007;45:507–39.
- Hepatitis B Foundation. HBF drug watch: compounds in development for chronic hepatitis B. Updated December 15, 2014 [Internet]. Available from: http://www.hepb.org/professionals/hbf_drug_watch.htm
- World Health Organization. Global policy report on the prevention and control of viral hepatitis in WHO member states [Internet]. Geneva: World Health Organization; 2013. Available from: http://www.who.int/hiv/pub/hepatitis/global_report/en/
- Sonneveld MJ, Hansen BE, Piratvisuth T, Jia JD, Zeuzem S, Gane E, et al. Response-guided peginterferon therapy in hepatitis B e antigen-positive chronic hepatitis B using serum hepatitis B surface antigen levels. Hepatology 2013;58:872–80.
- Lo AOS, Wong VWS, Wong GLH, Chan HLY, Dan YY. Cost effectiveness of response-guided therapy with peginterferon in the treatment of chronic hepatitis B. Clin Gastroenterol Hepatol 2015;13:377–85.
- Sonneveld MJ, Rijckborst V, Boucher CAB, Hansen BE, Janssen HLA. Prediction of sustained response to peginterferon alfa-2b for hepatitis B e antigen-positive chronic hepatitis B using on-treatment hepatitis B surface antigen decline. Hepatology 2010;52:1251–7.
- Spradling PR, Richardson JT, Buchacz K, Moorman AC, Brooks JT, HIV Outpatient Study (HOPS) Investigators. Prevalence of chronic hepatitis B virus infection among patients in the HIV Outpatient Study, 1996–2007. J Viral Hepat 2010;17:879–86.
- Thio CL, Seaberg EC, Skolasky R, Phair J, Visscher B, Muñoz A, et al. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet 2002;360:1921–6.
- Borgia G, Carleo MA, Gaeta GB, Gentile I. Hepatitis B in pregnancy. World J Gastroenterol 2012;18:4677–83.
- Terrault NA, Jacobson IM. Treating chronic hepatitis B infection in patients who are pregnant or are undergoing immunosuppressive chemotherapy. Semin Liver Dis 2007;27 Suppl 1:18–24.
- Chotiyaputta W, Lok AS. Role of antiviral therapy in the prevention of perinatal transmission of hepatitis B virus infection. J Viral Hepat 2009;16:91–3.
- Lee C, Gong Y, Brok J, Boxall EH, Gluud C. Effect of hepatitis B immunisation in newborn infants of mothers positive for hepatitis B surface antigen: systematic review and meta-analysis. BMJ 2006;332:328–36.
- Han L, Zhang HW, Xie JX, Zhang Q, Wang HY, Cao GW. A meta-analysis of lamivudine for interruption of mother-to-child transmission of hepatitis B virus. World J Gastroenterol 2011;17:4321–33.
- Deng M, Zhou X, Gao S, Yang SG, Wang B, Chen HZ, et al. The effects of telbivudine in late pregnancy to prevent intrauterine transmission of the hepatitis B virus: a systematic review and meta-analysis. Virol J 2012;9:185.
- Ter Borg MJ, Leemans WF, de Man RA, Janssen HLA. Exacerbation of chronic hepatitis B infection after delivery. J Viral Hepat 2008;15:37–41.
- Lai MW, Lin TY, Tsao KC, Huang CG, Hsiao MJ, Liang KH, et al. Increased seroprevalence of HBV DNA with mutations in the s gene among individuals greater than 18 years old after complete vaccination. Gastroenterology 2012;143:400–7.


























