Директор/Декан, Медицинский Колледж Равалпинди; Руководитель Объединенного Госпиталя Равалпинди; Председатель и Профессор Медицины; Медицинский Колледж Равалпинди, Пакистан; Руководитель Отдела Гастроэнтерологии и Гепатологии; Клинический Координатор Программы Профилактики и Контроля Гепатита; Госпиталь Святого Семейства, Равалпинди, Пакистан; Экс-президент, Американский Колледж Гастроэнтерологии (ACG); Председатель AsiaHep Pakistan; бывший Президент Пакистанского Общества Гастроэнтерологии; бывший Президент Пакистанского Общества Гепатологии; Президент Равалианского Исследовательского Форума
1. Глобальная перспектива ВГО—практические рекомендации, ориентированные на ресурсы, и “каскады”
Данные практические рекомендации будут интересны всем профессиональным медикам первичного и вторичного звеньев, занимающихся ведением пациентов с инфекцией вирусом гепатита C в разных странах по всему миру. Рекомендации охватывают все стадии ведения заболевания: скрининг, обследование, диагноз, направление на консультации, лечение, уход и динамическое наблюдение детей и взрослых, страдающих, или подверженных, инфекции вирусом гепатита С (HCV).
Многочисленные практические рекомендации, ежегодно выпускаемые престижными медицинскими организациями, концентрируются на практиках “золотого стандарта” и направлены на врачей, обладающими обширными ресурсами. Основные международные практические рекомендации по ведению гепатита С представлены в Таблице 1.
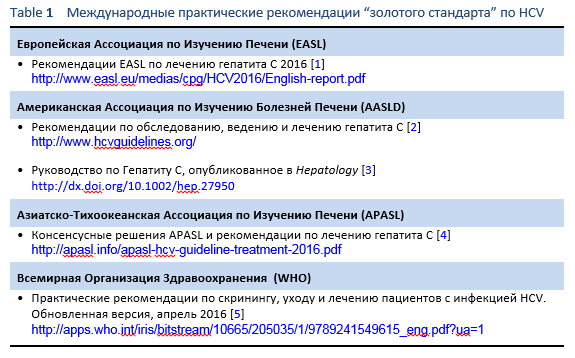
Некоторые из этих практических рекомендаций могут быть недоступны или неприменимы для многих врачей в развивающихся странах. Любые западные практические рекомендации, не признающие этого факта, могут препятствовать распространению знаний и доказательной базы среди всей мировой аудитории. Для того, чтобы сделать практические рекомендации более применимыми к различным ресурсным возможностям, ВГО разработала концепцию “каскадов”, предоставляя набор связанных диагностических и лечебных вариантов, объединенных в иерархическом порядке в терминах условий и доступных ресурсов [6].
Практические рекомендации ВГО включают в себя альтернативные решения для клиницистов, обладающих ограниченным финансированием. Эти альтернативы обычно предлагаются на основании стоимости лечения, но также могут учитывать местную доступность препаратов, технологии и инфраструктуру. Каскады могут варьировать от простого списка вариантов до более сложных параллельных диагностических и лечебных методов, постепенно они трансформировались от «слепых» к ресурсам до «ресурсо-чувствительных». Неизбежно каскады в значительной степени основываются на эмпирических доказательствах, а не на «золотых стандартах». Финансирование исследований обычно направлено на попытки совершенствовать «лучшую практику» в большей степени, чем на поиски возможностей применения в развивающихся странах. Тем не менее, учитывая широкое вовлечение опытных клиницистов из развивающихся стран, обычно бывает найден консенсус. Активное использование каскадов в практических рекомендациях также стимулирует поиск лучших вариантов в условиях ограниченных ресурсов.
2. Эпидемиология—глобальное сравнение и факторы ресурсов
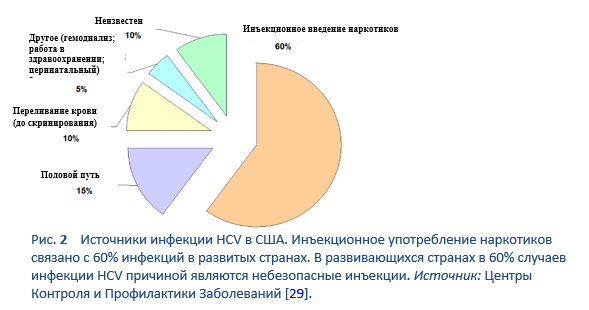
Когда эпидемиология инфекции HCV обсуждается в глобальном масштабе, очень важно рассматривать различия «север - запад» и «восток - юг». Они включают низкую распространенность инфекции HCV на “севере” и “западе” [7,8] и от умеренной до высокой распространенности [9–11] на “юге” и “востоке”, которая приводит к значительной профессиональной и финансовой нагрузке на уже ограниченные в ресурсах страны. Главным фактором риска HCV на “востоке” являются небезопасные терапевтические инъекции за счет недостаточного практического применения универсальных рекомендаций по контролю за инфекциями, включающих реутилизацию шприцев, игл и другого медицинского оборудования от пациента пациенту без адекватной стерилизационной техники. Это влияет на лечебные стратегии в развивающихся странах и подчеркивает необходимость развития профилактического направления, повышения уровня публичной медицинской грамотности, санитарно-просветительной работы и внимания со стороны медицинского персонала и работников специализированных правительственных ведомств. С другой стороны, в развитых западных странах HCV в основном передается среди наркоманов через общие инъекционные средства. Распространенность anti-HCV среди инъекционных наркоманов может варьировать от 35% до 61% [12,13], использование внутривенных наркотиков ответственно за 60–80% новых случаев инфекции HCV в США.
Другим фактором служит доступность, стоимость и качество диагностических тестов на инфекцию HCV, которые делают скрининг очень сложным даже в популяциях высокого риска, что приводит к неточностям в сборе данных и отчетах. Подобным же образом, стандартизация и методология тестирования с помощью полимеразной цепной реакции (ПЦР) еще сильнее усложняет ответ на вопрос «кого лечить?».
Естественная история HCV также различается на “востоке” и “западе”, что связано со специфическими факторами риска, такими как употребление алкоголя, наркомания, внутривенное введение препаратов, ко-инфекции и суперинфекции. Другие сопутствующие состояния (такие как ожирение и метаболический синдром), недостаточность питательных веществ также влияют на гистологическую картину в печени и прогрессирование заболевания.

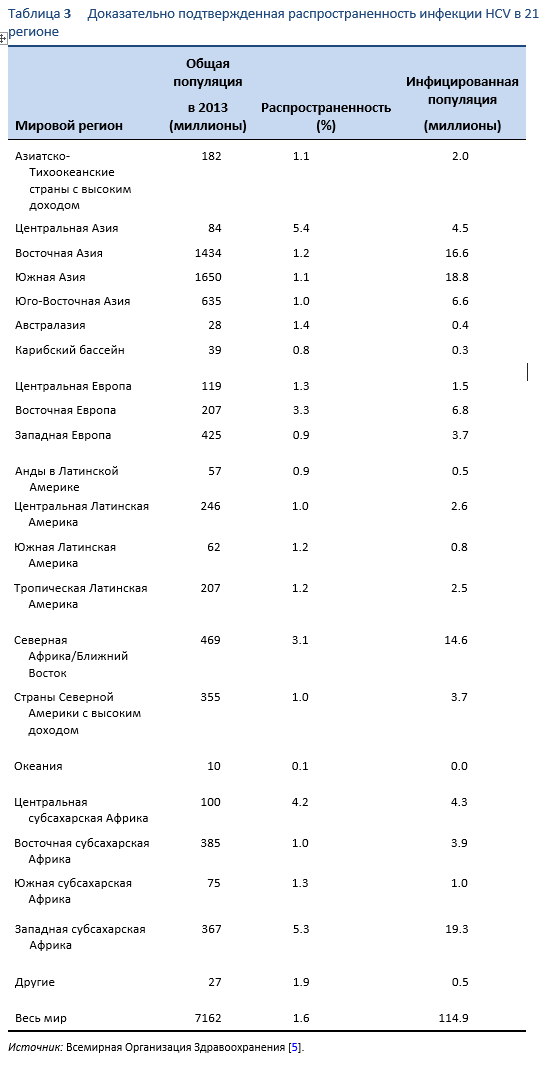
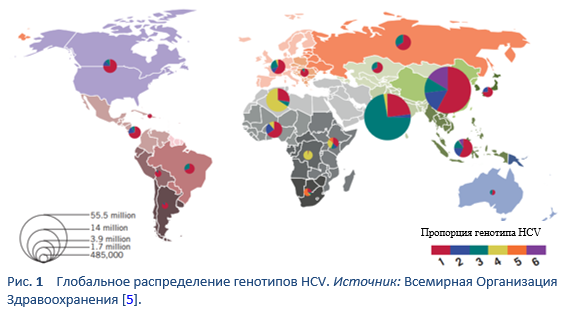
Гепатит C – это контагиозное заболевание печени, вызываемое вирусом гепатита С (HCV). Вирус эндемичен по всему миру, и недавний анализ, включающий 1217 исследований из 117 стран и 90% мировой популяции, показал, что приблизительно 180 миллионов людей во всем мире HCV-серопозитивны. Было рассчитано, что наиболее распространен во всем мире HCV генотип 1, охватывая 83.4 миллиона случаев (46.2% из всех случаев HCV), приблизительно треть из которых приходится на Восточную Азию. Генотип 3 – следующий по распространенности в мире (54.3 миллиона, 30.1%); генотипы 2, 4 и 6 ответственны в сумме за 22.8% всех случаев; на долю генотипа 5 приходится остающиеся < 1%.
В широкое распространение до наступления эры скрининга на HCV вносили свой вклад внутривенное использование наркотиков, татуировки и такие медицинские процедуры как гемодиализ и переливание крови. Это стало значительной признанной проблемой здравоохранения во всем мире [14]. Распределение инфекции HCV показывает сильное географическое разнообразие, с наиболее значительной частотой распространения в странах Восточной Азии, Латинской Америке, Средиземноморье и в некоторых районах Африки и Восточной Европы.
Гепатит C является глобальной проблемой. Данные по всемирной распространенности в основном основываются на результатах исследований по серологической диагностике HCV [15]. Тем не менее, данные ВОЗ основываются на опубликованных результатах исследований, а информация поступает из различных стран и регионов. Хотя HCV эпидемичен во всем мире, существует значительная разница в его распределении по различным регионам мира [5].
Наиболее высокие показатели распространенности отмечаются в развивающихся странах Африки и Азии, в то время как в развитых индустриальных странах Европы и Северной Америки распространенность HCV низкая. Страны с высоким уровнем распространения инфекции – это Китай, Пакистан, Нигерия и Египет. К сожалению, данные по африканским странам не слишком хороши, за исключением Египта, Марокко и Южной Африки. Главным путем передачи в этих странах являются небезопасные инъекции с использованием зараженного медицинского инвентаря — как в случае с Египтом, где эпидемия HCV в основном обусловлена длительным применением парентерального антишистосомозного лечения (антимонил-тартрат калия, рвотный камень) с использованием многоразовых стеклянных шприцев в течение более 30 лет.
Хронический гепатит С является самой частой причиной цирроза и самым частым показанием для трансплантации печени в Европе, Северной и Южной Америках, Австралии, Японии. Риск развития цирроза у пациента варьирует от 5% до 25% за период в 25–30 лет [16].

В первую очередь HCV передается через повреждения кожных покровов: инъекционное введение веществ, повреждения иглой и неадекватный контроль за инфекцией в медицинских учреждениях; во всем мире все еще встречаются внутрибольничные инфекции. Реже передача HCV происходит среди ВИЧ-положительных гомосексуальных мужчин в результате сексуального контакта с HCV-инфицированным партнером [19], и у новорожденных, рожденных HCV-инфицированными матерями. Чрезмерное назначение инъекций и небезопасные инъекционные практики приводят примерно к 2–5 миллионам случаев заболевания инфекцией HCV во всем мире [16,20–27].
Риск передачи HCV при моногамных гетеросексуальных отношениях представляется очень низким (1.2% или ниже) и максимальная частота передачи HCV половым путем составляет 0.07% в год или приблизительно одна на 190,000 сексуальных контактов [28].
3. Естественная история и профилактика
3.1 Естественная история
По тяжести инфекция может варьировать от умеренного выраженного заболевания, продолжающегося всего несколько недель (острая инфекция) до тяжелой или пожизненной болезни (хроническая инфекция). Приблизительно у 80% пациентов, инфицированных HCV, заболевание принимает хроническую форму, у большинства этих больных будут определяться признаки хронического гепатита. Инкубационный период составляет 14–180 дней (в среднем - 45 дней). В настоящее время вакцины против гепатита С нет.
Прогностические факторы хронизации инфекции HCV [30]:
- Мужской пол
- Возраст > 25 лет на момент заражения
- Бессимптомная острая инфекции
- Афро-американская этничность
- Инфекция ВИЧ
- Иммуносупрессия
Инфекция вирусом гепатита C обычно медленно прогрессирует в течение многих лет, у 5%-15% пациентов с хроническим гепатитом за период в 20 лет развивается цирроз печени [31]. Тем не менее, результаты некоторых исследований позволяют предполагать более благоприятное течение заболевания [32] и показывают высокую непредсказуемость процесса развития фиброза [33]. Приблизительно 80% пациентов с HCV становятся хронически инфицированными, хотя некоторые исследования показывают более высокие уровни спонтанного клиренса, особенно у молодых людей [34,35].
Примерно у 4–9% пациентов с циррозом печени ежегодно развивается прогрессирующая печеночная недостаточность (декомпенсация), с 1–4%-ным ежегодным риском развития гепатоцеллюлярной карциномы (ГЦК) [36]. Уровень смертности и-за прогрессирующей печеной недостаточности или ГЦК будет продолжать увеличиваться в течение следующих нескольких десятилетий. В некоторых странах инфекция HCV – главная причина смерти от заболеваний печени и ведущая причина проведения трансплантации печени [37].
Приблизительно 70–80% пациентов с гепатитом С не имеют клинической симптоматики; при остром или остром-на-хроническом гепатите симптомы всех типов вирусных гепатитов сходны и включают один или более из следующих: утомляемость, абдоминальную боль, снижение аппетита, желтуху.
3.2 Профилактика
3.2.1 Советы инфицированным лицам по предотвращению передачи HCV
- Инфицированным людям необходимо обрабатывать любые кровоточащие раны или порезы с помощью дезинфицирующих средств и повязок для предотвращения контакта с их кровью окружающих.
- Инфицированный человек не может быть донором крови или органов, хотя органы HCV-позитивных пациентов могут быть использованы для лиц, также уже инфицированных HCV.
- Лица, получающие инъекционное введение медикаментов, должны быть предупреждены о риске передачи HCV и инструктированы о безопасной технике инъекции.
- Рвотные массы и другие телесные выделения пациентов, инфицированных HCV, должны обрабатываться дезинфицирующими средствами — например, хлоркой или раствором глутаральдегида.
- Риск половой передачи HCV низок. Рекомендаций барьерной контрацепции для супругов нет. Тем не менее, по данным литературы риск инфицирования HCV у мужчин с гомосексуальным связями высок, особенно среди ВИЧ-инфицированных лиц.
- Риск передачи HCV через грудное молоко низок, поэтому прерывать грудное вскармливание нет необходимости.
- Бытовые и физические контакты не признаются факторами риска передачи HCV, поэтому HCV-инфицированный человек не должен отстраняться от любых нормальных активностей.
3.2.2 Профилактика в сообществе и медицинских учреждениях
- Все доноры крови должны быть скринированы на наличие антител к вирусу гепатита С и/или HCV RNA.
- В медицинских учреждениях, чрезвычайно важно строгое соблюдение универсальных правил инфекционного контроля. Они включают использование одноразовых или правильно стерилизованных материалов для инвазивных процедур и адекватную очистку и стерилизацию инструментов.
- Очень важно проводить образовательную работу с лицами, занимающимися татуажем, маникюром, педикюром, парикмахерами и практиками нетрадиционной и альтернативной медицины о способах минимизации риска заражения через кровь. Она включает в себя ознакомление со стерилизационными методами для процедур, вовлекающих повреждение кожного покрова или слизистых оболочек.
- Так как передача HCV через внутривенное употребление наркотиков представляет собой все возрастающую проблему, важно проведение образовательной программы о вреде наркотиков, особенно среди школьников. Также необходимо внедрять такие снижающие вред программы как «игла/шприц».
- Лица, ранее получавшие стоматологическое или хирургическое лечение, могли подвергаться риску заражения инфекцией HCV. Им должно быть предложено обследование, особенно в регионах, где главным риском заражения служат именно стоматология и хирургия.
- Индивидуумы с переливанием крови в анамнезе имеют более высокий риск развития инфекции HCV, и также должны направляться на обследование.
- После скринирования пациенты с хроническим гепатитом C должны быть вакцинированы против гепатита В.
- Использование инъекционного введения лекарств предпочтительно только в проверенных медицинских учреждениях, и, насколько возможно, пациентов необходимо убеждать отказаться от инъекций, особенно в условиях, где недоступно медицинское наблюдение. Когда инъекции необходимы, их проведение должно выполняться в соответствии с рекомендациями ВОЗ.
- Соответствующий протокол о согласии на лечение с использованием иглы должен быть подписан и прослежен во всех медицинских учреждениях (государственных и частных), как рекомендовано Центрами Контроля и Профилактики Заболеваний (CDC).
- Все повреждения кожи на руках медработников должны быть покрыты водонепроницаемой повязкой, и, если это возможно, должны использоваться двойные перчатки с индикатором крови.
- Работники здравоохранения должны быть вакцинированы против HBV.
4. Диагноз и скрининг
Инфекция HCV диагностируется с помощью исследования специфических антител с помощью иммуноферментного анализа (ELISA). Наличие антител к HCV показывает, что человек был инфицирован HCV, но не дает ответа на вопрос была ли инфекция острой, хронической или она разрешилась. Антитела не могут быть определены в первые несколько недель после первичной инфекции из-за «периода окна» или в ситуации, когда пациент иммуноскомпрометирован.
По контрасту с вирусами гепатита А и гепатита В, диагноз острой инфекции которыми основывается на определении антител к иммуноглобулину M (IgM), при острой инфекции HCV серологического маркера не существует. Скрининговыми тестами хронической инфекции HCV служат иммуноферментный анализ (EIA) или хемилюминисцентный анализ (CIA) для anti-HCV, а также верификация дополнительным, более специфичным методом — например, анализом нуклеиновой кислоты для HCV RNA.
Диагноз острого гепатита C основывается на:
- Выраженном или умеренном повышении уровня аланиновой аминотрансферазы (АЛТ иногда превышает норму в 10 раз)
- Наличии или отсутствии желтухи
- Определяемой сывороточной HCV RNA
- Появление сероконверсии anti-HCV несколько недель спустя
Если anti-HCV и HCV RNA определяются с самого начала заболевания, проведение дифференциального диагноза между острой и хронической с подъемом АЛТ инфекцией может вызывать затруднения.

ВОЗ предварительно классифицировала первый быстрый диагностический тест на HCV, метод, который будет способствовать диагностике инфекции HCV в странах с низким и среднем доходами и улучшит доступность лечения. Новый утвержденный тест, SD Bioline HCV, производимый Standard Diagnostics, Inc. (South Korea), - это первичный диагностический метод, что делает его особенно полезным в странах с низкими ресурсами, где может иметься недостаток лабораторий и обученного персонала. Напоминая фармакологический тест на беременность, его проведение не требует больничных условий, наличия подключения к электричеству и может исполняться медицинским персоналом без специального образования. Тест выдает результат в течение 20 минут. Продукт не валидизирован для новорожденных или детей младшего возраста [38].
Скрининг рекомендован для групп риска и специфических возрастных групп — факторы риска варьируют в разных странах, также как и риск инфекции HCV в различных группах. Если скринирование согласно списку в Таблице 6 практически не доступно (например, знают ли пациенты, что инъекции им проводились уже использованными шприцами?), пациенты должны проходить скрининг на основании факта повышенных уровней аминотрансфераз на момент первичного обращения за медицинской помощью. Центры Контроля Заболеваний в США рекомендуют проведение исследований всем «бэби-бумерам»; в Европе таких рекомендаций нет.

5. Ведение инфекции HCV
5.1 Цели лечения
Целью лечения инфекции HCV является уменьшение осложнений, связанных с вирусом. Эта цель достигается путем эрадикации вируса для получения устойчивого вирусологического ответа (УВО). У пациентов с УВО наблюдается клиренс вируса и шансы на его реактивацию минимальны. При УВО у больных отмечается улучшение картины печеночного некровоспаления, фиброза, снижается риск развития гепатоцеллюлярной карциномы.
При саморазрешении острой инфекции HCV противовирусного лечения не требуется. В зависимости от источников сообщается о спонтанном выздоровлении от 15% до 50% пациентов.
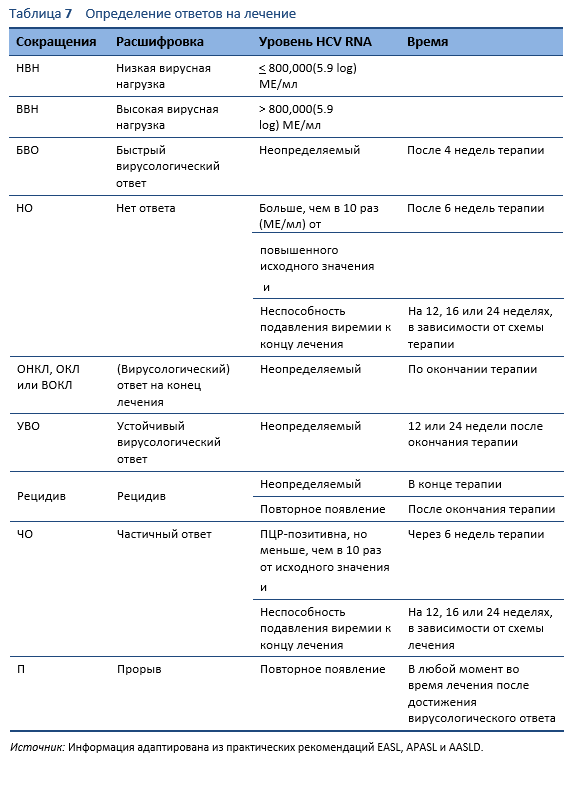
5.2 Принципы лечения
Лечение гепатита C доказало свою эффективность в предотвращении долговременного риска осложнений и служит важнейшей формой ведения пациентов с хронической инфекцией HCV.
Генотипы HCV не-1 наиболее часто встречаются в густонаселенных странах Южной Азии, Восточной Азии, Африки и Ближнего Востока. До эры пегилированного интерферона (ПЕГ-ИФН), главным методом лечения HCV в большинстве регионов мира служила монотерапия стандартным ИФН или комбинированная терапия стандартным интерфероном/рибавирином (ИФН/РБВ). После 2002 года стала доступна терапия ПЕГ-ИФН/РБВ. Важнейшие клинические исследования по терапии ПЕГ-ИФН/РБВ показали УВО у 40–45% пациентов с генотипом 1, до 80% - с генотипом 2, и только 50% - при генотипе 3a. Вышеупомянутые методы лечения оставляют 50–60% пациентов с хроническим гепатитом С как неответивших либо имеющих рецидив заболевания [35]. В дополнение, эти лечебные варианты требуют 24–48 недель инъекционного введения интерферона в комбинации с пероральным приемом рибавирина, что сопровождается выраженной токсичностью, кроме того слишком многим пациентам противопоказан интерферон или они отказываются от лечения из-за побочных эффектов. Следовательно, требовался такой метод, при котором использовались бы оральные формы препаратов, с однократным приемом в сутки, коротким курсом терапии и минимальными побочными эффектами. Также было необходимо пангенотипическое действие и высокий уровень УВО (> 95%) вне зависимости от стадии печеночного фиброза, отсутствия ответа на терапию ИФН/РБВ в анамнезе, пола, расы и возраста [39].
После 2011 года началась эра прямых противовирусных препаратов (ППП), которые в настоящий момент служат стандартом лечения.
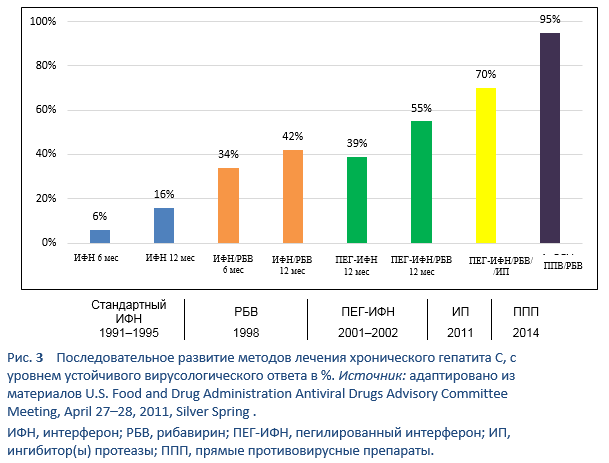
Софосбувир (СОФ), который легко доступен в развивающихся странах, принимается в виде таблетки 400 мг один раз в день. ПЕГ-ИФН-a2a должен вводиться в дозе 180 мкг один раз в неделю, в то время как ПЕГ-ИФН alfa-2b вводится в дозе зависимой от веса пациента 1.5 мкг/кг в неделю. Доза рибавирина (РБВ) зависит от веса пациента (например, 1000 мг < 75 кг и 1200 мг > 75 кг).
Новые ППП изначально были доступны только по очень высокой цене. Проводились попытки ввести договорные цены в странах с низким доходом. Это привело к разнородности цен в различных регионах мира. Например, одна упаковка софосбувира продавалась в США по цене $28,000 с общей суммой за 3-месячный курс лечения $84,000, в то время как такой же дженерик доступен в Пакистане и Индии стоимостью в $300 (полный курс на 6 месяцев стоит $1800).

Gilead Sciences, Inc., производитель Софосбувира, подписал добровольные лицензионные соглашения с несколькими производителями в отдельных странах с низким и средним уровнями доходов для продажи местных дженериков, в результате чего цены в этих конкретных странах еще сильнее снизились. Тем не менее, эти добровольные лицензионные соглашения не действуют в других странах со средними доходами, где также имеется значительная нагрузка на здравоохранение, например, в Китае, Бразилии, Аргентине, Иране и Турции. Дженерики ППП представляют собой достаточно дешевую и эффективную альтернативу. По результатам исследования 448 пациентов, Freeman et al. сообщают о достижении УВО приблизительно в 94% лечения дженериками ППП [43].
Методы лечения, обсуждаемые в практических рекомендациях, должны выбираться в зависимости от доступных медицинских и финансовых ресурсов. Все варианты основываются на эмпирических данных, полученных от региональных экспертов и обществ, с небольшими отклонениями от медицинской практики, основанной на доказательствах. Это представляет собой попытку сделать лечение гепатита С доступным во всем мире и практически осуществимым для врачей всех уровней, и, таким образом, позволить получить всем пациентам с гепатитом С максимальную пользу.
И, наконец, практические рекомендации не являются непреложными законами, а представляют собой отражение динамического и постоянно меняющегося процесса, помогающего врачам лечить пациентов должным образом, применяя, когда это необходимо, индивидуализированный подход. Практические рекомендации всегда требуют улучшения и обновления по мере поступления данных и доказательств, полученных в новейших исследованиях.
5.3 Кого необходимо лечить?
Инфекция HCV может быть излечена с помощью противовирусных средств; тем не менее, из-за бессимптомной природы заболевания, многие инфицированные люди не подозревают о наличии инфекции, а для тех, у кого инфекция была диагностирована, во многих ситуациях доступ к лечению остается ограниченным [5].
“Разъяснительная инструкция”, опубликованная Всемирной Организацией Здравоохранения, ставит целью элиминацию вирусов гепатита В и С к 2030 году [44]. Следовательно, все пациенты с хронической инфекцией HCV должны получать терапию, за исключением больных с коротким ожидаемым жизненным прогнозом, обусловленным наличием тяжелых сопутствующих заболеваний. Пациенты, имеющие высокий риск развития печеночных осложнений, должны иметь приоритет при назначении немедленного лечения.
Пациенты, имеющие высокий риск развития печеночных осложнений, включают:
- Пациентов с выраженным фиброзом, ≥ F2 по шкале Metavir
- Пациентов с декомпенсированным циррозом, ожидающие трансплантацию печени
- Пациентов с трансплантатом печени
- Пациентов с тяжелыми внепеченочными осложнениями, такими как васкулит, криоглобулинемия, вызывающая терминальное повреждение органов, или гломерулонефрит/нефротический синдром, приводящий к выраженной протеинурии
5.4 Прогнозирование ответа на лечение
Рекомендации по предпочтительным режимам лечения HCV продолжают развиваться, но они все еще зависят от некоторых факторов, которые в определенных случаях подвергают риску достижение УВО:
- Генотип HCV
- Ранее проводимое лечение HCV в анамнезе
- Компенсированное против декомпенсированного заболевания печени
- Взаимодействие препаратов
- Хроническое заболевание почек
- Наличие трансплантата солидного органа
Далее следуют прогностические факторы менее благоприятного ответа на комбинированное лечение ППП:
- Ранее проведенное лечение ППП
- Цирроз печени (классы B и C по Child–Pugh)
- Слабая приверженность лечению
5.5 Оценка до начала лечения
Перед началом лечения ППП необходимо оценить следующее:
- Очень важны физикальное обследование и тщательный сбор анамнеза, включающий наличие в анамнезе пациента любых других заболеваний печени и медицинских состояний, которые могут оказать отрицательное влияние на печень, таких как инфекция вирусом гепатита В, алкоголизм, аутоиммунные заболевания, метаболические заболевания печени, или прием гепатотоксических препаратов. Эти моменты очень важно выяснить и принять необходимые меры для уменьшения рисков.
- Необходимо провести оценку состояния других органов и систем (сердечно – легочной системы и психиатрической сферы), а также выявить возможный риск нежелания получать лечение. Должны быть предприняты необходимые меры для уменьшения этих рисков.
- Оценка проводящегося на настоящий момент и прошлого лечения и приверженности ему. Также должны быть проведена оценка клинически значимых лекарственных взаимодействий.
- Стадия фиброза печени должна быть проверена с помощью неинвазивных методов:
— Исследования показали, что FibroScan обладает хорошей чувствительностью и является альтернативой биопсии печени. Количество фибротической ткани может быть количественно определено очень просто и достоверно более чем у 95% пациентов [45]. Корректная интерпретация результатов транзиторной эластографии должна иметь межквартильный диапазон/медианные значения < 30% и уровень сывороточной АЛТ, менее чем в 5 раз превышающий верхнюю границу нормы. Не должно быть избыточного потребления алкоголя и во внимание необходимо принимать ИМТ пациента. Если ИМТ превышает 30 кг/м2, должен рассматриваться вопрос о возможности применения XL-датчиков.
— В регионах и местах с ограниченными ресурсами, где нет легкой доступности FibroScan, могут использоваться такие шкалы, как индекс фиброза 4 (FIB4), индекс отношения уровня АСТ к уровню тромбоцитов (APRI) и силовой импульс акустического излучения (ARFI). Показатель по шкале APRI ≥ 2 может использоваться для прогнозирования наличия цирроза. Максимальная чувствительность шкалы ARFI - 48%, но специфичность составляет 94% для прогнозирования наличия цирроза. Также она может применяться для прогнозирования присутствия выраженного фиброза (стадии 2-4). Применяя максимальное значение 1.5, чувствительность составляет 37% и специфичность - 95% для выраженного фиброза [46,47].
— Биопсия печени может рассматриваться только если существует возможность наличия дополнительного этиологического фактора.
- Количественное определение HCV-RNA в сыворотке крови с использованием чувствительного анализа ПЦР в настоящем времени с нижней границей определения ≤ 15 МЕ/мл.
- Генотипирование HCV.
- У пациентов с циррозом или подозрением на него необходимо проведение расчета баллов по шкалам Child–Turcotte–Pugh и Модели для Терминального Заболевания Печени (MELD).
5.5.1 Рекомендации по наблюдению перед началом лечения
1. Полный клинический анализ крови с лейкоцитарной формулой, функциональные печеночные пробы, сывороточный альбумин, МНО, уровень почечной фильтрации и определение тиреотропного гормона (ТТГ) (если планируется назначение ИФН) должны быть проведены за 12 недель до начала терапии.
2. До начала лечения необходимо провести количественную ПЦР и генотипирование.
3. У женщин детородного возраста перед началом лечения проводится уринарный тест на беременность. В настоящий момент все оральные режимы лечения, с рибавирином или без него, противопоказаны при беременности или во время грудного вскармливания из-за отсутствия достаточной информации о безопасности. Для женщин детородного возраста рутинно рекомендуется предпринимать адекватные меры контрацепции [48].
4. При назначении схем лечения с рибавирином необходимо принимать во внимание возраст пациента, сопутствующие заболевания сердечно-сосудистой системы и наличие анемии.
5.6 Оценка во время лечения
Рекомендации для пациентов во время лечения HCV:
1. Приверженность лечению должна поддерживаться либо при визитах к врачу либо по телефонному разговору с ним. Необходимо выяснять наличие любых побочных эффектов. Должны быть даны советы по лекарственному взаимодействию. В Университете Ливерпуля разработано пособие “HEP Drug Interaction Checker” (http://www.hep-druginteractions.org) [49].
2. Клинический анализ крови с лейкоцитарной формулой, креатинин в сыворотке, почечная фильтрация и печеночные пробы необходимо исследовать через 4 недели после начала лечения. Пациентам, получающим рибавирин, клинический анализ крови можно проводить чаще при наличии показаний.
3. Анализ на ТТГ пациентам, получающим интерферон, проводится через 12 недель терапии.
4. В конце лечения и через 12 недель после окончания проводится количественная ПЦР.
5.6.1 Когда прерывать лечение из-за побочных эффектов
- При появлении 10-кратного или более повышения АЛТ через 4 недели после начала лечения.
- Если повышение АЛТ менее 10-кратного, но имеется:
— Появление симптомов (тошнота, рвота, слабость)
— Желтуха
—Повышение билирубина, щелочной фосфатазы (ЩФ) или МНО
- Если повышение АЛТ менее 10-кратного и у пациента отсутствует симптоматика, исследование АЛТ должно быть повторено на 6 неделе терапии; если показатель постоянно высок, следует думать о возможности прекращения лечения.
5.7 Оценка после лечения
5.7.1 Для пациентов, неответивших на лечение
1. Функциональные пробы печени, клинический анализ крови, МНО каждые 6–12 месяцев для оценки прогрессирования заболевания (пациенты с F4).
2. Наблюдение за возможным развитием ГЦК у пациентов с выраженным фиброзом (стадии F3/F4 по Metavir) с использованием УЗИ каждые 6 месяцев.
3. Эндоскопическое наблюдение за варикозными венами пищевода у пациентов с циррозом.
4. Оценка возможности проведения повторного лечения после появления адекватных методов терапии. Исследование мутаций необходимо для выбора лучшей схемы лечения. В настоящее время, пациентам, неответившим на терапию ППП, рекомендуется проведение оценки резистентности NS5A, особенно перед решением вопроса о назначении элбасвира/гразопревира при генотипе 1a.
5.7.2 Для пациентов, достигших УВО
1. Для пациентов с фиброзом F0–F2 применимы те же самые рекомендации как при отсутствии инфекции HCV.
2. Для пациентов с фиброзом F3–F4, рекомендуется дважды в год проведение УЗИ для наблюдения за возможностью развития ГЦК.
3. Эндоскопическое исследование для пациентов с циррозом печени, при наличии варикозно расширенных вен пищевода – стандартное лечение и наблюдение.
4. Если уровни печеночных ферментов сохраняются постоянно повышенными, несмотря на достижение УВО, необходимо исключать другие причины заболевания печени.
5.8 Безинтерфероновая оральная терапия ХГС с 2014 года
- В декабре 2013 г. и в январе 2014 г., FDA одобрило ППП второго поколения для терапии хронического гепатита С, генотип 1, который наиболее распространен и считался трудным для лечения. Первым из этих препаратов был софосбувир (СОФ) - ингибитор NS5B полимеразы. Первым исследованием эффективности терапии СОФ/РБВ было ELECTRON. Его результаты показали достижение УВО у 84% из 25 наивных пациентов после 24 недель терапии (УВО 24) [50,51]. В последующем исследовании схемы комбинированной терапии софосбувиром и РБВ в течение 24 недель 60 наивных пациентов с генотипом 1 и плохими прогностическими факторами (афро-американская этничность, ccIL28B и вирусная нагрузка более 800,000 МЕ/мл), уровень УВО 24 составил 68% [51].
- В исследовании ELECTRON, СОФ/РБВ назначался пациентам с генотипами 2 и 3 без цирроза. 100% из них достигли УВО 24 [52]. В исследовании FISSION СОФ/РБВ применялся в течение 12 недель у 499 наивных пациентов; УВО 12 составил 97% у пациентов с HCV генотип 2. У пациентов с генотипом 3 УВО 12 был только 56% [53]. Подобно этому, в исследовании POSITRON уровень УВО 24 после 24 недель лечения составил 61% для генотипа 3 и 93% - для генотипа 2 [54]. Сходные результаты были получены и в исследовании FUSSION, с плохими показателями УВО для 62% пациентов, инфицированных вирусом генотипа 3.
- С тех пор FDA было одобрено большое количество препаратов в отдельных комбинациях или в комбинациях с фиксированными дозами, включая даклатасвир, схему 3D, паритапревир+дазабувир/омбитасвир+ритонавир (Viekira pak).
- Одной из последних, одобренных FDA комбинаций является пангенотипическая комбинация, доступная под торговым названием Epclusa, содержащая софосбувир + велпатасвир [55]. В исследовании фазы 3, Feld et al. назначали эту комбинацию на срок 12 недель, и сообщили о достижении УВО 12 у 99% пациентов с генотипами 1, 2, 4, 5 и 6 [56]. В исследовании ASTRAL-3 сообщается об УВО 12 у 95% пациентов с генотипом 3, получавших терапию софосбувиром + велпатасвиром в течение 12 недель [57]. В другом исследовании Curry et al. использовали эту комбинацию для лечения декомпенсированных пациентов с достижением УВО в 83% после курса 12 недель, 86% - после курса 24 недель, и в 94% у пациентов, получавших данную комбинацию в сочетании с рибавирином 12 недель [58].
- Zepatier – это еще одна пангенотипическая комбинация, основанная на ППП, одобренная к применению в 2016 г. Комбинация включает 100 мг гразопревира и 50 мг элбасвира. Комбинация Zepatier с софосбувиром изучалась в исследовании C-SWIFT, с эффективностью более 90% при курсе в 8 недель у пациентов с генотипом 1 и 12 недель при генотипе 3 [59].
5.9 Лечение особых популяций
5.9.1 Лечение острого гепатита C
Острый гепатит C трудно диагностировать у бессимптомных пациентов, особенно когда точно не определено время попадания вируса. При лечении пациента с острым гепатитом С необходимо решить два вопроса: первый, когда начинать терапию; и второй, какую выбрать схему терапии и ее длительность.
В одном метаанализе 16 исследований, исход заболевания в группе пациентов, которым проводилась ранняя терапия гепатита, был лучшим, чем в группе, наблюдавшейся по поводу спонтанного клиренса. В другом исследовании при ранней терапии высокими дозами традиционного ИФН УВО был достигнут в 85–100%. Доза ИФН составляла 5–10 миллионов единиц в день, курсом 12 недель. Другим препаратом выбора служил ПЕГ-ИФН в дозе 1.2–1.3 мг/кг еженедельно, но это лечение имело более высокую стоимость [60–65].
Исследование Deterding и соавт. показало, что отсроченное лечение было таким же эффективным, как и немедленно начатая терапия. В дополнение к этому, отсроченное лечение может уменьшить возможность проведения излишней терапии у пациентов со спонтанным клиренсом вируса без применения лекарственных средств. Тем не менее, в таких случаях необходимо проведение тщательного наблюдения [66].
Поскольку новые ППП имеют лучшие показатели эффективности и безопасности, аргументы в пользу раннего начала терапии стали относительно слабее. Следовательно, новые рекомендации таковы:
- В течение по меньшей мере 6 месяцев рекомендуется регулярное лабораторное наблюдение за уровнем HCV RNA для оценки спонтанного клиренса.
- Пациентам с острым гепатитом С необходимо рекомендовать избегать приема гепатотоксичных препаратов (например, ацетаминофена) и алкоголя. Также пациентам необходимо принимать защитные меры для снижения риска передачи вируса другим людям.
- Раннее лечение может рассматриваться только в особых обстоятельствах — например, у лиц, входящих в группу риска по передаче вируса другим людям (инъекционное наркоманы или хирурги), у пациентов уже страдающих заболеванием печени другой этиологии и у лиц, динамическое наблюдение за которыми может быть затруднено. Даже у таких пациентов необходимо выждать 12 – 16 недель, прежде чем начать лечение.
- При наличии показаний лечение острой инфекции HCV может проводиться с использованием ППП в тех же самых режимах, как и хроническое заболевание.
- Профилактическая терапия при повреждениях шприцевой иглой не рекомендуется из-за очень низкого риска заражения.
5.9.2 Лечение инфекции HCV у детей
Относительно лечения гепатита С у детей имеются различные научные школы. Так как естественное течение инфекции вирусом хронического гепатита С медленное, лечение может быть отложено до наступления подросткового возраста. Однако, как считается, возрастная группа подростков и молодых взрослых более беззаботна и менее склонна придерживаться лечения.
AASLD в детской популяции до сих пор рекомендует применение только интерферонов вместе с РБВ, причем считается, что ПЕГ-ИФН превосходит традиционный ИФН у детей также как и у взрослых пациентов [67]. Пегинтерферон alfa-2b вводится в дозе 60 мкг/м2/нед, в то время как пегинтерферон alfa-2a назначается в дозе 180 мкг/1.73 м2/нед вместе с РБВ в дозе 15 мг/кг/сут. Комбинация назначается на 48 недель пациентам с генотипами 1 или 4, и на 24 недели при генотипах 2 или 3.
Педиатрический ответ на терапию ИФН/РБВ при инфекции HCV - это 36–57% УВО для генотипа 1, 84–100% генотипов 2 и 3, и 50–80% генотипа 4. Профиль побочных эффектов при лечении ИФН/РБВ у детей включает гриппоподобные симптомы, лихорадку, лейкопению, головные боли, абдоминальную боль, потерю аппетита, диарею и психические нарушения [68–72].
Из-за побочных эффектов и низкого показателя УВО, особенно при генотипе 1 у детей, необходимо рассматривать вопрос о возможности назначения ППП. В двух исследованиях фазы 2, спонсируемых Gilead Sciences 2, оценивалась эффективность и безопасность ледипасвира и софосбувира для генотипа 1 и софосбувира и РБВ для генотипов 2 и 3, соответственно. Превосходная эффективность новых ППП во взрослой популяции стимулировала исследователей на оценку этих препаратов в подростковой популяции. Фармакокинетика и безопасность софосбувира и ледипасвира исследовались у детей в возрасте 12 – 17 лет. Результаты в этой группе были сравнимы с вышеприведенными [73]. Тем не менее, для одобрения применения этих ППП у детей требуется проведение дополнительных углубленных исследований.
Замечания:
- Другие специальные группы пациентов с ХГС — например, пациенты с почечной недостаточностью, ко-инфекция HCV/ВИЧ и HBV, реципиенты пересадки органов и другие проходят лечение в специализированных гепатологических отделениях; практические рекомендации можно найти в других международных источниках (см. Таблицу 1).
- Так как лечение гепатита C быстро меняется за счет стремительного развития ППП, мы отсылаем читателей к практическим рекомендациям AASLD, EASL и APASL для ознакомления с новыми алгоритмами терапии.
5.10 Эффективны ли местные дженерики и патентованные ППП?
После появления новых препаратов и новых ППП, возросли ожидания того, что эти средства обеспечат эффективное, безопасное и дешевое лечение HCV. Несмотря на то, что в мире существует огромная разница в ценах на дженерики, Hill et al. указывали в 2013 г., что стоимость оригинального производства ППП очень низка — например, 12-недельный курс лечения софосбувиром стоит приблизительно $101, а 12-недельный курс даклатасвира - $20 [74].
В настоящий момент существует несколько производителей дженериков и конкуренция между ними приводит к дальнейшему снижению цены на ППП. Страны с низким уровнем доходов, такие как Пакистан и Индия, имеют доступ к недорогим, активным фармацевтическим ингредиентам, но уверенность в качестве продукта остается под сомнением. В таких странах как Египет, где качество строго контролируется местными властями, данные по применению дженериков представляются многообещающими. ВОЗ разработала механизм контроля качества этих препаратов через свою программу предварительной квалификации [75].
Предварительные данные из одного из центров в Пакистане, основывающиеся на результатах применения дешевого дженерика софосбувира, показывают уровень быстрого вирусологического ответа в 86.8% у пациентов с генотипом 3 (абстракт представлен на Неделю Заболеваний Органов Пищеварения (Digestive Diseases Week) 2017). Также, на конгресс AASLD в Бостоне группами из России и Катара представлены два абстракта в отношении лечения дженериками, показавшие превосходные результаты с УВО приблизительно 92% и 95%, соответственно [76,77].
5.11 Необходим ли все еще ИФН, несмотря на появление ППП? Локальная перспектива
Интерферон в прошлом, без сомнения был главным средством лечения HCV, но большое количество побочных эффектов и появление безопасной и эффективной альтернативы в виде ППП ограничили его применение, и в ближайшем будущем ИФН устареет как метод терапии HCV. Не существует медицинских причин для отказа от применения ППП для лечения HCV, но в странах с низкими доходами – особенно в Азиатско-Тихоокеанском регионе – их продвижение пока что происходит очень медленно. В настоящее время единственным показанием к применению интерферонотерапии является отсутствие доступности ППП. Одним из аргументов в пользу ИФН служит относительно лучший ответ на него в азиатской популяции, частично за счет аллеля IL28Be; тем не менее, глобальная эрадикация вируса невозможна с помощью интерфероновых режимов лечения. Главной причиной заинтересованности должен служить доступ к ППП. Старания Gilead Sciences, Inc. обеспечить своими препаратами 90 стран с наиболее низкими доходами являются значительным шагом в этом направлении.
5.12 Лекарственная резистентность к ППП — недооцененная проблема
HCV обладает высокой скоростью репликации, что приводит к низкой корректирующей способности HCV RNA–зависимой RNA полимеразы [78,79]. Следствием этого является высокий уровень генетических вариаций даже в пределах одного генотипа [80]. Следовательно, любой индивидуум, инфицированный HCV имеет смесь генетически схожих штаммов вируса с предоминирующим штаммом дикого типа, чувствительного к лекарственным препаратам (определяемого в начале терапии) и низким уровнем резистентных штаммов (не определяемых в начале терапии). Такие резистентные штаммы обладают мутантной аминокислотой, которая либо снижает эффективность ППП, либо повышает сопротивляемость вируса [81].
После начала терапии ППП возникает быстрое снижение уровня чувствительного штамма, что обуславливает негативный количественный анализ HCV RNA. Если длительность терапии ППП достаточна, то в конце лечения чувствительные штаммы эрадицированы, а резистентные штаммы существуют на низком неопределяемом уровне, поэтому количественный анализ HCV RNA все еще остается негативным. После окончания лечения изменения в конкурентной среде (с элиминацией чувствительного штамма) приводят к появлению на первом плане резистентных штаммов, и, соответственно, к неэффективности терапии ППП/рецидиву.
Различные, связанные с резистентностью штаммы и их вариабельное преобладание хорошо задокументированы для разных ППП. Например, частыми резистентными вариантами для софосбувира являются штаммы L159F, V321A и S282R. Данные по первым двум вариантам недоступны, в то время как третий вариант имеет низкую резистентность с преобладанием примерно 0.4%. У даклатасвира имеется высоко резистентный вариант, M28, с преобладанием 0.5–4.0%. У ледипасвира два высоко резистентных варианта, один из которых преобладает до 100% для генотипов 2 и 4 [82].
В целом, резистентность к ингибиторам NS34A протеазы, таким как боцепревир, исчезает в периферической крови в срок от нескольких недель до нескольких месяцев, в то время как резистентность к ингибиторам NS5A — таким как даклатасвир, ледипасвир и омбитасвир — персистирует годами [81]. Ингибитор NS5B нуклеозид полимеразы софосбувир обладает самым высоким барьером к резистентности [82].
Резистентность к ППП – появившаяся проблема, которая требует дальнейшей оценки. Исследование резистентности до лечения вероятно будет включено в рекомендации в ближайшем будущем. В настоящий момент обновленные практические рекомендации AASLD 2016 предлагают проведение оценку резистентности NS5A у пациентов с неэффективностью терапии ППП, особенно перед рассмотрением возможности назначения лечения элбасвиром/гразопревиром больных с генотипом 1a [3]. Кроме генотипа 1a, резистентность NS5A также очень часто встречается при генотипе 3, который преобладает в Пакистане. Работа с пациентами, не ответившими на терапию ППП, в Пакистане требует большого внимания, и эти больные — особенно с выраженным фиброзом — могут нуждаться в усилении терапии софосбувиром/велпатасвиром [57,58]. Резистентность HCV к ППП может помешать достижению УВО у пациентов, и любой больной с неэффективностью лечения ППП должен вестись в соответствии с рекомендациями, изложенными в соответствующем разделе.
5.13 Лечение HCV врачами-неспециалистами
При применении всех оральных ППП, и особенно при доступности пангенотипических режимов с однократным приемом препаратов, лечение HCV кажется очень легким с ограниченной оценкой пациента. Поскольку распространение HCV очень высоко в некоторых странах с ограниченными ресурсами, где к тому же редки сертифицированные гепатологи и гастроэнтерологи, в отношении ведения пациентов необходимо применять гибкость. Kattakuzhy et al. инициировали исследование ASCEND для определения безопасности терапии HCV ППП, назначаемой врачами-неспециалистами. Результаты показали, что оно в равной степени было безопасным и эффективным [83]. Эти данные обнадеживают, но помня о местном сценарии, должны налагаться определенные модификации и ограничения — такие как уверенность в должных знаниях у врачей общей практики и поощрение их на следование практическим рекомендациям, а также понимание необходимости направления пациента на консультацию при наличии осложнений или вхождении его в особую популяцию. Это может быть с успехом выполнено с использованием средств телемедицины – модели, подобной проекту ECHO [84].
5.14 Резюме
Преимущества ППП:
- Оральная терапия, отсутствие инъекций.
- Пангенотипические средства: недавние исследования подтверждают эффективность ППП при всех генотипах (от 1 до 6).
- Отсутствие вирусологического прорыва во время лечения и высокий барьер к резистентности.
- Эффективность при вариантах IL28B CT, TT.
- Простое дозирование, отсутствие связи с приемом пищи, минимальные побочные эффекты и короткий курс лечения.
- Эффективность у наивных и ранее пролеченных пациентов
- Безопасны и эффективны у пациентов с циррозом.
Ограничения ППП:
- Высокая стоимость, особенно в регионах с ограниченными ресурсами. Меньшее количество опубликованных результатов исследований с малым опытом применения в различных группах пациентов.
- Недоступность в некоторых странах.
- Лекарственные взаимодействия.
- Резистентность к ППП.
6. Категории лечения и каскады
В этом разделе, пациенты с хроническим гепатитом C, подходящие по диагностическим критериям для лечения, разделены на следующие международно принятые шесть категорий, основанные на генотипе, вне зависимости от того, являются ли они наивными к лечению, при неэффективности лечения, ответе на лечение и наличии цирроза печени. Эти параметры основаны на доказательствах и представляют собой интегральную часть практических рекомендаций по лечению AASLD, EASL, APASL и других региональных сообществ.
Для работников здравоохранения доступны несколько вариантов, приоритет которых расставлен на основании эффективности терапии. Клиницисты могут выбрать варианты на основании состояния печени пациента и доступности/финансовой возможности приобретения препарата.
Хотя в практических рекомендациях более не советуется применение режимов, основанных на интерфероне, в некоторых частях мира, включая как развитые, так и развивающиеся страны, все еще очень осложнен доступ к ППП. Есть даже несколько стран, в которых все еще единственным вариантом лечения гепатита С являются интерфероны. Хотя основанные на интерфероне режимы не упоминаются как вариант лечения в нижеприведенных каскадах, мы все еще могли рекомендовать их использование в регионах, где оральные препараты недоступны. ПЕГ-ИФН alfa-2a должен применяться в дозе 180 мкг один раз в неделю, а ПЕГ-ИФН alfa-2b – в весозависимой дозе 1.5 мкг/кг в неделю, как указано в предыдущих рекомендациях/каскадах.
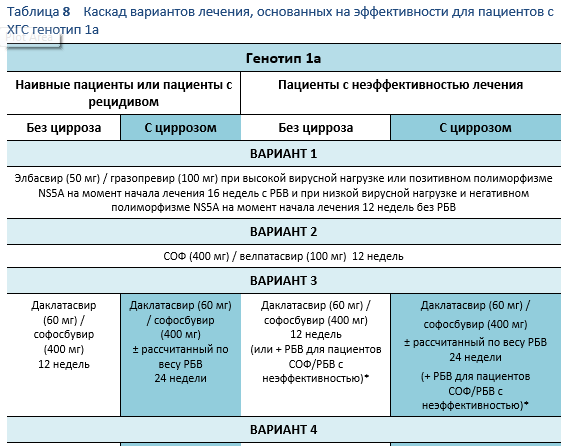
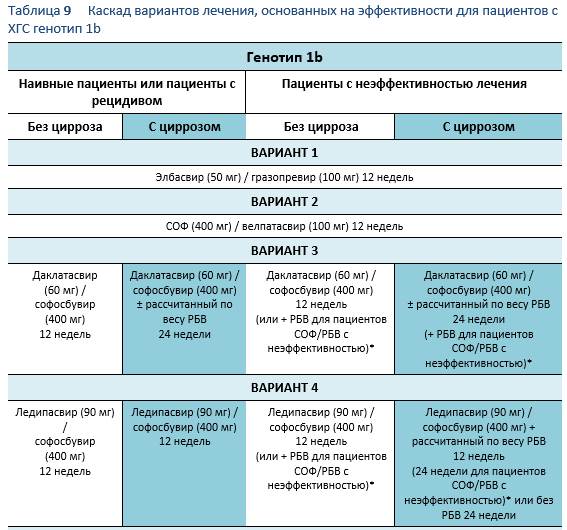
6.1 Каскады для ХГС генотип 1
Следующие варианты доступны для пациентов с инфекцией вирусом хронического гепатита C (ХГС) генотип 1, в зависимости от их предыдущего ответа на лечение и состояния печени.


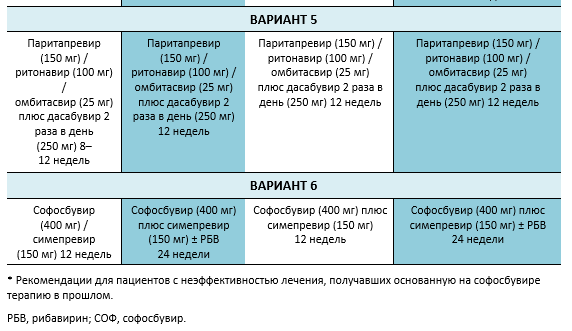
6.2 Каскады для ХГС генотип 2
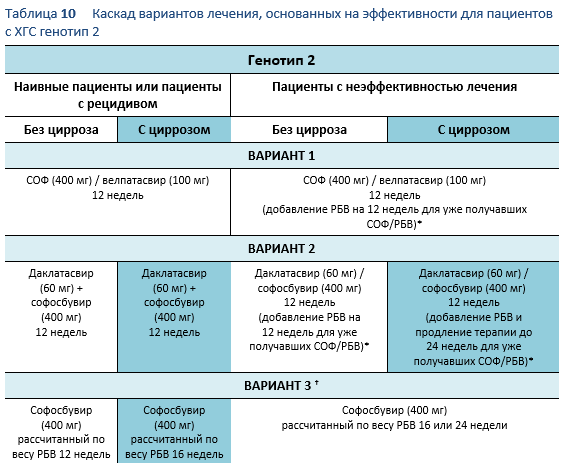
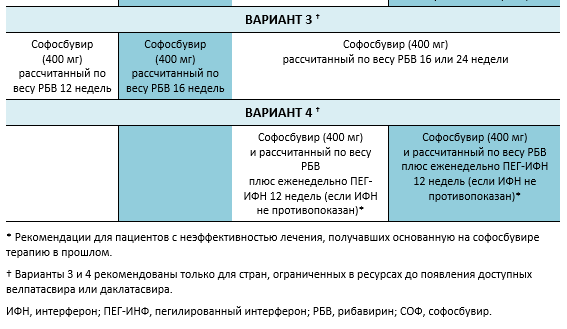
Следующие варианты доступны для пациентов с инфекцией вирусом хронического гепатита C (ХГС) генотип 2, в зависимости от их предыдущего ответа на лечение и состояния печени.
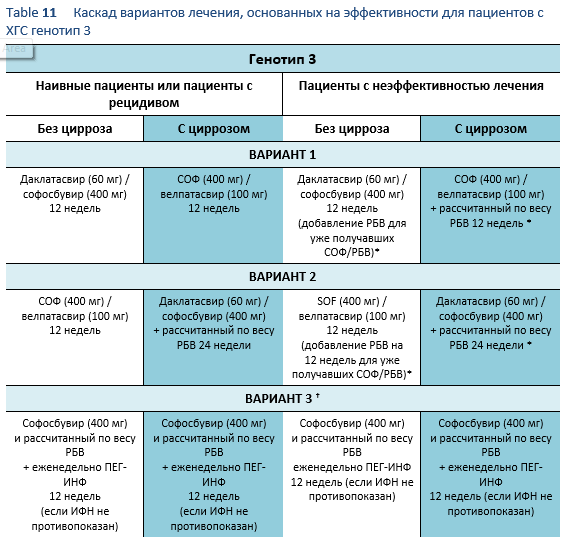
6.3 Каскады для ХГС генотип 3

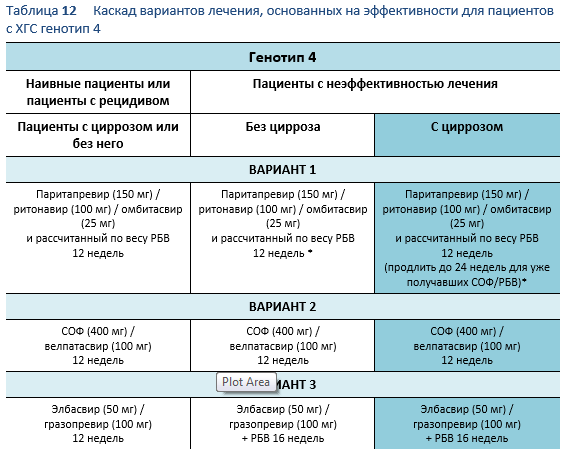
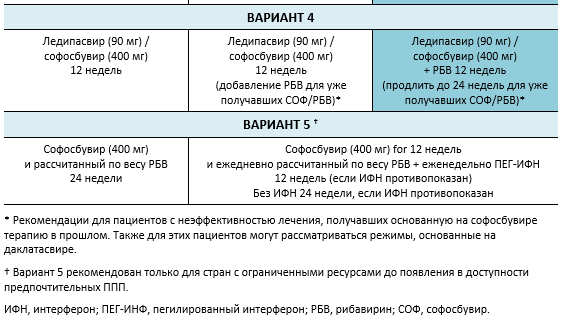
6.4 Каскады для ХГС генотип 4
Следующие варианты доступны для пациентов с инфекцией вирусом хронического гепатита C (ХГС) генотип 4, в зависимости от их предыдущего ответа на лечение и состояния печени.
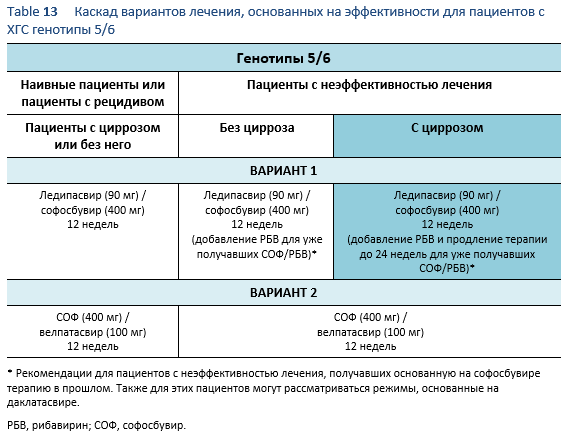
6.5 Каскады для ХГС генотипы 5/6
Следующие варианты доступны для пациентов с инфекцией вирусом хронического гепатита C (ХГС) генотип 5 или 6, в зависимости от их предыдущего ответа на лечение и состояния печени.
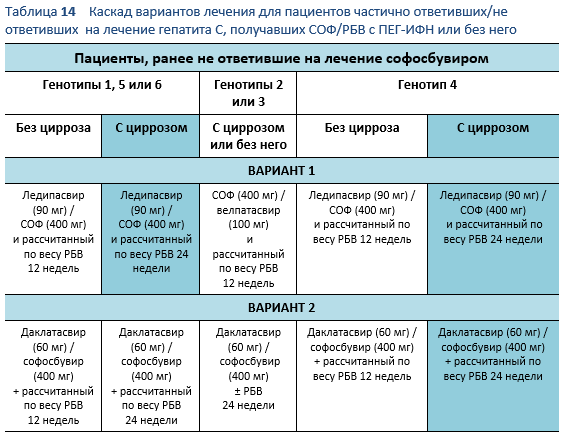
6.6 Каскады для пациентов с неэффективностью лечения софосбувиром
Ниже представлены варианты для пациентов, уже получавших ранее СОФ/РБВ с ПЕГ-ИФН или без него как терапию гепатита С, но либо полностью, либо частично на нее неответивших. Частично ответившими, по определению, являются пациенты, чья вирусная нагрузка возрастает, но < 1 log10 МЕ/мл по сравнению с началом лечения после 6 недель терапии.
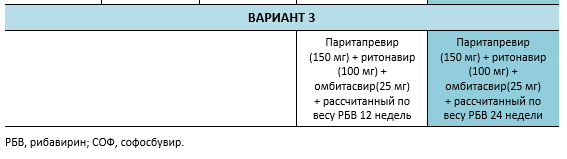
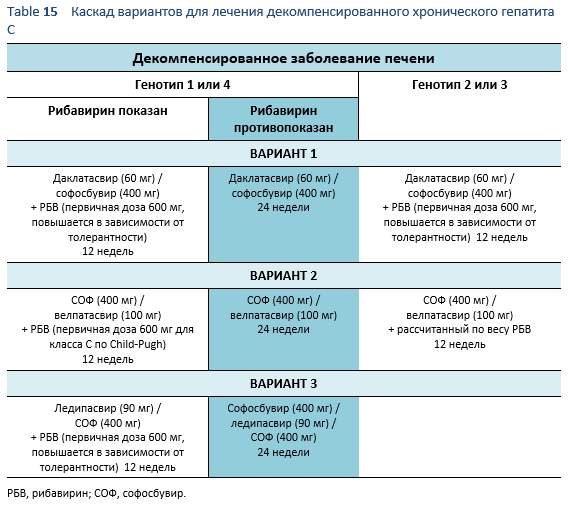
6.7 Каскады для декомпенсированного хронического гепатита C
6.8 Смешанные или неопределяемые генотипы
Данные, касающиеся применения ППП у пациентов с более чем одним генотипом или с неопределяемым генотипом, очень ограничены. Для этих больных лучшим вариантом является ожидание появления пангенотипического препарата. До этого времени, если лечение жизненно необходимо, выбор, комбинация и длительность применения ППП зависит от их максимальной эффективности при всех представленных генотипах, в то время как для неопределяемого генотипа отдается предпочтение тем же режимам как и при генотипе 1.
7. Ссылки
1. European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol. 2017 Jan;66(1):153–94.
2. AASLD/IDSA HCV Guidance Panel. Recommendations for testing, managing, and treating hepatitis C [Internet]. American Association for the Study of Liver Diseases (AASLD); 2017 [cited 2017 Feb 5]. Available from: http://www.hcvguidelines.org/full-report-view.
3. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015 Sep;62(3):932–54.
4. Omata M, Kanda T, Wei L, Yu M-L, Chuang W-L, Ibrahim A, et al. APASL consensus statements and recommendation on treatment of hepatitis C. Hepatol Int. 2016 Sep;10(5):702–26.
5. World Health Organization. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version, April 2016 [Internet]. Geneva: World Health Organization; 2016 [cited 2017 Jan 5]. 138 p. Available from: http://www.who.int/hepatitis/publications/hepatitis-c-guidelines-2016/en/.
6. Mandeville KL, Krabshuis J, Ladep NG, Mulder CJ, Quigley EM, Khan SA. Gastroenterology in developing countries: Issues and advances. World J Gastroenterol. 2009 Jun 21;15(23):2839–54.
7. Zou S, Tepper M, El Saadany S. Prediction of hepatitis C burden in Canada. Can J Gastroenterol J Can Gastroenterol. 2000 Aug;14(7):575–80.
8. Palitzsch KD, Hottenträger B, Schlottmann K, Frick E, Holstege A, Schölmerich J, et al. Prevalence of antibodies against hepatitis C virus in the adult German population. Eur J Gastroenterol Hepatol. 1999 Nov;11(11):1215–20.
9. Umar M, Khaar H-B, Khan AA, Mohsin A, Din W, Shah HA, et al. Diagnosis, management and prevention of hepatitis C in Pakistan 2009. Pak J Gastroenterol. 2009;23(2):7–67.
10. Qureshi H. Prevalence of hepatitis B & C in Pakistan. Islamabad: Pakistan Medical Research Council; 2008.
11. Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000 Mar 11;355(9207):887–91.
12. Amon JJ, Garfein RS, Ahdieh-Grant L, Armstrong GL, Ouellet LJ, Latka MH, et al. Prevalence of hepatitis C virus infection among injection drug users in the United States, 1994–2004. Clin Infect Dis. 2008 Jun 15;46(12):1852–8.
13. Xia X, Luo J, Bai J, Yu R. Epidemiology of hepatitis C virus infection among injection drug users in China: systematic review and meta-analysis. Public Health. 2008 Oct;122(10):990–1003.
14. Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med. 2001 Jul 5;345(1):41–52.
15. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis. 2005 Sep;5(9):558–67.
16. Seeff LB. Natural history of chronic hepatitis C. Hepatology. 2002 Nov;36(5 Suppl 1):S35-46.
17. Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol. 2014 Nov;61(1 Suppl):S45-57.
18. Kandeel A, Genedy M, El-Refai S, Funk AL, Fontanet A, Talaat M. The prevalence of hepatitis C virus infection in Egypt 2015: implications for future policy on prevention and treatment. Liver Int. 2017 Jan;37(1):45–53.
19. Tohme RA, Holmberg SD. Is sexual contact a major mode of hepatitis C virus transmission? Hepatology. 2010 Oct;52(4):1497–505.
20. Vandelli C, Renzo F, Romanò L, Tisminetzky S, De Palma M, Stroffolini T, et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study. Am J Gastroenterol. 2004 May;99(5):855–9.
21. Puoti C, Guarisco R, Spilabotti L, Bellis L, Mitidieri Costanza O, Dell’ Unto O, et al. Should we treat HCV carriers with normal ALT levels? The “5Ws” dilemma. J Viral Hepat. 2012 Apr;19(4):229–35.
22. Kane A, Lloyd J, Zaffran M, Simonsen L, Kane M. Transmission of hepatitis B, hepatitis C and human immunodeficiency viruses through unsafe injections in the developing world: model-based regional estimates. Bull World Health Organ. 1999;77(10):801–7.
23. Khan AJ, Luby SP, Fikree F, Karim A, Obaid S, Dellawala S, et al. Unsafe injections and the transmission of hepatitis B and C in a periurban community in Pakistan. Bull World Health Organ. 2000;78(8):956–63.
24. Kaldor JM, Dore GJ, Correll PK. Public health challenges in hepatitis C virus infection. J Gastroenterol Hepatol. 2000 May;15 Suppl:E83–90.
25. World Health Organization. Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium. J Viral Hepat. 1999 Jan;6(1):35–47.
26. Janjua NZ, Nizamy M a. M. Knowledge and practices of barbers about hepatitis B and C transmission in Rawalpindi and Islamabad. JPMA J Pak Med Assoc. 2004 Mar;54(3):116–9.
27. World Health Organization. Global alert and response (GAR). Hepatitis C. [Internet]. Geneva: World Health Organization; 2002. Available from: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4.html.
28. Terrault NA, Dodge JL, Murphy EL, Tavis JE, Kiss A, Levin TR, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013 Mar;57(3):881–9.
29. Centers for Disease Control and Prevention. Viral hepatitis surveillance — United States, 2009 [Internet]. [cited 2017 May 2]. Available from: https://www.cdc.gov/hepatitis/Statistics/2009Surveillance/Commentary.htm.
30. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006 Apr 1;3(2):47–52.
31. Freeman AJ, Dore GJ, Law МГ, Thorpe M, Von Overbeck J, Lloyd AR, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology. 2001 Oct;34(4 Pt 1):809–16.
32. Levine RA, Sanderson SO, Ploutz-Snyder R, Murray F, Kay E, Hegarty J, et al. Assessment of fibrosis progression in untreated Irish women with chronic hepatitis C contracted from immunoglobulin anti-D. Clin Gastroenterol Hepatol. 2006 Oct;4(10):1271–7.
33. Jacobson IM, Davis GL, El-Serag H, Negro F, Trépo C. Prevalence and challenges of liver diseases in patients with chronic hepatitis C virus infection. Clin Gastroenterol Hepatol. 2010 Nov;8(11):924–933; quiz e117.
34. Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, et al. Serum level of IP-10 increases predictive value of IL28B polymorphisms for spontaneous clearance of acute HCV infection. Gastroenterology. 2012 Jan;142(1):78–85.e2.
35. Vogt M, Lang T, Frösner G, Klingler C, Sendl AF, Zeller A, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood-donor screening. N Engl J Med. 1999 Sep 16;341(12):866–70.
36. Di Bisceglie AM. Hepatitis C and hepatocellular carcinoma. Hepatology. 1997 Sep;26(3 Suppl 1):34S–38S.
37. Kim WR. The burden of hepatitis C in the United States. Hepatology. 2002 Nov;36(5 Suppl 1):S30-34.
38. World Health Organization. Essential medicines and health products. First WHO prequalified hepatitis C rapid test opens the door to expanded treatment [press release] [Internet]. World Health Organization; 2016 [cited 2016 Dec 13]. Available from: http://www.who.int/medicines/news/prequal_hvc/en/.
39. Pockros PJ. Interferon-free hepatitis C therapy: how close are we? Drugs. 2012 Oct 1;72(14):1825–31.
40. Freeman JAD, Hill A. The use of generic medications for hepatitis C. Liver Int. 2016 Jul;36(7):929–32.
41. Hill A, Simmons B, Gotham D, Fortunak J. Rapid reductions in prices for generic софосбувир and Даклатасвир to treat hepatitis C. J Virus Erad. 2017 Jan 25;2(1):28–31.
42. Andrieux-Meyer I, Cohn J, de Araújo ESA, Hamid SS. Disparity in market prices for hepatitis C virus direct-acting drugs. Lancet Glob Health. 2015 Nov;3(11):e676-677.
43. Freeman J, Sallie R, Kennedy A, Hieu PTN, Freeman J, Jeffreys G, et al. High sustained virological response rates using generic direct acting antiviral treatment for hepatitis C, imported into Australia. J Hepatol. 2016 Jan 1;64(2):S209.
44. World Health Organization. Combating hepatitis B and C to reach elimination by 2030: advocacy brief [Internet]. Geneva: World Health Organization; 2016. Available from: http://www.who.int/hepatitis/publications/hep-elimination-by-2030-brief/en/.
45. Nguyen-Khac E. [Results and place of Fibroscan in the non-invasive diagnosis of hepatic fibrosis]. Rev Med Interne. 2007 Feb;28(2):94–102.
46. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015 Jul;63(1):237–64.
47. Houot M, Ngo Y, Munteanu M, Marque S, Poynard T. Systematic review with meta-analysis: direct comparisons of biomarkers for the diagnosis of fibrosis in chronic hepatitis C and B. Aliment Pharmacol Ther. 2016 Jan;43(1):16–29.
48. Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: Has anything changed for pregnant/lactating women? World J Hepatol. 2016 Apr 28;8(12):557–65.
49. University of Liverpool. Hepatitis drug interactions [Internet]. HEP Drug Interactions. 2017 [cited 2017 Jan 25]. Available from: http://www.hep-druginteractions.org/.
50. Lalezari JP, Nelson DR, Hyland RH, Lin M, Rossi SJ, Symonds WT, et al. Once daily sofosbuvir plus ribavirin for 12 and 24 weeks in treatment-naïve patients with HCV infection: the Quantum study [abstract, International Liver Congress 2013: 48th Annual Meeting of the European Association for the Study of the Liver, Amsterdam, Netherlands, 24 April–28 April 2013]. J Hepatol. 2013 Apr 1;58(Supplement 1):S346.
51. Osinusi A, Meissner EG, Lee Y-J, Bon D, Heytens L, Nelson A, et al. Sofosbuvir and ribavirin for hepatitis C genotype 1 in patients with unfavorable treatment characteristics: a randomized clinical trial. JAMA. 2013 Aug 28;310(8):804–11.
52. Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med. 2013 Jan 3;368(1):34–44.
53. Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May 16;368(20):1878–87.
54. Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Cofosbuvir for hepatitis C Genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May 16;368(20):1867–77.
55. FDA. U.S. Food & Drug Administration. FDA news release. FDA approves Epclusa for treatment of chronic hepatitis C virus infection [press release] [Internet]. Silver Spring : United States Food and Drug Administration; 2016 [cited 2017 Jan 26]. Available from: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm508915.htm.
56. Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med. 2015 Dec 31;373(27):2599–607.
57. Foster GR, Afdhal N, Roberts SK, Bräu N, Gane EJ, Pianko S, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med. 2015 Dec 31;373(27):2608–17.
58. Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med. 2015 Dec 31;373(27):2618–28.
59. Poordad F, Lawitz E, Gutierrez JA, Evans B, Howe A, Feng H-P, et al. C-swift: grazoprevir/elbasvir + софосбувир in cirrhotic and noncirrhotic, treatment-naive patients with hepatitis C virus genotype 1 infection, for durations of 4, 6 or 8 weeks and genotype 3 infection for durations of 8 or 12 weeks — abstract O006. J Hepatol. 2015 Apr 1;62:S192–3.
60. Gerlach JT, Diepolder HM, Zachoval R, Gruener NH, Jung M-C, Ulsenheimer A, et al. Acute hepatitis C: high rate of both spontaneous and treatment-induced viral clearance. Gastroenterology. 2003 Jul;125(1):80–8.
61. Lehmann M, Meyer MF, Monazahian M, Tillmann HL, Manns MP, Wedemeyer H. High rate of spontaneous clearance of acute hepatitis C virus genotype 3 infection. J Med Virol. 2004 Jul;73(3):387–91.
62. Nomura H, Sou S, Tanimoto H, Nagahama T, Kimura Y, Hayashi J, et al. Short-term interferon-alfa therapy for acute hepatitis C: a randomized controlled trial. Hepatology. 2004 May;39(5):1213–9.
63. Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, et al. Treatment of acute hepatitis C with interferon alfa-2b. N Engl J Med. 2001 Nov 15;345(20):1452–7.
64. Santantonio T, Fasano M, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, et al. Efficacy of a 24-week course of PEG-interferon alpha-2b monotherapy in patients with acute hepatitis C after failure of spontaneous clearance. J Hepatol. 2005 Mar;42(3):329–33.
65. Kamal S, Madwar M, He Q, Koziel M. Peginterferon alpha compared to conventional interferon alpha plus ribavirin combination therapy in symptomatic acute hepatitis C: a randomized trial of treatment onset, duration and cost effectiveness [abstract presented at 55th Annual Meeting of the American Association for the Study of Liver Diseases, Boston, Massachusetts, October 29–November 2, 2004]. Hepatology. 2004;40(Supplement S4):178A.
66. Deterding K, Grüner N, Buggisch P, Wiegand J, Galle PR, Spengler U, et al. Delayed versus immediate treatment for patients with acute hepatitis C: a randomised controlled non-inferiority trial. Lancet Infect Dis. 2013 Jun;13(6):497–506.
67. Mack CL, Gonzalez-Peralta RP, Gupta N, Leung D, Narkewicz MR, Roberts EA, et al. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents. J Pediatr Gastroenterol Nutr. 2012 Jun;54(6):838–55.
68. Wirth S, Lang T, Gehring S, Gerner P. Recombinant alfa-interferon plus ribavirin therapy in children and adolescents with chronic hepatitis C. Hepatology. 2002 Nov 1;36(5):1280–4.
69. Wirth S, Pieper-Boustani H, Lang T, Ballauff A, Kullmer U, Gerner P, et al. Peginterferon alfa-2b plus ribavirin treatment in children and adolescents with chronic hepatitis C. Hepatology. 2005 May;41(5):1013–8.
70. Wirth S, Ribes-Koninckx C, Calzado MA, Bortolotti F, Zancan L, Jara P, et al. High sustained virologic response rates in children with chronic hepatitis C receiving peginterferon alfa-2b plus ribavirin. J Hepatol. 2010 Apr;52(4):501–7.
71. Sokal EM, Bourgois A, Stéphenne X, Silveira T, Porta G, Gardovska D, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection in children and adolescents. J Hepatol. 2010 Jun;52(6):827–31.
72. González-Peralta RP, Kelly DA, Haber B, Molleston J, Murray KF, Jonas MM, et al. Interferon alfa-2b in combination with ribavirin for the treatment of chronic hepatitis C in children: efficacy, safety, and pharmacokinetics. Hepatology. 2005 Nov;42(5):1010–8.
73. El-Guindi MA. Hepatitis C Viral Infection in Children: Updated Review. Pediatr Gastroenterol Hepatol Nutr. 2016 Jun;19(2):83–95.
74. Hill A, Khoo S, Simmons B, Ford N. What is the minimum cost per person to cure HCV? In Kuala Lumpur, Malaysia: International Aids Society; 2013 [cited 2017 Jan 27]. Available from: http://pag.ias2013.org/abstracts.aspx?aid=3142.
75. World Health Organization. Notes on the design of a bioequivalance study: софосбувир. Guidance document, 13 October 2015 [Internet]. World Health Organization; 2015 [cited 2017 Jan 5]. Available from: https://extranet.who.int/prequal/.
76. Hill A, Golovin S, Dragunova J, Korologou-Linden RS. Virological response rates using generic direct acting antiviral treatment for hepatitis C, legally imported into Russia. AASLD Hepatol Poster Sess IV Abstr 1638-2112 [Internet]. 2017 Jan 25 [cited 2017 Jan 25]; Available from: http://onlinelibrary.wiley.com/doi/10.1002/hep.28800/full.
77. Derbala MF, Elsayad E, Hajelssedig O, Amer A, Eldweik N, Alkaabi SR, et al. Generic versus brand софосбувир-based therapy: safety and efficacy, real life data. AASLD Hepatol Poster Sess IV Abstr 1638-2112. 2016 Oct 1;64:811–1050.
78. Ogata N, Alter HJ, Miller RH, Purcell RH. Nucleotide sequence and mutation rate of the H strain of hepatitis C virus. Proc Natl Acad Sci U S A. 1991 Apr 15;88(8):3392–6.
79. Bartenschlager R, Lohmann V. Replication of hepatitis C virus. J Gen Virol. 2000 Jul;81(Pt 7):1631–48.
80. Ray SC, Thomas DL. Hepatitis C. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. 8th ed. Philadelphia: Elsevier Saunders; 2014. p. 1904–27.
81. Pawlotsky J-M. Hepatitis C virus resistance to direct-acting antiviral drugs in interferon-free regimens. Gastroenterology. 2016 Jul;151(1):70–86.
82. Ahmed A, Felmlee DJ. Mechanisms of hepatitis C viral resistance to direct acting antivirals. Viruses. 2015 Dec 18;7(12):6716–29.
83. Kattakuzhy S, Gross C, Teferi G, Jenkins V, Silk R, Akoth E, et al. A novel task shifting model to expand the HCV care continuum: the Ascend investigation [abstract of paper presented at International Liver Congress, Barcelona, Spain, 13–17 April 2015]. J Hepatol. 2016 Jan 1;64(2):S224–5.
84. Arora S, Thornton K, Murata G, Deming P, Kalishman S, Dion D, et al. Outcomes of treatment for hepatitis C virus infection by primary care providers. N Engl J Med. 2011 Jun 9;364(23):2199–207.






























