La strongyloïdose est une infection à Strongyloides stercoralis (Fig. 1), un vers rond qui existe surtout en milieu tropical ou subtropical, mais également dans les pays ayant un climat tempéré (Tableau 3).
- Chez les humains, deux espèces de nématodes parasites Strongyloides sont à l’origine de la strongyloïdose. Le pathogène le plus fréquent chez les humains étant S. stercoralis; S. fuelleborni est trouvé de façon sporadique en Afrique et en Papouasie-Nouvelle-Guinée.
- Les larves contagieuses de S. stercoralis peuvent se reproduire dans l’intestin et être à l’origine d’une auto-infection chez les patients positifs—l’auto-infection représente le fait majeur qui permet de différencier une strongyloïdose et d’autres helminthiases transmises par le sol macro parasitaires (STH). Les principales espèces à l’origine d’une infection chez les humains sont le vers rond (Ascaris lumbricoides), le trichocéphale (Trichuris trichiura), et l’ankylostome (Necator americanus et Ancylostoma duodenale) [1].
- Le vers adulte male vit uniquement dans la terre. Il n’est pas un parasite tissulaire et ne se rencontre pas chez l’hôte humain.
- Les femelles adultes sont très petites et presque transparentes. Elles mesurent approximativement 2.2–2.5 mm de long avec un diamètre de 50 µm et vivent enfoncées entre les entérocytes de l’intestin grêle chez l’humain.
- Les larves infectieuses peuvent se reproduire dans la terre contaminée et infecter les individus qui y sont exposés.
La strongyloïdose est différente de toutes les autres sources d’infections helminthiques transmises par le sol, car la femelle peut se reproduire par parthénogenèse dans l’intestin et produire des larves rhabditiformes.
- Les larves sont habituellement excrétées dans les selles, mais certaines peuvent murir jusqu’au stade filariforme et réinfecter l’hôte en pénétrant dans la dernière partie de l’intestin ou dans la peau péri-anale (cycle auto infectieux).
- En fonction de la réponse immunitaire de l’hôte, cela peut conduire à une dissémination et à une hyper infection (Tableau 4).


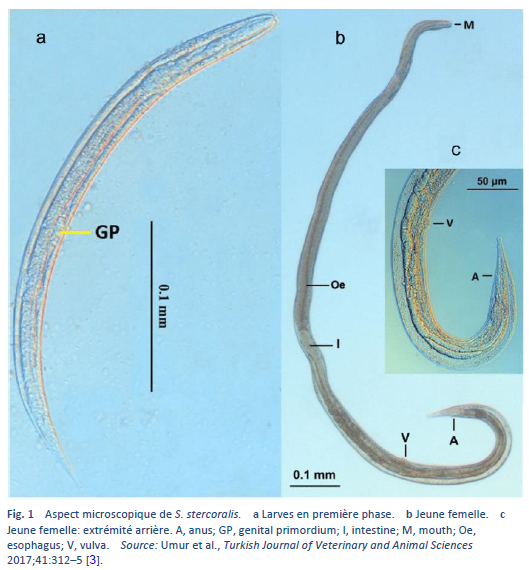
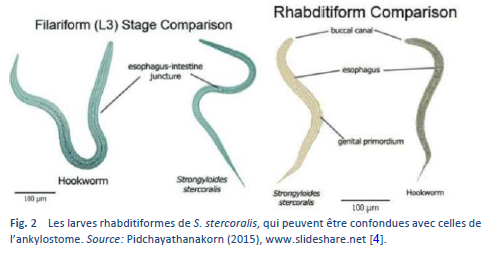
Il y a deux étapes importantes dans le cycle de vie du ver, l’étape rhabditiforme et l’étape filariforme (Figs. 2, 3).
2.1 Helminthe transmis par le sol
La strongyloïdose a une voie d’infection qui est similaire à celle d’autres helminthes transmis par le sol, mais elle nécessite d’autres outils diagnostiques en plus de la microscopie et nécessite un autre genre de traitement. Il y a eu une réduction notable de la prévalence de la strongyloïdose dans les régions où une chimiothérapie préventive par ivermectine a été introduite afin de limiter l’onchocercose ou la filariose lymphatique [6–10]. Le Comité OMS d’experts sur la sélection et l’utilisation de médicaments essentiels a ajouté l’ivermectine à sa liste, y compris en combinaison avec l’albendazole, pour le traitement de la strongyloïdose. Quelque 900 millions de personnes reçoivent actuellement ce traitement combiné dans le cadre des campagnes visant les maladies tropicales négligées (NTD ; neglected tropical disease) [11].
2.2 Pathophysiologie
Strongyloides stercoralis a un cycle de vie unique et complexe. La Figure 4 montre les voies de réplication du S. stercoralis.
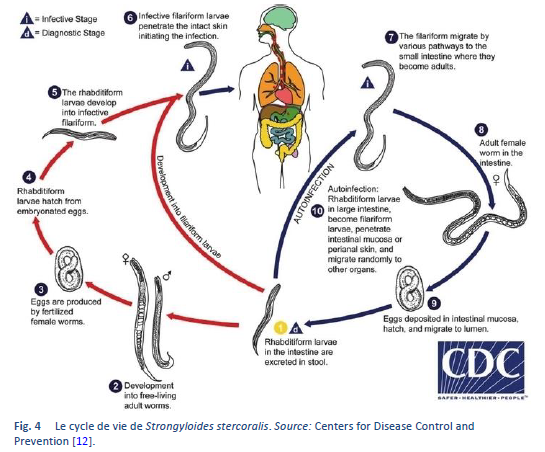
Le cycle de vie du Strongyloides est plus complexe que celui de la plupart des nématodes avec une alternance entre une génération libre et une génération parasite et une potentialité d’auto-infestation et de reproduction à l’intérieur de l’hôte. Deux types de cycle peuvent exister:
- Cycle à vie libre. Les larves rhabditiformes passées dans les selles peuvent se transformer deux fois et devenir des larves filariformes infestantes (développement direct) ou se transformer quatre fois et devenir des adultes libres, mâles ou femelles libres qui se reproduisent et pondent des oeufs dont éclosent des larves rhabditiformes. Ces dernières peuvent à leur tour devenir une nouvelle génération d’adultes libres ou des larves filariformes infestantes. Les larves filariformes pénètrent à l’intérieur de la peau de l’hôte humain pour initier le cycle parasitaire.
La phase génération libre du cycle de vie du nématode se limite uniquement à une génération [13]. Cette particularité de la strongyloïdose comporte des conséquences importantes tant pour le traitement des personnes infectées que pour la protection de l’environnement en évitant sa transmission, ce qui veut dire que c’est vital d’avoir un traitement d’éradication hautement efficace afin d’éliminer toutes les formes viables de l’organisme chez l’individu infecté.
- Cycle parasitaire. Les larves filariformes qui sont dans un sol souillé pénètrent dans la peau de l’humain et sont transportées dans les poumons où elles pénètrent dans les espaces alvéolaires; elles sont transportée à travers les bronches au pharynx où elles sont avalées ce qui leur permet d’atteindre l’intestin grêle. Là, elles se transforment deux fois et deviennent des vers femelles adultes. Les femelles vivent enfoncées dans l’épithélium de l’intestin grêle et par parthénogenèse elles pondent des oeufs qui donnent naissance à des larves rhabditiformes. Celles-ci peuvent passer dans les selles (voir Cycle à vie libre ci-dessus) ou causer une auto-infection. Dans ce cas, les larves rhabditiformes deviennent des larves filariformes infectantes qui peuvent pénétrer dans la muqueuse intestinale (auto-infection interne) ou dans la peau de la région péri-anale (auto-infection externe) ; dans les deux cas, les larves filariformes peuvent emprunter les voies décrites précédemment, en passant successivement aux poumons, aux bronches, au pharynx et à l’intestin grêle, où elles deviennent par maturation des adultes pour se disséminer largement dans l’organisme. Actuellement l’occurrence d’auto-infection chez l’humain est reconnue seulement dans le cas d’infections helminthiques par Strongyloides stercoralis et par Capillaria philippinensis. S. stercoralis est beaucoup plus fréquent et plus répandu. Dans le cas d’une strongyloïdose, l’auto-infection peut expliquer l’existence d’infections qui persistent pendant de nombreuses années chez les patients qui n’ont pas été en zones endémiques depuis longtemps (la durée la plus longue connue à ce jour est de 65 années) et la morbidité potentiellement mortelle de l’hyper-infection chez les patients immuno-immunodéprimés, les deux étant inhabituels pour des infections par des vers.
2.3 Fardeau de la maladie et endémie
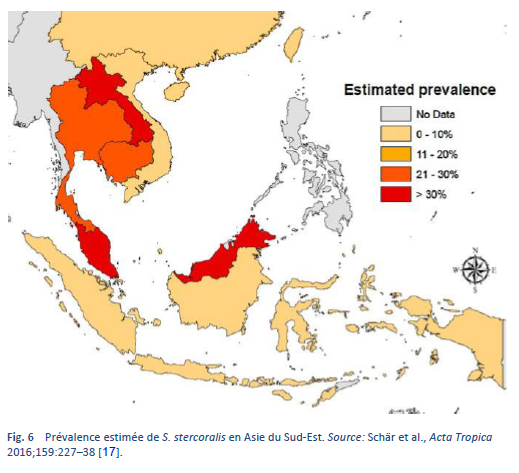
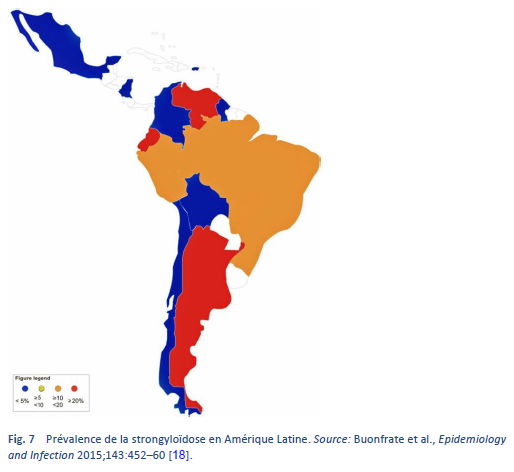
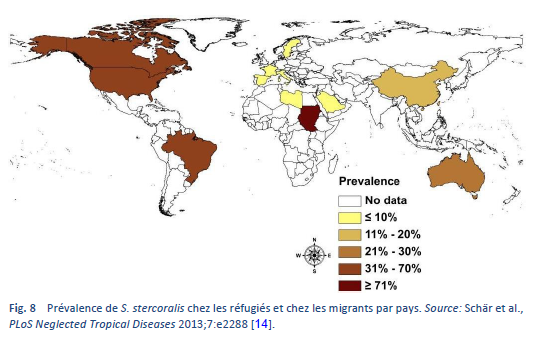
La strongyloïdose est endémique dans les régions tropicales et subtropicales (Figs. 5–8) et sa prévalence est probablement beaucoup plus élevée que le chiffre de cent millions de personnes cite auparavant: des estimations plus élevées allant jusqu’à 370 millions de personnes ont été évoquées dans la littérature [2]. Elle est également largement répandue en Europe de l’Est et on a fait état de foyers disséminés de l’infection chez les personnes âgées dans la région méditerranéenne.
Nous savons peu de choses en ce qui concerne la prévalence de l’infection et encore moins concernant le poids clinique en termes de morbidité. Si elle est effectivement largement répondue, le risque d’hyper-infection iatrogène (chez un patient sous traitement immuno-supresseur relève d’un défi. Il est estimé que jusqu’à 40% de la population dans certains régions des tropiques et des sub-tropiques seraient infectées [14].
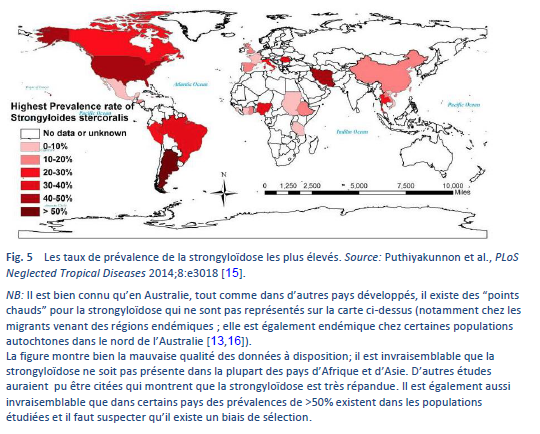
Les infections chez les migrants peuvent survenir dans n’importe quel pays et peuvent représenter un danger potentiel au niveau mondial. N’importe quel cabinet médical peut ainsi être confronté à des cas de la maladie.
2.4 Facteurs de risque et groupes à risque d’infection
Le plus grand facteur de risque en général est représenté par un status socio-économique défavorable dans un environnement où la strongyloïdose est endémique.
- La pauvreté, les pauvres conditions de logement, une mauvaise condition d’hygiène ; marcher pieds nus, vivre dans un milieu où la défécation en plein air est pratiquée
- Les prisonniers de guerre
- Le status de réfugié—en particulier les réfugiés venant des pays où la strongyloïdose est endémique
- Voyageurs à destination ou en provenance de régions endémiques
- Certaines études ont mentionné comme facteur de risque le sexe masculin, un âge avancé, une transmission animal-humain, les climats humides dans les régions tropicales ou subtropicales [17]
2.5 Facteurs de risque et groupes à risque d’une infection disséminée
- Immunosuppresseurs—en particulier corticostéroïdes, mais aussi tacrolimus et agents chimio thérapeutiques
- Patients avec immunité cellulaire altérée
- Infection au HTLV type 1
- Néoplasmes, surtout hématologiques (lymphome, leucémie)
- Greffe d’organe (receveur d’allogreffe du rein)
- Facteurs de risqué mineurs/possibles: maladies du collagène vasculaires, malabsorption et malnutrition, maladie rénale en phase terminale, diabète de type 2, facteurs locaux, diverticules et anses borgnes (strongyloïdose qui persiste dans un boucle de l’intestin)
2.6 Strongyloïdose chez les patients immunodéprimés
Les diverses formes de strongyloïdose peuvent présenter des variations allant d’asymptomatique à sévère et peuvent conduire à un syndrome d’hyper-infection et à une maladie disséminée qui sont associés à un taux de mortalité élevé chez les patients immunodéprimés.
De nombreux patients atteints d’arthrose rhumatoïde, d’asthme bronchique et de glomérulonéphrite vivent sous les tropiques où ils sont sous traitement de stéroïdes au long cours. Ils peuvent également acheter les stéroïdes directement à la pharmacie.
La strongyloïdose n’est pas une infection opportuniste importante associée avec le SIDA (AIDS), mais c’est une infection opportuniste associée au virus T-lymphotropique humain type 1 (HTLV-I) [19]. Même si les patients avec le virus du VIH/SIDA (HIV/AIDS) peuvent souffrir d’une strongyloïdose disséminée ou d’un syndrome d’hyper-infection, les études observationnelles n’ont pas pu démontrer un risque accru dans cette population [20].
2.7 Mortalité et morbidité
La strongyloïdose aiguë est souvent asymptomatique et peut rester cachée pendant des décennies. Les patients immuno-compétents présentent souvent une infection chronique asymptomatique pendant toute leur vie s’ils ne sont pas traités.
Les infections chroniques représentent potentiellement une cause importante de morbidité non déclarée officiellement. Il y également un manque d’outils diagnostiques efficaces, qui sont souvent encombrants et qui ont un faible niveau de sensibilité, ce qui veut dire que la vraie prévalence de l’infection et son taux de morbidité ne sont en effet pas connus. La strongyloïdose est considérée comme une maladie rare et de ce fait il n’y a eu que peu d’investissement dans des études diagnostiques ou épidémiologiques, notamment chez les enfants.
La strongyloïdose cliniquement apparente peut avoir des symptômes cutanés, gastro-intestinaux et pulmonaires.
L’évidence souligne la nécessité de surveiller les patients présentant une éosinophilie même si ceux-ci n’ont pas vécu ni voyagé dans une région endémique [22].
Plusieurs méthodes diagnostique ont été développées au fil des années; leur usage dépend de leur disponibilité localement ainsi que du niveau d’expertise à disposition : string tests, aspiration duodénale, biopsie duodénale, lavage broncho-alvéolaire (BAL), tests immuno-diagnostiques et examens répétés des selles par divers moyens.
La prévalence globale de l’infection par Strongyloides stercoralis a longtemps été sous-estimée, probablement en raison de la confiance dans l’examen microscopique direct des selles ainsi que dans la procédure Kato–Katz, qui sont souvent utilisés dans les études sur la prévalence mais qui ne sont pas aptes à détecter S. stercoralis [23]. Les examens de selles utilisés le plus souvent ont une très faible sensibilité. L’examen par microscopie peut être amélioré par l’examen de plusieurs échantillons de selles, ainsi que par l’utilisation de techniques de concentration [24], mais la sensibilité demeure faible.
Dans les pays à revenu bas/intermédiaire, ainsi que dans les pays développés, le nombre de professionnels de la santé ayant un bon niveau d’expérience dans l’identification microscopique de parasites semble diminuer.
- Le recours à des diagnostics moléculaires, toujours à la traîne derrière la virologie ou la bactériologie, devrait augmenter dans le domaine de la parasitologie.
- Un niveau de sensibilité optimal du diagnostic moléculaire de S. stercoralis n’a pas encore été atteint.
- Le diagnostic moléculaire ne remplacera probablement pas complètement les autres méthodes diagnostiques.
- Les analyses sérologiques montrent actuellement le niveau de sensibilité le plus grand et sont importantes dans le cadre du dépistage de S. stercoralis et l’évaluation de la guérison [23].
Lodh et al. [25] ont montré que l’ADN de S. stercoralis (DNA) peut être mis en évidence dans l’urine. Quand ils seront à disposition et s’ils montrent un niveau de sensibilité suffisant, les tests à base d’échantillons d’urine pourraient s’avérer très utiles car ils sont beaucoup moins exigeants en main-d’œuvre et en ressources et le risque pour la santé inhérent à l’examen de selles fraîches serait éliminé [25].
4.1 Examens des selles
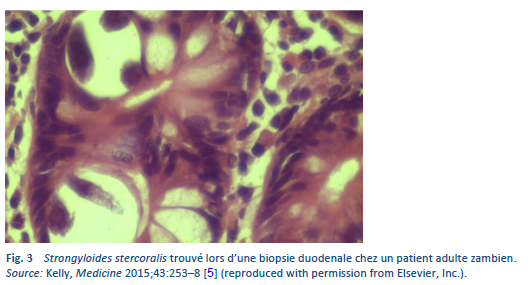
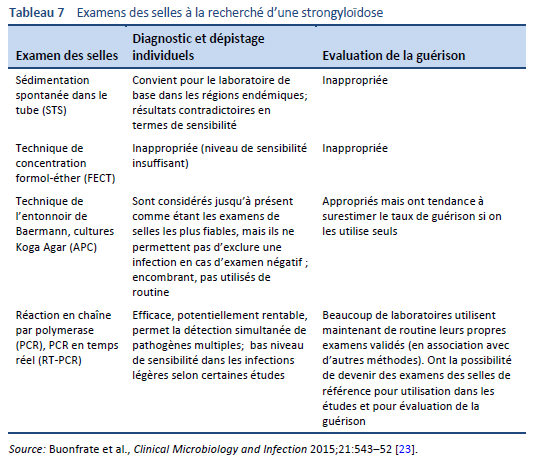
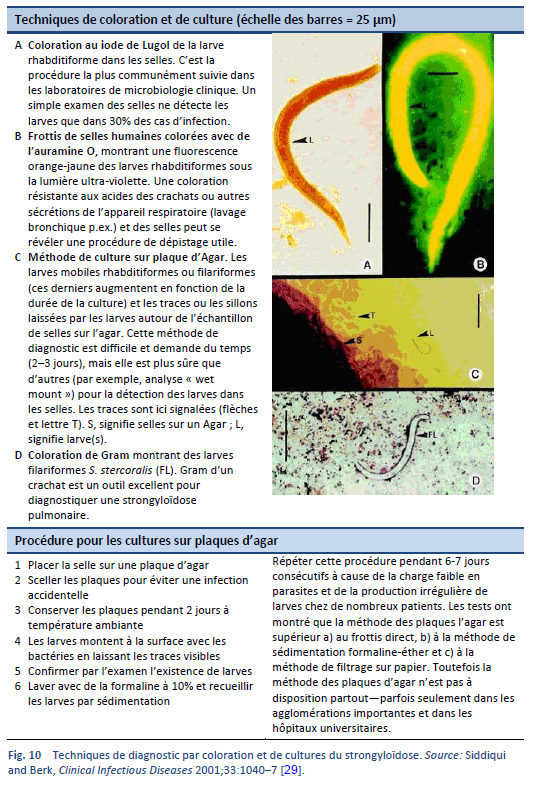
Un diagnostic définitif de strongyloïdose est posé par la découverte microscopique de larves dans les selles, dans le liquide duodénal, et occasionnellement dans d’autres tissus ou liquides (Tableaux 7, 8; Figs. 10, 11). Un seul examen peut cependant s’avérer peu sensible en raison d’une densité de larves basse [26].
Il existe plusieurs techniques pour identifier les larves dans les selles par microscopie:
- Microscopie après concentration
- Technique ou méthode de Baermann (encore considérée comme la méthode de choix (« gold standard »))
- Technique de concentration par Formalin–ether (FECT)
- Microscopie après culture
- Technique de Harada–Mori avec filtre de papier
- Technique de Koga avec cultures sur agar
- Utilisation du microscope stéréoscopique afin de visualiser les larves sur les plaques d’agar
- Frottis direct des selles dans une solution saline à coloration au iode de Lugol
L’usage de ces méthodes dépend de la disponibilité des ressources locales et, en particulier, du niveau d’expertise du microscopiste localement.
L’analyse des selles pour Strongyloides par la méthode de Baermann et la culture Koga agar représentent les meilleures méthodes de diagnostic par les selles sur le terrain actuellement. Ces méthodes permettent la détection du parasite avec un plus grand taux de sensibilité que les autres examens des selles.
- La PCR est prometteuse mais pas encore standardisée; il existe des craintes en ce qui concerne sa sensibilité qui montre des variations entre les différentes études.
- Anamnart et al. [27] ont étudié la stimulation de l’excrétion des larves de S. stercoralis dans les selles par l’administration orale d’une dose unique de 400 mg d’albendazole et ont suggéré que l’utilisation de l’albendazole en combinaison avec la technique de concentration formol-éther (FECT) pourrait être utile chez les patients avec une strongyloïdose suspectée asymptomatique—y compris chez les patients avec une diarrhée chronique inexpliquée, chez les patients de retour de voyage dans les régions endémiques et chez les patients chez qui les autres tests parasitologiques sont restés négatifs tests [27].


4.2 Sérodiagnostic de la strongyloïdose
Les tests sérologiques ont montré un niveau de sensibilité accru par comparaison avec la méthode de Baermann et les cultures sur plaque d’agar, mais certains auteurs ont exprimé des doutes quant à leur niveau de spécificité [20].
- Beaucoup de tests sérologiques ont montré une réaction croisée avec les parasites filariformes, les schistosome et l’Ascaris lumbricoides, diminuant ainsi la spécificité de ces tests.
- Il est parfois difficile à distinguer entre les cas actifs et les cas historiques car les anticorps peuvent persister pendant un certain temps.
- Des tests sérologiques plus spécifiques utilisant les antigènes recombinants ont été développés et sont en cours de développement et sont à disposition dans certains laboratoires d’analyse.
- Les tests sérologiques montrent typiquement une nette baisse dans les titres à 6–12 mois après l’éradication du parasite et peuvent ainsi être utilisés pour l’évaluation de la guérison [20].
La méthode sérodiagnostique la plus commode et la plus utilisée est le dosage immuno-enzymatique (ELISA) qui permet d’identifier l’immunoglobuline G (IgG) sur un extrait brut de larves filariformes. ELISA est exigeant en main-d’œuvre et nécessite un certain niveau d’infrastructures en termes de laboratoire pour sa pratique ainsi que pour l’interprétation des résultats et ceci a freiné son applicabilité, notamment dans les régions où la strongyloïdose est endémique [26]. De plus, les tests sérologiques ne sont pas très utiles dans le cadre du suivi après guérison dans les régions endémiques vu la possibilité de réinfection.
4.3 Diagnostic différentiel
De nombreuses pathologies produisent des symptômes similaires, telles les diarrhées aiguës et chroniques et les malabsorptions, les autres causes d’éosinophilie et les autres causes de septicémie sévère à gram négatif. Il faut penser aux affections suivantes lors du diagnostic différentiel:
- Infections intestinales—amibiases, colite bactérienne, Shigella, Campylobacter, Yersinia, Clostridium difficile; cf le guideline de l’OMG (WGO) sur les diarrhées aiguës, tableau 4 [30].
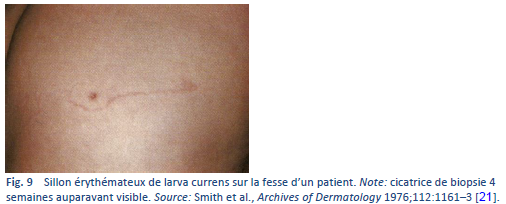
- Infections à ankylostomes non humains avec production de larva migrans cutanées—qu’on peut distinguer des larva currens du S. stercoralis par l’absence de desquamation, la migration rapide, l’atteinte du périnée et les bandes larges d’urticaires des larva currens.
- Maladies inflammatoires de l’intestin.
- Syndrome de l’intestin irritable.
- Troubles abdominaux fonctionnels.
- Les médicaments—les anti-inflammatoires non stéroïdiens (AINS/NSAID) et beaucoup d’autres—peuvent être la cause d’une éosinophilie.
Le point fondamental dans le diagnostic est de penser à une strongyloïdose comme diagnostic potentiel et d’identifier le parasite directement ou par des tests sérologiques/moléculaires.
- On ne peut s’attendre à une guérison spontanée en raison du cycle de vie unique auto infectant du parasite.
- Il convient de traiter tous les patients avec une strongyloïdose, même si celle-ci est asymptomatique, en raison du risque d’hyper infection—une complication potentiellement mortelle.
- Un diagnostic fiable chez les patients à risque est nécessaire afin de pouvoir reconnaître la maladie et la traiter avant d’instaurer un traitement immunosuppresseur ou chez les patients avec HTLV-I ou le virus de l’immunodéficience humaine (VIH/HIV).
- Si un traitement immunosuppresseur d’urgence est nécessaire chez un patient avec une strongyloïdose non diagnostiquée auparavant, et que des tests diagnostiques ne peuvent pas être effectués rapidement (peu d’hôpitaux sont à même d’effectuer une sérologie le jour même), il faut envisager d’instaurer un traitement présomptif par ivermectine.
- La guérison peut être obtenue avec une dose unique d’ivermectine.
- Un échec du traitement par ivermectine est généralement dû à une déficience du système immunitaire de l’hôte (fréquente chez les patients avec une infection HTLV-I) [26,31].
5.1 Strongyloïdose non compliquée
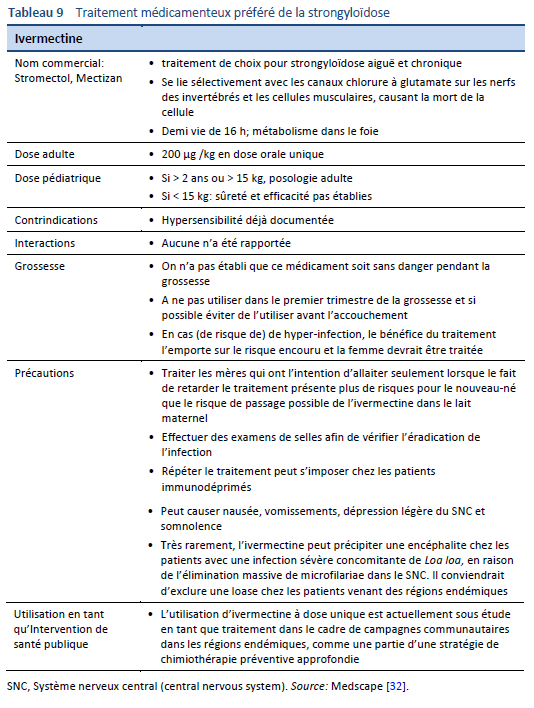
Le traitement de la strongyloïdose (Tableau 9) est difficile car, contrairement aux autres infections par helminthes, les Strongyloides doivent être complètement éradiqués.
- Une éradication complète est difficile à obtenir en raison de la faible charge de larves et de la production de larves irrégulière.
- Une guérison complète ne peut pas être prononcée sur la seule base d’un examen négatif des selles—il faut également pouvoir constater une diminution des titres sérologiques et de l’éosinophilie.
- Une recherche unique de strongyloïdose dans les selles s’est révélée négative dans le 70% des cas connus de strongyloïdose. Un diagnostic fiable nécessite plusieurs examens de selles, probablement un minimum de trois, avec un technique fiable.
- Le suivi est un problème dans les régions tropicales et peut devenir la méthode de choix uniquement si les examens de selles sont à disposition.
- Albendazole (400 mg 2x/jour pendant 3 jours) est parfois utilisé comme traitement alternatif ou en tant que traitement de compromis [33,34]. Cependant, l’efficacité de l’albendazole dans le traitement de la strongyloïdose a été démontré très basse en comparaison à celle de l’ivermectine et il ne devrait être utilisé que s’il n’existe aucune alternative [35].
5.2 Hyper-infection ou infection disséminée
Ces termes peuvent probablement être employée de manière indifférenciée, bien que certains auteurs prétendent qu’ils décrivent deux aspects différents de l’infection (hyper infection: niveau élevé de larves dans les parties du corps habituelles; dissémination: présence de larves dans n’importe quelle partie du corps, même dans les parties qui ne sont d’habitude pas concernées dans le cadre du cycle parasitique). En effet, les deux sont associées à une charge en parasites très élevée et une extension rapide de l’infection—d’ordinaire chez des patients immunodéprimés et souvent associées à un traitement par corticostéroïdes. L’hyper infection comporte un risque élevé de septicémie à gram négatif et en conséquence on utilise des antibiotiques à large spectre en particulier pour prévenir une méningite bactérienne.
Ivermectine a été administrée avec succès par voie sous cutanée chez les patients gravement atteints d’une hyper infection ou d’une strongyloïdose disséminée et qui ne peuvent pas prendre leurs médicaments par voie orale [36]. L’ivermectine est à administrer quotidiennement pendant au moins 14 jours, la durée totale du traitement dépendant du moment où l’examen microscopique des liquides corporels pour les larves précédemment positifs devient négatif (selles ou urines ou autres en cas d’hyper infection) [37].
5.3 Prévention et contrôle de la maladie
On prévient l’infection en évitant le contact direct de la peau avec un sol contenant des larves infectieuses. Les personnes à risque, spécialement les enfants, devraient porter des sandales lorsqu’elles marchent sur des sols souillés. Il faut identifier les patients à risque et conduire des tests diagnostiques appropriés avant de commencer une thérapie immunosuppressive.
Les personnes en contact familier avec des patients ne risquent pas d’infection. Un traitement approprié des excréments humains réduit substantiellement la prévalence de la strongyloïdose.
Il n’existe ni prophylaxie ni vaccin.
Il faut observer les précautions de base chez les patients hospitalisés pour strongyloïdose. Toutes les personnes entrant potentiellement en contact avec les selles de ces patients devraient porter des gants et des blouses et se laver les mains soigneusement [20].
- Détection précoce de l’infection par S. stercoralis et un traitement efficace.
- Dépistage des patients à risque pour une strongyloïdose chronique avant d’instaurer un traitement immunosuppresseur, en particulier par les corticostéroïdes.
- Une chimiothérapie préventive pour l’infection par S. stercoralis n’est pas encore recommandée par l’OMS et elle n’est pas non plus incluse dans la stratégie de contrôle pour les infections à helminthes transmises par le sol. Des effets bénéfiques ont cependant été démontrés sur la prévalence de S. stercoralis avec des programmes d’élimination de filariose lymphatique et d’onchocercose utilisant des chimiothérapies préventives à répétition avec ivermectine/albendazole ou avec ivermectine seule [38].
- Une évaluation appropriée d’un traitement utilisant les examens de selles (avec des tests hautement sensibles tels la technique de Baermann, culture sur papier filtre et culture sur plaques d’agar) et un suivi par sérologie spécifique pour les IgG pendant 1–2 ans [39].
- Les programmes de traitement présomptif chez les réfugiés venant de pays où les parasites intestinaux sont endémiques (ankylostomes, Trichuris trichiura, Ascaris lumbricoides, et Strongyloides stercoralis) [40].
- La mise en place et l’usage des systèmes de l’élimination des déchets sûrs demeurent importants [41].
- Porter les chaussures pourrait interrompre la transmission de la strongyloïdose mais il existe certaines régions où le port de chaussures n’est pas acceptable sur le plan culturel, en particulier dans les pays chauds, et il faudrait donc évaluer d’autres méthodes de contrôle de l’environnement [42]. Les gens qui n’ont pas de chaussures n’ont souvent pas non plus de chaises et les fesses deviennent ainsi un moyen de transmission.
- Dépister une résistance aux antihelminthiques à un stade précoce. Il existe différents méthodes in vivo et in vitro pour confirmer une suspicion de résistance et des tests de laboratoires spécifiques peuvent être utilisés sur le terrain afin de confirmer ou non une suspicion de résistance—par exemple comme ceux décrits dans les recommandations et les guidelines de l’étude Advancement of Veterinary Parasitology (WAAVP) [43–45].
L’étude de Forrer et al. [46] a montré qu’un traitement communautaire par ivermectine à dose unique pour S. stercoralis associé à des mesures d’assainissement réduit efficacement le risque d’infection dans les communautés rurales au Cambodge, avec plus de 85% de villageois restant négatifs une année après traitement. Le contrôle de l’infection est faisable et hautement bénéfique, en particulier en combinaison avec une amélioration de l’état sanitaire [46].
L’étude de Khieu et al. [47] a permis de montrer que les individus disposant d’une latrine chez eux sont infectés par S. stercoralis beaucoup moins fréquemment que ceux qui n’en disposent pas. Le risque attribuable dans la population pourrait être réduit par 39% si tous les participants utilisaient une latrine pour la défécation [17,47].
Croker et She ont noté que la prévalence élevée d’éosinophilie parmi les personnes avec une infection par Strongyloides latente dans le comté de Los Angeles souligne l’importance d’un dépistage chez les individus avec éosinophilie chez qui les causes les plus habituelles ont été exclues [48].
Le StrongNet [38], un réseau international visant à améliorer le diagnostic et l’accès au traitement pour contrôler la strongyloïdose, préconise un meilleur diagnostic approprié aux conditions locales ainsi qu’une disponibilité d’ivermectine à grande échelle pour contrôler la strongyloïdose dans les régions endémiques. Grâce à leurs efforts, l’ivermectine a récemment été inclue dans la liste des médicaments essentiels de l’OMS (WHO Essential Medicines List) pour le traitement de la strongyloïdose ; l’objectif final est de développer une stratégie de contrôle de santé publique et d’inclure S. stercoralis dans la stratégie de chimiothérapie préventive de l’OMS pour les infections à helminthes transmises par le sol.
5.4 Prognostic
Les strongyloïdose aiguës et chroniques ont un bon pronostic. Cependant si elle n’est pas traitée, l’infection peut subsister pour le reste de la vie du patient à cause du cycle d’auto-infection. L’absence prolongée d’une zone endémique ne garantit pas une absence d’infection. Une infection disséminée aiguë est d’ordinaire fatale et souvent elle ne répond pas au traitement.
L’immunosuppression constitue un risque pour une accélération de l’auto-infection dans la strongyloïdose chronique. Cela peut entraîner un syndrome de type sepsis, une hyper infection par S. stercoralis et la dissémination des larves aux organes distants tels le système nerveux central avec une méningite à S. stercoralis [49].
6.1 Abréviations
6.2 Guideline de référence (« gold standard »)
6.3 Références
1. World Health Organization. Soil-transmitted helminth infections [Internet]. Geneva: World Health Organization; 2017 [accessed 2018 Mar 13]. Available from: http://www.who.int/mediacentre/factsheets/fs366/en/.
2. Bisoffi Z, Buonfrate D, Montresor A, Requena-Méndez A, Muñoz J, Krolewiecki AJ, et al. Strongyloides stercoralis: a plea for action. PLoS Negl Trop Dis 2013 May 9;7(5):e2214.
3. Umur Ş, Meral Y, Bölükbaş CS, Gürler AT, Açici M. First clinical Strongyloides stercoralis case in a dog in Turkey. Turk J Vet Anim Sci 2017;41:312–5.
4. Pidchayathanakorn P. Nemathelminthes [46 slides] [Internet] 2015 [accessed 2018 Mar 13]. Available from: https://www.slideshare.net/PaemikaPidchayathana/nemathelminthes-review.
5. Kelly P. Infectious diarrhoea. Med Abingdon 2015 May;43(5):253–8.
6. Knopp S, Mohammed KA, Rollinson D, Stothard JR, Khamis IS, Utzinger J, et al. Changing patterns of soil-transmitted helminthiases in Zanzibar in the context of national helminth control programs. Am J Trop Med Hyg 2009 Dec;81(6):1071–8.
7. Anselmi M, Buonfrate D, Guevara Espinoza A, Prandi R, Marquez M, Gobbo M, et al. Mass administration of ivermectin for the elimination of onchocerciasis significantly reduced and maintained low the prevalence of Strongyloides stercoralis in Esmeraldas, Ecuador. PLoS Negl Trop Dis 2015 Nov;9(11):e0004150.
8. Barda B, Albonico M, Buonfrate D, Ame SM, Ali S, Speich B, et al. Side benefits of mass drug administration for lymphatic filariasis on Strongyloides stercoralis. Prevalence on Pemba Island, Tanzania. Am J Trop Med Hyg 2017 Sep;97(3):681–3.
9. Bisoffi Z. Human strongyloidiasis: time to act? Paper presented at the 27th European Congress of Clinical Microbiology And Infectious Diseases (ECCMID), Vienna, April 2017. Basel, Switzerland: European Society of Clinical Microbiology and Infectious Diseases; 2017. (ESCMID eLibrary). Available from: www.escmid.org/escmid_publications/escmid_elibrary/material/?mid=44339.
10. World Health Organization. What are intestinal worms (soil transmitted helminthiasis)? [Internet]. Geneva: World Health Organization; [accessed 2018 Mar 13]. Available from: http://www.who.int/intestinal_worms/disease/en/.
11. Bundy DAP, Appleby LJ, Bradley M, Croke K, Hollingsworth TD, Pullan R, et al. Mass deworming programs in middle childhood and adolescence. In: Bundy DAP, de Silva N, Horton S, Jamison DT, Patton GC, editors. Child and Adolescent Health and Development [Internet]. 3rd ed. Washington, DC: International Bank for Reconstruction and Development / World Bank Group; 2017. p. 165–82. (Disease Control Priorities; vol. 8). Available from: http://dcp-3.org/chapter/2437/deworming.
12. Centers for Disease Control and Prevention. Parasites — Strongyloides [Internet]. Atlanta, GA: Centers for Disease Control and Prevention; 2015 [accessed 2018 Mar 13]. Available from: https://www.cdc.gov/parasites/strongyloides/biology.html.
13. Ross KE, Bradbury RS, Garrard TA, O’Donahoo FJ, Shield JM, Page W, et al. The National Strongyloides Working Group in Australia 10 workshops on: commendations and recommendations. Aust N Z J Public Health 2017 Jun;41(3):221–3.
14. Schär F, Trostdorf U, Giardina F, Khieu V, Muth S, Marti H, et al. Strongyloides stercoralis: global distribution and risk factors. PLoS Negl Trop Dis 2013;7(7):e2288.
15. Puthiyakunnon S, Boddu S, Li Y, Zhou X, Wang C, Li J, et al. Strongyloidiasis — an insight into its global prevalence and management. PLoS Negl Trop Dis 2014 Aug;8(8):e3018.
16. Kearns TM, Currie BJ, Cheng AC, McCarthy J, Carapetis JR, Holt DC, et al. Strongyloides seroprevalence before and after an ivermectin mass drug administration in a remote Australian Aboriginal community. PLoS Negl Trop Dis 2017 May;11(5):e0005607.
17. Schär F, Giardina F, Khieu V, Muth S, Vounatsou P, Marti H, et al. Occurrence of and risk factors for Strongyloides stercoralis infection in South-East Asia. Acta Trop 2016 Jul;159:227–38.
18. Buonfrate D, Mena MA, Angheben A, Requena-Mendez A, Muñoz J, Gobbi F, et al. Prevalence of strongyloidiasis in Latin America: a systematic review of the literature. Epidemiol Infect 2015 Feb;143(3):452–60.
19. Crompton DWT, Engels D, Savioli L, Montresor A, Neira M, editors. Preparing to control schistosomiasis and soil-transmitted helminthiasis in the twenty-first century [special double issue of journal]. Acta Trop 2003;86(2–3):121–347.
20. Centers for Disease Control and Prevention. Parasites — Strongyloides. Resources for health professionals [Internet]. Atlanta, GA: Centers for Disease Control and Prevention; 2016 [accessed 2018 Mar 13]. Available from: https://www.cdc.gov/parasites/strongyloides/health_professionals/index.html.
21. Smith JD, Goette DK, Odom RB. Larva currens. Cutaneous strongyloidiasis. Arch Dermatol 1976 Aug;112(8):1161–3.
22. Repetto SA, Ruybal P, Solana ME, López C, Berini CA, Alba Soto CD, et al. Comparison between PCR and larvae visualization methods for diagnosis of Strongyloides stercoralis out of endemic area: A proposed algorithm. Acta Trop 2016 May;157:169–77.
23. Buonfrate D, Formenti F, Perandin F, Bisoffi Z. Novel approaches to the diagnosis of Strongyloides stercoralis infection. Clin Microbiol Infect 2015 Jun;21(6):543–52.
24. Knopp S, Mgeni AF, Khamis IS, Steinmann P, Stothard JR, Rollinson D, et al. Diagnosis of soil-transmitted helminths in the era of preventive chemotherapy: effect of multiple stool sampling and use of different diagnostic techniques. PLoS Negl Trop Dis 2008;2(11):e331.
25. Lodh N, Caro R, Sofer S, Scott A, Krolewiecki A, Shiff C. Diagnosis of Strongyloides stercoralis: detection of parasite-derived DNA in urine. Acta Trop 2016 Nov;163:9–13.
26. van Doorn HR, Koelewijn R, Hofwegen H, Gilis H, Wetsteyn JCFM, Wismans PJ, et al. Use of enzyme-linked immunosorbent assay and dipstick assay for detection of Strongyloides stercoralis infection in humans. J Clin Microbiol 2007 Feb;45(2):438–42.
27. Anamnart W, Pattanawongsa A, Intapan PM, Maleewong W. Albendazole stimulates the excretion of Strongyloides stercoralis larvae in stool specimens and enhances sensitivity for diagnosis of strongyloidiasis. J Clin Microbiol 2010 Nov;48(11):4216–20.
28. Tello R, Terashima A, Marcos LA, Machicado J, Canales M, Gotuzzo E. Highly effective and inexpensive parasitological technique for diagnosis of intestinal parasites in developing countries: spontaneous sedimentation technique in tube. Int J Infect Dis 2012 Jun;16(6):e414-416.
29. Siddiqui AA, Berk SL. Diagnosis of Strongyloides stercoralis infection. Clin Infect Dis 2001 Oct 1;33(7):1040–7.
30. World Gastroenterology Organisation. Acute diarrhea in adults and children: a global perspective [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2012 [accessed 2018 Mar 13]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/acute-diarrhea/acute-diarrhea-english.
31. Varatharajalu R, Kakuturu R. Strongyloides stercoralis: current perspectives. Rep Parasitol 2016;(5):23–33.
32. Medscape. Ivermectin (Rx). Brand and other names: Stromectol. Dosage forms & strengths. [Internet]. Medscape; [accessed 2018 Mar 13]. Available from: https://reference.medscape.com/drug/stromectol-ivermectin-342657.
33. Horton J. Albendazole: a review of anthelmintic efficacy and safety in humans. Parasitology 2000;121 Suppl:S113-132.
34. Venkatesan P. Albendazole. J Antimicrob Chemother 1998 Feb;41(2):145–7.
35. Henriquez-Camacho C, Gotuzzo E, Echevarria J, White AC, Terashima A, Samalvides F, et al. Ivermectin versus albendazole or thiabendazole for Strongyloides stercoralis infection. Cochrane Database Syst Rev 2016 Jan 18;(1):CD007745.
36. Chiodini PL, Reid AJ, Wiselka MJ, Firmin R, Foweraker J. Parenteral ivermectin in Strongyloides hyperinfection. Lancet 2000 Jan 1;355(9197):43–4.
37. Boulware DR. Strongyloides infection. BMJ Best Pract [Internet]. Available from: http://bestpractice.bmj.com/best-practice/monograph/907/treatment/step-by-step.html.
38. Albonico M, Becker SL, Odermatt P, Angheben A, Anselmi M, Amor A, et al. StrongNet: An international network to improve diagnostics and access to treatment for strongyloidiasis control. PLoS Negl Trop Dis 2016 Sep;10(9):e0004898.
39. Luvira V, Watthanakulpanich D, Pittisuttithum P. Management of Strongyloides stercoralis: a puzzling parasite. Int Health 2014 Dec;6(4):273–81.
40. Maskery B, Coleman MS, Weinberg M, Zhou W, Rotz L, Klosovsky A, et al. Economic analysis of the impact of overseas and domestic treatment and screening options for intestinal helminth infection among US-bound refugees from Asia. PLoS Negl Trop Dis 2016 Aug;10(8):e0004910.
41. Nelson GS. [Review of D.I. Grove, A history of human helminthology (1990).]. J Helminthol 1991;65(2):120.
42. Ross KE, O’Donahoo FJ, Garrard TA, Taylor MJ. Simple solutions to Strongyloides stercoralis infection. BMJ Clin Res Ed 2013 Oct 22;347:f6294.
43. European Medicines Agency Committee for Medicinal Products for Veterinary Use (CVMP). Reflection paper on anthelmintic resistance [Internet]. London: European Medicines Agency; 2017 [accessed 2018 Mar 13]. Available from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_001563.jsp&mid=WC0b01ac058002ddc2.
44. Wood IB, Amaral NK, Bairden K, Duncan JL, Kassai T, Malone JB, et al. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) second edition of guidelines for evaluating the efficacy of anthelmintics in ruminants (bovine, ovine, caprine). Vet Parasitol 1995 Jun;58(3):181–213.
45. Coles GC, Bauer C, Borgsteede FH, Geerts S, Klei TR, Taylor MA, et al. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet Parasitol 1992 Sep;44(1–2):35–44.
46. Forrer A, Khieu V, Schindler C, Schär F, Marti H, Char MC, et al. Ivermectin treatment and sanitation effectively reduce Strongyloides stercoralis infection risk in rural communities in Cambodia. PLoS Negl Trop Dis 2016 Aug;10(8):e0004909.
47. Khieu V, Schär F, Forrer A, Hattendorf J, Marti H, Duong S, et al. High prevalence and spatial distribution of Strongyloides stercoralis in rural Cambodia. PLoS Negl Trop Dis 2014 Jun;8(6):e2854.
48. Croker C, She R. Increase in reports of Strongyloides infection — Los Angeles County, 2013–2014. MMWR Morb Mortal Wkly Rep 2015 Aug 28;64(33):922–3.
49. Keiser PB, Nutman TB. Strongyloides stercoralis in the immunocompromised population. Clin Microbiol Rev 2004 Jan;17(1):208–17.
50. World Health Organization. World Health Assembly adopts resolution on neglected tropical diseases [Internet]. Geneva: World Health Organization; 2013 [accessed 2018 Mar 13]. Available from: http://www.who.int/neglected_diseases/WHA_66_seventh_day_resolution_adopted/en/.