1. Introdução
A constipação é um problema crônico que acomete muitos pacientes no mundo. Em alguns grupos de pacientes, como os idosos, a constipação constitui um problema sanitário importante; no entanto, na maioria dos casos a constipação crônica é um motivo para consulta que provoca moléstia mas não ameaça a vida nem debilita o indivíduo. Habitualmente, pode ser manejada em nível de atenção primária com controle custo-efetivo dos sintomas.
A terminologia relacionada à constipação é problemática. Existem duas fisiopatologias que, em princípio, diferem mas que se superpõem: os transtornos do trânsito e os transtornos da evacuação. Os primeiros podem surgir secundariamente aos segundos, e os segundos em ocasiões podem apresentar-se após os primeiros.
Este guia refere-se aos pacientes adultos e não analisa especificamente nem crianças nem grupos especiais de pacientes (por exemplo, aqueles apresentando lesão raquidiana).
1.1 Cascatas—uma abordagem sensível aos recursos
Nas regiões e países que dispõem de todo o leque de testes diagnósticos e opções de tratamento médico para o manejo de todos os tipos e subtipos de constipação, é factível utilizar um enfoque de padrão ouro.
Cascata: conjunto hierárquico de opções diagnósticas, terapêuticas e de tratamento para manejar o risco e a doença, catalogados segundo os recursos disponíveis.
2. Definição e patogênese
A palavra “constipação” tem vários significados e a maneira como é utilizada pode diferir não só entre os pacientes mas também entre as diferentes culturas e religiões. Em estudo populacional sueco, encontrou-se que o conceito mais comum de constipação era a necessidade de ingerir laxantes (para 57% dos que responderam). No mesmo estudo, as mulheres (41%) tiveram duas vezes de probabilidades que os homens (21%) de considerar os movimentos intestinais infreqüentes como representativos de constipação, enquanto igual proporção de homens e mulheres entendiam por constipação às fezes endurecidas (43%), o esforço ao evacuar (24%), e a dor ao evacuar (23%). Dependendo de diversos fatores -a definição diagnóstica, fatores demográficos, e a amostragem dos grupos- as pesquisas sobre constipação mostram uma prevalência que vai de 1% até mais de 20% nas populações ocidentais. Em estudos de populações idosas, até 20% dos indivíduos que habitam uma comunidade e 50% das pessoas idosas institucionalizadas relataram sintomas.
Habitualmente, define-se a constipação funcional como um transtorno caracterizado por uma dificuldade persistente para evacuar ou uma sensação de evacuação incompleta e/ou movimentos intestinais infreqüentes (a cada 3–4 dias ou com menor freqüência), em ausência de sintomas de alarme ou causas secundárias. As diferenças na definição médica e as variações entre os sintomas relatados dificultam a obtenção de dados epidemiológicos confiáveis.
2.1 Patogênese e fatores de risco
A constipação funcional pode ter diferentes causas, que vão desde mudanças na dieta, atividade física ou estilo de vida, até disfunções motoras primárias produzidas por miopatia ou neuropatia colônica. A constipação também pode ser secundária a um transtorno de evacuação. O transtorno de evacuação pode estar associado a uma contração paradoxal ou espasmo involuntário do esfíncter anal, que pode resultar de um transtorno adquirido do comportamento defecatório que ocorre em dois terços dos pacientes.
Tabela 1 Fisiopatologia da constipação funcional

Embora o exercício físico e a dieta rica em fibras tenham um efeito protetor, os seguintes fatores aumentam o risco de constipação (a associação pode não ser causal):
- Envelhecimento (mas a constipação não é consequência fisiológica do envelhecimento normal)
- Depressão
- Inatividade
- Baixa ingestão calórica
- Baixa renda e baixo nível educativo
- Quantidade de medicação recebida (independentemente dos perfis de efeitos colaterais)
- Abuso físico e sexual
- Sexo feminino— as mulheres relatam uma maior incidência de constipação do que os homens
2.2 Condições e medicamentos associados
Tabela 2 Possíveis causas e condições associadas à constipação

Tabela 3 Medicamentos associados à constipação

3. Diagnóstico
A constipação é uma afecção comum e, apesar dos indivíduos que consultam constituírem uma minoria, nos Estados Unidos esta afecção é responsável por vários milhões de consultas médicas por ano. No Reino Unido, em 2006, os médicos gerais emitiram mais de 13 milhões de receitas para laxantes. A ajuda de um especialista gastroenterologista deveria concentrar-se em aplicar os recursos sanitários de maneira eficiente, identificando aqueles pacientes que têm probabilidades de se beneficiar de avaliações diagnósticas e tratamentos especializados.
3.1 Critérios diagnósticos para a constipação funcional
Um painel de especialistas internacionais elaborou critérios uniformes no diagnóstico de constipação—os critérios de Roma III.
Tabela 4 Critérios de Roma III para constipação funcional

3.2 Avaliação dos pacientes
O histórico médico e o exame físico nos pacientes com constipação devem focar-se na identificação das possíveis condições causais e sintomas de alarme.
- Consistência das fezes. Considerado melhor indicador do tempo de trânsito colônico que a frequência das fezes (Figura. 1).
Figura. 1 A Escala Bristol da Forma das Fezes é uma medida desenhada para ajudar os pacientes a descrever a consistência do bolo fecal (reproduzido com licença de Lewis SJ e Heaton KW, et al, Scandinavian Journal of Gastroenterology 1997;32:920–4). ©1997 Informa Healthcare

- Descrição dos sintomas de constipação do paciente; diário de sintomas:
- Distensão abdominal, dor, desconforto
- Natureza das fezes
- Movimentos intestinais
- Esforço defecatório prolongado/excessivo
- Defecação insatisfatória
- Uso de laxantes, passado e presente; frequência e dosagem
- Condições atuais, histórico médico, cirurgia recente, doença psiquiátrica
- Estilo de vida do paciente, fibra na dieta e ingestão de líquidos
- Uso de supositórios ou enemas, outras medicações (de receita o de venda livre)
- Exame físico:
- Tumoração gastrointestinal
- Inspeção anorretal:
Impactação fecal
Estenose, prolapso retal, retocele
Atividade paradoxal ou não relaxante do músculo puborretal
Tumoração retal
- Se estiver indicado: exames de sangue—perfil bioquímico, hemograma completo, cálcio, glicose, e função tireóidea
3.3 Sintomas de alarme
Tabela 5 Sintomas de alarme na constipação

3.4 Indicações para os testes de triagem
Está indicado realizar estudos de laboratório, imagenologia ou endoscopia e testes funcionais somente nos pacientes apresentando constipação crônica severa ou sintomas de alarme.
Tabela 6 Testes fisiológicos para constipação crônica (reproduzido com licença de Rao SS, Gastrointest Endosc Clin N Am 2009; 19:117–39)
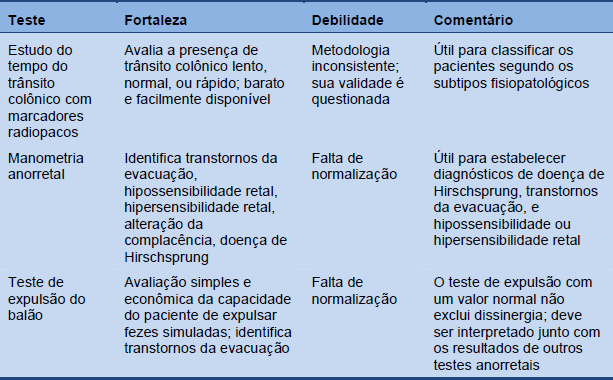
3.5 Medição do trânsito
O estudo de retenção de marcadores de 5 dias é um método simples para medir o trânsito colônico que requer a ingestão de marcadores de uma só vez. A realização de uma radiografia simples de abdômen 120 horas após, é suficiente para avaliar o tempo de trânsito colônico através da quantificação dos marcadores presentes. Se persistirem mais de 20% dos marcadores no cólon, significa que o trânsito está retardado. O acúmulo distal dos marcadores pode indicar um transtorno da evacuação e, nos casos típicos de constipação por trânsito lento, quase todos os marcadores se mantêm e se observam tanto no cólon direito como no esquerdo.
Várias companhias produzem marcadores, mas estes também podem ser obtidos a partir do corte de um tubo radiopaco, em pequenos pedaços de 2–3 mm de longitude, não apresentando riscos para o paciente. Um número adequado de marcadores (20–24) podem ser incluídos em uma cápsula de gelatina para facilitar sua ingestão.
3.6 Avaliação clínica
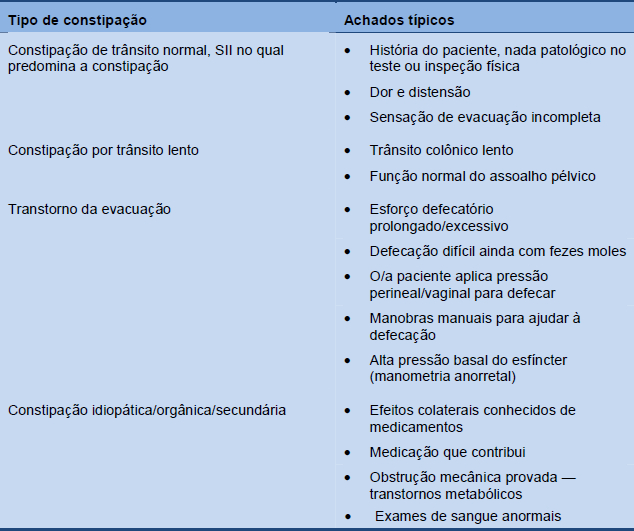
A classificação da constipação dos pacientes deveria ser possível com base no histórico médico e um correto exame e valoração de laboratório.
Tabela 7 Categorias de constipação com base na avaliação clínica
3.7 Opções em cascata para investigar a constipação severa e refratária ao tratamento
Nível 1—Recursos limitados
- Anamnese e exame físico geral
- Exame anorretal. Diário com registro dos movimentos intestinais durante 1 semana
- Estudo do trânsito usando marcadores radiopacos
- Teste de expulsão do balão
Nível 2—Recursos intermédios
- Anamnese e exame físico geral
- Exame anorretal. Diário com registro dos movimentos intestinais durante 1 semana
- Estudo do trânsito usando marcadores radiopacos
- Teste de expulsão do balão ou defecografia
Nível 3—Recursos amplos
- Anamnese e exame físico geral
- Exame anorretal. Diário com registro dos movimentos intestinais durante 1 semana
- Estudo do trânsito usando marcadores radiopacos
- Defecografia ou proctografia -ressonância magnética (RMN)
- Manometria anorretal
- Eletromiografia (EMG) do esfíncter
4. Tratamento
4.1 Esquema para o manejo geral da constipação
Tabela 8 Manejo geral da constipação
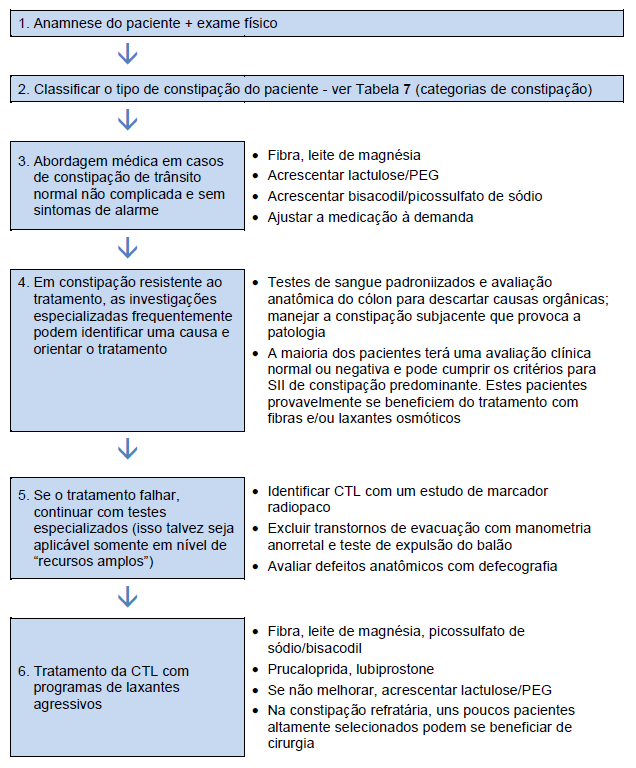
SII: síndrome de intestino irritável; PEG, polietilenoglicol; CTL, constipação por trânsito lento.
4.2 Abordagem sintomática
Uma vez estudada e excluída uma constipação orgânica e secundária, a maioria dos casos podem ser manejados adequadamente com uma abordagem sintomática.
- A abordagem gradativa do tratamento é baseada na recomendação de mudar o estilo de vida e a dieta, interrompendo ou reduzindo medicações que produzem constipação e administrando suplementos com fibra ou outros agentes formadores de volume. Geralmente, é recomendado um aumento gradual da fibra (seja como suplementos padronizados ou incorporada na dieta) e um aumento da ingestão de líquidos.
- O segundo passo na abordagem gradativa é acrescentar laxantes osmóticos. A melhor evidência é utilizar polietilenoglicol, mas também existe boa evidência para a lactulose. As novas drogas lubiprostone e linaclotide atuam estimulando a secreção ileal aumentando assim a água fecal. Prucaloprida também está aprovada em muitos países e na Europa.
- O terceiro passo inclui laxantes estimulantes, enemas, e fármacos procinéticos. Laxantes estimulantes podem ser administrados por via oral ou retal para estimular a atividade motriz colorretal. Os fármacos procinéticos também procuram aumentar a atividade de propulsão do cólon, mas ao contrário dos laxantes estimulantes, que devem se tomar ocasionalmente, estes estão desenhados para ser administrados a diário.
4.3 Dieta e suplementos
- A modificação da dieta pode consistir em acrescentar fibras para alcançar uma dieta rica em fibras (25 g de fibras) e suplementos de líquidos (até 1.5–2.0 L/dia); pode melhorar a frequência das fezes e diminuir a necessidade de laxantes.
- Não há evidências de que as medidas vinculadas à dieta e ao estilo de vida tenham nenhum efeito sobre a constipação nos idosos, apesar dos suplementos de fibra e os laxantes osmóticos simples constituírem rotineiramente um manejo adequado para a constipação nestes pacientes.
- Nos pacientes com dilatação colônica deve-se evitar a suplementação com fibras.
- Os suplementos com psílio e lactulose podem ser úteis para o tratamento da constipação crônica.
4.4 Medicação
- Os transtornos de evacuação respondem mal aos programas de laxantes orais padrão. Se um transtorno da evacuação intervém de maneira considerável na constipação, deve-se considerar biofeedback e treinamento da musculatura pélvica. Entre os fatores críticos para o sucesso se encontram o nível de motivação do paciente, a frequência do programa de treinamento e a participação de um psicólogo condutista e um nutricionista.
- Se a abordagem da dieta falhar, pode-se utilizar polietilenoglicol (17 g de laxante PEG durante 14 dias) ou lubiprostone (24 mg duas vezes por dia) para promover a função intestinal nos pacientes com constipação crônica.
- Os agentes procinéticos (por exemplo, prucaloprida um antagonista dos receptores 5-HT4) podem ser utilizados no SII com predominância da constipação.
- Os agentes laxantes simples, como leite de magnésia, sena, bisacodil, e os agentes que amolam as fezes são uma escolha razoável para tratar a constipação.
4.5 Cirurgia
Se o tratamento falhar uma e outra vez na constipação por trânsito lento, um grupo selecionado de pacientes bem avaliados e informados pode se beneficiar de uma colectomia total com anastomose ileorretal. A indicação excepcional de colectomia deve ser estabelecida em um centro terciário especializado e com experiência. Pode haver resultados decepcionantes, nos quais o paciente pode ficar com incontinência fecal e constipação recorrente após a cirurgia, especialmente com transtornos da evacuação.
- São muito poucos os pacientes que se beneficiam de uma colostomia (reversível) para tratar a constipação.
4.6 Resumo baseado em evidências
Tabela 9 Resumo: Base de evidência para o tratamento da constipação (adaptado de Rao SS, Gastrointest Endosc Clin N Am 2009;19:117–39)

* Adaptado pela atual equipe de revisão dos guias de constipação.
4.7 Opções em cascata para o tratamento da constipação crônica
A seguinte cascata está destinada a pacientes com constipação crônica sem sintomas de alarme e com pouca ou nenhuma suspeita de um transtorno da evacuação. Os principais sintomas seriam fezes duras e/ou movimentos intestinais infrequentes.
Nível 1— Recursos limitados
- Assessoria nutricional (fibra e líquidos)
- Suplementação com fibras
- Leite de magnésia (hidróxido de magnésio em uma solução aquosa)
- Laxantes estimulantes (bisacodil melhor do que sena) de uso transitório
Nível 2— Recursos intermédios
- Assessoria nutricional (fibra e líquidos)
- Suplementação com fibras, psílio
- Leite de magnésia, lactulose, macrogol
- Laxantes estimulantes de uso transitório
Nível 3— Recursos amplos
- Assessoria nutricional (fibra e líquidos)
- Psílio ou lactulose
- Macrogol ou lubiprostone
- Procinéticos (prucaloprida)
- Laxantes estimulantes (bisacodil ou picossulfato de sódio)
4.8 Opções em cascata para o tratamento dos transtornos da evacuação
Esta cascata se aplica a pacientes com constipação crônica sem sintomas de alarme mas com suspeita de um transtorno da evacuação. Os principais sintomas seriam esforço defecatório prolongado, sensação de evacuação incompleta, fezes finas, sensação de bloqueio (estar entupido), ou falha do tratamento por constipação com fezes endurecidas.
Nível 1— Recursos limitados
- Assessoria nutricional e comportamental (fibra, líquidos, treinamento intestinal com horários)
- Terapia para a constipação crônica
Nível 2— Recursos intermédios
- Assessoria nutricional e comportamental (fibra, líquidos, treinamento intestinal com horários)
- Terapia para a constipação crônica
- Terapia por biofeedback
Nível 3— Recursos amplos
- Assessoria nutricional e comportamental (fibra, líquidos, treinamento intestinal com horários)
- Terapia para a constipação crônica
- Terapia por biofeedback
- Avaliação cirúrgica














