Julio C. Bai (Chair, Argentina), Carolina Ciacci (Co-chair, Italy), Gino Roberto Corazza (Italy), Michael Fried (Switzerland), Carolina Olano (Uruguay), Mohammad Rostami-Nejad (Iran), Andrea González (Argentina), Peter Green (USA), Javier Gutierrez-Achury (UK/Netherlands), Michael Schultz (New Zealand), Elena Verdú (Canada), Kassem Barada (Lebanon), Peter Gibson (Australia), Sibylle Koletzko (Germany), Thierry Coton (France), Chris Mulder (Netherlands), Govind Makharia (India), Anton LeMair (Netherlands)
1- تعاریف
گلوتن به صورت یک توده پروتئینی کش سان تعریف می شود که هنگام شست و شوی خمیر گندم جهت حذف نشاسته باقی می ماند (1). اجزای پروتئینی اصلی گلوتن شامل گلیادینها و گلوتنینها نقش پروتئینهای ذخیرهای گندم را دارند. گلوتن و پروتئینهای مرتبط با آن در گندم، چاودار و جو وجود دارند و به صورت گسترده در فرایند تهیه غذا به منظور بهبود بافت، خوشطعمی و ایجاد کیفیت مطلوب نانوایی خمیر استفاده میشوند. عرضه گلوتن در افراد مستعد از نظر ژنتیکی منجر به بیماری سلیاک میشود (2, 3).
1-1- بیماری سلیاک
بیماری سلیاک (CD) یک بیماری مزمن خودایمنی است که روده باریک را در افراد مستعد از نظر ژنتیکی تحت تاثیر قرار میدهد و در اثر مصرف غذاهای حاوی گلوتن به وجود میآید (3). این بیماری ممکن است با عناوین اسپروی سلیاک، انتروپاتی حساس به گلوتن یا اسپروی غیر حارهای نامبرده شود.
1-2- آلرژی به گندم
آلرژی به گندم یک واکنش مضر ایمونولوژیک است که با واسطه IgE یا بدون واسطه IgE در برابر پروتئینهای مختلف گندم ایجاد میشود. آلرژی به گندم بسته به مسیر عرضه آلرژن و مکانیسم های ایمونولوژیک مربوطه، به چهار گروه اصلی تقسیم میشود (4):
- آلرژی غذایی کلاسیک که پوست، مجاری گوارش و تنفس را تحت تاثیر قرار میدهد.
- آنافیلاکسی القا شده در اثر ورزش
- آسم شغلی (آسم نانوایان) و رینیت
- کهیر تماسی
1-3- حساسیت به گلوتن غیر سلیاکی
بیمارانی که با استفاده از رژیم غذایی فاقد گلوتن علایم گوارشی و غیر گوارشی شان بهبود یافته و از طرفی احتمال ابتلا به بیماری سلیاک و آلرژی گندم در آنها رد شده است، تحت عنوان حساسیت به گلوتن غیر سلیاکی (NCGS) قرار میگیرند (5). علی رغم گزارش بهبود اساسی علایم بیماری با استفاده از رژیم غذایی فاقد گلوتن (اغلب توسط خود بیمار) نتایج آزمایشات بالینی ضد و نقیضی حاصل شده و منجر به عدم اطمینان درباره فراوانی واقعی چنین سندرمی میشود (10-6).
در حال حاضر تنها راه تشخیص حساسیت غذایی اختصاصی (هنگامی که تست مکانیکی اختصاصی در دسترس نیست) اجرای چالش های غذایی متقاطع کنترل شده با کنترل پلاسبو دوسو کور (DBPC) ، با استفاده از پروتئین گندم به همراه اندکی از سایر مواد برانگیزنده علایم مانند فروکتوزانها میباشد. با این وجود اثر nocebo به عنوان یک پدیده معمول در چنین آزمایشاتی باید در هنگام تفسیر نتایج در نظر گرفته شود (8, 9). سایر عوامل غذایی همراه یا احتمالی که قادر به برانگیختن علایم هستند شامل کربوهیدارتها (الیگو، دی، مونوساکاریدها و پلیاُلهای قابل تخمیر، FODMAPs) و پروتئینهای گندم مانند بازدارندههای آلفاآمیلاز/تریپسین (ATIs) میباشند. علاوه بر این، هنوز دلیل محکمی مبنی بر این که آیا گلوتن مسئول بروز علایم است و یا اینکه مکانسیم دقیق بروز بیماری چیست، وجود ندارد. از این رو برخی نویسندگان اعتقاد دارند "ازدیاد حساسیت به گندم غیرسلیاکی " یا "سندرم عدم تحمل گندم " اصطلاحات مناسب تری میتوانند باشند (11, 12).
2-ترتیب اقدامات لازم دستیابی به تشخیص بیماری سلیاک
2-1- اقدامات مستمر سازمان جهانی گوارش
سازمان جهانی گوارش ( WGO) به منظور راهنمایی ارائه کنندگان خدمات بهداشتی در رابطه با مدیریت بیماری سلیاک و سایر اختلالات مرتبط با گلوتن مدارک مختصر و فشرده ای فراهم آورده است که در برگیرنده توصیه هایی بر مبنای آخرین شواهد و تجربیات اخیر و برگرفته از رویه مورد توافق متخصصین جهانی گوارش است.
در این اقدامات مستمر تشخیصی و درمانی، گایدلاینهای WGO روشی حساس به منبع و محتوا را فراهم میآورند. یک روش استاندارد جهانی، مستلزم زمینه اپیدمیولوژی و بالینی مناسبی بوده تا بتواند در همه نقاط جهان قابل مقایسه باشد. چنین روشی باید مجموعه کاملی از تست های تشخیصی و گزینه های درمانی را در بر بگیرد. اپیدمیولوژی و دسترسی منابع تشخیصی و مدیریتی بیماری سلیاک و سایر اختلالات مرتبط با گلوتن فاقد یکنواختی لازم به منظور ارائه روش واحد استاندارد طلایی هستند. بنابرین گایدلاین جهانی WGO، مجموعه ای از اقدامات مستمر را شامل می شود که گزینه های حساس به منبع و محتوا را برای تشخیص و مدیریت اختلالات مرتبط با گلوتن فراهم می آورند. همچنین اقدامات مستمر WGO در نظر دارند که به عنوان یک مکمل جهانی و نه جایگزین گایدلاین های استاندارد طلایی که توسط گروه های منطقه ای و جوامع ملی تهیه شده اند عمل کنند. گایدلاین های استاندارد طلایی جدید در ضمیمه ارائه شده اند.
به دلیل فقدان اطلاعات کافی در مورد NCGS و آلرژی به گندم، نویسندگان این راهنما بر این باورند که در حال حاضر تهیه لیست اقدامات برای NCGS و آلرژی به گندم امکانپذیر نیست.
اقدامات سازمان جهانی گوارش: مجموعه ای از راه کارهای تشخیصی، درمانی و مدیریتی برای مواجهه با بیماری بر اساس منابع موجود است.
گایدلاین ها و اقدامات مستمر WGO این هدف را دنبال می کنند که روش های مدیریت منابع حساس به و مدیریت محتوای مناسب را برای همه مناطق جغرافیایی فارغ از سطح توسعه یافتگی کشورها ارائه دهند. اقدامات مستمر WGO حساس به محتوا هستند که تنها به صورت تابعی از در دسترس بودن منابع تعریف نمی شود.
2-2- اقدامات مستمر تشخیصی بیماری سلیاک
تشخیصی که صرفا بر اساس بررسی بالینی و بهبود علایم پس از رعایت رژیم غذایی فاقد گلوتن باشد به هیچ وجه توصیه نمی شود. این مسئله از منابع تشخیص اشتباه محسوب می شود و فقط در اقلیتی از بیماران (بیماران مبتلا به سلیاک کلاسیک دارای علایم سوء جذب) و در مناطق با منابع به شدت محدود می تواند کمک کننده باشد و می تواند موجب سردرگمی و در نهایت تشخیص اشتباه سلیاک در بیماران دارای NCGS، انتروپاتی غیر مرتبط با گلوتن و سندرم روده تحریک پذیر شود و حتی ممکن است به صورت اتفاقی موجب بهبود علایم مثلا در عفونت های روده ای گردد. در واقع رژیم غذایی فاقد گلوتن ممکن است اثری غیر اختصاصی از
طریق تغییرات غیر وابسته به گلوتن، سطح پایین FODMAPs یا به دلیل اثر پلاسبو ایجاد کند.
به عنوان اولین آزمایشات، IgA ضد ترانس گلوتامیناز بافتی (anti-tTG) + IgA تام، برای بیماران دارای علایم و بدون علایم پیشنهاد می شوند. با این وجود توصیه می شود به منظور تایید بیماری در افراد با تست مثبت یا در موارد تیتر مرزی tTG IgA، سایر تست ها نیز بررسی شوند. سایر سنجش های ایمنی شامل آنتی بادی ضد اندومیزیوم (EMA) و تست IgA-ترانس گلوتامیناز2 (TG2) مثبت یا تست IgG-پپتید گلیادین دآمیده (DGP) مثبت به عنوان آزمون های مطلوب در نظر گرفته می شوند. ترکیب IgG-DGP و IgA-TG2 به عنوان تست های مکمل، خصوصا برای تشخیص بیماران سلیاکی دارای نقص کارایی IgA مفید خواهد بود. بر اساس گزارشات IgG-DGP می تواند تعداد بیشتری از بیمارانی که با IgA-TG2 شناسایی نشده اند و دارای نقص در کاراییIgA هستند را شناسایی کند. برخی معتقدند بررسی IgA-tTG + IgG-DGP از آنجایی که آنتی ژن های متفاوتی را شناسایی می کنند از تست هایی که اتوآنتی ژن های یکسانی را شناسایی می کنند (IgA-tTG + IgA-EMA) بهتر است.

Anti-tTG، آنتی بادی ضد ترانس گلوتامیناز بافتی-2؛ EMA IgA، آنتی بادی IgA اندومیزیال؛ anti-DGP، آنتی بادی ضد پپتیدهای گلیادین دآمیده
2-3- اقدامات مستمر مدیریت بیماری سلیاک

بادی IgA ضد اندومیزیال؛ anti-DGP، آنتی بادی ضد پپتیدهای گلیادین دآمیده
* پیگیری:
- مهم ترین مانع اجرای توصیه ها آگاهی پایین بیماران و پزشکان در رابطه با بیماری سلیاک است.
- در میان متخصصین گوارش این احساس وجود دارد که پس از تشخیص بیماری سلیاک نیاز به پیگیری توسط پزشک متخصص وجود ندارد و ممکن است به صورت یک وضعیت خفیف در مقایسه با بیماری التهابی روده (IBD) و (IBS) در نظر گرفته شود.
2-4- نکات کلیدی
گلوتن و پروتئین های مرتبط با گلوتن در گندم، جو و چاودار حضور دارند. یولاف (جو دوسر) نیز در صورت آلودگی با گندم عاری از آن نیست و عامل خارجی ایجاد بیماری سلیاک است. بیماری سلیاک منحصرا در افرادی که مولکول های HLA-DQ2 و HLA-DQ8 رده II مجموعه سازگاری بافتی (MHC) را بیان می کنند دیده می شود.
بروز این بیماری در 20 سال اخیر در حال افزایش بوده است.
شیوع بیماری سلیاک در جمعیت بین یک نفر از 100 نفر و یک نفر از 300 نفر در اکثر نقاط جهان متغیر است.
بالاترین وقوع تغییرات سرمی بیماری سلیاک بین 36-12 ماهگی است.
وابستگان درجه یک و درجه دو (به مقدار کمتر) خطر بالای ابتلا به بیماری سلیاک را دارند (حدود 70 % بستگان درجه یک در مقایسه با 35-30 % در جمعیت عمومی، HLA-DQ2 یا HLA-DQ8 مثبت هستند). تظاهرات بالینی بیماری سلیاک بسیار گسترده است و شروع بیماری یا علایم آن در هر مرحلهای از زندگی ممکن است اتفاق بیافتد. بسیاری از بیماران ممکن است دارای علایم گوارشی محدود یا تظاهرات خارج روده ای باشند، در مقابل، عده کمی از بیماران دارای سوء جذب (بیماری سلیاک کلاسیک) هستند. به نظر می رسد بیماران با سلیاک دارای علایم، ریسک بالاتری از عوارض (شامل مرگ) را در مقایسه با جمعیت عمومی دارند. اگرچه به نظر می رسد نرخ افزایشی این عوارض اصلی، پس از 5-3 سال رژیم غذایی فاقد گلوتن بر طرف شود اما ریسک موارد بیماری سلیاک بدون علایم که فقط با تست های سرولوژیک تشخیص داده می شود، کمتر شناخته شده است.
یافته های تشخیصی کلیدی عبارتند از:
تغییرات هیستوپاتولوژیک مشخص در بیوپسی مخاط روده شامل افزایش لنفوسیت های درون اپیتلیال، هایپرپلازی کریپت ها و درجات مختلف آتروفی پرزهای روده می باشد.
شواهد انتروپاتی روده کوچک به گلوتن، آنتی بادی های اختصاصی بیماری سلیاک، بهبود بالینی یا هیستولوژیکی در پاسخ به رژیم غذایی فاقد گلوتن وابسته است.
تست های سرولوژیک می توانند:
بیماری سلیاک را در بیماران دارای انتروپاتی مشخص تایید کنند.
بیمارانی که بیوپسی در آن ها توجیه پذیر است را شناسایی کنند.
بیماران دارای ریسک بالای بیماری سلیاک را شناسایی کنند.
به تشخیص بیماری در برخی موارد مشکوک کمک کنند.
درمان:
بیماران سلیاکی نباید محصولات حاوی گندم، چاودار یا جو را مصرف نمایند. معمولا بیماران نیاز دارند رژیم غذایی فاقد گلوتن را در تمام طول زندگی خود دنبال کنند. امکان مصرف جو دوسر وجود دارد ولی ممکن است با گندم آلوده شده باشد و در نتیجه جو دوسر خالص بدون آلودگی و عاری از گلوتن معمولا در دسترس نیست. همچنین ممکن است زیرگروه کوچکی از بیماران (کمتر از 5 %) به جو دوسر خالص عدم تحمل داشته باشند، از این رو رژیم غذایی فاقد جو دوسر، حداقل برای سه ماه اول درمان توصیه نمی شود.
3-اپیدمیولوژی
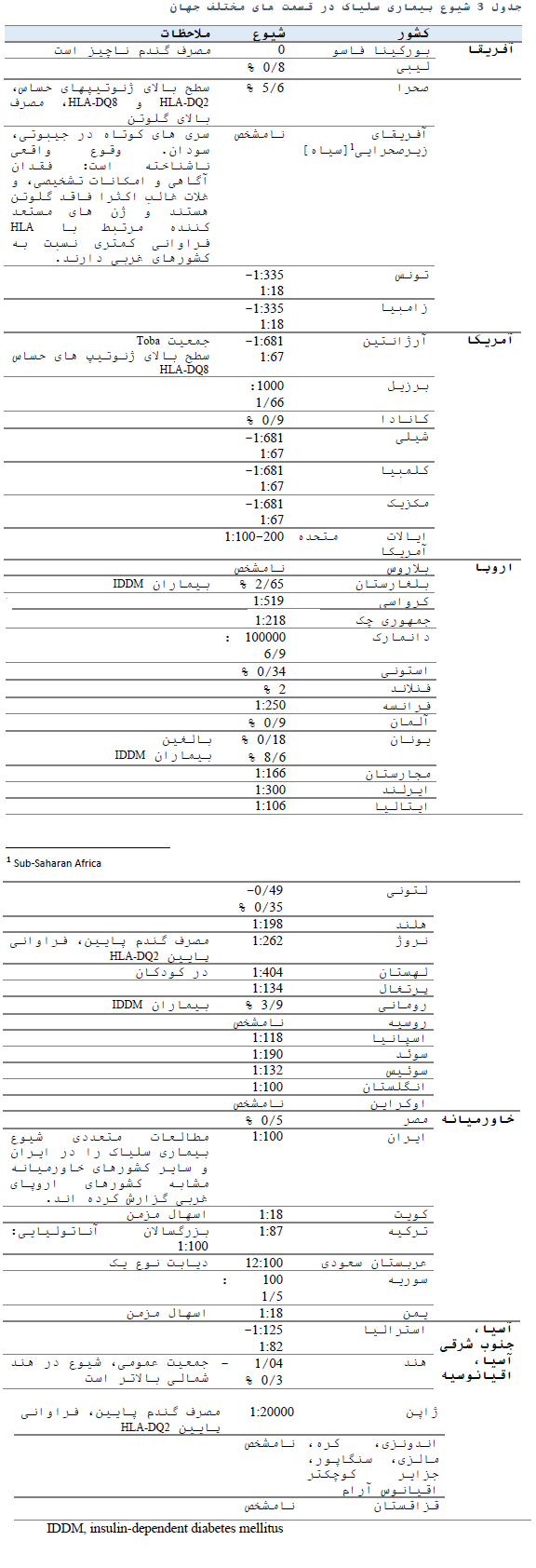
بیماری سلیاک در سراسر جهان شایع بوده و شیوع آن به طور معنی داری در طی 20 سال اخیر افزایش یافته است و افزایش چشم گیری در تعداد موارد جدید بیماری سلیاک گزارش شده است (13). از یک سو به علت بهبود ابزار های تشخیصی و از سوی دیگر غربالگری افراد با ریسک بالای بیماری سلیاک تعداد موارد تشخیص داده شده افزایش یافته است (14). با این حال تعداد موارد تشخیص داده نشده بیماری سلیاک از موارد تشخیص داده شده بیشتر است (17-15).
بیماری سلیاک دارای شیوعی در حدود 1 % از جمعیت عمومی در کشورهای غربی است ولی به طور قابل ملاحظه ای در سایر نقاط جهان در حال افزایش است.
نسبت زن به مرد به طور متفاوتی گزارش شده است به نحوی که مطالعات آیندهنگر این نسبت را در حدود 1 به 3 تا 5/1 به 1 گزارش کرده اند.
مشخص شده است که بیماری سلیاک همه گروه های سنی از جمله افراد مسن را تحت تاثیر قرار می دهد؛ به طوری که بیش از 70 % بیماران در سن بالای 20 سال تشخیص داده می شوند (18).
ریسک ابتلا به بیماری سلیاک در بستگان درجه یک نسبت به بستگان درجه دو، افراد مبتلا به دیابت نوع یک و سایر بیماری های خود ایمن، سندرم داون و سایر بیماری های مرتبط به مراتب بیشتر است (تا 10 %) (16).
تظاهرات شدید بالینی طی بارداری یا دوره پس از زایمان ممکن است تا 17 % از بیماران زن را تحت تاثیر قرار دهد (19).
3-1- ظهور جهانی بیماری سلیاک
مطالعات اپیدمیولوژیک اولیه، بیماری سلیاک را به عنوان بیماری نژاد هندواروپایی در نظر می گرفتند، و تصور می کردند که افراد این نژاد عمدتا در اروپا و آمریکای شمالی زندگی می کنند (20). اگرچه مطالعات بعدی شیوع مشابهی از بیماری سلیاک را در سایر نقاط جهان آشکار کردد (23-21). شیوع این بیماری به صورت جهانی 1 % است ولی تنوع زیادی بین کشورهای مختلف نشان داده شده است (17).
شیوع بیماری سلیاک در جمعیت های با خطر پایین در کشورهای در حال توسعه 7/5-14/0 درصد و در جمعیت های با خطر بالا 55-2/1 درصد گزارش شده است (24).
تعدادی از این مطالعات بیماری سلیاک را در بین افراد با اصالت بومی آمریکا و یا آفریقایی-آمریکایی گزارش کرده است (25).
گزارشات اخیر نشان داده اند که بیماری سلیاک یک اختلال شایع در آفریقای شمالی (26)، خاورمیانه(17)، هند (27) و پاکستان (28) می باشد.
بیماری سلیاک از نواحی گرمسیری آفریقا خصوصا کشورهای جیبوتی و سودان گزارش شده است (31-29). سطح آگاهی پایین، عدم وجود ابزار های تشخیصی، عرضه کمتر گلوتن به دلیل رژیم غذایی متفاوت، می تواند وقوع کمتر بیماری سلیاک را در جنوب صحرای آفریقا توجیه کند. ولی بر مبنای تست های سرولوژیک اطلاعی از شیوع بیماری در این مناطق در دسترس نیست.
گزارشاتی از چین نشان داده اند که آلل های HLA-DQ مستعدکننده بیماری سلیاک و همچنین خود بیماری سلیاک حداقل در استان های Jiangsu و Zhejiang نادر نیست (32).
به طور خلاصه توزیع جهانی غذاهای حاوی گلوتن، ژنوتیپ های مستعد کننده و فاکتور های دخیل در پاتوژنز بیماری سلیاک احتمالا مسئول ظهور گسترده و جهانی این اختلال می باشند.
یک مطالعه چند مرکزی در اروپا میزان شیوع 1 % را همراه با کمی تنوع در کشورهای مختلف تایید کرد.
یک مطالعه متاآنالیز بر روی مطالعات انجام شده در آسیا مشخص کرده است که بیماری سلیاک در آسیا غیر معمول نیست و شیوع سرمی و شیوع بیماری سلیاک در آسیا به ترتیب 6/1 % و 5/0 % است (33).
در مطالعه اپیدمیولوژی اخیری که بر روی جمعیتی از بومیان آمریکا از شمال آرژانتین (جمعیت Toba) که در یک ماموریت بهداشتی چند رشته ای شرکت کرده بودند، بیماری سلیاک (2/2 %) یا خودایمنی مزمن (2 %) در افراد حامل هاپلوتیپ HLA-DQ8 شناسایی شد (34).
بالاترین شیوع بیماری سلیاک در جهان در جمعیت خاصی از صحرای غربی در حد 6/5 % شناسایی شده است که تقریبا 10 برابر اکثر کشورهای اروپایی می باشد. جمعیت مذکور همچنین یکی از بالاترین فراوانی های HLA-DQ2 و HLA-DQ8 و مصرف بسیار بالای گلوتن را نشان داده است (35).
سایر مطالعات نشان می دهند که تعداد موارد جدید بیماری سلیاک که در یک دوره زمانی خاص و در یک جمعیت معین تشخیص داده شده اند (وقوع) در حال افزایش است (در آمریکای شمالی و اروپا) (13, 36).
نسبت موارد تشخیص داده شده به موارد تشخیص داده نشده بیماری سلیاک در کشورهای مختلف متفاوت است (یک به دو در فنلاند، یک به 10 در ایالات متحده، آرژانتین و آلمان) (15, 21, 37, 38). این امر نشان می دهد بیشتر موارد بیماری سلیاک بدون غربالگری فعال، تشخیص داده نشده باقی می مانند.
لذا نیاز مبرمی به افزایش آگاهی پزشکان عمومی و متخصصین اطفال در مورد تنوع تظاهرات بالینی و نقش کلیدی تست های سرولوژیک در تشخیص بیماری سلیاک وجود دارد. این مسئله در ایرلند شمالی و فنلاند به عنوان عامل اصلی افزایش تشخیص بیماری سلیاک نشان داده شده است (39, 40).
در هیچ یک از کشورها و مناطق جغرافیایی که مطالعات اپیدمیولوژیک انجام گرفته است، تفاوت قابل ملاحظه ای بین بیماران دارای علایم و بیماران تشخیص داده شده با غربالگری (اکثرا با فنوتیپ تحت بالینی) مشاهده نشده است
3-2- ژنتیک
نقش اختصاصی ژن های HLA-DQA1 و HLA-DQB1 در ارائه پپتیدهای گلوتن به عنوان آنتی ژن، لوکوس MHC HLA را تبدیل به مهمترین عامل ژنتیکی در ایجاد بیماری سلیاک کرده است. بیماری سلیاک با HLA-DQ2 و HLA-DQ8 مرتبط است؛ HLA-DQ2 تقریبا در 95 % بیماران سلیاکی اروپای شمالی حضور دارد و بقیه نیز حامل HLA-DQ8 می باشند (41). آنالیز های اخیر نشان داده اند که مولکول های HLA کلاس I نیز با بیماری سلیاک مرتبط هستند (42, 43).
تفاوت فراوانی هاپلوتیپ های HLA-DQ با خطر بالا برای بیماری سلیاک در جمعیت های مختلف نشان داده شده است (42) و این مسئله ممکن است با تفاوت در شیوع بیماری سلیاک مرتبط باشد. تفاوت های مشخصی بین گروه های خطر HLA وجود دارد، تا شش برابر خطر بالاتر در گروه های با خطر بالا (هاپلوتیپ HLA DR3-DQ2، خصوصا هموزیگوتها) درمقایسه با گروههای با خطر پایین (DR4-DQ8) (44).
حضور آلل های خطر HLA برای ایجاد بیماری سلیاک ضروری است، ولی کافی نیست (کمتر از 1 % بیماران فاقد DQ2 یا DQ8 هستند((45, 46).
مطالعات نشان می دهند با وجود نقش کلیدی هاپلوتیپ های HLA ، آنها تنها 40-35 % ریسک ژنتیکی بروز بیماری سلیاک را اعطا می کنند (42, 47).
تست های HLA تایپینگ دارای ارزش پیشگویی منفی بالایی هستند و فقدان HLA-DQ2/DQ8 ابتلا به بیماری سلیاک را در افراد حساس رد می کند (44, 47).
علاوه بر ژن های HLA، مناطق ژنتیکی مرتبط دیگری با بیماری سلیاک شناخته شده اند که در مجموع 32 % وراثت پذیری ژنتیکی را توجیه می کنند (5/25 % برای MHC HLA و 5/6 % برای مناطق غیر HLA، که با استفاده از شیوع 1 % محاسبه شده است) (42).
به طور کلی، حضور گلوتن در رژیم غذایی فاکتور ضروری برای ابتلا به بیماری سلیاک است، حتی در صورت وجود استعداد ژنتیکی، بدون وجود گلوتن بیماری سلیاک وجود نخواهد داشت.
آزمایشات HLA در موارد زیر توصیه می شوند:
تست HLA منفی برای رد بیماری سلیاک مفید است.
در افراد با وضعیت نامشخص تشخیص بیماری سلیاک (سرولوژی منفی، ولی هیستولوژی دلالت کننده بر بیماری سلیاک) آزمایش HLA فقط در صورتی که منفی باشد کمک کننده خواهد بود. در صورتی که سرولوژی مثبت و یافته های هیستولوژیک منفی باشند، نتیجه آزمایش HLA به احتمال زیاد مثبت خواهد بود.
به منظور تشخیص خواهر و برادرها جهت اطمینان از غیر محتمل بودن بروز بیماری سلیاک در آنها نسبت به مواردی که نیاز به غربالگری دارند.
در افراد دارای سایر اختلالات خودایمنی و برخی اختلالات ژنتیکی که باید بیماری سلیاک در آنها بررسی شود (مانند تیروئیدیت خود ایمن).
3-3- عوامل محیطی
گلوتن برای ایجاد بیماری سلیاک ضروری است.
آنچه که قبلا تصور می شد عرضه زودهنگام (قبل از پنج ماهگی) یا دیرهنگام (در 12 ماهگی) گلوتن می تواند خطر بیماری سلیاک را کاهش دهد که این تصور بوسیله آزمایشات کنترل شده تصادفی تایید نشده است (50-48). از این رو اهمیت مقدار گلوتن در سنین پایین هنوز مورد بحث است (51). مدت زمان تغذیه با شیر مادر (به تنهایی، در کل، یا در زمان عرضه گلوتن) نیز ارتباطی با کاهش ریسک ایجاد بیماری سلیاک ندارد (50-48, 52).
عدم تحمل گلوتن در نتیجه سایر عوامل علاوه بر گلوتن، ممکن است در هر سنی اتفاق بیافتد.
4-تاریخچه بالینی و علایم کلیدی
افزایش اخیر در تعداد افرادی که بیماری سلیاک در آنها شناسایی شده با افزایش آشنایی پزشکان با تظاهرات بالینی متنوع و گسترده این اختلال و توسعه و بهبود دسترسی به تست های دقیق غربالگری مرتبط است (3, 35, 36, 38, 53, 54). در آزمایشات بالینی گستره وسیعی از علایم مشاهده می شود. ما در این مبحث از تعریف اسلو برای بیماری سلیاک پیروی می کنیم (3).
4-1- بیماری سلیاک کلاسیک
مبتلایان به بیماری سلیاک علایم و نشانه های سوء جذب شامل اسهال، مدفوع چرب، کم خونی فقر آهن و کاهش وزن یا کاهش رشد را بروز می دهند (3).
نشانه ها و علایم در بالغین
- اسهال مزمن (قبلا به عنوان شایع ترین علامت شناخته می شد)
- کاهش وزن
- کم خونی فقر آهن
- اتساع شکمی در اثر نفخ
- ضعف و خستگی
- ادم (هیپوپروتئینمی)
- پوکی استخوان
نشانه ها و علایم در کودکان
- اختلال رشدی، کاهش وزن، کاهش رشد
- استفراغ
- اسهال مزمن
- اتساع شکمی در اثر نفخ
- کم خونی فقر آهن
- کاهش حجم عضله
- ادم (هیپوپروتئینمی)
- تحریک پذیری و غمگینی
4-2- بیماری سلیاک غیرکلاسیک
در بیماری سلیاک غیر کلاسیک علایم گوارشی غیر اختصاصی بدون نشانه های سوءجذب یا همراه با تظاهرات خارج روده ای (بدون علایم گوارشی) دیده می شود (3, 55). شیوع بیماری سلیاک در دنیای غرب در بیمارانی که علایم غالبشان کم خونی فقر آهن با علت ناشناخته است، بسیار بالا است.
نشانه ها و علایم در بالغین و کودکان
تظاهر بیماری ممکن است به صورت تک علامتی یا چند علامتی یا با شدت پایین باشد.
- اتساع شکمی
- درد شکمی
- بحران سلیاک (سندم شبه وبا) (56)
- یبوست مزمن در کودکان
- میگرن مزمن
- تظاهرات پوستی (مانند راش، پسوریازیس، تاول)
- نوروپاتی محیطی
- هایپرترانسآمینازمی با علت ناشناخته (57)
- کمبود اسید فولیک
- کاهش تراکم استخوان
- ناباروری با علت ناشناخته
- بلوغ دیررس، قاعدگی دیررس/یائسگی زودرس
- سقط جنین با علت ناشناخته، تولد نوزاد نارس یا نوزاد کوچکتر از سن بارداری
- نقص مینای دندان
- سوءهاضمه، سیری زودرس، بی اشتهایی
- افسردگی و اضطراب، تغییرات رفتاری و تحریک پذیری
- کمبود ویتامین B12
4-3- بیماری سلیاک بدون علایم
بسیاری از بیماران، خصوصا مواردی که طی غربالگری تشخیص داده میشوند علی رغم زخم های مشخص روده ای حتی با پرسشنامه دقیق علایمی گزارش نمی کنند. رژیم غذایی فاقد گلوتن معمولا موجب بهبود کیفیت زندگی بیماران حتی در آن دسته از بیمارانی که هنگام تشخیص بدون علایم در نظر گرفته شده اند، می شود (58). این مسئله از تداوم محدودیت غذایی بلند مدت حمایت می کند (59).
تنوع گسترده علایم برای آن دسته از متخصصین سلامت که با بیماری سلیاک آشنا نیستند، چالش برانگیز است.
مطالعات خانواده نشان داده است که حدود 50 % بیمارانی که به تازگی تشخیص داده می شوند، سیر بالینی بدون علایم داشته اند. بنابرین احتمالا نصف جمعیت تشخیص داده نشده، فرم بالینی بدون علایم دارند. با این وجود بسیاری از بیماران بدون علایم، یک نوع حالت طبیعی جدید را پس از شروع رژیم غذایی فاقد گلوتن گزارش می کنند و بیشتر آن ها بر رژیم غذایی فاقد گلوتن باقی میمانند.
5-تشخیص بیماری سلیاک
5-1- چرا تشخیص بیماری سلیاک مشکل است؟
- طیف وسیع تظاهرات بالینی که ممکن است در طول عمر بیمار متغییر باشد.
- علایم ممکن است با علایم سندرم روده تحریک پذیر همپوشانی داشته باشند.
- ممکن است بیماران دارای تظاهرات خارج روده ای یا حتی بدون علایم باشند.
- آگاهی کافی در بین پزشکان (و بیماران) در مورد بیماری سلیاک وجود ندارد.
- در برخی مناطق جغرافیایی مانند مناطق داخل حاره ای آفریقا امکانات تشخیصی کافی وجود ندارد.
برخی باورهای غلط درباره بیماری سلیاک:
- بیماری سلیاک یک بیماری نادر است.
- بیماری سلیاک فقط در موارد زیر دیده می شود:
- نژاد هندواروپایی
- غالبا در اروپا و ایالات متحده
- فقط در کودکی
- صرفا در بیماران با اسهال مزمن
- بیماری سلیاک پس از یک دوره درمانی قابل درمان است.
- بیماری سلیاک یک اختلال ملایم است و مشکل پس از تشخیص و رژیم غذایی فاقد گلوتن رفع می شود.
تشخیص سلیاک در کودکان و بالغین منوط بر وجود آنتیبادی های اختصاصی بیماری سلیاک همراه با بیوپسی روده ای است (15).
در بیماران دارای علایم، وجود نشانه های سوءجذب (سلیاک کلاسیک)، تیتر بالای (×10) اتوآنتیبادی (آنتی ترانس گلوتامیناز) که به وسیله اتوآنتیبادی مثبت یا اتوآنتیبادی دیگر (EMA یا DGP) در دومین نمونه خون تایید شود، برای تشخیص بیماری سلیاک، بدون بیوپسی کافی است و پس از آنکه همه جوانب به وسیله پزشک متخصص بررسی شود می تواند اعمال گردد (62).
- بیوپسی مجدد (بعد از درمان) برای بسیاری از بیماران در صورتی که سرولوژی اولیه مثبت و پاسخ به رژیم غذایی فاقد گلوتن رضایت بخش باشد، ضروری نیست. البته اتفاق نظری در این رابطه بین متخصصین یا گایدلاین ها وجود ندارد (63, 64).
- در صورتی که نتیجه بیوپسی اول و تست سرولوژیک قاطع نباشد (مانند انتروپاتی با سرم منفی) یا برای بیمارانی که به رژیم غذایی فاقد گلوتن پاسخ مناسبی نداده اند، بیوپسی دوم باید در نظر گرفته شود (65).
- در بیمارانی که رژیم غذایی فاقد گلوتن را شروع کرده اند ولی تشخیص مشکوکی دارند، چالش گلوتن به وسیله گلوتن خالص یا غذای حاوی گلوتن باید در نظر گرفته شود (66, 67).
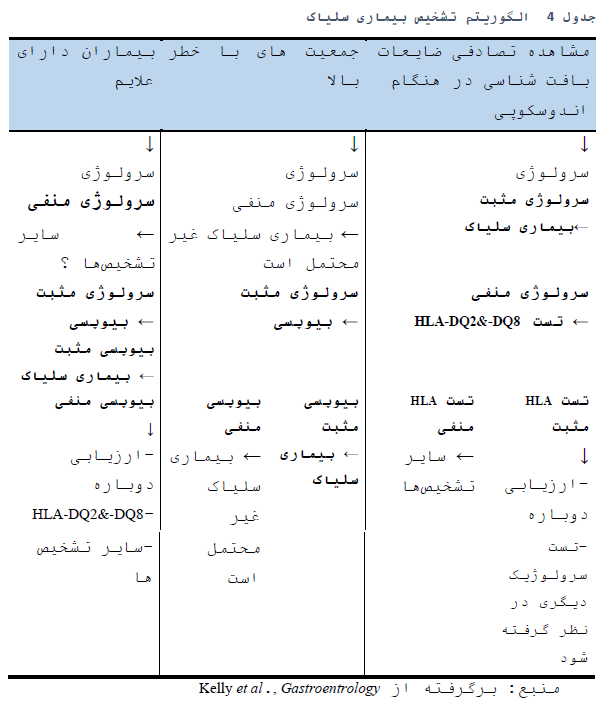
5-2- کدام بیماران باید آزمایش شوند؟
یک مطالعه مروری (68) جدید پیشنهاد می کند اگرچه بیماری سلیاک معیارهای متعدد WHOرا برای غربالگری انبوه دارد، هنوز شواهد کافی در خصوص منافع آن وجود ندارد و در حال حاضر راهبرد یافتن موارد در جمعیت های پرخطر رویکرد مناسبی می باشد.
5-2-1- بیماران دارای علائم بالینی دلالت کننده بر بیماری سلیاک
- اسهال مزمن یا متناوب (مانند IBS)
- کم خونی فقر آهن
- اختلال رشدی
- کاهش وزن
- کاهش رشد
- بلوغ دیررس
- آمنوره اولیه یا ثانویه
- خستگی دائم
- راش های مشابه درماتیت هرپتی فرم
- شکستگی با میزان کم تروما (بیماری استئوپنی یا استئوپروز)
- ناباروری
- آتاکسی
- افزیش بدون علت ترانس آمیناز
5-2-2- اختلالات مرتبط با افزایش ریسک بیماری سلیاک
- دیابت نوع یک
- بیماری تیروئیدی خودایمن
- بیماری کبدی خودایمن
- سندرم داون
- سندرم ترنر
- سندرم ویلیامز
- کمبود انتخابی IgA
- سطح بالای آمینوترانسفراز سرمی با علت ناشناخته
توجه: این اختلالات از نظر پاتولوژیک به بیماری سلیاک ارتباطی ندارند لیکن به دلیل شیوع بالای موارد بیماری سلیاک در مبتلایان به این اختلالات، انجام تست های سرولوژیک در آنها ضروری است.
5-2-3- بستگان درجه یک بیماران سلیاکی
- همه بستگان درجه یک باید برای بیماری سلیاک غربال شوند.
- تقریبا در 10-7 درصد بستگان درجه یک ممکن است بیماری سلیاک دیده شود و این ریسک به صورت معنی داری بستگی به رابطه با فرد مبتلا دارد.
- ریسک ابتلا به بیماری سلیاک در خواهر -برادرها 9 درصد، در فرزندان 8 درصد و در والدین حدود 3 درصد گزارش شده است. خواهران و دختران فرد مبتلا بالاترین ریسک ابتلا به بیماری سلیاک را دارند (به ترتیب یک از هفت و یک از هشت نفر). این ریسک در پسرها یک در 13، در برادرها یک از 16، در مادرها 1 از 32 و در پدرها یک از 33 می باشد. ریسک ابتلا به بیماری سلیاک در بستگان درجه دو (3/2 %) نسبت به جمعیت عمومی بالاتر است (69).
- HLA تایپینگ برای همه بستگان درجه یک؛ برای افراد HLA-DQ2/8 منفی لازم نیست. ریسک بیماری برای افراد HLA-DQ2/8 مثبت وابسته به آلل است و بالاترین ریسک در افراد هموزیگوت برای DQ2 است. تغییرات سرمی به سمت آنتیبادی های مثبت در سال به صورت تجمعی زیر 1 % بوده و بالاترین نرخ بروز بین 12 و 36 ماه است (44).
5-3- تفاوت معیارهای تشخیصی برای بیماری سلیاک
معیار های تشخیصی برای بیماری سلیاک در برخی نقاط جهان به دلایل مختلف ممکن است متفاوت باشد.
- تیتر برای اکثر تستهای سرولوژیک بر اساس مطالعاتی که بر روی جمعیت های هندواروپایی انجام گرفته تعیین شده است. تیتر برای تست مثبت، حساسیت و اختصاصیت ممکن است بسته به سن، نژاد و محل زندگی متفاوت باشد.
- با وجود اینکه بیماری سلیاک علت غالب اختلالات پرزهای روده در جمعیت های هندواروپایی است، در بسیاری از کشورها اسپروی حاره ای، آلودگی های انگلی و بیماری های روده ای ایمونوپرولیفراتیو از علل شایع اختلالات پرزهای روده می باشند.
5-4- تست های تشخیصی
5-4-1- آندوسکوپی بیماران مشکوک به بیماری سلیاک
با وجود اینکه اندوسکوپی حساسیت و اختصاصیت لازم را در مورد تشخیص بیماری سلیاک ندارد (70)، یافته های زیر (71) در اندوسکوپی موجب مشکوک شدن نسبت به بیماری سلیاک می شوند:
- تا خوردن چین های دوازدهه
- چاکدار شدن چین ها و الگوی موزاییکی در مخاط
- صاف شدن چینها
- کاهش تعداد و اندازه چین ها و یا ناپدید شدن چین ها همراه با حداکثر انسداد
- نبود پرز هنگام بزرگنمایی
- گرانوله به نظر رسیدن بولب دوازدهه
بیوپسی مخاط روده باید پس از مشاهده کامل ویژگی های آندوسکوپیک مناطق بالاتر اخذ شود. زمانی که شک بالینی بیماری وجود دارد، حتی در صورت نرمال بودن نمای آندوسکوپی، بیوپسی در حین آندوسکوپی باید انجام شود. زیرا اغلب بیماران سلیاکی نمای آندوسکوپی نرمال دارند. نبود یافته آندوسکوپی دارای ارزش پیشگویی پایینی برای رد احتمال بیماری سلیاک در جمعیت های با خطر پایین است (64, 70).
5-4-2- بیوپسی روده ای و بافت شناسی
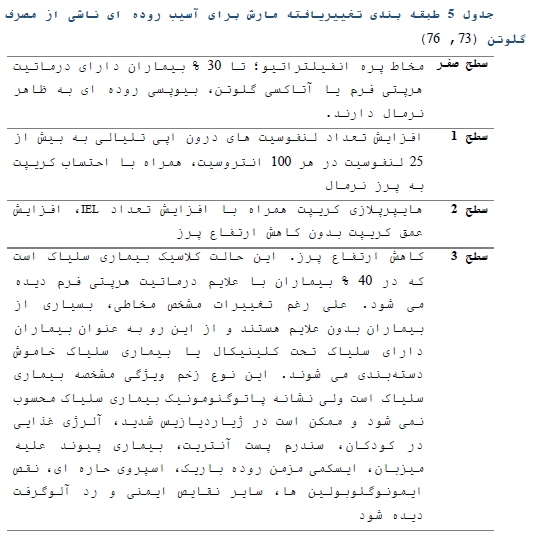
نمای غیر طبیعی پرزها در بیوپسی روده به همراه تست سرولوژیک مثبت معیار استاندارد طلایی برای تشخیص بیماری سلیاک است. هم اکنون طبقه بندی تغییر یافته مارش برای وضعیت غیر طبیعی پرزها به طور گسترده ای دارای کاربرد بالینی برای ارزیابی شدت آتروفی پرزها میباشد (63, 72, 73)
اگرچه تغییرات بافت شناسی به عنوان مشخصه بارز بیماری سلیاک در نظر گرفته می شود ولی نشانه پاتوگنومونیک نیست؛ چرا که تغییرات مشابهی در بیماری های متعددی شامل اسپروی حاره ای، آلودگی انگلی، نقص ایمنی متغیر شایع، انتروپاتی، HIV، دارو و انتروپاتی ناشی از آلرژی غذایی (مانند آلرژی به شیر گاو) دیده می شود.
بیماری سلیاک غالبا مخاط پروگزیمال روده باریک را تحت تاثیر قرار می دهد و به سمت دیستال روده باریک به تدریج از شدت آسیب کاسته می شود. با این وجود در موارد شدید ممکن است زخم ها به مناطق دیستال گسترش بیابند (20).
ممکن است زخم ها در دوازدهه و ژژنوم فوقانی تکه تکه باشند، این مسئله موجب می شود در صورتی که تعداد نمونه کافی گرفته نشود برخی از آنها از دست بروند. تعداد 6-4 نمونه باید از قسمت دوم دوازدهه و بولب دوازدهه گرفته شود (3). در بیماران با بیماری سلیاک فوق کوتاه ممکن است پاتولوژی به بولب دوازدهه محدود باشد که نشان دهنده اهمیت اخذ بیوپسی از این منطقه می باشد (74). نمونه بیوپسی باید در شرایطی گرفته شود که بیمار تحت رژیم غذایی حاوی گلوتن قرار گرفته باشد (حداقل 3 گرم گلوتن در روز به مدت 2 هفته) (75). در بیماران با بافت شناسی منفی و سرولوژی مثبت، (آنتیبادی با تیتر بالا ضد tTG، ضد DGP و
یا آنتیبادی های اندومیزیال) لازم است مجددا نمونه بیوپسی اخذ شود .
نمونه های بیوپسی که از دوازدهه پروگزیمال بالاتر از آمپول واتر گرفته می شوند ممکن است نتیجه مثبت کاذب باشد (مانند کشیده شدن پرزها) که به وسیله غده های زیر مخاطی برونر تولید می شوند و ممکن است اشتباها به صورت آتروفی ویلی ها تفسیر شوند.
زیر میکروسکوپ نوری بارزترین یافته های بافت شناسی در بیماران سلیاکی که از رژیم غذایی حاوی گلوتن استفاده می کنند عبارت اند از (209:
- افزایش تراکم لنفوسیت های درون اپی تلیالی (بیش از 25 لنفوسیت به ازای هر 100 سلول اپی تلیال)
- هایپرپلازی کریپت ها همراه با کاهش نسبت پرز به کریپت
- پرزهای صاف یا آتروفیک
- ارتشاح سلول های تک هسته ای در لامینا پروپریا
-
تغییرات اپی تلیال شامل وضعیت غیر طبیعی در ساختار سلول های اپی تلیال
اکیدا توصیه می شود گزارش پاتولوژیست شامل تغییرات ساختاری مذکور، تعداد لنفوسیتهای درون اپی تلیالی و تفسیر آنها بر اساس طبقه بندی تغییر یافته مارش باشد. پاتولوژیست همچنین باید در مورد کیفیت بیوپسی اظهار نظر کند. در صورت کیفیت پایین بیوپسی همراه با قطعات کوچک پراکنده، پاتولوژیست باید از تشخیص خودداری کند. در این گونه موارد آندوسکوپی همراه با بیوپسی متعدد باید قبل از شروع رژیم غذایی فاقد گلوتن تکرار شود.
مجموعه مطالعات انجام شده توسط پروفسور مارش امکان تفسیر آسیب های مخاطی گسترده ناشی از گلوتن را فراهم آورده است (20). بر این اساس تغییرات بافت شناسی سلیاک از محدوده مخاط نرمال تا آتروفی کلی پرزها در بیماران سلیاکی طبقهبندی شده است. طبقه بندی تغییر یافته مارش کاربرد بالینی گسترده ای دارد (73, 76). طبقه بندی ساده تری نیز به منظور کاهش تغییرپذیری حاصل از مشاهده پیشنهاد شده است (77).
5-5- تست های آنتی بادی سرمی
دو گروه اصلی از مارکرهای سرولوژیک نشان داده شده است که برای بیماری سلیاک درمان نشده بسیار حساس و اختصاصی هستند (78, 79):
- آنتیبادی هایی که اتوآنتیژن را هدف قررار می دهند
- آنتیبادی های ضداندومیزیال و آنتیبادی های ضد ترانس گلوتامیناز بافتی
- آنتیبادی هایی که عامل بیماری (گلیادین) را هدف قرار می دهند
- آنتیبادی های علیه پپتید های گلیادین دآمیده سنتتیک
همه این آنتیبادی ها بر پایه ایمونوگلوبولین A (IgA) یا ایمونوگلوبولین G (IgG) هستند. خصوصا تست های بر مبنای IgG برای تشخیص بیماری سلیاک در بیماران مبتلا به نقص کارایی IgA مفید هستند.
- در بیماران دارای تیتر آنتیبادی پایین و بیوپسی نرمال ممکن است تست مثبت کاذب مشاهده شود. در حالی که بیمار از رژیم غذایی حاوی گلوتن استفاده می کند، تست سرولوژیک باید پس از شش ماه تکرار شود. در صورت منفی شدن تست ها این حالت به عنوان مثبت گذرا در نظر گرفته می شود. درباره پیگیری دراز مدت در چنین بیمارانی اطلاعات محدودی وجود دارد.
- در صورت مثبت ماندن سرولوژی، این بیماران ممکن است بیماری سلیاک بالقوه داشته باشند و باید مورد پیگیری قرار گیرند و نمونه بیوپسی مجددا بررسی شود. در اکثریت بیماران دارای بیماری سلیاک بالقوه بیماری سلیاک بعدا به وجود می آید.
- علاوه بر این 30 % بیمارن دارای درماتیت هرپتی فرم که سرولوژی مثبت دارند دارای هیستولوژی نرمال می باشند. با این وجود رژیم غذایی فاقد گلوتن با وجود هیستولوژی منفی توصیه می شود، چرا که موجب منفی شدن سرولوژی و بهبود زخم های پوستی می گردد.
- افراد بدون علایم با تیتر مرزی باید بعد از 3-6 ماه پس از شروع رژیم غذایی معمول (بدون هیچ گونه محدودیت در رابطه با مصرف گلوتن) دوباره آزمایش شوند. بیماران دارای علایم با سرولوژی مرزی، حدالامکان پس از افزایش گلوتن در رژیم غذایی، حتما باید تحت بیوپسی قرار بگیرند.
- تست های آنتیبادی علیه گلیادین طبیعی (AGA-IgA یا AGA-IgG) هیچ گونه حساسیت و اختصاصیتی برای بیماران سلیاکی ندارند و نباید استفاده شوند (62).
- آزمایشات اندازه گیری آنتی بادی های اختصاصی سلیاک در مدفوع، ادرار و بزاق کارایی پایین تری در مقایسه با آزمایشات خونی دارند و نباید در کارهای بالینی مورد استفاده قرار گیرند.
5-5-1- IgA EMA
آنتیبادی های IgA اندومیزیال به اندومیزیوم اتصال می یابند. اندومیزیوم نوعی بافت پیوندی است که پیرامون ماهیچه های صاف را گرفته و الگوی رنگ آمیزی خاصی به وجود می آورد که به وسیله ایمونوفلورسانس غیرمستقیم قابل شناسایی است (80). آزمایش ها حد الامکان باید مورد تیتراسیون قرار بگیرند چرا که حتی تیترهای پایین آنتیبادی های IgA اندومیزیال سرم برای بیماری سلیاک اختصاصی هستند. این تست گران، وابسته به کاربر، پرزحمت و نیازمند متخصص برای تفسیر صحیح است. آنتیژن هدف این آنتیبادی ترانس گلوتامیناز بافتی-2 می باشد. حساسیت آنتیبادی IgA اندومیزیال متوسط است (حدود 80 %) و بالاترین اختصاصیت را در میان تست های اختصاصی بیماری سلیاک برای بیماری سلیاک درمان نشده (فعال) دارد (نزدیک به 100 % در صورتی که توسط افراد با تجربه انجام شود) (62, 78).
5-5-2- IgA ضد tTG
آنتیبادی های ضد tTG حساسیت و اختصاصیت بالایی برای تشخیص بیماری سلیاک دارند (81). تست های الایزا برای آنتیبادی IgA ضد tTG امروزه دارای کاربرد بالینی گسترده ای می باشد. این تست ها به صورت وسیع در دسترس بوده، انجام آن راحتتر است، وابستگی کمتری به کاربر داشته و از آزمایش ایمونوفلورسانس که برای تشخیص آنتیبادی های IgA اندومیزیال استفاده می شود، ارزانتر می باشد (78, 79). جالب آنکه tTG و EMA اتوآنتیژن یکسانی (TG2) را مورد هدف قرار می دهند. دقت تشخیص در آزمایشات IgA ضد tTG با استفاده از tTG انسانی به جای tTG غیر انسانی (با دقت تشخیصی کمتر، که در کیت های قدیمی استفاده می شد) بهبود یافته است. علی رغم استفاده گسترده از آنتیبادی ضد tTG در سراسر جهان تفاوت های اساسی در کارایی کیت های تجاری مختلف دیده می شود (79).
5-5-3- آنتیبادی های IgA و IgGضد DGP
الایزا بر مبنای شناسایی پپتیدهای گلیادین دآمیده که به صورت سنتتیک تولید شده اند چند سال پیش معرفی شد و تحقیقات بالینی دقت بالای این آزمون را در جمعیت های با خطر بالا و پایین نشان دادند. این مسئله در مطالعات اخیر نیز تایید شده است (82).
آنتیبادی های IgG ضد DGP عملکرد بهتری نسبت به تست های بر مبنای IgA برای تشخیص بیماری سلیاک داشته اند (84-82).
5-5-4- انتخاب بهترین تست سرولوژیک در موقعیت های بالینی متفاوت
متفاوت
تست های سرولوژیک اختصاصی بیماری سلیاک به دو دلیل زیر اهمیت دارند (78, 85):
1. به منظور تایید وابستگی به گلوتن در بیماران با انتروپات
- EMA-IgA، IgA ضد tTG و IgG و IgA ضد DGP عملکرد مشابهی دارند و با ارزش ترین جایگزین ها را برای تایید وابستگی به گلوتن عرضه می کنند.
- تست های بر مبنای IgG (tTG، EMA و ضد DGP) در بیماران دارای نقص کارایی IgA که برای تست های متناظر برمبنای IgA منفی هستند مفید می باشد.
2. به منظور انتخاب بیماران برای بیوپسی دوازدهه
به منظور کاهش نیاز به بیوپسی دوازدهه و بر اساس اختلاف دقت تست های سرولوژیک، تعدادی الگوریتم برای انتخاب بیماران برای بیوپسی در موقعیت های بالینی مختلف استفاده می شود.
انتخاب تست سرولوژیک برای غربالگری جمعیت عمومی
- IgA ضد tTG به همراه IgA تام و یک تست بر مبنای IgG (در افراد دارای نقص کارایی IgA) به دلیل حساسیت بالا و اختصاصیت بسیار خوب، الگوریتمی با گسترده ترین استفاده برای غربالگری می باشد.
- ارزش پیشگویی مثبت در جمعیت های با خطر پایین بستگی به سطح تیتر دارد (86, 87). افراد بدون علایم با تیتر پایین (برای مثال کمتر از 3 برابر مقدار cut-off) باید پس از 3-6 ماه استفاده از رژیم غذایی با گلوتن بالا تحت آندوسکوپی مجدد قرار گیرند و بیوپسی آنها بررسی شود.
- یک الگوریتم سرولوژیک بر اساس استفاده متوالی از آزمون های غربالگری اختصاصی تر (برای مثال EMA) به صورت گسترده به منظور بهبود دقت تشخیصی در جمعیت های عمومی مورد استفاده قرار گرفته است (86, 87).
- استفاده از چند تست ممکن است در پیدا کردن موارد مشکوک مفید باشد. در صورت مثبت شدن همزمان چند تست تشخیص بیماری سلیاک بسیار محتمل است (85, 89, 90).
تست EMA نیاز به کاربر متخصص دارد. تست های بر مبنای الایزا یا رادیوایمونواسی برای شناسایی IgA ضد tTG یا IgG ضد DGP در شرایط با سطح پایینی از تخصص توصیه می شود.
5-6- ژنوتایپینگ HLA-DQ2/8
ژنوتایپینگ HLA-DQ2/8 در تشخیص موارد با سرولوژی منفی و به منظور رفع احتمال بیماری سلیاک قبل از اعمال چالش گلوتن اهمیت دارد.
5-7- رژیم غذایی بدون گلوتن
در برخی مناطق جغرافیایی مانند آفریقای بین حاره ای که امکانات تشخیصی وجود ندارد یا در دسترس نیست رژیم غذایی بدون گلوتن در صورتی که موجب بهبود بالینی چشمگیری شود می تواند به عنوان ابزار تشخیصی غیر مستقیم در نظر گرفته شود (29). به همین ترتیب در بسیاری از مناطق آفریقا می تواند به عنوان درمان کم هزینه و بدون ریسک معرفی شود. مشکل اصلی متقاعد کردن والدین برای تغذیه کودک دچار سوء تغذیه با یک رژیم غذایی جدید می باشد. خصوصا که این رژیم غذایی باید به صورت مادام العمر مصرف شود (اگرچه این مشکل مختص این مناطق نیست).
با وجود اینکه این استراتژی برای مناطق دور افتاده مناسب است، چرا که تنها راه تایید و درمان بیماری سلیاک در این مناطق می باشد، ولی در شرایطی که انجام سرولوژی در دسترس باشد قویا بررسی بر اساس سرولوژی را توصیه می کنیم.
در همه افرادی که رژیم غذایی بدون گلوتن را شروع کرده اند (به هر دلیلی_ برای مثال آلرژی به گندم، سبک زندگی یا IBS) بیماری سلیاک قبل از شروع رژیم غذایی حتما به وسیله یک تست منفی برای آنتی بادی اختصاصی سلیاک رد شود.
5-8- تشخیص افتراقی
طیف وسیعی از تظاهرات بالینی بیماری سلیاک وجود دارد و ممکن است با علایم بسیار دیگری از بیماری های گوارشی مشابه باشد. به علاوه زخم های هیستولوژیک بیماری سلیاک در شرایط بسیار دیگری دیده می شوند مانند:
- اسپروی حاره ای
- نقص ایمنی مختلط
- ژیاردیازیس
- انتروپاتی ناشی از دارو (اومسارتان، میکوفنولات)
- انتروپاتی HIV
- آسیب پرتوی
- شیمی درمانی
- بیماری پیوند علیه میزبان
- ایسکمی مزمن
- بیماری کرون
- آلودگی به هلیکوباکتر پیلوری
- گاستروانتریت ائوزینوفیلیک
- انتروپاتی در اثر آلرژی غذایی (در کودکان)
- انتروپاتی خود ایمن
- سوء تغذیه شدید
5-9- چرا باید بیماری سلیاک را شناسایی کنیم؟
برای بیماران سلیاکی دارای علایم، استفاده از رژیم غذایی بدون گلوتن ممکن است موجب بهبود قابل ملاحظه علایم، اندازه گیری های بیوشیمیایی غیرعادی و کیفیت زندگی شود (91). درمان مادام العمر همچنین موجب کاهش خطر بروز عوارض بدخیم و غیر بدخیم می شود. نگرانی هایی درباره اثرات طولانی مدت در بیماران بدون علایم وجود دارد و اینکه آیا رژیم غذایی بدون گلوتن برای همه بیماران ضروری است یا خیر. مطالعات متعددی پیشنهاد می کنند بیمارانی که طی برنامه های غربالگری شناسایی می شوند و بیشتر آنها به عنون بیماران بدون علایم در نظر گرفته می شوند کیفیت زندگی شان در دراز مدت با استفاده از رژیم غذایی فاقد گلوتن بهبود می یابد (92, 93).
بیمارانی که بیماری آنها در دراز مدت به صورت درمان نشده باقی مانده خطر بالای مشکلات بدخیمی، خوشخیمی و مرگ و میر را دارند (64, 94, 95).
- سرطان- بالاترین ریسک در سال های ابتدایی و پس از تشخیص تا سال پنجم نزدیک به ریسک نرمال کاهش می یابد (96)، افزایش ریسک کلی 35/1
- لنفوم بدخیم
- آدنوکارسینوم روده کوچک
- تومورهای اوروفارینگ
- ناباروری بدون علت
- اختلال در سلامت و رشد استخوان (استئوپورز 40-30 %)
- شکستگی استخوان _ 35 % افزایش ریسک برای بیماران سلیاکی دارای علایم کلاسیک (97, 98)
- ریسک مرگ و میر در بیماران سلیاکی بالغ به دلیل افزایش ریسک بدخیمی جنینی (نرخ خطر 31/1؛ 95 % بازه اطمینان، 51/1-13/1 در یک مطالعه) (64)
- پیامدهای نامطلوب بارداری (99)
6 - مدیریت بیماری سلیاک
در حال حاضر تنها راه درمان بیماری سلیاک رژیم غذایی مادام العمر بدون گلوتن می باشد (20, 66, 100, 101). هیچ غذا یا داروی حاوی گلوتن از گندم، جو و چاودار یا مشتقات آنها نباید استفاده شود، چرا که حتی مقادیر کم گلوتن ممکن است زیان آور باشد.
- حذف گلوتن از رژیم غذایی (کاهش مصرف گلوتن به کمتر از 20 میلیگرم در روز) در بسیاری از بیماران موجب بهبود علایم، هیستولوژی و سروولوژی می شود (84, 93).
- تقریبا 70 % بیماران بهبود علایم را ظرف مدت دو هفته پس از شروع رژیم غذایی فاقد گلوتن گزارش می کنند (93).
- رشد و نمو کودکان با رعایت رژیم غذایی بدون گلوتن به حالت عادی بر می گردد. بسیاری از عوارض این بیماری با استفاده از رژیم غذایی بدون گلوتن قابل پیشگیری است (102, 103).
- با رعایت رژیم غذایی بدون گلوتن تیتر آنتیبادی های اختصاصی بیماری سلیاک به حد نرمال باز می گردد.
- اگرچه وضعیت پرزهای روده در طی ماه های ابتدایی شروع رژیم غذایی بدون گلوتن شروع به بهبود می کند، بهبود کامل هیستولوژیک ممکن است سالها به طول انجامد و حتی در برخی بیماران هرگز حاصل نشود (104, 105). شواهدی مبنی بر اینکه ممکن است عدم بهبود هیستولوژیک در اثر مصرف مداوم گلوتن باشد وجود دارد (64).
حد امن مصرف گلوتن در بیماران متفاوت است و در حدود 100-10 میلیگرم در روز در نظر گرفته می شود. اگرچه مطالعه اخیر اشاره می کند که حد بالا نباید بیشتر از 50 میلیگرم در روز باشد (106).
- جو دوسر خالص و بدون آلودگی در 95 % بیماران بی خطر است و در برخی کشورها (مثل فنلاند) بیش از 15 سال است بدون افزایش ریسک انتروپاتی به عنوان بخشی از رژیم غذایی بدون گلوتن در بالغین و کودکان استفاده می شود. زیرگروه کوچکی (کمتر از 5 %) وجود دارد که جو دوسر برایشان ایمن نیست (107, 108). در برخی کشورها مقاومتی در برابر توصیه استفاده آزاد از جو دوسر وجود دارد چرا که تضمین اینکه جو دوسرهای تجاری موجود، عاری از آلودگی با سایر دانه های غلات باشند مشکل است. بنابرین رژیم غذایی فاقد جو دوسر حداقل در ماه های ابتدایی درمان توصیه می شود.
- برنج و ذرت در رژیم غذایی بدون گلوتن جای می گیرند.
با وجود اینکه بسیاری از بیماران سریعا به رژیم غذایی بدون گلوتن پاسخ می دهند، نرخ پاسخ بسیار متغیر است. در موارد شدید بیماری ممکن است به منظور جایگزینی مایعات و الکترولیت ها، تغذیه داخل وریدی، آهن، ویتامینها و گاها استروئیدها نیاز به بستری در بیمارستان باشد (109).
بیماران باید به استفاده از غذاهای حاوی مقادیر بالای آهن و فولیک اسید تشویق شوند، خصوصا در مواردی که کمبود این عناصر ثبت شده باشد. بیماران باید با یک متخصص تغذیه که اطلاع کافی از رژیم غذایی فاقد گلوتن دارد خصوصا در طی سال اول بعد از تشخیص مشورت کنند. همه کارشناسان تغذیه با رژیم غذایی بدون گلوتن آشنایی کافی ندارند و گروه های حمایتی محلی و بین المللی باید اطلاعات لازم را در اختیار آنها قرار دهند.
آموزش و حمایت بیماران در زمان تشخیص بسیار مهم است و باید یک قسمت اصلی از مدیریت بیماری باشد (110).
نوجوانان مبتلا به بیماری سلیاک باید تحت یک فرایند آموزشی و انتقال مدیریت شده به مراقبت بالغین قرار گیرند (111).
6-1- توصیه های بعد از تشخیص
به منظور پیگیری بیماری سلیاک در نظر گرفتن پیامدهای موارد زیر در موقع ارزیابی رژیم غذایی بدون گلوتن اهمیت دارد:
- تست های سرولوژیک نمی توانند مصرف حداقلی گلوتن را تشخیص دهند بنابرین یک راهبرد بین رشته ای به منظور ارزیابی دقیق وضعیت بالینی و رژیم غذایی بدون گلوتن لازم است. این ارزیابی باید توسط پزشک متخصص و کارشناس تغذیه انجام شود (93, 112).
- نیاز به بیوپسی مجدد به منظور ارزیابی بهبود زخم ها و بررسی پایبندی بیمار به رژیم غذایی بدون گلوتن مسئله چالش برانگیزی بین متخصصین است. اگرچه این روش در عمل غالبا استفاده می شود ضرورت آن برای بیمارانی که از نظر بالینی به رژیم غذایی بدون گلوتن پاسخ می دهند و سطح آنتیبادی آنها کاهش یافته یا منفی است روشن نیست. در میان متخصصینی که تکرار بیوپسی را توصیه می کنند نیز زمان گرفتن نمونه به درستی مشخص نشده است. معمولا التیام کامل مخاط روده خصوصا در بالغین کند بوده یا ناکامل است. بیوپسی روده ای در بیمارانی که علی رغم پایبندی کامل به رژیم غذایی بدون گلوتن علایم مداوم بروز می دهند ضروری است.
- ادامه مصرف بالا یا ناچیز گلوتن (عمدا یا به صورت غیر عمد) محتمل ترین علت عدم پاسخ به درمان در برخی بیماران است (108, 113, 114).
موارد زیر خلاصه ای از توصیه ها برای پیگیری بعد از تشخیص و ابزارهایی برای پایش رعایت رژیم غذایی فاقد گلوتن در طی اولین سال بعد از تشخیص می باشد:
ارزیابی بالینی: علایم را بررسی کرده و تست های بالینی را به عمل آورید (مانند شمارش کامل خون، وضعیت آهن، ویتامین B12، سرولوژی سلیاک، کلسیم و ویتامین D) تست های سرولوژی بیماری سلیاک (بهترین پیشگویی کننده ها درحال حاضر: تعیین کمی IgA ضد tTG و IgA ضد DGP) (84, 104, 115).
- کودکان و نوجوانان هرساله باید پایش شوند (تن سنجی، وضعیت بلوغ، سرولوژی اختصاصی سلیاک) توسط متخصص کودکان یا متخصص گوارش کودکان تا زمانی که به رشد کامل قدی برسند.
- اسکن تراکم معدنی استخوان به منظور اندازه گیری پایه ای تراکم استخوان می تواند انجام شود (116).
- واکسیناسیون علیه پنوموکوک، هموفیلوس آنفولانزا و مننگوکوک (117).
- مشاوره با کارشناس تغذیه: ارزیابی وضعیت تغذیه ای و رعایت رژیم غذایی بدون گلوتن بر اساس مصاحبه، دفتر یادداشت تغذیه ای و تعداد دفعات صرف غذا (همزمان با معاینه بالینی)
- کمک به بیمار به منظور پیوستن به گروه های حمایتی با تجربه درباره بیماری سلیاک- سطح پایبندی به رژیم غذایی بدون گلوتن با عضویت در گروه های حامی و پیگیری های منظم تغذیه ای ارتباط دارد (118, 119).
- در صورت نیاز و یا درخواست، مشاوره روانشناسی توصیه می شود (120).
6-2- رژیم غذایی بدون گلوتن
6-2-1- مواد غذایی غیر مجاز در رژیم غذایی بدون گلوتن
دانه ها، نشاسته ها و آرد های غیرمجاز در رژیم غذایی بدون گلوتن (101, 102):
- جو
- سبوس
- بلغور
- کوسکوس
- آرد دوروم
- اینکورن (Triticum monococcum)*
- اِمِر (Triticum dicoccum)*
- فارو*
- گلوتن، آرد گلوتن
- آرد گراهام
- کاموت™ (گندم خراسان)*
- مالت، عصاره مالت، چاشنی مالت، سوپ مالت
- جو دوسر، سبوس جو دوسر، سوپ جو دوسر، که برچسب بدون گلوتن نداشته باشند.
- چاودار
- سمولینا (گندم دوروم)*
- اسپلت (گندم دینکل، Triticum spelta)
- تریتیکاله
- جوانه گندم، نشاسته گندم، سبوس گندم
- هر چیزی که در نامش دارای گندم، جو یا چاودار باشد.
* ارقام گندم
جو دوسر فاقد آلودگی در برخی کشورها در دسترس است و مقادیر مشخص قابل استفاده است. با وجود اینکه مطالعات متعددی بیان می دارند که مقدار متوسط جو دوسر توسط بیماران سلیاکی قابل استفاده است، نگرانی هایی در رابطه با آلودگی جو دوسر با گندم و جو در طی فرآوری وجود دارد.
6-2-2- مواد غذایی مجاز در رژیم غذایی بدون گلوتن
دانه ها، آرد ها و نشاسته های فاقد گلوتن مجاز در رژیم غذایی بدون گلوتن:
- تاج خروس
- عصاره میوه جات
- آرد لوبیا
- گندمسیاه
- ذرت
- نخود
- دانه ها
- ارزن
- آرد مونیتا (نوعی برنج هندی)
- آرد آجیل
- جو دوسر (بدون آلودگی، دارای برچسب بدون گلوتن)
- آرد سیب زمینی، نشاسته سیب زمینی
- کینوآ
- همه انواع برنج (قهوه ای، سفید، شیرین، انواع وحشی، جاسمین، باسمتی، برنج چسبناک (گلوتینوس)، برنج پوست کنده و سبوس برنج)
- آرد سورگوم
- تاپیوکا
- آرد تف
اگرچه مصرف این دانه ها، آرد ها و نشاسته های بدون گلوتن در رژیم غذایی بدون گلوتن مجاز است، نگرانی هایی در رابطه با آلودگی آنها با گندم و جو وجود دارد. آردها و نشاسته ها قبل از اجازه مصرف برای بیماران سلیاکی باید برای محتوای گلوتن آنالیز شوند. برخی کشورها به صورت دوره ای لیست محصولات بدون گلوتن را در اینترنت به روز می کنند. غذاهای موجود در این لیست، از نظر محتوای گلوتن آنالیز شده اند (122, 123).
6-2-3- سایر غذاها برای رژیم غذایی بدون گلوتن
- لبنیات
- گوشت تازه و گوشت های نگهداری شده بدون گلوتن
- غذاهای دریایی
- تخم مرغ
- حبوبات: عدس، نخود (لوبیای گاربانزو)، نخودفرنگی، لوبیا، آجیل، دانه ها_ به صورت بسته بندی شده، نه باز
- میوه ها و سیزی جات (تازه، یخ زده، کنسرو شده)، آبمیوه ساده
- روغن های مایع
6-2-4- موارد متفرقه مجاز در رژیم غذایی بدون گلوتن
- شیرینیجات: عسل، شربت ذرت، شکر (سفید و قهوه ای)
- تنقلات: پاپکورن ساده، آجیل خام، ترشی ساده، زیتون، چیپس سیب زمینی بدون گلوتن، سیب زمینی برشته
- ادویهجات: گیاهان طبیعی، فلفلسیاه خالص، سرکه (سیب، انگور)
آشپزی و تهیه غذا: باید بیماران آموزش کافی در خصوص عدم آلوده کردن غذای فاقد گلوتن را ببینند. استفاده از ظروف و وسایل آشپزی ، میز آشپزی، توستر و... جداگانه.
اکثر غذاهایی که به صورت صنعتی تولید می شوند دارای محتویات غیرمجاز می باشند - توجه به برچسب بسیار مهم است و لیست های موجود باید برای مواد غذایی مجاز بررسی شوند. در رابطه با این مسئله دسترسی به گروه های حمایتی حائز اهمیت است.
رژیم غذایی بدون گلوتن فیبر کمی دارد. باید به بیماران توصیه شود که از رژیم غذایی پرفیبر حاوی برنج، ذرت کامل، سیب زمینی و میوه فراوان استفاده کنند. هر نوع کمبود تغذیه ای شامل آهن، فولیک اسید، کلسیم، و به ندرت ویتامین B12 باید اصلاح شود.
6-3- پیشگیری – پایش
در حال حاضر هیچ گونه اقدام معینی برای پیشگیری از بیماری سلیاک بر اساس زمان عرضه گلوتن در دوره نوزادی یا در طی تغذیه با شیر مادر وجود ندارد. آزمایشات کنترل شده تصادفی به منظور القا تحمل به وسیله خوراندن مقادیر کم گلوتن (48) یا تاخیر در عرضه گلوتن تا 12 ماهگی (49)، همگی با شکست مواجه شده اند و اهمیت مقدار گلوتن هنوز در هاله ای از ابهام باقی مانده است (51, 124, 125). در حال حاضر تشخیص و درمان به موقع معتبرترین روش به منظور پیشگیری ثانویه از بیماری سلیاک می باشد (126).
در رابطه با این بحث که چگونه تشخیص اختلالات مرتبط با گلوتن را بهبود ببخشیم برخی افراد تغییر روش از یافتن موارد بر پایه ریسک به سیاست فعال تست سرولوژی بیماری سلیاک را در جمعیت عمومی توصیه می کنند (68, 127).
6-4- راهکارهای مدیریتی جدید
همچنانکه مراحل درگیر در ایمونوپاتولوژی بیماری سلیاک آشکار می شوند اهداف ایمونوپاتوژنیک متعددی برای یافتن درمان های جایگزین مانند هضم درون لومینال گلوتن، بهبود عملکرد سدهای دفاعی و تعدیل کننده های سیستم ایمنی کاوش می شوند. بسیاری از راهکارهای جدید به مرحله آزمایشات بالینی رسیده اند ولی هیچ یک در حال حاضر برای استفاده بالینی در دسترس نمی باشند.
6-5- پایش
6-5-1- ارزیابی آزمایشگاهی
پایش سرولوژی برای تایید صحت رژیم فاقد گلوتن بیماری سلیاک مفید است و افت غلظت آنتیبادی های اختصاصی بیماری سلیاک نشان دهنده کاهش مقدار گلوتن است ولی توانایی محدودی برای مشخص کردن رعایت کامل رژیم غذایی دارد. در صورت نرمالیزه کردن سطح آنتیبادی ها افزایش آن ها نشان دهنده مصرف گلوتن توسط بیمار می باشد. رعایت کامل رژیم غذایی بدون گلوتن باید منجر به التیام روده ای بشود ولی این مسئله حتی در بیمارانی که شدیدا از مصرف گلوتن پرهیز می کنند نیز اتفاق نمی افتد.
بازه زمانی تشخیص: هر 6-3 ماه تا زمانی که تست های baseline غیرطبیعی اصلاح شوند یا تا زمان تثبیت علایم بالینی؛ هر 2-1 سال
- مطالعات پیشنهاد می کنند که تست های دوره ای IgA ضد tTG یا IgA ضد DGP راه حل مناسبی برای پایش رعایت رژیم غذایی می باشند.
- اگرچه این تست ها بی احتیاطی های تغذیه ای جزیی را شناسایی نمی کنند. تیترهای نرمال در مورد ادامه مصرف گلوتن یا انتروپاتی حساس نیستند. کاهش مستمر غلظت آنتیبادی سرم به رعایت رژیم غذایی توسط بیمار دلالت دارد.
- مقدار مرزی بدون تغییر، افزایش یافته یا در حال افزایش دلالت بر مصرف قابل توجه گلوتن دارد (64).
6-5-2- مشاوره تغذیه ای
بازه زمانی: به صورت ایده آل هر 6-3 ماه تا بهبود علایم بالینی، سپس هر 2-1 سال. این مسئله خصوصا در مورد زنان در سنین باروری و در حین بارداری اهمیت دارد. یک متخصص تغذیه باید با مقاصد زیر مشاوره ارائه کند:
- ارزیابی وضعیت تغذیه ای بیمار در حال حاضر.
- بررسی جذب درشت مغذی ها و ریز مغذی ها و شناسایی کمبود ها و بیشبود ها.
-این مسئله اهمیت دارد که بیماران سلیاکی با مشاوره متخصص، رژیم غذایی متعادلی شامل ویتامین ها، کلسیم و فیبرها مصرف نمایند.
- بررسی عادات تغذیه ای و عوامل بالقوه موثر در دسترسی به رژیم غذایی مطلوب.
- فراهم کردن اطلاعات لازم و شروع رژیم غذایی بدون گلوتن.
- فراهم کردن یادگیری تغذیه ای
- پایش و ارزیابی رژیم غذایی و بهبود مشاوره تغذیه ای
بیمارانی که نمی تواند رژیم غذایی را رعایت کنند نیاز به حمایت و مشاوره روانشناسی دارند.
6-5-3- پایداری علایم
پایداری علایم معمولا به وسیله مصرف مستمر گلوتن ایجاد می شود. دشواری معمول در مورد رژیم غذایی بدون گلوتن، آلودگی متقاطع و وجود گلوتن غیر منتظره در محصولات غذایی یا دارویی فرآوری شده می باشد. گلوتن به صورت گسترده در محصولات غذایی استفاده می شود و ماده تشکیل دهنده پنهان محسوب می گردد. از این رو، رعایت احتیاط از جانب بیماران در جهت بررسی مواد تشکیل دهنده فرآورده های غذایی که خریداری می کنند ضروری است. در صورتی که پاسخ به رژیم غذایی بدون گلوتن مطلوب نباشد مصرف عمدی یا غیر عمدی گلوتن باید در نظر گرفته شود. در چنین مواردی ادامه سرولوژی مثبت نشان دهنده عدم رعایت رژیم غذایی توسط بیمار می باشد.
لیست علل پایداری علایم در بیماران سلیاکی:
- همپوشانی با سندرم روده تحریک پذیر یا مصرف غیر عمدی گلوتن
- تشخیص اشتباه
- عدم تحمل لاکتوز اولیه
- آلرژی غذایی به موادی غیر از گندم
- نارسائی پانکراس
- کولیت میکروسکوپی
- رشد بیش از حد باکتری های روده
- بیماری التهابی روده
- ژژونیت اولسراتیو*
- لنفوم سلول T مرتبط با انتروپاتی*
- بیماری سلیاک مقاوم*
* این موارد را می توان به عنوان پیامدهای بیماری سلیاک طولانی مدت در نظر گرفت.
مراقبت گذار از کودکی به بزرگسالی
6-6- انتقال مراقبت از کودکی به بزرگسالی
نوجوانان یا بالغین جوان مبتلا به بیماری سلیاک قبل و حین انتقال به مراقبت پزشکی بالغین در معرض خطر ترک مراقبت پزشکی هستند (128, 129). به طور کلی بالغین سلیاکی به مراقبت از رژیم غذایی عادت دارند و به سرعت غذاهایی را که باید بخورند یاد می گیرند. با این وجود نوجوانان معمولا به کمک والدین و مراقبین نیاز دارند و نمی توانند در برخورد با بیماری به صورت مستقل عمل کنند. گایدلاین معینی برای پر کردن فاصله بین خدمات بالغین و کودکان وجود ندارد و مراقبت های پزشکی گذار توصیه می شوند. کلینیک های گذار باید بر آموزش (تغذیه ای و مسائل سلامت) و نیاز به پایش بیماری تمرکز کنند و با مسائل روانشناختی که به وجود می آیند برخورد مناسبی داشته باشند (111).
6-7- بیماری سلیاک مقاوم
بیماری سلیاک مقاوم به صورت پایداری (یا بازگشت) علایم بالینی و حالات غیرعادی هیستوپاتولوژیک در رابطه با علایم بالینی علی رغم رعایت مطلوب رژیم غذایی بدون گلوتن خداقل برای 12 ماه تعریف می شود (108). این حالت ممکن است در تظاهرات اولیه یا بعد از پاسخ ابتدایی به رژیم غذایی بدون گلوتن (ثانویه) اتفاق بیافتد (130). بیماری سلیاک مقاوم به صورت خاص باید در بیماران سلیاکی که بعد از 50 سال تشخیص داده می شوند مد نظر قرار گیرد.
دو زیرنوع برای بیماری سلیاک مقاوم وجود دارد:
نوع I: لنفوسیت های درون اپیتلیال از نظر فنوتیپی نرمال هستند.
نوعII: با گسترش کلونی لنفوسیت های درون اپیتلیال و فنوتیپ نابجای فاقد گیرنده های CD3، CD8 و گیرنده های سلول T همراه است.
بیماری نوع II شکل خفیف لنفوم درون اپی تلیالی در نظر گرفته می شود که به وسیله سوء جذب شدیدی که به رژیم غذایی بدون گلوتن پاسخ نمی دهد شناخته می شود. این نوع، شدیدترین شکل بیماری سلیاک مقاوم می باشد و با نرخ مرگ میر بالا مرتبط می باشد (131).
7-ضمیمه
7-1- اختصارات

7-2- گایدلاین های استاندارد طلایی
- 2016:
Transition from childhood to adulthood in coeliac disease: the Prague consensus report. Ludvigsson et al. Gut 2016;65:1242–51 [111].
- 2014:
Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Ludvigsson et al. Gut 2014;63:1210–28 [63].
- 2013:
ACG clinical guidelines: diagnosis and management of celiac disease. Rubio-Tapia et al. Am J Gastroenterol 2013;108:656–76; quiz 677. doi: 10.1038/ajg.2013.79 [132].
- 2012:
European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. Husby et al. J Pediatr Gastroenterol Nutr 2012;54:136–60 [87].
- 2005:
Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Hill et al. J Pediatr Gastroenterol Nutr 2005;40:1–19 [67].
7-3- منابع
- Stern M, Ciclitira PJ, van Eckert R, Feighery C, Janssen FW, Méndez E, et al. Analysis and clinical effects of gluten in coeliac disease. Eur J Gastroenterol Hepatol 2001;13(6):741–7.
- Jabri B, Sollid LM. Mechanisms of disease: immunopathogenesis of celiac disease. Nat Clin Pract Gastroenterol Hepatol 2006;3(9):516–25.
- Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PHR, et al. The Oslo definitions for coeliac disease and related terms. Gut 2013;62(1):43–52.
- Cianferoni A. Wheat allergy: diagnosis and management. J Asthma Allergy 2016;13.
- Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PHR, Hadjivassiliou M, et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med 2012;10:13.
- Carroccio A, Mansueto P, Iacono G, Soresi M, D’Alcamo A, Cavataio F, et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012;107(12):1898–906.
- Biesiekierski JR, Newnham ED, Irving PM, Barrett JS, Haines M, Doecke JD, et al. Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial. Am J Gastroenterol 2011;106(3):508–14.
- Biesiekierski JR, Peters SL, Newnham ED, Rosella O, Muir JG, Gibson PR. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology 2013;145(2):320–328.e3.
- Di Sabatino A, Volta U, Salvatore C, Biancheri P, Caio G, De Giorgio R, et al. Small amounts of gluten in subjects with suspected nonceliac gluten sensitivity: a randomized, double-blind, placebo-controlled, cross-over trial. Clin Gastroenterol Hepatol 2015;13(9):1604–1612.e3.
- Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, et al. Non-celiac gluten sensitivity has narrowed the spectrum of irritable bowel syndrome: a double-blind randomized placebo-controlled trial. Nutrients 2015;7(6):4542–54.
- Carroccio A, D’Alcamo A, Mansueto P. Nonceliac wheat sensitivity in the context of multiple food hypersensitivity: new data from confocal endomicroscopy. Gastroenterology 2015;148(3):666–7.
- Guandalini S, Polanco I. Nonceliac gluten sensitivity or wheat intolerance syndrome? J Pediatr 2015;166(4):805–11.
- Lohi S, Mustalahti K, Kaukinen K, Laurila K, Collin P, Rissanen H, et al. Increasing prevalence of coeliac disease over time. Aliment Pharmacol Ther 2007;26(9):1217–25.
- Choung RS, Ditah IC, Nadeau AM, Rubio-Tapia A, Marietta EV, Brantner TL, et al. Trends and racial/ethnic disparities in gluten-sensitive problems in the United States: findings from the National Health and Nutrition Examination Surveys from 1988 to 2012. Am J Gastroenterol 2015;110(3):455–61.
- Fasano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology 2001;120(3):636–51.
- Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, Drago S, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study. Arch Intern Med 2003;163(3):286–92.
- Lionetti E, Catassi C. New clues in celiac disease epidemiology, pathogenesis, clinical manifestations, and treatment. Int Rev Immunol 2011;30(4):219–31.
- Tortora R, Zingone F, Rispo A, Bucci C, Capone P, Imperatore N, et al. Coeliac disease in the elderly in a tertiary centre. Scand J Gastroenterol 2016;51(10):1179–83.
- Smecuol E, Mauriño E, Vazquez H, Pedreira S, Niveloni S, Mazure R, et al. Gynaecological and obstetric disorders in coeliac disease: frequent clinical onset during pregnancy or the puerperium. Eur J Gastroenterol Hepatol 1996;8(1):63–89.
- Marsh MN. Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity (“celiac sprue”). Gastroenterology 1992;102(1):330–54.
- Gomez JC, Selvaggio GS, Viola M, Pizarro B, la Motta G, de Barrio S, et al. Prevalence of celiac disease in Argentina: screening of an adult population in the La Plata area. Am J Gastroenterol 2001;96(9):2700–4.
- Gandolfi L, Pratesi R, Cordoba JC, Tauil PL, Gasparin M, Catassi C. Prevalence of celiac disease among blood donors in Brazil. Am J Gastroenterol 2000;95(3):689–92.
- Parada A, Araya M, Pérez-Bravo F, Méndez M, Mimbacas A, Motta P, et al. Amerindian mtDNA haplogroups and celiac disease risk HLA haplotypes in mixed-blood Latin American patients. J Pediatr Gastroenterol Nutr 2011;53(4):429–34.
- Barada K, Abu Daya H, Rostami K, Catassi C. Celiac disease in the developing world. Gastrointest Endosc Clin N Am 2012;22(4):773–96.
- Brar P, Lee AR, Lewis SK, Bhagat G, Green PHR. Celiac disease in African-Americans. Dig Dis Sci 2006;51(5):1012–5.
- Catassi C, Rätsch IM, Gandolfi L, Pratesi R, Fabiani E, El Asmar R, et al. Why is coeliac disease endemic in the people of the Sahara? Lancet 1999;354(9179):647–8.
- Sood A, Midha V, Sood N, Avasthi G, Sehgal A. Prevalence of celiac disease among school children in Punjab, North India. J Gastroenterol Hepatol 2006;21(10):1622–5.
- Aziz S, Muzaffar R, Zafar MN, Mehnaz A, Mubarak M, Abbas Z, et al. Celiac disease in children with persistent diarrhea and failure to thrive. J Coll Physicians Surg Pak 2007;17(9):554–7.
- Diallo I, Coton T. Celiac disease: a challenging disease uneasy to diagnose in Sub-Saharan Africa. J Gastroenterol Hepatol Res [Internet] 2013;2(8):753–6. Available at: http://www.ghrnet.org/index.php/joghr/article/view/459.
- Ageep AK. Celiac disease in the Red Sea state of Sudan. Trop Gastroenterol 2012;33(2):118–22.
- Mohammed IM, Karrar ZEA, El-Safi SH. Coeliac disease in Sudanese children with clinical features suggestive of the disease. East Mediterr Health J 2006;12(5):582–9.
- Wu J, Xia B, von Blomberg BME, Zhao C, Yang XW, Crusius JBA, et al. Coeliac disease: emerging in China? Gut 2010;59(3):418–9.
- Singh P, Arora S, Singh A, Strand TA, Makharia GK. Prevalence of celiac disease in Asia: a systematic review and meta-analysis. J Gastroenterol Hepatol 2016;31(6):1095–101.
- Vázquez H, de la Paz Temprano M, Sugai E, Scacchi SM, Souza C, Cisterna D, et al. Prevalence of celiac disease and celiac autoimmunity in the Toba native Amerindian community of Argentina. Can J Gastroenterol Hepatol 2015;29(8):431–4.
- Lionetti E, Gatti S, Pulvirenti A, Catassi C. Celiac disease from a global perspective. Best Pract Res Clin Gastroenterol 2015;29(3):365–79.
- Catassi C, Kryszak D, Bhatti B, Sturgeon C, Helzlsouer K, Clipp SL, et al. Natural history of celiac disease autoimmunity in a USA cohort followed since 1974. Ann Med 2010;42(7):530–8.
- Mäki M, Mustalahti K, Kokkonen J, Kulmala P, Haapalahti M, Karttunen T, et al. Prevalence of Celiac disease among children in Finland. N Engl J Med 2003;348(25):2517–24.
- Green PHR. The many faces of celiac disease: clinical presentation of celiac disease in the adult population. Gastroenterology 2005;128(4 Suppl 1):S74-78.
- Dickey W, McMillan SA, Hughes DF. Identification of coeliac disease in primary care. Scand J Gastroenterol 1998;33(5):491–3.
- Collin P, Huhtala H, Virta L, Kekkonen L, Reunala T. Diagnosis of celiac disease in clinical practice: physician’s alertness to the condition essential. J Clin Gastroenterol 2007;41(2):152–6.
- Rostami-Nejad M, Romanos J, Rostami K, Ganji A, Ehsani-Ardakani MJ, Bakhshipour AR, et al. Allele and haplotype frequencies for HLA-DQ in Iranian celiac disease patients. World J Gastroenterol 2014;20(20):6302–8.
- Gutierrez-Achury J, Zhernakova A, Pulit SL, Trynka G, Hunt KA, Romanos J, et al. Fine mapping in the MHC region accounts for 18% additional genetic risk for celiac disease. Nat Genet 2015;47(6):577–8.
- Romanos J, van Diemen CC, Nolte IM, Trynka G, Zhernakova A, Fu J, et al. Analysis of HLA and non-HLA alleles can identify individuals at high risk for celiac disease. Gastroenterology 2009;137(3):834–40, 840–3.
- Liu E, Lee HS, Aronsson CA, Hagopian WA, Koletzko S, Rewers MJ, et al. Risk of pediatric celiac disease according to HLA haplotype and country. N Engl J Med 2014;371(1):42–9.
- Polvi A, Arranz E, Fernandez-Arquero M, Collin P, Mäki M, Sanz A, et al. HLA-DQ2-negative celiac disease in Finland and Spain. Hum Immunol 1998;59(3):169–75.
- Spurkland A, Sollid LM, Polanco I, Vartdal F, Thorsby E. HLA-DR and -DQ genotypes of celiac disease patients serologically typed to be non-DR3 or non-DR5/7. Hum Immunol 1992;35(3):188–92.
- Abadie V, Sollid LM, Barreiro LB, Jabri B. Integration of genetic and immunological insights into a model of celiac disease pathogenesis. Annu Rev Immunol 2011;29:493–525.
- Vriezinga SL, Auricchio R, Bravi E, Castillejo G, Chmielewska A, Crespo Escobar P, et al. Randomized feeding intervention in infants at high risk for celiac disease. N Engl J Med 2014;371(14):1304–15.
- Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, et al. Introduction of gluten, HLA status, and the risk of celiac disease in children. N Engl J Med 2014;371(14):1295–303.
- Aronsson CA, Lee HS, Liu E, Uusitalo U, Hummel S, Yang J, et al. Age at gluten introduction and risk of celiac disease. Pediatrics 2015;135(2):239–45.
- Andrén Aronsson C, Lee HS, Koletzko S, Uusitalo U, Yang J, Virtanen SM, et al. Effects of gluten intake on risk of celiac disease: a case-control study on a Swedish birth cohort. Clin Gastroenterol Hepatol 2016;14(3):403–409.e3.
- Szajewska H, Shamir R, Chmielewska A, Pieścik-Lech M, Auricchio R, Ivarsson A, et al. Systematic review with meta-analysis: early infant feeding and coeliac disease—update 2015. Aliment Pharmacol Ther 2015;41(11):1038–54.
- Ferguson A, Arranz E, O’Mahony S. Clinical and pathological spectrum of coeliac disease—active, silent, latent, potential. Gut 1993;34(2):150–1.
- Green PHR, Jabri B. Coeliac disease. Lancet 2003;362(9381):383–91.
- Santonicola A, Iovino P, Cappello C, Capone P, Andreozzi P, Ciacci C. From menarche to menopause: the fertile life span of celiac women. Menopause 2011;18(10):1125–30.
- Sbai W, Bourgain G, Luciano L, Brardjanian S, Thefenne L, Al Shukry A, et al. Celiac crisis in a multi-trauma adult patient. Clin Res Hepatol Gastroenterol 2016;40(3):e31–2.
- Korpimäki S, Kaukinen K, Collin P, Haapala A-M, Holm P, Laurila K, et al. Gluten-sensitive hypertransaminasemia in celiac disease: an infrequent and often subclinical finding. Am J Gastroenterol 2011;106(9):1689–96.
- Nachman F, Mauriño E, Vázquez H, Sfoggia C, Gonzalez A, Gonzalez V, et al. Quality of life in celiac disease patients: prospective analysis on the importance of clinical severity at diagnosis and the impact of treatment. Dig Liver Dis 2009;41(1):15–25.
- Lindfors K, Koskinen O, Kaukinen K. An update on the diagnostics of celiac disease. Int Rev Immunol 2011;30(4):185–96.
- Kinos S, Kurppa K, Ukkola A, Collin P, Lähdeaho ML, Huhtala H, et al. Burden of illness in screen-detected children with celiac disease and their families. J Pediatr Gastroenterol Nutr 2012;55(4):412–6.
- Kurppa K, Paavola A, Collin P, Sievänen H, Laurila K, Huhtala H, et al. Benefits of a gluten-free diet for asymptomatic patients with serologic markers of celiac disease. Gastroenterology 2014;147(3):610–617.e1.
- Giersiepen K, Lelgemann M, Stuhldreher N, Ronfani L, Husby S, Koletzko S, et al. Accuracy of diagnostic antibody tests for coeliac disease in children: summary of an evidence report. J Pediatr Gastroenterol Nutr 2012;54(2):229–41.
- Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut 2014;63(8):1210–28.
- Kelly CP, Bai JC, Liu E, Leffler DA. Advances in diagnosis and management of celiac disease. Gastroenterology 2015;148(6):1175–86.
- Catassi C, Fasano A. Celiac disease diagnosis: simple rules are better than complicated algorithms. Am J Med 2010;123(8):691–3.
- Ciclitira PJ, King AL, Fraser JS. AGA technical review on Celiac Sprue. American Gastroenterological Association. Gastroenterology 2001;120(6):1526–40.
- Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005;40(1):1–19.
- Ludvigsson JF, Card TR, Kaukinen K, Bai J, Zingone F, Sanders DS, et al. Screening for celiac disease in the general population and in high-risk groups. United Eur Gastroenterol J 2015;3(2):106–20.
- Singh P, Arora S, Lal S, Strand TA, Makharia GK. Risk of celiac disease in the first- and second-degree relatives of patients with celiac disease: a systematic review and meta-analysis. Am J Gastroenterol 2015;110(11):1539–48.
- Oxentenko AS, Grisolano SW, Murray JA, Burgart LJ, Dierkhising RA, Alexander JA. The insensitivity of endoscopic markers in celiac disease. Am J Gastroenterol 2002;97(4):933–8.
- Niveloni S, Fiorini A, Dezi R, Pedreira S, Smecuol E, Vazquez H, et al. Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease: assessment of interobserver agreement. Gastrointest Endosc 1998;47(3):223–9.
- Marsh MN, W Johnson M, Rostami K. Mucosal histopathology in celiac disease: a rebuttal of Oberhuber’s sub-division of Marsh III. Gastroenterol Hepatol Bed Bench 2015;8(2):99–109.
- Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol 1999;11(10):1185–94.
- Mooney PD, Kurien M, Evans KE, Rosario E, Cross SS, Vergani P, et al. Clinical and immunologic features of ultra-short celiac disease. Gastroenterology 2016;150(5):1125–34.
- Leffler D, Schuppan D, Pallav K, Najarian R, Goldsmith JD, Hansen J, et al. Kinetics of the histological, serological and symptomatic responses to gluten challenge in adults with coeliac disease. Gut 2013;62(7):996–1004.
- Rostami K, Kerckhaert J, Tiemessen R, von Blomberg BM, Meijer JW, Mulder CJ. Sensitivity of antiendomysium and antigliadin antibodies in untreated celiac disease: disappointing in clinical practice. Am J Gastroenterol 1999;94(4):888–94.
- Corazza GR, Villanacci V. Coeliac disease. J Clin Pathol 2005;58(6):573–4.
- Rostom A, Dubé C, Cranney A, Saloojee N, Sy R, Garritty C, et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology 2005;128(4 Suppl 1):S38-46.
- Leffler DA, Schuppan D. Update on serologic testing in celiac disease. Am J Gastroenterol 2010;105(12):2520–4.
- Chorzelski TP, Beutner EH, Sulej J, Tchorzewska H, Jablonska S, Kumar V, et al. IgA anti-endomysium antibody. A new immunological marker of dermatitis herpetiformis and coeliac disease. Br J Dermatol 1984;111(4):395–402.
- Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat Med 1997;3(7):797–801.
- Sugai E, Moreno ML, Hwang HJ, Cabanne A, Crivelli A, Nachman F, et al. Celiac disease serology in patients with different pretest probabilities: is biopsy avoidable? World J Gastroenterol 2010;16(25):3144–52.
- Bufler P, Heilig G, Ossiander G, Freudenberg F, Grote V, Koletzko S. Diagnostic performance of three serologic tests in childhood celiac disease. Z Gastroenterol 2015;53(2):108–14.
- Nachman F, Sugai E, Vázquez H, González A, Andrenacci P, Niveloni S, et al. Serological tests for celiac disease as indicators of long-term compliance with the gluten-free diet. Eur J Gastroenterol Hepatol 2011;23(6):473–80.
- Weile B, Hansen BF, Hägerstrand I, Hansen JP, Krasilnikoff PA. Interobserver variation in diagnosing coeliac disease. A joint study by Danish and Swedish pathologists. APMIS 2000;108(5):380–4.
- Webb C, Norström F, Myléus A, Ivarsson A, Halvarsson B, Högberg L, et al. Celiac disease can be predicted by high levels of anti-tissue transglutaminase antibodies in population-based screening. J Pediatr Gastroenterol Nutr 2015;60(6):787–91.
- Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012;54(1):136–60.
- Sandström O, Rosén A, Lagerqvist C, Carlsson A, Hernell O, Högberg L, et al. Transglutaminase IgA antibodies in a celiac disease mass screening and the role of HLA-DQ genotyping and endomysial antibodies in sequential testing. J Pediatr Gastroenterol Nutr 2013;57(4):472–6.
- Sugai E, Hwang HJ, Vázquez H, Moreno ML, Costa F, Longarini G, et al. Should ESPGHAN guidelines for serologic diagnosis of celiac disease be used in adults? A prospective analysis in an adult patient cohort with high pretest probability. Am J Gastroenterol 2015;110(10):1504–5.
- Oyaert M, Vermeersch P, De Hertogh G, Hiele M, Vandeputte N, Hoffman I, et al. Combining antibody tests and taking into account antibody levels improves serologic diagnosis of celiac disease. Clin Chem Lab Med 2015;53(10):1537–46.
- Newnham ED, Shepherd SJ, Strauss BJ, Hosking P, Gibson PR. Adherence to the gluten-free diet can achieve the therapeutic goals in almost all patients with coeliac disease: a 5-year longitudinal study from diagnosis. J Gastroenterol Hepatol 2016;31(2):342–9.
- Kurppa K, Collin P, Mäki M, Kaukinen K. Celiac disease and health-related quality of life. Expert Rev Gastroenterol Hepatol 2011;5(1):83–90.
- Nachman F, del Campo MP, González A, Corzo L, Vázquez H, Sfoggia C, et al. Long-term deterioration of quality of life in adult patients with celiac disease is associated with treatment noncompliance. Dig Liver Dis 2010;42(10):685–91.
- Cranney A, Rostom A, Sy R, Dubé C, Saloogee N, Garritty C, et al. Consequences of testing for celiac disease. Gastroenterology 2005;128(4 Suppl 1):S109–20.
- Brousse N, Meijer JWR. Malignant complications of coeliac disease. Best Pract Res Clin Gastroenterol 2005;19(3):401–12.
- Anderson LA, Gadalla S, Morton LM, Landgren O, Pfeiffer R, Warren JL, et al. Population-based study of autoimmune conditions and the risk of specific lymphoid malignancies. Int J Cancer 2009;125(2):398–405.
- Corazza GR, Di Stefano M, Mauriño E, Bai JC. Bones in coeliac disease: diagnosis and treatment. Best Pract Res Clin Gastroenterol 2005;19(3):453–65.
- Olmos M, Antelo M, Vazquez H, Smecuol E, Mauriño E, Bai JC. Systematic review and meta-analysis of observational studies on the prevalence of fractures in coeliac disease. Dig Liver Dis 2008;40(1):46–53.
- Saccone G, Berghella V, Sarno L, Maruotti GM, Cetin I, Greco L, et al. Celiac disease and obstetric complications: a systematic review and metaanalysis. Am J Obstet Gynecol 2016;214(2):225–34.
- Green PHR, Cellier C. Celiac disease. N Engl J Med 2007;357(17):1731–43.
- Ciacci C, Ciclitira P, Hadjivassiliou M, Kaukinen K, Ludvigsson JF, McGough N, et al. The gluten-free diet and its current application in coeliac disease and dermatitis herpetiformis. United Eur Gastroenterol J 2015;3(2):121–35.
- Collin P. Should adults be screened for celiac disease? What are the benefits and harms of screening? Gastroenterology 2005;128(4 Suppl 1):S104–8.
- Hoffenberg EJ. Should all children be screened for celiac disease? Gastroenterology 2005;128(4 Suppl 1):S98–103.
- Sugai E, Nachman F, Váquez H, González A, Andrenacci P, Czech A, et al. Dynamics of celiac disease-specific serology after initiation of a gluten-free diet and use in the assessment of compliance with treatment. Dig Liver Dis 2010;42(5):352–8.
- Moreno M de L, Cebolla Á, Muñoz-Suano A, Carrillo-Carrion C, Comino I, Pizarro Á, et al. Detection of gluten immunogenic peptides in the urine of patients with coeliac disease reveals transgressions in the gluten-free diet and incomplete mucosal healing. Gut 2015 Nov 25. doi: 10.1136/gutjnl-2015-310148 [Epub ahead of print].
- Forbes GM. If only my celiac patients and I knew that…. Clin Gastroenterol Hepatol 2015;13(3):614–5.
- Pulido OM, Gillespie Z, Zarkadas M, Dubois S, Vavasour E, Rashid M, et al. Introduction of oats in the diet of individuals with celiac disease: a systematic review. Adv Food Nutr Res 2009;57:235–85.
- Akobeng AK, Thomas AG. Systematic review: tolerable amount of gluten for people with coeliac disease. Aliment Pharmacol Ther 2008;27(11):1044–52.
- Ciacci C, Maiuri L, Russo I, Tortora R, Bucci C, Cappello C, et al. Efficacy of budesonide therapy in the early phase of treatment of adult coeliac disease patients with malabsorption: an in vivo/in vitro pilot study. Clin Exp Pharmacol Physiol 2009;36(12):1170–6.
- Ludvigsson JF, Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, et al. Support for patients with celiac disease: a literature review. United Eur Gastroenterol J 2015;3(2):146–59.
- Ludvigsson JF, Agreus L, Ciacci C, Crowe SE, Geller MG, Green PHR, et al. Transition from childhood to adulthood in coeliac disease: the Prague consensus report. Gut 2016;65(8):1242–51.
- Haines ML, Anderson RP, Gibson PR. Systematic review: the evidence base for long-term management of coeliac disease. Aliment Pharmacol Ther 2008;28(9):1042–66.
- Leffler DA, Edwards George JB, Dennis M, Cook EF, Schuppan D, Kelly CP. A prospective comparative study of five measures of gluten-free diet adherence in adults with coeliac disease. Aliment Pharmacol Ther 2007;26(9):1227–35.
- Hollon JR, Cureton PA, Martin ML, Puppa ELL, Fasano A. Trace gluten contamination may play a role in mucosal and clinical recovery in a subgroup of diet-adherent non-responsive celiac disease patients. BMC Gastroenterol 2013;13:40.
- Ciacci C, Cavallaro R, della Valle N, d’Argenio G. The use of serum tTG-ab assay in patients on gluten-free diet as a measure of dietetic compliance. Gastroenterology 2002;122(2):588.
- García-Manzanares A, Tenias JM, Lucendo AJ. Bone mineral density directly correlates with duodenal Marsh stage in newly diagnosed adult celiac patients. Scand J Gastroenterol 2012;47(8–9):927–36.
- Zingone F, Abdul Sultan A, Crooks CJ, Tata LJ, Ciacci C, West J. The risk of community-acquired pneumonia among 9803 patients with coeliac disease compared to the general population: a cohort study. Aliment Pharmacol Ther 2016;44(1):57–67.
- Hall NJ, Rubin G, Charnock A. Systematic review: adherence to a gluten-free diet in adult patients with coeliac disease. Aliment Pharmacol Ther 2009;30(4):315–30.
- Leffler DA, Edwards-George J, Dennis M, Schuppan D, Cook F, Franko DL, et al. Factors that influence adherence to a gluten-free diet in adults with celiac disease. Dig Dis Sci 2008;53(6):1573–81.
- Ciacci C, Iavarone A, Siniscalchi M, Romano R, De Rosa A. Psychological dimensions of celiac disease: toward an integrated approach. Dig Dis Sci 2002;47(9):2082–7.
- Niewinski MM. Advances in celiac disease and gluten-free diet. J Am Diet Assoc 2008;108(4):661–72.
- Pinto-Sanchez MI, Verdu EF, Gordillo MC, Bai JC, Birch S, Moayyedi P, et al. Tax-deductible provisions for gluten-free diet in Canada compared with systems for gluten-free diet coverage available in various countries. Can J Gastroenterol Hepatol 2015;29(2):104–10.
- Republic of Argentina. National Ministry of Health. [Clinical practice guidelines on diagnosis and treatment of celiac disease. Detection and National Celiac Disease Control. Official Gazette No. 32148]. May 2011. [Internet]. Available at: http://www.msal.gob.ar.
- Chmielewska A, Pieścik-Lech M, Szajewska H, Shamir R. Primary prevention of celiac disease: environmental factors with a focus on early nutrition. Ann Nutr Metab 2015;67 Suppl 2:43–50.
- Szajewska H, Shamir R, Mearin L, Ribes-Koninckx C, Catassi C, Domellöf M, et al. Gluten introduction and the risk of coeliac disease: a position paper by the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 2016;62(3):507–13.
- Mearin ML. The prevention of coeliac disease. Best Pract Res Clin Gastroenterol 2015;29(3):493–501.
- Catassi C, Fasano A. Coeliac disease. The debate on coeliac disease screening—are we there yet? Nat Rev Gastroenterol Hepatol 2014;11(8):457–8.
- O’Leary C, Wieneke P, Healy M, Cronin C, O’Regan P, Shanahan F. Celiac disease and the transition from childhood to adulthood: a 28-year follow-up. Am J Gastroenterol 2004;99(12):2437–41.
- Mozer-Glassberg Y, Zevit N, Rosenbach Y, Hartman C, Morgenstern S, Shamir R. Follow-up of children with celiac disease—lost in translation? Digestion 2011;83(4):283–7.
- Cellier C, Delabesse E, Helmer C, Patey N, Matuchansky C, Jabri B, et al. Refractory sprue, coeliac disease, and enteropathy-associated T-cell lymphoma. French Coeliac Disease Study Group. Lancet 2000;356(9225):203–8.
- Rubio-Tapia A, Murray JA. Classification and management of refractory coeliac disease. Gut 2010;59(4):547–57.
- Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol 2013;108(5):656–76.










