1. Introducción
La disfagia se refiere ya sea a la dificultad que alguien puede tener en las fases iniciales de la deglución (descrita habitualmente como “disfagia orofaríngea”) o a la sensación de que de alguna manera hay una obstrucción al pasaje de los alimentos y/o líquidos de la boca al estómago (descrita habitualmente como “disfagia esofágica”). Por lo tanto la disfagia es la percepción de que hay un impedimento al pasaje normal del material deglutido. Estos pacientes pueden presentar intermitentemente un síntoma especial: la impactación de los alimentos [1].
La deglución orofaríngea es un proceso regulado por el centro de deglución en el bulbo raquídeo y en el esófago medio y distal por un reflejo peristáltico fundamentalmente autónomo coordinado por el sistema nervioso entérico. La Tabla 1 enumera los mecanismos fisiológicos que intervienen en estas diversas fases.
Tabla 1 Mecanismos fisiológicos que intervienen en las etapas de deglución, por fase

Resulta clave determinar si la disfagia es orofaríngea o esofágica. Esta distinción se puede hacer con confianza sobre la base de una anamnesis muy cuidadosa que arroja una valoración exacta del tipo de disfagia (orofaríngea vs. esofágica) en alrededor de 80–85% de los casos [2]. No se puede hacer una localización más precisa de forma confiable. A continuación se enumeran los detalles de las características clave a considerar en la historia médica:
- Localización
- Tipos de alimentos y/o líquidos
- Progresiv o intermitente
- Duración de los síntomas
Si bien es frecuente que la disfagia y la odinofagia (deglución dolorosa) ocurran juntas, es importante excluir esta última entidad. Finalmente, un diagnóstico diferencial basado en síntomas debería descartar el globo faríngeo (una sensación de “nudo en la garganta”), presión torácica, disnea, y fagofobia (miedo a deglutir).
1.1 Causas de disfagia
Cuando uno está tratando de establecer la etiología de una disfagia, es útil seguir la misma clasificación adoptada para valoración de los síntomas—es decir, distinguir entre las causas que afectan fundamentalmente la faringe y el esófago proximal (disfagia orofaríngea o “alta”), por un lado, y las causas que fundamentalmente afectan el cuerpo esofágico y la unión esofagogástrica (disfagia esofágica o “baja”), por la otra. Sin embargo, es verdad que muchos trastornos se solapan y pueden producir tanto disfagia orofaríngea como esofágica. Es muy importante hacer una anamnesis minuciosa que incluya el uso de medicación, ya que los medicamentos pueden estar involucrados en la patogenia de la disfagia.
Disfagia orofaríngea
En los pacientes jóvenes, la disfagia orofaríngea generalmente es provocada por enfermedades musculares, membranas o anillos. En los individuos de más edad habitualmente es provocada por trastornos del sistema nervioso central, como el accidente cerebrovascular, enfermedad de Parkinson y demencia. El envejecimiento normal puede provocar anomalías leves de la motilidad esofágica (rara vez sintomáticas [3]). En el paciente mayor no se debe atribuir la disfagia automáticamente al proceso normal de envejecimiento.
Generalmente es útil tratar de establecer una distinción entre los problemas mecánicos y los trastornos neuromusculares, tal como se muestra a continuación.
Causas mecánicas y obstructivas:
- Infecciones (ej. Abcesos retrofaríngeos)
- Tiromegalia
- Linfadenopatía
- Divertículo de Zenker
- Reducción de la complacencia muscular (miositis, fibrosis, barra cricofaríngea)
- Esofagitis eosinófila
- Neoplasias de cabeza y cuello y consecuencias (ej. Estenosis fibróticas duras) de intervenciones quirúrgicas y/o radioterapéuticas sobre estos tumores
- Osteofitos cervicales
- Neoplasias orofaríngeas benignas y malignas (raras)
Trastornos neuromusculares:
- Patología del sistema nervioso central como accidente cerebrovascular, enfermedad de Parkinson, parálisis de pares craneanos o parálisis bulbar (ej.: esclerosis múltiple, enfermedad de neurona motora), esclerosis lateral amioatrófica
- Trastornos de la contractilidad como miastenia gravis, distrofia muscular óculo faríngea, entre otros
Dentro de los 3 primeros días del accidente cerebrovascular, 42–67% de los pacientes presentan disfagia orofaríngea— lo que hace que el accidente cerebrovascular sea la principal causa de disfagia. Entre estos pacientes, 50% se aspira y un tercio desarrolla una neumonía que requiere tratamiento [4]. La gravedad de la disfagia tiende a asociarse con la gravedad del accidente cerebrovascular. En los pacientes con accidente cerebrovascular es crucial hacer estudios para descartar disfagia para así evitar resultados adversos debidos a aspiración y a una inadecuada hidratación/nutrición [5].
Hasta 50% de los pacientes con Parkinson muestran algunos síntomas consistentes con disfagia orofaríngea, y hasta 95% presentan anomalías en la video esofagografía [6,7]. Puede aparecer una disfagia clínicamente significativa al principio de la enfermedad de Parkinson, pero es más frecuente en las etapas más tardías.
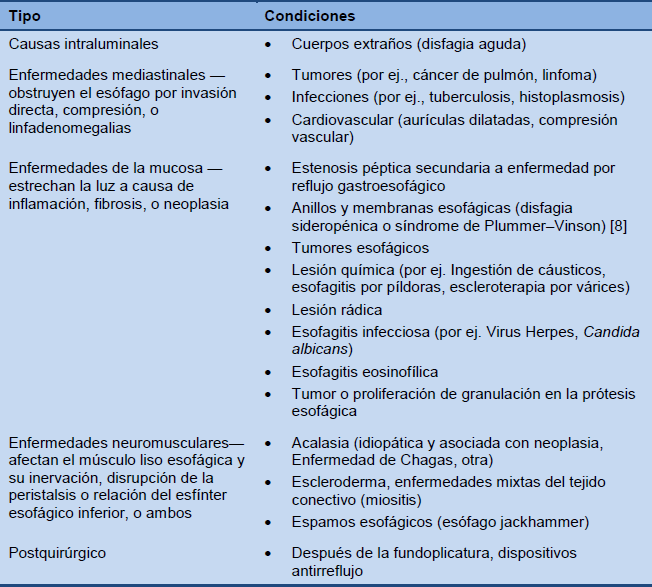
Disfagia esofágica
Tabla 2 Causas más comunes de disfagia esofágica
1.2 Cascadas de la WGO — guías mundiales
Cascadas— enfoque que tiene en cuenta los recursos
Solo resulta factible aplicar un enfoque patrón oro si se dispone de todas las opciones de tratamiento médico y de las pruebas diagnósticas. Es posible que esos recursos para el diagnóstico y el manejo de la disfagia no sean suficientes en todos los países. Las guías de la Organización Mundial de Gastroenterología (WGO) ofrecen un enfoque que tiene en cuenta los recursos en forma de cascadas de diagnóstico y tratamiento.
Una cascada de la WGO es un conjunto jerárquico de opciones diagnósticas, terapéuticas y de manejo para manejar el riesgo y la enfermedad, catalogadas según los recursos disponibles.
Otras guías disponibles al público
1.3 Carga de la enfermedad y epidemiología
La disfagia es un problema frecuente. Una de cada 17 personas presenta alguna forma de disfagia en el correr de su vida. Un estudio realizado en el Reino Unido en 2011 describe una tasa de prevalencia de disfagia de 11% en la comunidad general [9]. La condición afecta a 40–70% de los pacientes con accidente cerebrovascular, 60–80% de los pacientes con enfermedades neurodegenerativas, hasta 13% de los adultos de 65 años y > 51% de los pacientes añosos institucionalizados [10,11], así como 60–75% de los pacientes sometidos a radioterapia por cáncer de cabeza o cuello.
La carga de esta enfermedad está claramente descrita en una resolución del congreso de EE.UU. en 2008 [12], destacando que:
- La disfagia afecta a 15 millones de americanos; todos los americanos mayores de 60 presentarán disfagia en algún momento.
- Los Centros para el Control y Prevención de Enfermedades han estimado que cada año se diagnostica disfagia a 1 millón de personas en Estados Unidos.
- La Agencia para la Investigación y Calidad de la Atención Médica (Agency for Healthcare Research and Quality) ha estimado que anualmente mueren 60.000 americanos por complicaciones de una disfagia.
- Las complicaciones de la disfagia aumentan los costos sanitarios como resultado de internaciones repetidas, consultas en sala de emergencia, estadías hospitalarias prolongadas, necesidad de atención institucionalizada prolongada, y necesidad de apoyo respiratorio y nutricional oneroso.
- Si se cuenta el dinero gastado en hospitales, el costo total de la disfagia para el sistema sanitario supera en mucho los mil millones de dólares anuales.
- La disfagia es una patología en gran medida no notificada y mal comprendida por el público general.
Es difícil dar datos epidemiológicos a nivel mundial, dado que la prevalencia de la mayoría de las enfermedades que pueden provocar disfagia tiende a diferir entre las diferentes regiones y continentes. Por lo tanto solo se pueden hacer aproximaciones a nivel global. Las tasas de prevalencia también varían dependiendo de la edad de los pacientes, y se debería recordar que el tipo de patología que se presenta con disfagia en pediatría difiere de las patologías de los grupos de mayor edad. En los pacientes más jóvenes la disfagia a menudo está vinculada a lesiones de cabeza y cuello por accidentes, así como cánceres de garganta y boca. Si bien se observa disfagia en todos los grupos etarios, su prevalencia aumenta con la edad.
La prevalencia de los tumores difiere en los diferentes países. En Estados Unidos y Europa, por ejemplo, el adenocarcinoma es el tipo más frecuente de cáncer esofágico, mientras que en India y China la patología más frecuente es el carcinoma escamocelular. Asimismo, las estenosis corrosivas del esófago (en individuos que consumen agentes corrosivos en intentos de suicidio) y la tuberculosis también pueden tener su importancia fuera de occidente.
Notas regionales
- América del Norte/EE.UU.:
- Las tasas de estenosis por reflujo han ido disminuyendo en Estados Unidos desde la aparición y amplia difusión de los inhibidores de la bomba de protones [13].
- La esofagitis eosinofílica es cada vez más reconocida como una importante causa de disfagia tanto en niños como en adultos [13].
- Si bien los números absolutos de los pacientes a los que se les diagnostica cáncer esofágico en Estados Unidos sigue siendo pequeña, la incidencia de este tipo de cáncer está aumentando.
- Con el crecimiento de la población de pacientes añosos en los Estados Unidos, la compresión por osteofitos cervicales, los accidentes cerebrovasculares y otros trastornos neurológicos están cobrando una mayor importancia como causas de disfagia que en el pasado.
- Es probable que el uso difundido de tratamientos ablativos del esófago de Barrett (ablación por radiofrecuencia, terapia fotodinámica, y resección endoscópica de la mucosa) dé lugar a un nuevo grupo de pacientes con estenosis provocada por la endoterapia.
- Europa/Países de occidente:
- Si bien la enfermedad por reflujo gastroesofágico (ERGE) y las estenosis pépticas están disminuyendo como causas de disfagia esofágica, el adenocarcinoma de esófago y la esofagitis eosinofílica están aumentando [14–16].
- Asia [17,18]:
- El carcinoma escamocelular esofágico, la acalasia, y la estenosis de origen quirúrgico son causas comunes de disfagia de origen esofágico. La prevalencia de la ERGE parece estar aumentando, pero comparado con los países de occidente, la ERGE sigue siendo prevalente en Asia. La disfagia posterior a accidentes cerebrovasculares es bastante común en Asia, y gracias a las mejoras en la atención sanitaria, gradualmente se la está reconociendo y tratando cada vez más temprano.
- América Latina:
- La enfermedad de Chagas tiene una alta prevalencia en algunas partes de América Latina. Puede dar lugar a acalasia chagásica y megaesófago, entidades que provocan desnutrición. Algunas características de la acalasia chagásica la distinguen de la acalasia idiopática. La presión del esfínter esofágico inferior tiende a estar en el rango bajo, aparentemente por daño de los mecanismos de control tanto excitatorios como inhibitorios. Pese a las diferencias, los tratamientos médicos y quirúrgicos son similares [19].
- África:
- En Africa es posible que el tratamiento de la disfagia posterior a un accidente cerebrovascular no sea el óptimo debido a la falta de recursos o al mal manejo de los recursos disponibles. La falta de profesionales de la salud con buena formación puede contribuir también a que los servicios dejen que desear. También son muy escasas las unidades de atención de individuos con accidente cerebrovascular y la instrumentación correspondiente — particularmente las instalaciones de imagenología necesarias para poder cumplir con el patrón oro, el trago de bario modificado [20].
2. Diagnóstico clínico
Se debe hacer una buena anamnesis que abarque los principales elementos diagnósticos, ya que a menudo ayuda a definir el diagnóstico con certeza. Es importante establecer cuidadosamente la altura a la que se percibe el trastorno de la deglución para determinar si la disfagia es orofaríngea o esofágica.
2.1 Disfagia orofaríngea
Antecedentes clínicos
La disfagia orofaríngea se denomina también disfagia “alta”, y se refiriere al compromiso oral o faríngeo. A los pacientes les cuesta comenzar la deglución, y habitualmente identifican el área cervical como el origen del problema.
En los pacientes neurológicos, la disfagia orofaríngea es una afección comórbida sumamente prevalente y suele evolucionar mal, con complicaciones como deshidratación, desnutrición, neumonía, e incluso la muerte. Los trastornos de la deglución pueden provocar ansiedad y miedo, lo que puede llevar a los pacientes a evitar la ingesta oral— provocando así desnutrición, depresión y aislamiento.
Síntomas acompañantes frecuentes:
- Dificultad para comenzar a deglutir, deglución repetitiva
- Regurgitación nasal
- Tos
- Voz nasal
- Babeo
- Disminución del reflejo tusígeno
- Ahogo (nótese que puede haber penetración laríngea y aspiración sin tos ni ahogo concomitantes)
- Disartria y diplopía (pueden acompañar a patologías neurológicas que provoquen disfagia orofaríngea)
- Halitosis en pacientes con un divertículo de Zenker que contenga residual o en pacientes con acalasia avanzada u obstrucción prolongada, con acumulación de residual en descomposición en la luz
- Neumonías recurrentes
Hay una serie de afecciones neurológicas definidas que acompañan la disfagia orofaríngea y que permiten hacer un diagnóstico preciso:
- Hemiparesia luego de un accidente cerebrovascular
- Ptosis parpebral y fatigabilidad que sugieren miastenia gravis
- Rigidez, temblores y disautonomía que sugieren enfermedad de Parkinson
- Otras enfermedades neurológicas que incluyen distonía cervical y compresión de los pares craneanos, como una hiperostosis o deformidad de Arnold–Chiari (herniaciones del encéfalo posterior)
- Hay déficits específicos de los pares craneanos que intervienen en la deglución y que también pueden ayudar a identificar el origen del trastorno orofaríngeo, estableciendo un diagnóstico
Estudios
Para evaluar la disfagia se pueden elegir diferentes exámenes, dependiendo de las características del paciente, la gravedad y los recursos disponibles. Después de un accidente cerebrovascular el paciente debe ser evaluado dentro de las primeras 24 horas en busca de disfagia, antes de ofrecerle nada por boca, ya que un diagnóstico oportuno reduce tres veces el riesgo de complicaciones derivadas de la disfagia. Los pacientes con adelgazamiento persistente e infecciones torácicas recurrentes deben ser estudiados de urgencia [21].
La Asociación estadounidense ASHA (American Speech-Language-Hearing Association) desarrolló un protocolo de evaluación de la deglución en la cabecera del enfermo; se puede bajar la plantilla de http://www.speakingofspeech.info/medical/BedsideSwallowingEval.pdf. Se trata de una herramienta accesible que brinda un enfoque detallado y estructurado de los mecanismos de la disfagia orofaríngea y su manejo, y puede ser útil en regiones que dispongan de recursos acotados.
A continuación se presentan los principales estudios con los que se puede evaluar la disfagia orofaríngea:
- Videofluoroscopía de la deglución, también conocida como “deglución o trago de bario modificado”
- Este es el patrón oro para evaluar la disfagia orofaríngea [22–24].
- Durante la fluoroscopía se registra la deglución en video, obteniéndose detalles de los mecanismos de deglución del paciente.
- También puede ayudar a predecir el riesgo de neumonía por aspiración [25].
- Las técnicas video fluoroscópicas permiten reducir la velocidad de observación, mostrar cuadro por cuadro y transmitirse por internet, facilitando lecturas interpretativas desde sitios remotos [26].
- Endoscopía alta
- La nasoendoscopía es el patrón oro para evaluar las causas estructurales de disfagia [22–24] — por ej. lesiones en la orofaringe— e inspección de las secreciones o el material proveniente de alimentos.
- No es un medio sensible para detectar una función deglutoria anormal.
- Cuando se practica un seguimiento video fluoroscópico se constata que no logra identificar la aspiración en 20–40% de los casos, debido a la ausencia del reflejo tusígeno
- Fibroscopía de la deglución (FEES, por su sigla en inglés)
- La FEES es una técnica endoscópica modificada que consiste en visualizar las estructuras laríngeas y faríngeas a través de un fibroscopio flexible transnasal mientras que el paciente recibe alimentos y bolos líquidos.
- Manometría faringoesofágica de alta resolución
- Se trata de una evaluación cuantitativa de la presión y la sincronización de la contracción de la faringe y la relajación del esófago superior.
- Se puede utilizar junto con video fluoroscopía para poder apreciar mejor el movimiento y las presiones que intervienen.
- Puede tener un cierto valor en los pacientes con disfagia orofaríngea a pesar de tener un estudio de bario convencional negativo.
- Puede ser útil cuando se está considerando la miotomía.
- Manometría de impedancia automatizada (MIA) [27]
- Se trata de una combinación de impedancia y manometría de alta resolución.
- Las variables presión/flujo que surgen del análisis automatizado de las mediciones combinadas de manometría e impedancia brindan información valiosa para el diagnóstico.
- Cuando se combinan para dar una puntuación del índice de riesgo de deglución (SRI) estas mediciones son un fuerte predictor de aspiración.
- Prueba de deglución de agua
- Se trata de una prueba de tamizaje básica y barata que puede ser útil si se la considera junto con la historia clínica y el examen físico.
- Consiste en hacer que el paciente beba 150 ml de agua de un vaso lo más rápido que pueda, mientras que el examinador registra el tiempo que le lleva y la cantidad de veces que traga. A partir de esos datos se puede calcular la velocidad de la deglución y el volumen promedio por cada trago. Se le ha adjudicado una sensibilidad predictiva > 95% para identificar la presencia de disfagia, y se la puede complementar con una “prueba de ingesta de comida” colocando una pequeña cantidad de budín en el dorso de la lengua [2 8].
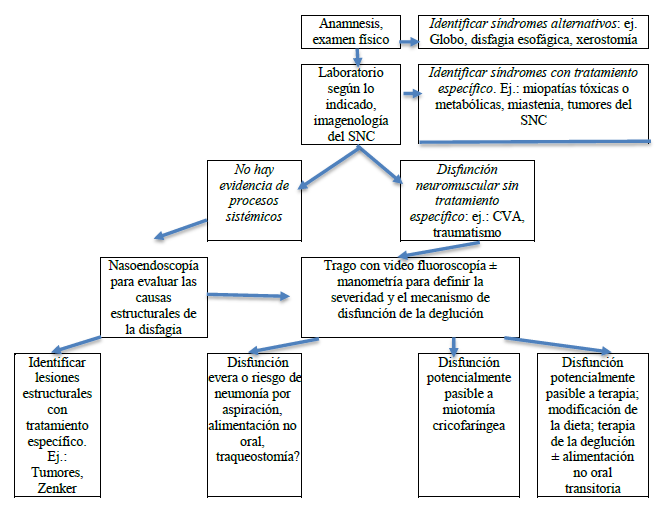
El algoritmo que se muestra en la Fig. 1 da una indicación de los exámenes y procedimientos más sofisticados necesarios para emprender un estudio diagnóstico que lleve a las terapias específicas.
Fig. 1 Evaluación y manejo de la disfagia orofaríngea
2.2 Disfagia esofágica
Diagnóstico diferencial
He aquí las condiciones más comunes asociadas a disfagia esofágica:
- Estenosis péptica — ocurre en hasta 10% de los pacientes con ERGE [29,30], pero la incidencia disminuye con el uso de los inhibidores de la bomba de protones
- Neoplasia de esófago — incluye neoplasia del cardias y pseudoacalasia
- Telarañas y anillos esofágicos
- Acalasia, que incluye otros trastornos primarios y secundarios de la motilidad esofágica
- Escleroderma
- Trastornos de la motilidad espástica
- Disfagia funcional
- Lesión rádica
Causas infrecuentes:
- Esofagitis linfocítica
- Anomalías cardiovasculares
- Compromiso esofágico de la enfermedad de Crohn
- Lesión cáustica
Historia clínica
La disfagia esofágica también se denomina disfagia “baja”, refiriéndose a la probable ubicación en el esófago distal — si bien es de destacar que algunos pacientes con formas de disfagia esofágica tales como acalasia pueden ubicarla en la región cervical, como si fuera una disfagia orofaríngea.
- La disfagia que se presenta por igual con sólidos y líquidos a menudo refleja un problema de motilidad esofágica. Esta sospecha se ve reforzada cuando la disfagia intermitente para sólidos y líquidos se acompaña de dolor torácico.
- La disfagia que se presenta solo con sólidos pero nunca con líquidos sugiere la posibilidad de obstrucción mecánica, y que la estenosis luminal tiene un diámetro < 15 mm. Si la disfagia es progresiva, en particular se debe considerar una estenosis péptica o un carcinoma. Vale también la pena destacar que los pacientes con estenosis pépticas suelen tener síntomas de larga data como pirosis y regurgitación, pero no pérdida de peso. A la inversa, los pacientes con cáncer esofágico tienden a ser de más edad, de sexo masculino, y suelen presentar un adelgazamiento marcado.
- En caso de disfagia intermitente con impactación de alimentos, especialmente en hombres jóvenes, se debe sospechar una esofagitis eosinofílica.
El examen físico de los pacientes con disfagia esofágica habitualmente tiene un valor limitado, si bien los pacientes con cáncer esofágico pueden presentar linfadenopatías cervicales/supraclaviculares palpables. Algunos pacientes con escleroderma y estenosis pépticas secundarias también pueden presentarse con el síndrome de CREST – por sus siglas en inglés - (calcinosis, fenómeno de Raynaud, compromiso esofágico, esclerodactilia, y telangiectasia).
La halitosis es un signo muy inespecífico que puede sugerir una acalasia avanzada o una obstrucción de larga data, donde se acumulan residuos de lenta descomposición en la luz del esófago.
La historia clínica es la piedra angular de la evaluación y se debe considerar en primera instancia. Una gran preocupación con la disfagia esofágica es descartar la neoplasia maligna. La historia del paciente puede dar algunas pistas. Es probable que se trate de una neoplasia maligna si se observa:
- Duración breve – menos de 4 meses
- Avance de la enfermedad
- Disfagia más para sólidos que para líquidos
- Adelgazmiento
Por otra parte, es más probable que se trate de una acalasia si:
- Hay disfagia tanto para sólidos como para líquidos. Una disfagia para líquidos es altamente sugestiva del diagnóstico.
- Hay regurgitación nocturna pasiva de mucus o alimentos.
- El problema ya lleva varios meses o años.
- El paciente adopta otras medidas para hacer que pasen los alimentos, como beber algo o cambiar su cuerpo de posición.
La esofagitis eosinofílica es más probable si hay:
- Una disfagia intermitente acompañada de impactación ocasional de alimentos.
Estudios
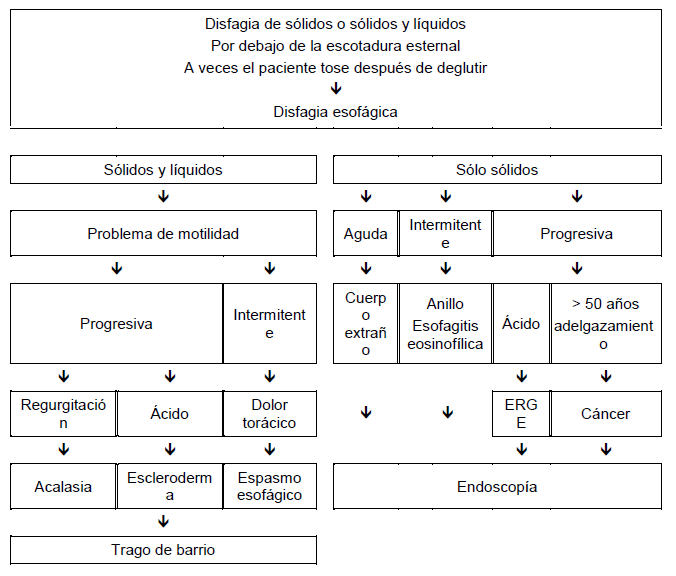
La historia médica es la base de los primeros estudios. Habitualmente los pacientes requieren una derivación temprana, ya que muchos de ellos tendrán que realizarse una endoscopía. El algoritmo que se muestra en la Fig. 2 resume la toma de decisiones de manejo, en cuanto a si comenzar a estudiar al paciente con endoscopía o un trago de bario.
- Evaluación endoscópica:
- Se pasa un video endoscopio (los fibroscopios han sido en gran parte sustituidos por endoscopios electrónicos o video endoscopios) por la boca hasta el estómago, observando el tracto gastrointestinal de forma detallada.
- De estar disponible, se puede utilizar video endoscopía de alta resolución para detectar cambios sutiles, como los típicos islotes blancuzcos de la esofagitis eosinofílica.
- Es muy importante introducir el endoscopio en la cavidad gástrica para descartar una pseudoacalasia debida a un tumor de la unión esofagogástrica.
- La endoscopía permite obtener piezas tisulares y realizar intervenciones terapéuticas.
- La ultrasonografía endoscópica (UE) es útil en algunos casos de obstrucción del tracto de salida.
- Esofagografía de contraste baritado (prueba de trago de bario):
- Los esofagogramas baritados tomados con el paciente en posición supina y en bipedestación pueden poner de manifiesto irregularidades en la luz del esófago e identificar la mayoría de los casos de obstrucción, membranas y anillos.
El estudio baritado de orofaringe y esófago durante la deglución es la prueba inicial más útil en los pacientes con antecedentes o características clínicas que sugieran una lesión del esófago proximal. En manos expertas puede llegar a ser más sensible y seguro que la endoscopía alta.
- También puede ayudar a detectar acalasia y espasmo difuso del esófago, si bien estas entidades se diagnostican de forma más definitiva con la manometría.
- Es útil incluir un comprimido de bario para identificar las estenosis sutiles. El trago de bario también puede ayudar en los pacientes disfágicos con endoscopía negativa si se agrega el comprimido.
- Si se sospecha una obstrucción mecánica sutil pese a que la endoscopía alta haya sido negativa, puede ser útil hacer una evaluación radiográfica con columna llena [31].
- El esofagograma baritado seriado minutado es muy útil para evaluar una acalasia antes y después del tratamiento.
- Manometría esofágica:
- Este método diagnóstico se basa en registrar la presión en la luz del esófago usando técnicas con estado sólido o de perfusión.
- La manometría está indicada cuando se sospecha que la disfagia obedece a una causa esofágica si el trago de bario y la endoscopía no logran determinar una causa, y luego de una adecuada terapia antirreflujo, una vez que se ha confirmado la curación de la esofagitis por vía endoscópica.
- Las tres principales causas de disfagia que se puede diagnosticar usando la manometría esofágica son acalasia, escleroderma, y espasmo esofágico.
- Manometría esofágica de alta resolución (MAR) con topografía de presión esofágica (TPE):
- Se utiliza para evaluar los trastornos de la motilidad esofágica.
- Se basa en la lectura simultánea de la presión con catéteres provistos de hasta 36 sensores distribuidos longitudinal y radialmente que permiten leer la presión dentro de los esfínteres y el cuerpo esofágico, utilizando un formato de diagramación tridimensional para describir los resultados del estudio (TPE).
- El esquema algorítmico diagnóstico de la Clasificación de Chicago (CC) ofrece una categorización jerárquica de los trastornos de la motilidad esofágica. La CC ha aclarado el diagnóstico de acalasia y del espasmo esofágico distal.
- Centellografía de tránsito esofágico con radionucleótidos:
- El paciente traga un líquido radiomarcado (por ejemplo, agua mezclada con coloide de azufre tecnesio Tc 99m o alimento radiomarcado), y se mide la radiactividad esofágica.
- Los pacientes con trastornos de la motilidad esofágica tienen un retardo del pasaje del radiofármaco desde el esófago. Por lo tanto, se debe sospechar anomalías de la motilidad en pacientes con endoscopía negativa y una duración anormal del tránsito.
- Cuando se usan pruebas baritadas y pruebas de impedancia MAR, la centellografía esofágica agrega muy poca información.
Fig. 2 Evaluación y manejo de la disfagia esofágica
2.3 Cascadas diagnósticas
Las Tablas 3 y 4 ofrecen opciones diagnósticas alternativas para situaciones con recursos limitados, recursos medianos, o “de última generación”.
Tabla 3 Cascada: opciones diagnósticas para disfagia orofaríngea

CT, tomografía computarizada; PET, tomografía de emisión de positrones.
Tabla 4 Cascada: opciones diagnósticas para la disfagia esofágica

CT, tomografía computarizada; PET, tomografía de emisión de positrones.
3. Opciones de tratamiento
3.1 Disfagia orofaríngea
Las metas de tratamiento son mejorar el pasaje de alimentos y bebidas y evitar la aspiración. La causa de la disfagia es un importante factor a tener en cuenta al elegir el enfoque.
Tabla 5 Disfagia orofaríngea: causas y enfoque del tratamiento

El manejo de las complicaciones es de crucial importancia. En ese sentido, cuando se consideran las opciones de tratamiento es fundamental identificar el riesgo de aspiración. A los pacientes que reciben rehabilitación activa por un accidente cerebrovascular se les debe ofrecer terapia para disfagia en la medida que la toleren. Los remedios sencillos pueden ser importantes — por ej.: uso de prótesis dental para solucionar sus problemas dentales, modificaciones de la textura de los líquidos [32] y alimentos [33], o cambiando el volumen del bolo.
- Rehabilitación y re-educación de la deglución:
- Se han sugerido modificaciones apropiadas de la postura, nutrición y comportamiento.
- Algunas maniobras relativamente sencillas durante la deglución pueden reducir la disfagia orofaríngea.
- Entrenamiento específico deglutorio a cargo de un especialista en trastornos de la deglución.
- Se han desarrollado diferentes técnicas de terapia de la deglución para mejorar las alteraciones de la deglución. Incluyen ejercicios de fortalecimiento y biofeedback.
- Modificaciones nutricionales y dietéticas:
- Los alimentos más blandos mejoran los resultados, posiblemente en combinación con medidas posturales.
- Siempre que sea posible, la alimentación oral es la mejor opción. Puede hacer una gran diferencia si se modifica la consistencia de los alimentos para espesar los líquidos y se dan alimentos blandos [34].
- Se debe tener cuidado de controlar las necesidades nutricionales y de líquidos (considerando el riesgo de deshidratación).
- El agregado de ácido cítrico para mejorar los alimentos mejora los reflejos deglutorios, posiblemente debido a que el ácido aumenta la estimulación gustatoria y trigeminal [35].
- También puede ayudar el tratamiento adyuvante con un inhibidor de la enzima convertidora de la angiotensina para facilitar el reflejo tusígeno [36].
- Apoyo nutricional alternativo:
- Si existe un alto riesgo de aspiración, o si la ingesta oral no logra un adecuado estado nutricional debe considerarse la introducción de una sonda de alimentación blanda con perforaciones finas bajo guía radiológica.
- La alimentación por gastrostomía tras un accidente cerebrovascular reduce la tasa de mortalidad y mejora el estado nutricional del paciente en comparación con la alimentación nasogástrica.
- La gastrostomía endoscópica percutánea consiste en introducir una sonda de gastrostomía en el estómago por una vía abdominal percutánea guiada por endoscopía y de encontrarse disponible es generalmente preferible a la gastrostomía quirúrgica.
- La probabilidad de que se pueda finalmente retirar las sondas de alimentación es menor para los pacientes añosos que hayan sufrido un accidente cerebrovascular bilateral, o que se hayan aspirado durante la video fluoroscopía inicial [37].
- La alimentación por sonda yeyunal debe utilizarse en agudo, dejando la alimentación por gastrostomía percutánea o sonda de yeyunostomía para las patologías crónicas.
- Los tratamientos quirúrgicos dirigidos a aliviar las causas espásticas de la disfagia, como la miotomía cricofaríngea, han arrojado buenos resultados en hasta 60% de los casos, pero su uso sigue siendo controvertido [38]. Por otro lado, la cirugía abierta y la miotomía endoscópica en los pacientes con divertículo de Zenker constituye una terapia bien establecida.
3.2 Disfagia esofágica
La disfagia aguda requiere evaluación e intervención inmediatas. En los adultos, la causa más común es la impactación de alimentos. Es posible que haya un componente de base de obstrucción mecánica. Luego de extraer el bolo de alimentos impactado se observa una mejora inmediata. Se debe tener cuidado de evitar la perforación al intentar empujar el cuerpo extraño hacia abajo.
En la Tabla 6 se presenta una lista de opciones a considerar para el manejo para la disfagia esofágica.
Tabla 6 Opciones de manejo de la disfagia esofágica
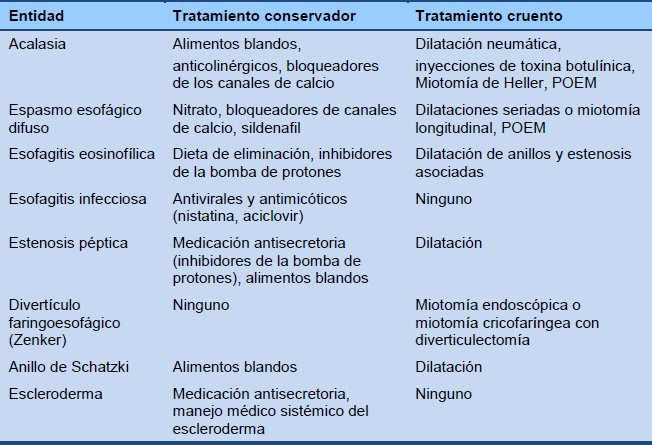
POEM, (por las siglas en inglés) miotomía endoscópica peroral.
Estenosis esofágicas pépticas
Las estenosis pépticas habitualmente son el resultado de enfermedad por reflujo gastroesofágico (ERGE), pero las estenosis también pueden ser provocadas por medicación. El diagnóstico diferencial debe excluir:
- Estenosis cáusticas tras la ingestión de sustancias o productos químicos corrosivos
- Estenosis medicamentosas
- Estenosis pos operatorias
- Estenosis micóticas
- Esofagitis eosinofílica
Una vez que se ha confirmado la estenosis por vía endoscópica, la dilatación gradual [39,40] con una bujía de Savary constituye el tratamiento de elección. La dilatación con balón es una alternativa, pero puede llegar a ser más riesgosa.
- Una terapia agresiva antirreflujo con inhibidores de la bomba de protones — como omeprazol 20 mg 2 veces al día o equivalente — o la fundoplicatura mejoran la disfagia y reduce la necesidad de dilataciones ulteriores de esófago en pacientes con estenosis pépticas del esófago. Algunos pacientes pueden necesitar dosis más altas.
- Para los pacientes cuya disfagia persiste o se reinstala después de una prueba inicial de dilatación y terapia anti-reflujo, se debe confirmar la esofagitis por reflujo por vía endoscópica antes de repetir la dilatación.
- Cuando se haya logrado la curación de la esofagitis por reflujo, la necesidad de proceder con más dilataciones ulteriormente se evalúa empíricamente.
- A los pacientes que presentan solo un alivio pasajero de la disfagia después de la dilatación se le puede enseñar la técnica de la autodilatación con bujía.
- Para las estenosis refractarias, las opciones terapéuticas incluyen la inyección intralesional de corticoides antes de la dilatación, y la incisión electroquirúrgica endoscópica.
- En algunas raras ocasiones, las estenosis realmente refractarias requieren resección y reconstrucción del esófago.
- Excepcionalmente puede estar indicado hacer una prótesis endoluminal en pacientes con estenosis benignas [41]. El riesgo de perforación es de alrededor de 0.5% y en esas condiciones hay un alto índice de migración de la prótesis.
- En general la cirugía está indicada si se produce una perforación manifiesta, pero se están desarrollando métodos endoscópicos para el cierre de las heridas.
Tratamiento de los anillos mucosos del esófago inferior (incluyendo el anillo de Schatzki)
- La terapia de dilatación de los anillos mucosos del esófago inferior consiste en pasar una única bujía grande (45–60 Fr) o hacer una dilatación con balón (18–20 mm) para fracturar los anillos (y no simplemente estirarlos).
- Después de una dilatación abrupta, toda esofagitis por reflujo asociada se trata agresivamente con altas dosis de inhibidores de la bomba de protones.
- La necesidad de dilataciones ulteriores se determina empíricamente. Sin embargo, es posible que la disfagia recidive, y los pacientes deben saber que tal vez haya que volver a dilatar. En esos casos se debe obtener biopsias de la mucosa esofágica para evaluar una posible esofagitis eosinofílica.
- La manometría esofágica está recomendada en aquellos pacientes en los que la disfagia persista o en los que vuelve a instalarse rápidamente pese a una adecuada dilatación y terapia antirreflujo.
- Para los pacientes con un trastorno de la motilidad tratable como acalasia, la terapia está dirigida al problema de motilidad.
- Si no se encuentra un trastorno de la motilidad tratable, se repite la endoscopía para confirmar que la esofagitis haya curado y que se haya vencido el anillo.
- Para los pacientes con anillos persistentes se justifica hacer otra prueba de dilatación.
- Los anillos refractarios que no responden a la dilatación usando balones y bujías estándar pueden responder a la incisión electroquirúrgica endoscópica y a una exéresis quirúrgica. Estas terapias solo se necesitarían raras veces para los pacientes con anillos mucosos del esófago inferior, y solo luego de haber excluido otras causas de disfagia.
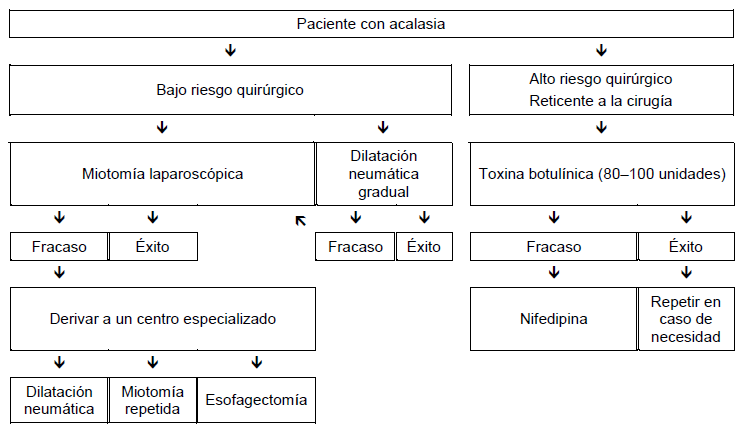
Acalasia
- Debe excluirse la posibilidad de pseudoacalasia (edad avanzada, adelgazamiento rápido y severo) o la enfermedad de Chagas.
- El manejo de la acalasia depende fundamentalmente del riesgo quirúrgico.
- El tratamiento médico con nitratos o bloqueadores de los canales de calcio es a menudo ineficaz o mal tolerado.
- Para los pacientes con riesgo quirúrgico, si el clínico considera que las medicaciones y la dilatación neumática serían mal toleradas se puede utilizar una inyección de toxina botulínica como tratamiento inicial. La inyección de toxina botulínica parece ser un procedimiento seguro que puede inducir una remisión clínica durante por lo menos 6 meses en aproximadamente dos tercios de los pacientes con acalasia. Sin embargo, la mayoría de los pacientes necesitan repetir las inyecciones para mantener la remisión. Los resultados a largo plazo con este tratamiento han sido decepcionantes, y algunos cirujanos sienten que la cirugía se torna más difícil por las cicatrices que pueden provocar las inyecciones.
- Una vez que han fracasado esos tratamientos, el médico y el paciente deben decidir si los potenciales beneficios de la dilatación neumática o la miotomía superan los riesgos sustanciales que plantean estos procedimientos en los pacientes añosos o muy debilitados.
- Para aquellos en los que la cirugía es una opción, la mayoría de los gastroenterólogos comienza con la dilatación neumática con endoscopía y cuando han fracasado dos o tres dilataciones neumáticas graduales (con balones de 30 mm, 35 mm, y 40 mm) optan por la miotomía laparoscópica tipo Heller. Algunos gastroenterólogos prefieren optar directamente por la cirugía sin una prueba previa de dilatación neumática, o limitan el diámetro de los dilatadores neumáticos que utilizan a 30–35 mm.
- La miotomía peroral endoscópica (POEM) se está presentando como una alternativa ya sea para una dilatación neumática o una miotomía de Heller.
- Si estos tratamientos fallaran, especialmente en los pacientes con un esófago descompensado, se podría necesitar esofagectomía.
- La gastrostomía para alimentación es una alternativa a la dilatación neumática o la miotomía, pero muchos pacientes sin daño neurológico encuentran que la vida con una gastrostomía es inaceptable.
Fig. 3 Opciones de manejo en los pacientes con acalasia
Esofagitis eosinofílica
- La esofagitis eosinofílica es una inflamación del esófago provocada por un alergeno [42].
- El diagnóstico se basa en el examen histológico de biopsias de la mucosa del esófago superior e inferior después del tratamiento inicial con inhibidores de la bomba de protones durante 6–8 semanas. Aproximadamente un tercio de los pacientes en los que se sospecha esofagitis eosinofílica logran la remisión con inhibidores de la bomba de protones [43].
- La identificación de un alergeno alimentario o transmitido por el aire puede dirigir el asesoramiento con respecto a la dieta.
- Si no se puede identificar ningún alergeno específico se puede intentar la dieta de eliminación de los seis alimentos.
- Las recomendaciones estándar para la terapia farmacológica de la esofagitis eosinofílica incluye corticoides tópicos y antagonistas de leucotrieno [44,45].
- La dilatación esofágica de los pacientes con estenosis y anillos asociados es segura (con una tasa de perforaciones verdaderas de menos de 1%) y eficaz (la disfagia mejora hasta 1–2 años en más de 90% de los casos) [46,47].
3.3 Cascadas de manejo
Las Tablas 7–9 enumeran las opciones de manejo alternativas para situaciones con recursos limitados, recursos de niveles medianos, o recursos de “última generación”.
Tabla 7 Cascada: opciones de manejo de la disfagia orofaríngea

Tabla 8 Cascada: opciones de manejo de la disfagia esofágica

Tabla 9 Cascada: opciones de manejo de la acalasia

4. Referencias
Referencias generales
Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
Lista de referencias
- Ginsberg GG. Food bolus impaction. Gastroenterol Hepatol 2007;3:85–6.
- Hila A, Castell D. Upper gastrointestinal disorders. In: Hazzard W, Blass J, Halter J, Ouslander J, Tinetti ME, editors. Principles of geriatric medicine and gerontology. 5th ed. New York: McGraw-Hill Professional; 2003: 613–40.
- Shamburek RD, Farrar JT. Disorders of the digestive system in the elderly. N Engl J Med 1990;322:438–43.
- Hinchey JA, Shephard T, Furie K, Smith D, Wang D, Tonn S, et al. Formal dysphagia screening protocols prevent pneumonia. Stroke J Cereb Circ 2005;36:1972–6.
- Donovan NJ, Daniels SK, Edmiaston J, Weinhardt J, Summers D, Mitchell PH, et al. Dysphagia screening: state of the art: invitational conference proceeding from the State-of-the-Art Nursing Symposium, International Stroke Conference 2012. Stroke J Cereb Circ 2013;44:e24–31.
- Kalf JG, de Swart BJM, Bloem BR, Munneke M. Prevalence of oropharyngeal dysphagia in Parkinson’s disease: a meta-analysis. Parkinsonism Relat Disord 2012;18:311–5.
- Nicaretta DH, Rosso AL, Mattos JP de, Maliska C, Costa MMB. Dysphagia and sialorrhea: the relationship to Parkinson’s disease. Arq Gastroenterol 2013;50:42–9.
- Atmatzidis K, Papaziogas B, Pavlidis T, Mirelis C, Papaziogas T. Plummer–Vinson syndrome. Dis Esophagus 2003;16:154–7.
- Holland G, Jayasekeran V, Pendleton N, Horan M, Jones M, Hamdy S. Prevalence and symptom profiling of oropharyngeal dysphagia in a community dwelling of an elderly population: a selfreporting questionnaire survey. Dis Esophagus 2011;24:476–80.
- Turley R, Cohen S. Impact of voice and swallowing problems in the elderly. Otolaryngol Head Neck Surg 2009;140:33–6.
- Lin LC, Wu SC, Chen HS, Wang TG, Chen MY. Prevalence of impaired swallowing in institutionalized older people in Taiwan. J Am Geriatr Soc 2002;50:1118–23.
- United States. Congress. House. Resolution expressing the sense of the Congress that a National Dysphagia Awareness Month should be established. 110th Congress. 2nd session. H. Con. Res. 195 (2008). Washington, DC: United States Government Printing Office, 2008. Available at: http://thomas.loc.gov/cgi-bin/query/z?c110:H.CON.RES.195:.
- Kidambi T, Toto E, Ho N, Taft T, Hirano I. Temporal trends in the relative prevalence of dysphagia etiologies from 1999–2009. World J Gastroenterol 2012;18:4335–41.
- Rutegård M, Lagergren P, Nordenstedt H, Lagergren J. Oesophageal adenocarcinoma: the new epidemic in men? Maturitas 2011;69:244–8.
- Ronkainen J, Talley NJ, Aro P, Storskrubb T, Johansson SE, Lind T, et al. Prevalence of oesophageal eosinophils and eosinophilic oesophagitis in adults: the population-based Kalixanda study. Gut 2007;56:615–20.
- Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen M, et al. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol 2011;128:1349–50.
- Zhang HZ, Jin GF, Shen HB. Epidemiologic differences in esophageal cancer between Asian and Western populations. Chin J Cancer 2012;31:281–6.
- Ronkainen J, Agréus L. Epidemiology of reflux symptoms and GORD. Best Pract Res Clin Gastroenterol 2013;27:325–37.
- Matsuda NM, Miller SM, Evora PRB. The chronic gastrointestinal manifestations of Chagas disease. Clinics (São Paulo, Brazil) 2009;64:1219–24.
- Blackwell Z, Littlejohns P. A review of the management of dysphagia: a South African perspective. J Neurosci Nurs 2010;42:61–70.
- National Stroke Foundation. Clinical guidelines for stroke management 2010. Melbourne: National Stroke Foundation, 2010: 78–95.
- Scharitzer M, Pokieser P, Schober E, Schima W, Eisenhuber E, Stadler A, et al. Morphological findings in dynamic swallowing studies of symptomatic patients. Eur Radiol 2002;12:1139–44.
- Barkhausen J, Goyen M, von Winterfeld F, Lauenstein T, Arweiler-Harbeck D, Debatin JF. Visualization of swallowing using real-time TrueFISP MR fluoroscopy. Eur Radiol 2002;12:129–33.
- Ramsey DJC, Smithard DG, Kalra L. Early assessments of dysphagia and aspiration risk in acute stroke patients. Stroke J Cereb Circ 2003;34:1252–7.
- Pikus L, Levine MS, Yang YX, Rubesin SE, Katzka DA, Laufer I, et al. Videofluoroscopic studies of swallowing dysfunction and the relative risk of pneumonia. AJR Am J Roentgenol 2003;180:1613–6.
- Perlman AL, Witthawaskul W. Real-time remote telefluoroscopic assessment of patients with dysphagia. Dysphagia 2002;17:162–7.
- Omari TI, Dejaeger E, van Beckevoort D, Goeleven A, Davidson GP, Dent J, et al. A method to objectively assess swallow function in adults with suspected aspiration. Gastroenterology 2011;140:1454–63.
- Chang YC, Chen SY, Lui LT, Wang TG, Wang TC, Hsiao TY, et al. Dysphagia in patients with nasopharyngeal cancer after radiation therapy: a videofluoroscopic swallowing study. Dysphagia 2003;18:135–43.
- Katz PO, Knuff TE, Benjamin SB, Castell DO. Abnormal esophageal pressures in reflux esophagitis: cause or effect? Am J Gastroenterol 1986;81:744–6.
- Spechler SJ. AGA technical review on treatment of patients with dysphagia caused by benign disorders of the distal esophagus. Gastroenterology 1999;117:233–54.
- Ott DJ. Radiographic techniques and efficacy in evaluating esophageal dysphagia. Dysphagia 1990;5:192–203.
- Cichero J, Nicholson T, Dodrill P. Liquid barium is not representative of infant formula: characterisation of rheological and material properties. Dysphagia 2011;26:264–71.
- Gisel E. Interventions and outcomes for children with dysphagia. Dev Disabil Res Rev 2008;14:165–73.
- Wilkinson TJ, Thomas K, MacGregor S, Tillard G, Wyles C, Sainsbury R. Tolerance of early diet textures as indicators of recovery from dysphagia after stroke. Dysphagia 2002;17:227–32.
- Pelletier CA, Lawless HT. Effect of citric acid and citric acid-sucrose mixtures on swallowing in neurogenic oropharyngeal dysphagia. Dysphagia 2003;18:231–41.
- Marik PE, Kaplan D. Aspiration pneumonia and dysphagia in the elderly. Chest 2003;124:328–36.
- Ickenstein GW, Kelly PJ, Furie KL, Ambrosi D, Rallis N, Goldstein R, et al. Predictors of feeding gastrostomy tube removal in stroke patients with dysphagia. J Stroke Cerebrovasc Dis 2003;12:169–74.
- Gervais M, Dorion D. Quality of life following surgical treatment of oculopharyngeal syndrome. J Otolaryngol 2003;32:1–5.
- Mann NS. Single dilation of symptomatic Schatzki ring with a large dilator is safe and effective. Am J Gastroenterol 2001;96:3448–9.
- Dumon JF, Meric B, Sivak MV, Fleischer D. A new method of esophageal dilation using Savary-Gilliard bougies. Gastrointest Endosc 1985;31:379–82.
- Pouderoux P, Verdier E, Courtial P, Bapin C, Deixonne B, Balmès JL. Relapsing cardial stenosis after laparoscopic nissen treated by esophageal stenting. Dysphagia 2003;18:218–22.
- Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:1066–78.
- Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
- Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
- Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
- Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
- Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
















