J. Feld (Canadá) y H.L.A. Janssen (Canadá/Países Bajos)
Z. Abbas (Pakistán)
A. Elewaut (Bélgica)
P. Ferenci (Austria)
V. Isakov (Rusia)
A.G. Khan (Pakistán)
S.G. Lim (Singapur)
S. Locarnini (Australia)
S.K. Ono (Brasil)
J. Sollano (Filipinas)
C.W. Spearman (Sudáfrica)
C.T. Yeh (Taiwán)
M.F. Yuen (Hong Kong)
A.W. LeMair (Países Bajos)
1. Introducción
El virus de hepatitis B (VHB) provoca enfermedad hepática aguda y crónica y es endémico en muchas partes del mundo. El virus se trasmite por contacto con sangre o con otros fluídos corporales de una persona infectada.
- Cuando la trasmisión ocurre verticalmente (de madre a hijo) u horizontalmente a niños pequeños (durante el juego, a partir de contactos en el hogar, etc), es frecuente que la infección se haga crónica.
- Por el contrario, cuando la trasmisión ocurre en la adolescencia o en la edad adulta—habitualmente por contacto sexual o agujas contaminadas (“objetos punzantes”), y menos frecuentemente por trasfusión de productos hemáticos – lo habitual es que la infección se resuelva, a menos que el individuo esté inmunocomprometido (por ejemplo, infectado con el virus de inmunodeficiencia humana).
- En la prevención del VHB es muy importante educar a la población sobre cómo evitar un comportamiento riesgoso.
- El VHB representa un importante riesgo ocupacional para el personal de la salud.
- Desde 1982 se dispone de una vacuna segura y eficaz para el VHB, cuya eficacia evitando nuevas infecciones es de 95%.
Cada individuo con infección crónica por VHB (HBC) representa una oportunidad para evitar nuevos casos. Es importante tomarse el tiempo necesario para instruir a los pacientes y explicarles los riesgos que plantea la infección a ellos mismos y a otros.
- La vacunación contra el VHB es altamente efectiva, siendo deseable instituir la vacunación universal a edad temprana – preferentemente al nacimiento en los países con alta endemicidad.
- Lo mínimo que se puede hacer es ofrecerle vacunación a todos los individuos en riesgo.
- Debe hacerse un tamizaje de todas las mujeres embarazadas en búsqueda del VHB antes del embarazo, ya que permite evitar que haya una generación más de personas con infección crónica.
Si bien la mayoría de los pacientes con HBC no presenta complicaciones hepáticas, todos los individuos infectados corren un mayor riesgo de fibrosis hepática progresiva, una patología que lleva a la cirrosis, y de última a la descompensación hepática y/o carcinoma hepatocelular (CHC). Afortunadamente el tratamiento efectivo puede reducir el riesgo de complicaciones relacionadas con VHB.
1.1 Cascadas de la WGO
Esta guía mundial de la WGO incluye una serie de cascadas que brindan diferentes opciones según los recursos disponibles para el diagnóstico y el manejo. Estas Cascadas de WGO pretenden servir como complemento a nivel “mundial” más que sustituir a las pautas “patrón oro” de la Asociación Europea para el Estudio del Hígado (EASL1), la Asociación Americana para el Estudio de Enfermedades Hepáticas (AASLD2), la Asociación Asia–Pacífico para el Estudio del Hígado (APASL3), y el Instituto Nacional de Cuidados y Excelencia en la Salud (NICE4) [1–4].
1 European Association for the Study of the Liver
2 American Association for the Study of Liver Diseases
3 Asian–Pacific Association for the Study of the Liver
4 National Institute for Care and Health Excellence
1.2 Epidemiología y transmisión de la hepatitis B
De los muchos virus causantes de enfermedad humana, hay pocos con mayor importancia mundial que el virus de la hepatitis B [5]:
- Más de 2 mil millones de personas viven hoy con evidencia serológica de infección actual o pasada por VHB.
- 250 millones presentan infección crónica y tienen riesgo de desarrollar enfermedad hepática relacionada con su VHB [6].
- Alrededor de 15–40% de los pacientes con infección crónica presentarán cirrosis que evoluciona a insuficiencia hepática y/o CHC en el curso de sus vidas.
- Todos los años hay más de 4 millones de casos clínicos agudos de VHB.
- Se estima que cada año fallecen 1 millón de personas por infección crónica de VHB y sus complicaciones: cirrosis o cáncer de hígado primario [7].
- Se estima que anualmente fallecen 786,000 personas (2010) por enfermedades hepáticas relacionadas con el VHB [8].
La prevalencia del VHB varía de forma importante entre las diferentes regiones del mundo (Fig. 1). En la literatura habitualmente se establece una diferencia entre las áreas de endemicidad alta, media, baja y muy baja.
- En las áreas de alta endemicidad [5], aproximadamente 70–90% de la población contrae VHB antes de los 40 años, y entre 8–20% de la población desarrolla infección crónica con portación persistente del virus [9].
- La prevalencia de la HBC varía desde más de 10% de la población en el sudeste asiático, China, el área amazónica y África sub sahariana, a menos de 1% en Europa Occidental y América del Norte.
- En términos generales, aproximadamente 45% de la población mundial vive en áreas de alta endemicidad. Con la globalización muchos individuos con el VHB están inmigrando a áreas en las que las tasas de HBC tradicionalmente habían sido bajas, y es fácil que la afección pase desapercida.
Fig. 1 Distribución geográfica de los genotipos del virus de hepatitis B a nivel mundial (reproducido con permiso de [10,11]). Con los patrones migratorios, la distribución de los genotipos del VHB para hepatitis B crónica puede cambiar rápidamente, particularmente en occidente.
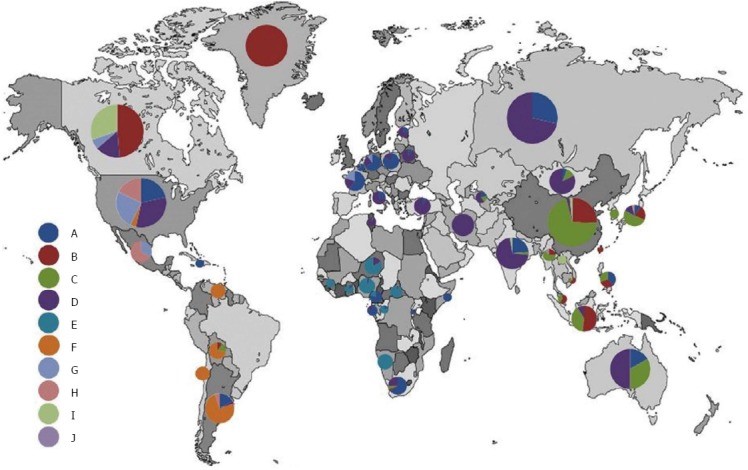
Notas: Datos recientemente publicados [12,13] demuestran la siguiente distribución del genotipo para Rusia: genotipo D, 85%; genotipo A, 10.7%; genotipo C, 3.2%; todos los otros genotipos, 1.1%. En Venezuela, en la población general el genotipo F del VHB es el más frecuente (al igual que en Colombia y Perú) [14]; la prevalencia en poblaciones urbanas es de aproximadamente 80% [15], mientras que entre los indios Americanos es de casi 100% [16].
La gran variedad en la prevalencia de la infección por HBC tiene que ver fundamentalmente con las diferencias de edad en el momento de contraer la infección.
- La probabilidad que una infección aguda se haga crónica es de 70–90% para la infección adquirida en el período perinatal (vertical) y de 20–50% para las infecciones (horizontales) adquiridas durante la primera infancia (antes de los 5 años de edad).
- La probabilidad de desarrollar HBC ronda 1–3% en el caso de individuos inmunocompetentes que contrajeron la infección por VHB en la edad adulta, siendo las tasas mayores en los individuos inmunosuprimidos.
- Ya se han identificado ocho [17] (y posiblemente hasta 10) genotipos del virus de hepatitis B (A–H), cada uno de los cuales difiere en cuanto a su distribución geográfica y su potencial de afectar la evolución clínica de la enfermedad (Tabla 1). La prevalencia actual de los genotipos VHB en las diferentes regiones depende en gran medida de los patrones migratorios.
Tabla 1 Distribución geográfica de los genotipos y subgenotipos de la infección por hepatitis B [10]

Son cada vez más los pacientes con infección crónica que están presentando variantes de VHB que expresan poco o nada el antígeno e de la hepatitis B (HBeAg); esta forma HBeAg negativa de la hepatitis B puede requerir un tratamiento prolongado para reducir la probabilidad de avance de la enfermedad hepática; la recidiva aparece cuando el paciente no está recibiendo el tratamiento. Se establece una distinción entre la mutación pre-core, en la que hay una mutación stop en el gen precore que elimina completamente la producción de HBeAg, y la mutación del promotor core basal (BCP), que afecta al promotor, por lo que reduce la producción de HBeAg pero sin eliminarla. La prevalencia de mutaciones precore es más alta en los países mediterráneos; es allí donde se observa una mayor prevalencia del genotipo D, mientras que las mutaciones del promotor core se encuentran fundamentalmente en el genotipo C (en el este y sudeste de Asia).
2. Evolución clínica de la infección por VHB
El resultado de la infección por VHB depende fundamentalmente de la interacción entre el huésped y el virus, mediada por la respuesta inmune adquirida. La respuesta de las células T específicas para el virus es uno de los factores clave en la patogenia de la infección por VHB. Las variantes virales pueden influir sobre la evolución y el desenlace de la enfermedad. Todavía no se comprende bien cuál es el efecto de los factores del huésped sobre la progresión de la enfermedad. Es muy raro que el virus de la hepatitis B se haga directamente citopático (tiene que haber una inmunosupresión profunda).
2.1 Historia natural
La evolución clínica de la infección por VHB es variable e incluye la infección aguda (autolimitada), la insuficiencia hepatocítica fulminante, el estado de portador del virus inactivo, y la hepatitis crónica que puede progresar a cirrosis y CHC [24,25].
2.2 Infección crónica por el VHB
El riesgo de cronicidad en la infección aguda por el VHB está vinculado a la edad del sujeto cuando ocurre la infección primaria. Los adultos que se han infectado crónicamente durante la infancia tienen un riesgo de 15–25% de fallecer por cirrosis vinculada con el VHB o cáncer hepático, siendo el riesgo significativamente mayor en los hombres que en las mujeres [26].
Tabla 2 Riesgo de cronicidad y edad al momento de la infección primaria

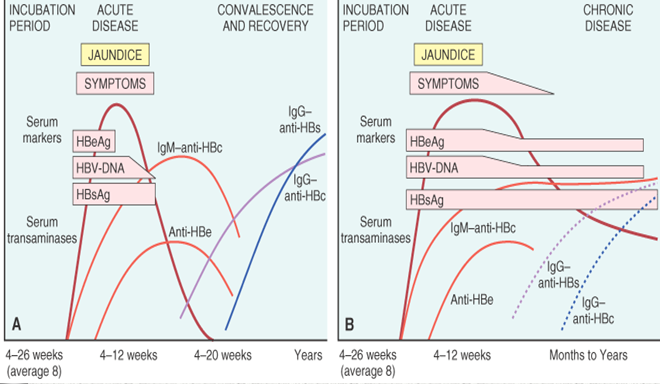
Fig. 2 Secuencia de los marcadores serológicos en la infección aguda por hepatitis B (reproducido con permiso de [27]). A, resolución de la infección activa; B, progresión a infección crónica.
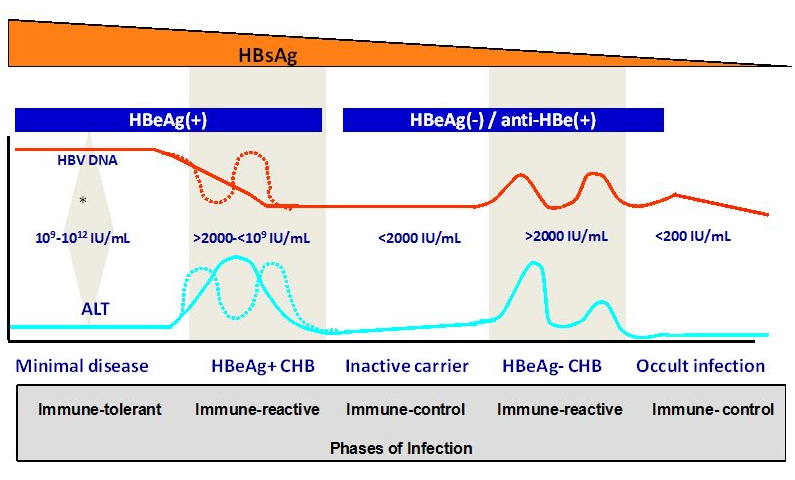
2.3 Fases de la enfermedad crónica por el virus HB (HBC)
La HBC es una efermedad dinámica que fluctúa con el tiempo, probablemente como consecuencia de las interacciones entre el virus y el sistema inmunitario del huésped. En la infección crónica por VHB se pueden identificar las cinco fases siguientes—no necesariamente en secuencia.
- Fase de inmunotolerancia:
- Caracterizada por altos niveles séricos de ADN del VHB, positividad HBeAg, niveles normales de alanino aminotransferasa (ALT), y ausencia de necrosis inflamatoria hepática.
- El avance de la enfermedad es mínimo en los pacientes que se mantienen en esta fase [28].
- En esta fase los pacientes son altamente contagiosos.
- Fase inmuno reactiva (HBC HBeAg positiva):
- Los pacientes ingresan a esta fase después de un tiempo variable que depende de la edad en la que ocurrió la infección por VHB.
- Aumenta la actividad del sistema inmunitario y ataca a los hepatocitos infectados.
- Esta fase está caracterizada por niveles de ADN del VHB sumamente fluctuantes, pero progresivamente decrecientes, una ALT elevada, y necrosis inflamatoria hepática (HBC HBeAg positiva).
- Una fase de actividad inmunitaria prolongada con múltiples empujes de ALT puede dar lugar a una fibrosis hepática progresiva que evoluciona a la cirrosis.
- Fase de control inmunitario (y estado de portador inactivo):
- La transición a esta fase como resultado de la fase inmuno activa está marcada por la seroconversión de HBeAg a positividad anti-HBe.
- Caracterizado por niveles séricos bajos o no detectables del ADN del VHB (< 2000 UI/ml), niveles normales de ALT, y desaparición de la necrosis inflamatoria hepática (estado de portador inactivo).
- Fase de reactivación (HBC HBeAg negativa):
- A pesar de la seroconversión HBe, la reactivación de la replicación del VHB puede ocurrir debido a la selección de mutaciones del VHB con HBeAg defectuosos.
- Caracterizado por niveles de anticuerpos anti-HBe positivos, niveles fluctuantes del ADN del VHB y de ALT, y un alto riesgo de fibrosis hepática severa (HBC HBeAg negativa).
- Puede haber elevaciones periódicas de ALT intercalados con épocas de normalización que hacen difícil distinguir entre una HBC HBeAg negativa y la enfermedad inactiva; es por eso que se necesita hacer un seguimiento continuo antes de poder designar a los pacientes con ALT normal y niveles bajos del ADN del VHB comoportadores inactivos.
- Ha surgido evidencia que sugiere que un título bajo del ADN del VHB (< 2000 UI/ml), combinado con un título bajo de antígeno de superficie de hepatitis B (HBsAg) (< 1000 UI/ml) puede ayudar a identificar a los portadores inactivos, particularmente a aquellos con infección del tipo D [29].
- Fase HBsAg negativa:
- Después de la pérdida de HBsAg, pueden persistir niveles bajos de replicación del VHB, pudiéndose detectar ADN del VHB en el hígado y algunas pocas veces en suero [30].
- En pacientes con infección por VHB “oculta”, se ha demostrado la persistencia del control inmunológico efectivo del VHB. [31].
- Una inmunosupresión importante puede llevar a una reactivación del VHB, con reaparición de HBsAg, conocida como“seroconversión inversa.”
Fig. 3 Marcadores e historia natural de la infección crónica por hepatitis B (reproducido con permiso de [27]).
2.4 Progresión de la HBC
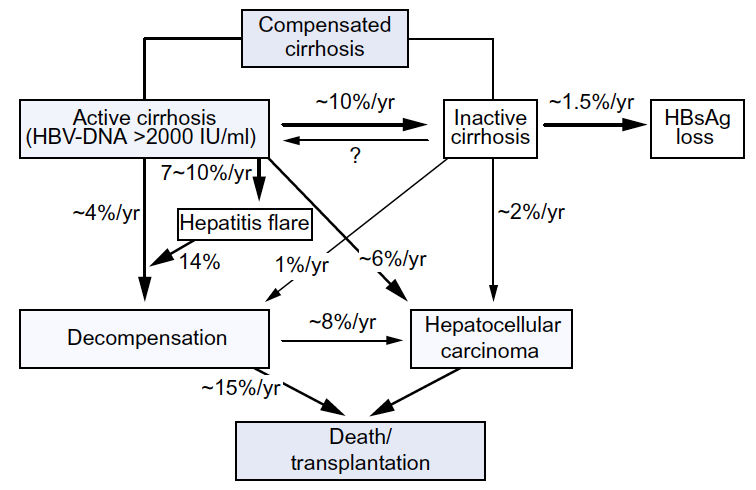
La HBC tiene una evolución variable, yendo desde una infección subclínica silente hasta una hepatitis persistente con fibrosis progresiva que lleva a cirrosis, insuficiencia hepática y/o cáncer de hígado. Los factores que determinan los resultados de la enfermedad no están totalmente claros, pero intervendrían factores virales, ambientales, y del huésped (Tabla 3), todos los cuales interactúan. Los determinantes virales del pronóstico tienen importancia variable, dependiendo de la etapa de la enfermedad. Por ejemplo, los títulos séricos del ADN del VHB son más altos en la fase inmunotolerante de la enfermedad a pesar de la falta de inflamación hepática o de fibrosis progresiva durante este período. Por el contrario, en la HBC HBeAg negativa, cuanto más alto el nivel del ADN del VHB, mayor el riesgo de progresión de la enfermedad y de CHC. En la Fig. 4 se muestran las tasas de progresión de la cirrosis y de CHC y las tasas de mortalidad asociadas.
Tabla 3 Factores que inciden en el resultado de la hepatitis B crónica

BCP, promotor core basal; HBeAg, antígeno e de hepatitis B; VHB, virus de hepatitis B; CHC, carcinoma hepatocelular; VHC, virus de hepatitis C; VHD, virus de hepatitis D; VIH, virus de inmunodeficiencia humana.
Fig. 4 Riesgo de progresión en pacientes con cirrosis relacionada con el VHB. Reproducido con permiso de Peng y col. (2012) [32], a los que se puede hacer referencia cuando se hace un análisis detallado de la evolución natural de la cirrosis y el CHC relacionados con VHB.
3. Diagnóstico y monitoreo de la hepatitis B
3.1 Cascada— hepatitis B aguda
El diagnóstico de hepatitis B aguda se basa en la detección de HBsAg y anti-HBc (inmunoglobulina M).
- Durante la fase inicial de la infección también se observa la presencia de marcadores de replicación del VHB —HBeAg y ADN del VHB.
- La recuperación se acompaña de la desaparición del ADN del VHB detectable, seroconversión de HBeAg a anti-HBe, y el ulterior aclaramiento de HBsAg con seroconversión a anti-HBs y aparición de anti-HBc (IgG).
- La evolución de VHB aguda debería tener lugar dentro de los 3 meses del diagnóstico —la infección crónica por VHB se caracteriza por persistencia de HBsAg en plasma durante más de 6 meses.
En unas pocas ocasiones los pacientes se presentan durante un período ventana en el que el HBsAg ya se ha negativizado pero todavía no se ha hecho positivo el anti- HBs. En esta situación, que es más frecuente en pacientes con hepatitis B fulminante en los que el aclaramiento viral tiende a ser más rápido, la inmunoglobulina M (IgM) anti-HBc es el único marcador de infección aguda por VHB.
Cascada 1 Pruebas diagnósticas para hepatitis B aguda

El diagnóstico diferencial de la hepatits aguda HBsAg positiva incluye exacerbaciones de HBC, que pueden presentarse en cualquier momento en cualquier individuo que padezca una infección crónica (en estas ocasiones puede haber una inversión de vuelta a IgM anti-HBc). La hepatitis aguda puede aparecer tras interrumpir el tratamiento inmunosupresor o por una sobreinfección en una persona portadora de una infección crónica de hepatitis B con hepatitis C y/o el virus de hepatitis D, o el virus de hepatitis A. La hepatitis aguda superpuesta debida a medicamentos y otras toxinas administradas a alguien que tenga una infección “silente” por HBC también puede presentarse como una hepatitis aguda. Algunas veces no se logra identificar ningún factor precipitante.
3.2 Infección por VHB resuelta
La infección pasada por VHB se caracteriza por la presencia de anti-HBs e IgG anti- HBC. Los anti-HBs algunas veces se tornan indetectables después de algunos años. (Los Anti-HBs suelen ser indetectables si la infección por VHB tuvo lugar durante la infancia, comose ve en el África subsahariana). Es de notar que si bien se dice que estos individuos tienen una infección por “VHB resuelta”, en sus hígados se mantienen durante años cantidades traza del ADN del VHB y es posible que incluso se mantengan durante toda la vida. El control inmunitario evita la expansión viral pero significa que con una inmunosupresión severa (por ejemplo, si hay coinfección avanzada con el virus de inmunodeficiencia humana (VIH), trasplante de médula ósea, tratamiento con rituximab, etc.), puede volver a aparecer el HBsAg (seroconversión inversa) o la repliación viral puede hacerse detectable en el hígado aún sin reaparición sérica del ADN del VHB. La inmunidad a la infección por VHB tras vacunación se caracteriza por la presencia de anti-HBs únicamente.
3.3 Infección crónica por VHB
El diagnóstico de infección crónica por VHB se define como la persistencia de HBsAg por más de 6 meses.
- En primer lugar se debe establecer si el individuo está en una fase positiva de HBeAg o en una fase de la infección HBeAg negativa (Tabla 4).
- Se deben realizar exámenes adicionales de marcadores de replicación del VHB—a saber, HBeAg y mediciones seriadas del ADN del VHB sérico, además de ALT.
- Esto en parte determinará si el paciente debe recibir tratamiento por VHB.
- Tanto en los pacientes HBeAg positivos como los HBeAg negativos, aún cuando tengan niveles séricos normales de ALT (mujeres < 20 UI/L y hombres < 30 UI/L) y/o ADN de HBV no detectable, necesitan control de por vida, ya que la condición puede cambiar con el tiempo, aún cuando se mantengan asintomáticos.
- Entre los individuos con persistencia crónica de HBsAg, aquellos que tengan concentraciones elevadas de ALT deben ser controlados de cerca, preferentemente con mediciones seriadas del ADN del VHB.
- Es importante conocer el límite inferior de detección del método utilizado para medir el ADN del VHB, ya que los valores que se mantienen persistentemente ≥ 2000 UI/ml deben llevar a considerar la terapia antiviral.
- La decisión de si iniciar el tratamiento o no depende de múltiples factores (es decir, no solamente del nivel del ADN del VHB y/o ALT). Cuando la enfermedad hepática parece ser progresiva (según se desprenda de la biopsia hepática y los marcadores no invasivos de inflamación y fibrosis, tales como la elastografía de transición), se debe considerar el tratamiento.
- Se deben realizar pruebas adicionales para hepatitis C y hepatitis D para descartar sobreinfección con uno o más virus más de hepatitis, particularmente en pacientes con ALT elevada pero con ADN del VHB bajo o no detectable.
- Otros aspectos a considerar incluyen la lesión hepática medicamentosa (debida a suplementos), esteatohepatitis no alcohólica (NASH), y sobrecarga de hierro.
Tabla 4 Diferenciación de las fases de la infección HBC
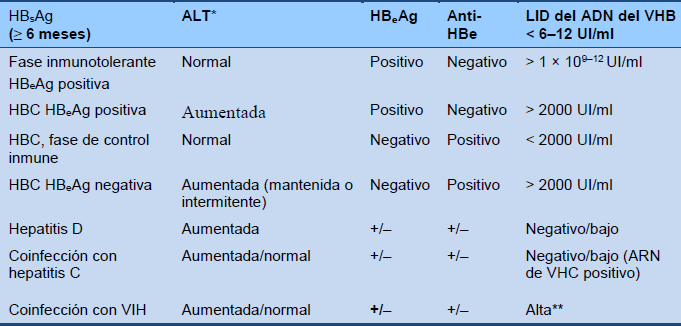
HBC, hepatitis B crónica; HBeAg,antígeno e de hepatitis B; HBsAg, antígeno de superficie de hepatitis B; VHB, virus de hepatitis B; VIH, virus de inmunodeficiencia humana; LID, límite inferior de detección.
*Rango normal < 20 UI/L en mujeres, < 30 UI/L en hombres.
** Puede ser variable, dependiendo del modo y la edad a la que se contrajo el VHB, coinfección VIH/VHB, y el recuento de CD4.
En el caso de enfermedad HBeAg positiva y HBeAg negativa se utilizan diferentes niveles del ADN del VHB para iniciar el tratamiento, dependiendo del genotipo prevalente en las diferentes regiones. Como regla general (y dado que no es factible realizar la genotipificación de todos los pacientes), se puede utilizar el nivel EASL para los pacientes caucásicos: 2 : 2 × 103 UI/ml ((y edad > 30 y); y el nivel APASL/AASLD se puede utilizar para los pacientes asiáticos: 2 × 104 UI/ml (y edad > 40 a).
3.4 Evaluación inicial de los pacientes con infección crónica por VHB
Los individuos con HBC recién detectada deben comprender que es preciso hacer un seguimiento prolongado para detectar la aparición de hepatitis crónica, cirrosis y CHC, que requiere una serie de exámenes clínicos y pruebas de laboratorio aún si el individuo se mantiene asintomático. Es importante verificar el estadío de HBC y decidir la frecuencia de exámenes de seguimiento necesarios.
- La infección crónica por VHB no necesariamente se acompaña de enfermedad hepática progresiva que requiera terapia antiviral.
- Se necesita una evaluación exacta de todos los portadores HBsAg positivos para identificar [33]:
- Fase de infección
- Grado de inflamación hepática
- Estadío de la fibrosis hepática
- Causas concomitantes de enfermedad hepática
- Necesidad de tratamiento
- La presencia de cofactores aumenta el riesgo de progresión a cirrosis o CHC: coinfecciones con virus de hepatitis D (VHD), virus de hepatitis C (VHC), y VIH; comorbilidades que incluyen alcoholismo, enfermedad autoinmune, o enfermedad hepática metabólica
El examen inicial debe incluir:
- Anamnesis y examen físico que incluya examen de piel y abdomen.
- Marcadores de infección por VHB, que incluyan: HBeAg/anti-HBe y ADN del VHB para clasificar la fase de la HBC, así comoel genotipo del VHP si se contempla terapia antiviral con interferón.
- Marcadores de otras infecciones virales, inclusive VHC y VHD, particularmente si la ALT está elevada pero el ADN del VHB se encuentra bajo o indetectable.
- Antes de introducir la terapia antiviral oral se debe hacer un tamizaje en todos los pacientes en búsqueda del virus de inmunodeficiencia humana (VIH).
- Estudio funcional hepático completo (ALT/AST para identificar inflamación activa, y bilirrubina, tiempo de protrombina, y albúmina para controlar la función de síntesis del hígado).
- Hemograma completo, particularmente plaquetas, que sirven como marcador sustituto de hipertensión portal.
- Ecografía abdominal para tamizaje basal de CHC – en las áreas con alta endemicidad de VHB y CHC pobremente diferenciado se puede utilizar la alfafetoproteína, al igual que en áreas sin fácil acceso a ecografía de alta calidad.
- Medición de la fibrosis hepática mediante pruebas serológicas, FibroScan (elastografía de transición), o biopsia hepática.
Tabla 5 Factores de riesgo vinculados al huésped y al virus asociados con progresión de hepatitis B crónica

ALT, alanino aminotransferasa; HBeAg, antígeno e anti hepatitis B; HBV, virus de hepatitis B; CHC, carcinoma hepatocelular; VHD, virus de hepatitis D; VIH, virus de inmunodeficiencia humana; NAFLD, enfermedad hepática grasa no alcohólica.
3.5 Infección oculta por el VHB
La infección oculta por el VHB consiste en la persistencia del ADN del VHB en el tejido hepático (y en algunos casos en plasma) en individuos en los que no se puede detectar el antígeno de superficie de hepatitis B (HBsAg) en sangre, habitualmente anti-HBc positivo.
La infección oculta por VHB es prevalente a nivel mundial, pero su frecuencia está vinculada con la prevalencia de la infección manifiesta por VHB en un área geográfica específica. La VHB oculta se transmite a través de transfusiones de sangre y trasplante de órganos.
- Es preciso hacer un cribado de los productos sanguíneos para detectar HBsAg, anti-HBc, e idealmente el ADN del VHB.
- Preferentemente se deben utilizar órganos de donantes con anti-HBc y/o anti-HBs solamente para receptores con pruebas positivas para anti-HBs o HBsAg.
Si bien no se conoce la verdadera pertinencia de la infección oculta por VHB, es posible que sea un factor de riesgo adicional para CHC en los pacientes anti-VHC positivos y en individuos infectados con VIH. También es posible que tienda a evolucionar hacia una hepatopatía crónica por otras causas que no sean VHB.
3.6 Reactivación del VHB
La replicación del VHB es controlada por el sistema inmunitario del huésped. La supresión inmunitaria de cualquier tipo puede llevar a una pérdida del control inmunitario y la ulterior reactivación del VHB, lo que puede derivar en una serie de consecuencias, desde un aumento subclínico del ADN del VHB hasta la ictericia, e inclusive la enfermedad hepática fulminante y/o fatal. La reactivación se da con mayor frecuencia con la quimioterapia oncológica, pero puede ocurrir con otras terapias inmunosupresoras o inmunomoduladoras (por ejemplo, inmunoterapia selectiva). El agregado de corticoides sistémicos (CS) a los corticoides inhalatorios aumenta el riesgo de reactivación del VHB, especialmente cuando los corticoides sistémicos se administran crónicamente o a dosis altas [35].
El tratamiento preventivo con análogos de nucleósido/nucleótido está recomendado en los pacientes HBsAg positivos que vayan a recibir medicación oncológica o inmunosupresora. El tratamiento debe continuar durante todo el curso de la inmunosupresión y hasta 6–12 meses después, haciendo controles de seguimiento para asegurarse que no aparezcan recaídas de la enfermedad al suspender la terapia antiviral.
También puede ocurrir reactivación en pacientes que sean HBsAg negativos pero anti-HBc-positivos (con o sin ADN del VHB oculto), pero se necesita una mayor inmunosupresión. Cuando reaparede el HBsAg se dice que hay una seroconversión inversa. El riesgo parece estar aumentado con rituximab u otras quimioterapias basadas en anti-CD20– probablemente debido a un agotamiento prolongado de las células B. El ADN del VHB puede aumentar incluso antes de que vuelva a aparecer el HBsAg en sangre. El tratamiento preventivo con un análogo de nucleósido/nucleótido reduce el riesgo de reactivación del VHB, pero tal vez no sea necesario en todos los pacientes [36]. Aquellos que no sean tratados preventivamente deben ser controlados con exámenes seriados de HBsAg, ALT, y posiblemente ADN del VHB, comenzando la terapia antiviral si vuelve a aparecer HBsAg o si aumenta el ADN del VHB.
En resumen:
- Es preciso realizar un tamizaje para HBsAg y anti-HBc antes de comenzar una quimioterapia o un tratamiento inmunosupresor/inmunomodulador.
- Los pacientes que sean HBsAg positivos deberían recibir tratamiento antiviral preventivo durante la quimioterapia y hasta 6-12 meses después.
- Hasta la fecha no quedan claros los beneficios para la reactivación de un VHB oculto.
- Para los pacientes con evidencia de infección previa por VHB, confirmada por su positividad anti-HBc, con o sin anti-HBs, se recomienda hacer monitoreos seriados de marcadores relacionados con VHB durante y después de la terapia inmunosupresora.
- Los pacientes que reciben quimioterapia o inmunosupresión deben seguir las guías de la Asociación Americana para el Estudio de Enfermedades Hepáticas (AASLD) y de la Asociación Asia-Pacífico para el Estudio del Hígado (APASL) (Fig. 5).
Fig. 5 Algoritmo de APASL para todos los candidatos a quimioterapia. NA, análogo nucleósido. Fuente: Asociación Asia–Pacífico para el Estudio del Hígado.
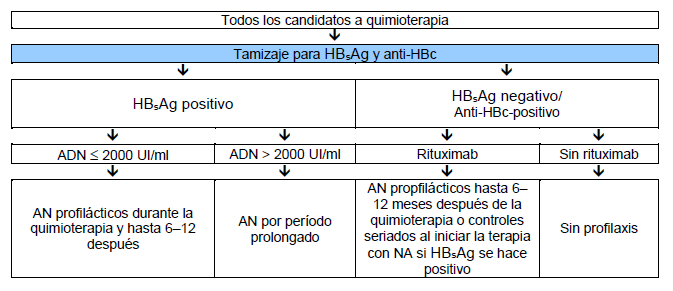
3.7 Tamizaje de CHC
La finalidad es detectar tumores menores de 3 cm de diámetro, y preferentemente menores de 2 cm, para ofrecer un tratamiento curativo. El tamizaje en busca de CHC se propone para todos los pacientes psicóticos porque tienen un mayor riesgo de presentar CHC. Sin embargo en África y el sudeste de Asia donde la infección por VHB se adquiere tempranamente en la vida, el CHC puede aparecer en un hígado no cirrótico.
La AASLD recomienda vigilancia para detección de CHC en los siguientes tipos de pacientes con HBC:
- Hombres asiáticos mayores de 40 y mujeres asiáticas mayores de 50 años
- Todos los pacientes que tengan cirrosis, independientemente de la edad
- Pacientes con antecedentes familiares de CHC; de cualquier edad
- Africanos mayores de 20
- Cualquier individuo con coinfección VHB/VIH
Singal y col. mostraron que en condiciones clínicas del “mundo real”, la estrategia más eficaz para la detección del CHC en cualquier etapa es una combinación de ultrasonido y alfa fetoproteína (AFP). La sensibilidad aumentó significativamente a
90%, con una pérdida mínima de especificidad (83%). La AFP sola puede ser mejor que la ecografía sola, ya que la confiabilidad de la ecografía depende mucho de la pericia y experiencia de quien la realiza [37].
Para los portadores de hepatitis B no incluidos en esta lista, el riesgo de CHC varía según la severidad de la enfermedad hepática de base y la actividad inflamatoria hepática actual o pasada. Los individuos que presenten concentraciones del ADN del VHB elevadas y que tengan actividad inflamatoria hepática en curso (manifestada por valores elevados de ALT) tienen un mayor riesgo de CHC, y se debe considerar su vigilancia. La infección por genotipo C y la presencia de BCP y mutaciones pre-S1 también se acompañan de un aumento del riesgo de CHC.
4. Tratamiento de la CHB
Antes de comenzar con cualquier tipo de tratamiento para el VHB y óptimamente en el momento de la primera presentación, el paciente tiene que recibir información sobre la HBC y su tratamiento. La información importante incluye:
- La evolución clínica dinámica de la HBC.
- La mayoría de las infecciones se mantienen inicialmente totalmente asintomáticas aún en el caso de enfermedad severa.
- La necesidad de un control regular de por vida
- Posible transmisión a contactos— la familia y los contactos deben hacerse estudios de VHB y se debe vacunar a aquellos sin inmunidad contra el VHB, y derivar a aquellos que sean HBsAg positivos para su evaluación clínica.
- Mejor momento para iniciar el tratamiento.
- La necesidad de un absoluto cumplimiento con el tratamiento, posiblemente de por vida.
- La necesidad de un cumplimiento absoluto con los exámenes de control, tanto cuando el paciente está en tratamiento como en los períodos de descanso.
- Se debe enfatizar la importancia de no beber alcohol y de tener cautela con el uso de la medicación que pueda ser hepatotóxica o peligrosa en pacientes con enfermedad hepática avanzada (por ejemplo, AINEs).
- Aquellos que no sean inmunes a la hepatitis A deben recibir dos dosis de vacuna contra hepatitis A con 6–18 meses de separación.
Esta información se le debe explicar el paciente y se debe conversar al respecto. Para las mujeres en edad de procrear se prefieren los medicamentos considerados como seguros en el embarazo, dado que una vez que se recete un nucleósido o nucleótido ya no se puede interrumpir en quienes se mantengan HBeAg positivos. El paciente debe comprender que la interrupción del tratamiento puede precipitar una hepatitis severa, lo que en algunas raras ocasiones puede llevar a una insuficiencia hepatocítica fulminante, aún en ausencia de cirrosis.
La fase de la HBC se puede determinar sobre la base del perfil serológico y virológico – cada tipo se caracteriza por una evolución natural diferente, con diferente pronóstico y distintas indicaciones de tratamiento [1,2,38]
- Portador inmunotolerante:
- No está indicado el tratamiento.
- Es crucial hacer un seguimiento longitudinal apropiado.
- Medir ALT cada 3-6 meses
- Portador inactivo:
- No está indicado el tratamiento.
- Es crucial hacer un seguimiento longitudinal apropiado.
- Valorar los niveles de ALT y ADN del VHB cada 3 meses durante el primer año, y luego cada 6 meses.
- Si el ADN del VHB sérico es < 2000 UI/ml y el nivel de HBsAg es < 1000 UI/ml, la probabilidad de reactivación de la enfermedad es baja y los pacientes puedan requerir un seguimiento menos frecuente.
- HBC activa:
- HBC HBeAg positiva.
- HBC HBeAg negativa.
El pronóstico y el tratamiento de la HBC depende en gran medida de la fase de la enfermedad y del estadío de la fibrosis hepática, y por ende del riesgo de presentar cirrosis. El seguimiento de los portadores de HBsAg con HBC incluye:
- Continuación de los estudios diagnósticos.
- Valoración de la gravedad de la enfermedad hepática.
- Exámenes de laboratorio buscando inflamación (ALT), función hepática (bilirrubina, albúmina, factores de la coagulación) y carga viral (ADN del VHB), si se cuenta con ellos.
- Ecografía de hígado.
- Medidas no invasivas para valorar la fibrosis (paneles séricos, elastografía de transición).
- Biopsia hepática, que sirve para determinar el grado de necrosis inflamatoria y la etapa de la fibrosis.
- Biopsia hepática. Puede ayudar a descartar otras causas coexistentes de enfermedad hepática y aclarar el diagnóstico cuando hay discordancia entre los niveles de ALT y el ADN del VHB.
Las normas actuales para decidir el tratamiento de HBC se muestran en las Figuras 6 y 7. Se incluyen cascadas para reflejar las distintas opciones según los recursos disponibles.
Fig. 6 Tratamiento de la infección crónica HBeAg positiva. La vigilancia para detección del carcinoma hepatocelular debe realizarse si está indicada (dependiendo de edad, sexo, gravedad de la enfermedad hepática y antecedentes familiares). Adaptado de Lok y McMahon 2007 [39].
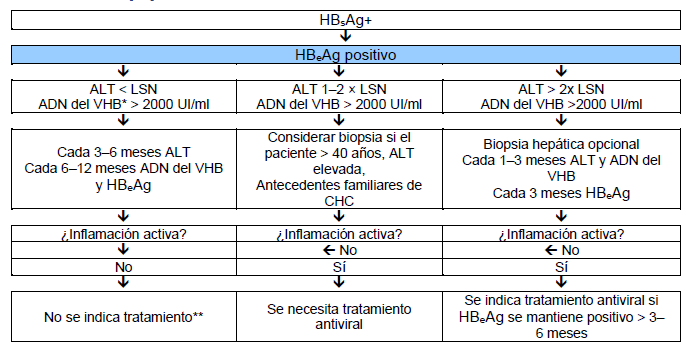
* En pacientes de origen asiático es frecuente observar niveles muy elevados del ADN del VHB – fundamentalmente en pacientes con trasmisión perinatal. No queda claro si deben recibir tratamiento antiviral con AN. El nivel del ADN del VHB se correlaciona con el riesgo de CHC durante el seguimiento pero no queda claro si la supresión del virus reduce el riesgo.
** Los pacientes con cirrosis y ADN del VHB detectable deben recibir tratamiento independientemente del valor de ALT y del nivel del ADN del VHB.
Fig. 7 Tratamiento de la infección crónica HBeAg negativa.
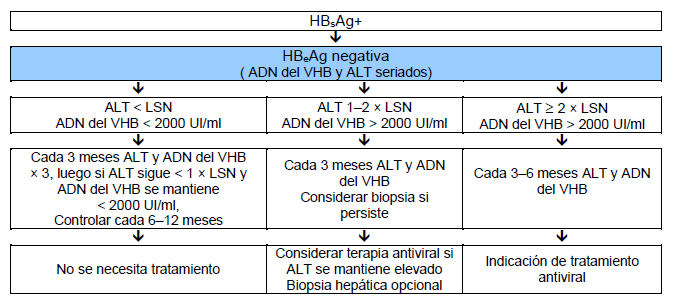
NB: Se debe realizar vigilancia del CHC si está indicado (dependiendo de edad, sexo, gravedad de la enfermedad hepática y antecedentes familiares).
El límite superior normal para ALT es 20 UI/L en mujeres y 30 UI/L en hombres.
El control del ADN del VHB cada 3 meses en los pacientes con ALT una o dos veces por encima del límite superior del normal es caro y tal vez no sea práctico cuando se cuenta con recursos económicos limitados —ver enfoques alternativos en las cascadas a continuación.
4.1 Cascadas para el tratamiento de HBC – enfoque sensible a los recursos
Un enfoque estándar sólo es factible si se dispone de la escala completa de exámenes diagnósticos y opciones de tratamiento médico. Dichos recursos tal vez no estén disponibles en su totalidad en todo el mundo. Con sus cascadas diagnósticas y terapéuticas, las pautas de la Organización Mundial de Gastroenterología brindan un enfoque sensible a los recursos.
- Se recomienda hacer una valoración del nivel basal del ADN del VHB, VHD y VIH en todos los niveles de recursos antes de iniciar cualquier tratamiento.
- La valoración inicial de CHC mediante ecografía se debe realizar en todos los casos, de ser posible. La alfa fetoproteína sigue teniendo su papel en el seguimiento en áreas con pocos recursos y con alta endemicidad de VHB, CHC pobremente diferenciado y accesos limitados a ecografía de alta calidad.
Cascada 2 Monitoreo de la fase inmuno tolerante (sin tratamiento)

Cascada 3 Monitoreo de la fase inmunoactiva (sin tratamiento)
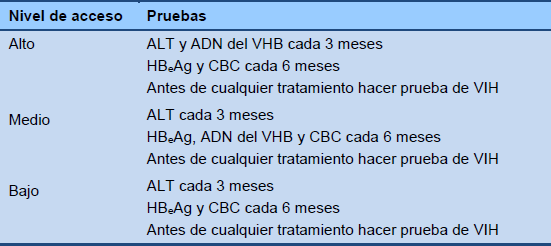
Cascada 4 Monitoreo de la fase de control inmunitario, HBeAg-negativo (descanso de tratamiento)

Cascada 5 Monitoreo de la fase reactivación, HBeAg negativa (descanso de tratamiento)
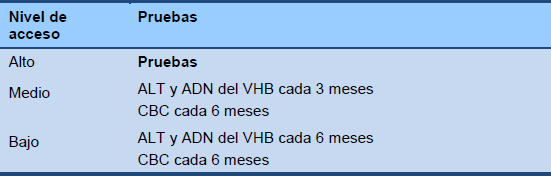
Cascada 6 Monitoreo de la fase inmunoactiva HBeAg positiva (terapia basada en interferón)
* Título de HBsAg en la semana 12—“regla de interrupción del interferón a las 12 semanas.”
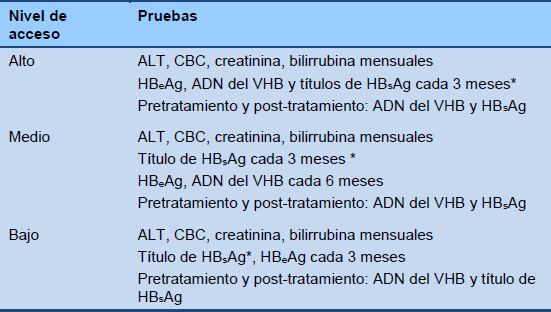
Cascada 7 Monitoreo de la fase inmunoactiva, HBeAg positiva (en tratamiento con NA)

* En todos los niveles: si el paciente está recibiendo tenofovir, la frecuencia de los estudios de creatinina estará determinada por la funcionalidad renal.
** Las pruebas de fosfato son necesarias sólo para los pacientes que reciben tenofovir.
Cascada 8 Monitoreo de la fase de reactivación, HBeAg negativo (en tratamiento con AN)

* Si el paciente está recibiendo tenofovir, la frecuencia de los estudios de creatinina estará determinada por la funcionalidad renal.
** Las pruebas de fosfato son necesarias sólo para los pacientes que reciben tenofovir.
4.2 Tratamiento de la HBC
Medicación aprobada
Tabla 6 Medicación aprobada para la hepatitis B crónica
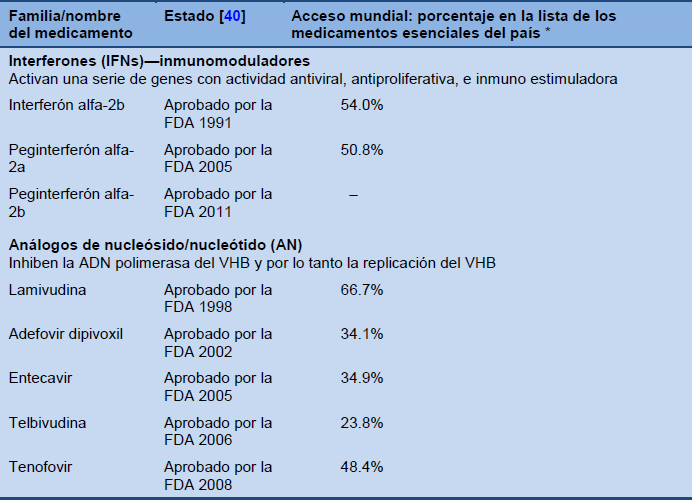
* Los porcentajes comunicados por los estados miembros de la OMS sobre los medicamentos para hepatitis B en sus vademécums nacionales esenciales o subsidiados por sus gobiernos [41].
La Tabla 7 muestras los resultados de los principales estudios sobre el tratamiento de la hepatitis B crónica, HBeAg negativa y HBeAg positiva 6 meses después de haber completado 12 meses (48 semanas) de interferón alfa pegilado (PEG-IFN) y después de 12 meses (48 o 52 semanas) de terapia con análogo de nucleósido/nucleótido.
Tabla 7 Resultados de la investigación sobre el tratamiento de hepatitis crónica HBeAg negativa y HBeAg positiva
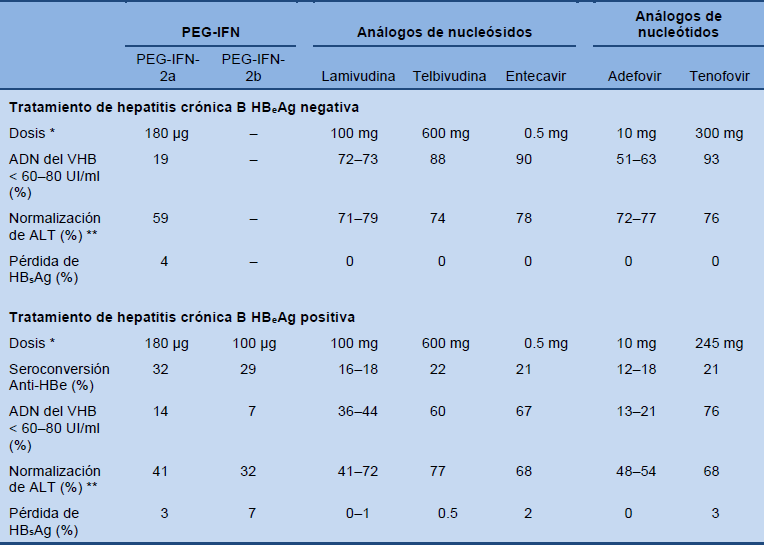
ALT, alanino aminotransferasa; VHB, virus de hepatitis B; HBsAg, antígeno de superficie de hepatitis B; PEG-IFN, peginterferón. Adaptado de las Guías de EASL 2012 [2]; por más referencias, se debe consultar la fuente.
* Administración de PEG-IFN: inyecciones percutáneas una vez por semana; análogos de nucleósido/nucleótido: comprimidos por vía oral una vez al día.
** La definición de normalización de ALT varió entre los diferentes estudios (por ejemplo, utilizando una disminución de ALT de hasta 1.25 veces el límite superior normal (LSN) en el ensayo con entecavir, o hasta 1.3 veces el LSN en el ensayo con telbivudina).
Por una discusión detallada del tratamiento “patrón oro” para HBC, por favir, consultar las guías más recientes de EASL 2012 [2] (www.easl.eu).
Resistencia a los medicamentos
Si no hay respuesta o si hay un nueva irrupción virológica definida por un aumento del nivel del ADN del VHB de más de 1 log 10 UI/ml en comparación con el nadir (valor más bajo) del nivel del ADN del VHB durante el tratamiento con cumplimiento confirmado, entonces se debe sustituir el agente o agregar otro agente con perfil de resistencia óptimo—a saber, tenofovir o entecavir.
Para evitar la resistencia se pueden usar las siguientes estrategias:
- Para el tratamiento de primera línea elegir un medicamento antiviral potente y/o uno que tenga una baja incidencia de resistencia (alta barrera genética) con el paso del tiempo (entecavir/tenofovir).
- Enfatizarle al paciente nuevamente la importancia de cumplir estrictamente con el tratamiento.
- Durante el tratamiento, es preciso monitorear el nivel del ADN del VHB frecuentemente cuando se están utilizando medicamentos con baja barrera a la resistencia (cada 3–6 meses), y las pruebas de resistencia (genotipos) deben realizarse en caso de reaparición viral o supresión viral subóptima, para posibilitar la detección de la resistencia genotípica antes de que aparezcan consecuencias clínicas.
- No se ha descrito ninguna resistencia medicamentosa al interferón, si bien algunos individuos no responden al tratamiento, en cuyo caso de lo debe interrumpir. En caso de estar disponible, el título de HBsAg se puede utilizar para guiar la terapia con interferón (ver a continuación).
Hepatitis HBeAg positiva
Recomendaciones. Los pacientes HBeAg positivos con niveles persistentes de ALT ≥ 2 × límite superior del normal y con ADN del VHB ≥ 2000 UI/ml, deben considerarse para tratamiento.
- Es imprescindible verificar la coinfección con VIH antes del tratamiento porque todos los análogos de nucleósido/nucleótido aprobados tienen actividad anti VIH y rápidamente llevarían a una resistencia medicamentosa del VIH si se los utiliza como monoterapia.
- Las pruebas para VHD deberían ser obligatorias en los países con alta prevalencia de infección por hepatitis D (Rumania, Moldavia, las antiguas Repúblicas Soviéticas de Asia Central, Rusia).
- En el caso de los pacientes que han sido sometidos a biopsia hepática, se debe comenzar con el tratamiento en aquellos que presenten inflamación moderada a severa o fibrosis importante (≥ F2).
- Se debe empezar el tratamiento en aquellos que tienen cirrosis con ADN del VHB detectable, aún en los que tienen nivel del ADN del VHB bajo, independientemente del nivel de ALT.
- Se puede elegir cualquiera de los tratamientos aprobados y la decisión en cuanto a la selección del tratamiento debe constar de una valoración de la eficacia, la seguridad, y barreras genéticas en la resistencia. Para evitar la resistencia, las elecciones preferidas para terapia NA son entecavir y tenofovir. Antes de comenzar con el tratamiento es importante garantizar que los pacientes tengan una fuente segura de respaldo para pagar los medicamentos en el largo plazo para evitar una interrupción abrupta del tratamiento que puede ser peligrosa.
- Los pacientes deben ser controlados regularmente durante el tratamiento a intervalos de 3-6 meses, o más frecuentemente si están recibiendo terapia basada en interferón, para monitorear la eficacia, la seguridad y evidencias tempranas de resistencia (para los análogos de nucleósido/nucleótido).
- Idealmente, a los pacientes se los debe controlar con ALT, HBeAg, anti-HBe, y ADN del VHB, pero esto tal vez no sea posible en países que no disponen de estos estudios o donde su precio es prohibitivo, en cuyo caso habrá que contentarse tan sólo con ALT.
- Avance virológico: aumento de > 1 logaritmo del ADN del VHB por encima del nadir después de haber logrado la respuesta virológica durante el tratamiento continuado (para análogos de nucleósido/nucleótido). Antes de concluir que esto sea una resistencia, se debe analizar con el paciente si realmente cumplió con el tratamiento. En un paciente que está cumpliendo con el tratamiento, un aumento continuo de los títulos del ADN del VHB con el tiempo sugiere resistencia.
- En los pacientes con resistencia se debe considerar la terapia de rescate con nucleósidos/nucleótidos que no tengan un perfil de resistencia cruzada (lamivudina, telbivudina, y entecavir tienen perfiles de resistencia superpuestos, de modo que sería preferible sustituir con tenofovir -o si no está disponible agregarle adefovir a la terapia).
- Se debe continuar con los agentes por vía oral hasta por lo menos 12 meses después de la variable evaluable de la seroconversión de HBeAg en hepatitis HBeAg positiva, y puede ser preferible continuar hasta que ocurra una pérdida de HBsAg, dado el alto riesgo de reactivación en caso de interrumpirse el tratamiento. Se recomienda hacer un monitoreo cercano después de haber interrumpido o retirado la terapia por vía oral, debido al riesgo de recidiva por suspensión del tratamiento.
- Las terapias basadas en peginterferón tienen la ventaja de tener una duración fija. La seroconversión de HBeAg puede tener lugar hasta 6 meses después de haber interrumpido el interferón. La pérdida de HBeAg y la seroconversión parecen ser mucho más duraderas cuando son inducidas con interferón, comparado con un análogo nucleósido/nucleótido. El interferón es más eficaz en los pacientes con infección por el genotipo A y menos eficaz en los que presentan genotipos D y C.
- Si se cuenta con los títulos de HBsAg, se los puede utilizar para guiar la terapia basada en interferón. La interrupción de la terapia de interferón está indicada en todos los pacientes con HBsAg > 20.000 UI/ml en la semana 24, independientemente del genotipo de VHB [42]. Otra posibilidad es que quienes no tengan disminución de los títulos de HBsAg a las 12 semanas también interrumpan el tratamiento. Las reglas de interrupción mejoran la relación costo- eficacia de la terapia con peginterferón [43].
Hepatitis HBeAg negativa
La HBC HBeAg negativa representa una fase tardía en el curso de la infección crónica por VHB.
- El paciente se debe considerar para tratamiento si:
- el ADN del VHB ≥ 20.000 UI/ml y la ALT sérica > 2 × LSN
- La biopsia hepática u otras formas de valoración de la fibrosis deben considerarse en pacientes con:
- ADN del VHB ≥ 20.000 UI/ml y ALT sérica < 2 × LSN
- ADN del VHB ≥ 2000 UI/ml y/o ALT sérica > LSN
- Se debe administrar tratamiento si la biopsia hepática muestra necrosis inflamatoria moderada/severa o fibrosis significativa (≥ F2)
- Tratar cualquier paciente con cirrosis que tenga ADN del VHB detectable.
Recomendaciones para el tratamiento:
- Es imprescindible verificar la coinfección por VIH antes del tratamiento, dado que todos los análogos de nucleósido/nucleótido tienen actividad contra VIH y rápidamente llevarán a VIH resistente a los medicamentos si se los utiliza como monoterapia.
- El régimen de tratamiento puede ser interferón convencional, alfa peginterferón, o análogos de nucleósido/nucleótido. No se debe utilizar terapia basada en interferón en presencia de insuficiencia hepatocítica.
- En los pacientes con contraindicaciones para el uso de interferón, tales como la cirrosis decompensada o enfermedad autoinmune, se recomienda utilizar análogos de nucleósido/nucleótido orales.
- La duración de la terapia con interferón o peginterferón es de 1 año. Si para la semana 12 no ha habido una caída de HBsAg, junto con una declinación menor de 2 logaritmos del ADN del VHB, se debe interrumpir la terapia con interferón, ya que es improbable que el paciente responda [42,44].
- Para la terapia antiviral oral, es preferible utilizar agentes con una baja tasa de resistencia - como entecavir o tenofovir - particularmente en pacientes con cirrosis. Sin embargo, cuando existan limitantes económicas, se puede comenzar el tratamiento con lamivudina (o telbivudina), agregando precozmente adefovir o pasando a tenofovir cuando se detecte resistencia medicamentosa o cuando el ADN del VHB se mantenga a ≥ 2000 UI/ml en la semana 24 del tratamiento.
- No se sabe cuál es la duración óptima de la terapia antiviral para la HBC HBeAg negativa pero se necesita tratamiento prolongado—posiblemente toda la vida, o hasta pérdida de HBsAg.
- Se recomienda hacer un seguimiento de control tanto bioquímico como del ADN del VHB cada 3-6 meses para valorar la respuesta al tratamiento y para poder detectar rápido la aparición de resistencia medicamentosa.
- Cuando se detecte resistencia al medicamento se debe agregar un fármaco con perfil de resistencia que no se superponga (adefovir para resistencia a lamivudina).
- Si ALT está elevada y los niveles del ADN del VHB son bajos (< 2000 UI/ml), se debe descartar otras causas de inflamación (hígado graso, medicación, coinfección con VHD y VHC). VHD inhibe la replicación del VHB, y por lo tanto los pacientes coinfectados con VHD habitualmente son HBeAg negativos, con niveles bajos o incluso no detectables del ADN del VHB, pero niveles persistentemente altos de ALT, a menudo con evidencia de fibrosis/cirrosis avanzada.
4.3 Coinfección
VHB–VHD
El virus de hepatitis D (VHD) es un virus defectuoso con un genoma de ARN circular y una única proteína estructurada, el antígeno de hepatitis delta. El virus requiere antígeno de superficie VHB que actúe como envoltura para su antígeno delta. Esta función de ayuda de VHB resulta necesaria para el ensamblaje y la propagación del VHD.
- Hasta 5% de la población mundial está infectada con VHB, y probablemente 5% de quienes están infectados crónicamente con VHB tengan infección por VHD.
- Sin embargo, algunas áreas endémicas en el mundo en desarrollo pueden tener tasas mucho más altas (Cuerno de África, Europa Oriental, Cuenca del Amazonas). El virus coinfecta simultáneamente con VHB, o se sobreinfecta en algunos pacientes con infección crónica con VHB.
- La coinfección evoluciona a la cronicidad en sólo 2% de los casos, pero entraña una mayor propensión a la infección aguda fulminante, mientras que la sobreinfección evoluciona a enfermedad progresiva y cirrosis en más de 80% de los casos.
- La cirrosis aparece a una edad más temprana que en pacientes con monoinfección con VHB crónica.
Recomendaciones:
- Debería implementarse la vacunación universal contra VHB para evitar la infección por VHD en la comunidad y por lo tanto disminuir su prevalencia.
- Se debe evaluar a los pacientes HBsAg positivos para descartar la infección por VHD, particularmente si la hepatitis se presenta ante poca o ninguna replicación viral de VHB (es decir, ADN del VHB bajo) o si los pacientes vienen de una región en que el VHD es endémico, o han adquirido VHB por el uso de drogas inyectables.
- La infección por VHD se puede diagnosticar mediante la detección del ARN del VHD en suero por la reacción de cadena de polimerasas o indirectamente por detección de anticuerpos contra el antígeno de hepatitis D (anti-VHD) o las clases de IgG e IgM.
- La hepatitis D crónica debe tratarse con interferón (preferentemente interferón pegilado) durante por lo menos 12 meses, pero los resultados del tratamiento son subóptimos. Los pacientes con replicación activa de VHB pese a la coinfección con VHD pueden mejorar con un tratamiento con análogo de nucleósido/nucleótido (AN) en combinación con peginterferón.
VHB–VHC
Puede darse infección con VHB y virus de hepatitis C (VHC), ya que ambos comparten factores de riesgo similares y algunos modos de trasmisión en común. La coinfección es más frecuente en las regiones con alta endemicidad para ambos virus y en individuos que hayan contraído la infección a través del uso de drogas inyectables—dado que a diferencia del VHB, VHC se trasmite mal por vía sexual o por vía vertical. Por las mismas razones, la coinfección de VHB y VHC—e inclusive la triple infección con VHB, VHC y VIH y potencialmente la infección cuádruple (agregando VHD)—puede observarse en poblaciones de alto riesgo.
- Los interferones (y los interferones pegilados) son agentes terapéuticos bien estabecidos tanto para VHB como VHC y representan el tratamiento de elección para los pacientes coinfectados (en ausencia de VIH).
- Cuando predomina VHC (con ARN de VHC detectable y ADN del VHB bajo o no detectable), la terapia del VHC debería ser priorizada, ya que evoluciona rápidamente. Tal vez sea preferible utilizar terapia para VHC basada en IFN para controlar también el VHB, pero no hay información robusta sobre este enfoque a la fecha. Las nuevas terapias sin interferón para VHC son altamente eficaces y deberían considerarse en los pacientes coinfectados con VHB/VHC. Se están evaluando los abordajes óptimos para estos pacientes.
- Cuando predomina VHB (con altos niveles del ADN del VHB), a menudo se ha resuelto la hepatitis C (es decir, el ARN de VHC se vuelve indetectable). En dichos casos se deben tomar decisiones de tratamiento en cuanto a VHB independientemente del antecedente de infección con VHC.
- Es necesario hacer un monitoreo regular de ALT y del ARN del VHC y el ADN del VHB durante y después del tratamiento, ya que la supresión del virus dominante mediante terapia antiviral puede dar lugar a una reactivación de virus que estaban hasta el momento suprimidos.
VHB–VIH
Se estima que a nivel mundial hay 36 millones de personas infectadas con VIH. Puede haber coinfección crónica con VHB debido a que comparten los modos de trasmisión de los virus —parenteral, vertical, y sexual.
- La prevalencia de HBC entre las personas infectadas con VIH puede ser 10 veces o más veces superior que en la población general.
- La infección crónica por VHB tiene lugar en 5–10% de las personas infectadas con VIH en Europa Occidental y en Estados Unidos [45]
- La progresión de HBC a cirrosis, enfermedad hepática terminal, y/o CHC es más rápida en las personas infectadas con VIH que en las personas que sólo tienen CHV [46].
La ausencia de ensayos controlados y la actividad doble de algunos agentes complica el tratamiento de la infección por CHV en pacientes con coinfección con VIH. Los regímenes de tratamiento dependen del estado clínico tanto en cuanto a su VIH como su VHB.
- Muchos análogos nucleósidos/nucleótidos aprobados con actividad contra el VHB también suprimen el VIH, y por lo tanto es fundamental evitar la monoterapia con cualquiera de los agentes orales aprobados contra VHB, ya que la resistencia a VIH y posiblemente a VHB se va a dar rápidamente. Cuando está indicado el tratamiento se prefiere un esquema basado en tenofovir en combinación con otros agentes altamente activos para VIH.
- Por lo tanto, antes de iniciar un tratamiento antiviral siempre habría que controlar a todos los pacientes con HBC, para descartar coinfección con VIH.
Los principales objetivos del tratamiento anti-VHB son detener o disminuir la progresión de la enfermedad hepática y evitar la cirrosis y el CHC.
- La supresión prolongada de la replicación del VHB lleva a una mejora histológica, una disminución importante de las aminotransferasas o su normalización, y prevención del avance hacia la cirrosis y enfermedad hepática terminal.
- El control viral sostenido exige terapia de mantenimiento a largo plazo.
- La interrupción del tratamiento en particular se puede asociar con reactivación de VHB y aumentos de ALT.
- La desventaja de la terapia prolongada es el riesgo de que aparezca resistencia del VHB. Para reducir la resistencia a los medicamentos, la mayoría de los pacientes coinfectados requieren terapia de combinación contra VHB.
4.4 Embarazo
Las siguientes recomendaciones también se basan en las guías de EASL 2012 [2]:
- En todas las mujeres embarazadas se debe descartar la presencia de HBsAg.
- Antes de comenzar el tratamiento contra VHB, se debe conversar con la paciente el riesgo que representa el tratamiento para el feto en caso de embarazo y se debe encarar la planificación familiar de la paciente.
- El (PEG-)IFN está contraindicado durante el embarazo.
- Tenofovir tiene un mejor perfil de resistencia y datos de seguridad más amplios en mujeres embarazadas VHB-positivas que telbivudina (ambos son medicamentos de embarazo categoría B: sin riesgo en estudios en animales pero desconocido en humanos) [47]. Los datos en las mujeres embarazadas VIH positivas sugieren que el uso de lamivudina, emtricitabina, y tenofovir es seguro [48,49].
- La trasmisión perinatal del VHB ocurre fundamentalmente en el momento del parto, y la prevención se enfoca en la inmunización pasiva y activa con inmunoglobulina contra hepatitis B (IgHB) y vacunación contra VHB; ambos deben administrarse dentro de las 12 horas del nacimiento.
- En un metaanálisis sobre la utilidad de IgHB administrada a recién nacidos para evitar la trasmisión madre a hijo (TMH) de VHB, la IgHB y la vacuna de origen plasmático contra VHB redujeron la trasmisión de 20% a 10% comparado con la vacuna plasmática sola (RR 0.49; IC 95%, 0.32 a 0.74); con la IgHB y la vacuna recombinante contra VHB, la trasmisión se redujo de 30.8% a 18.9% (RR 0.61; IC 95%, 0.41 a 0.92) [50].
- Las mujeres con concentraciones elevadas del ADN del VHB (ADN de VHB sérico> 106–7 UI/ml, y fundamentalmente HBeAg positivas) pueden todavía tener un alto riesgo de TMH a pesar de una vacunación apropiada y se les debe considerar para tratamiento con lamivudina, telbivudina, o tenofovir durante el último trimestre de embarazo, además de vacunación pasiva y activa con IgHB y vacunación contra VHB.
- En un meta análisis de ECA, la lamivudina redujo la trasmisión del VHB de 25.4% a 12% en comparación con placebo cuando se la administró a fines del embarazo. En comparación con pacientes que recibieron IgHB, la lamivudina redujo la trasmisión de 20.4% a 6.3% [51]. En un metaanálisis sobre el tratamiento con telbivudina en el embarazo, los resultados acumulados fueron similares a los de lamivudina, pero el análisis sólo incluyó dos ECA y tres ensayos clínicos no aleatorizados (no ECA) [52].
- La terapia con NA administrada sólo para la prevención de la trasmisión perinatal puede ser interrumpida en los primeros 3 meses después del parto.
- Las mujeres infectadas con VHB deben ser controladas de cerca después del parto ya que pueden presentar exacerbaciones [53].
5. Vacunación contra hepatitis B
La implementación de un programa de vacunación universal de todos los recién nacidos constituye un paso clave hacia un control efectivo de la infección por VHB a nivel mundial. La vacunación contra VHB ha demostrado ser altamente costo- efectiva. La vacunación evita la infección con VHB y por lo tanto reduce la incidencia de hepatitis crónica, cirrosis, y CHC en la población vacunada, además de reducir la transmisión, al limitar el número de individuos susceptibles.
5.1 Vacunación activa con vacuna contra hepatitis B
En la formulación de la vacuna de hepatitis B se utiliza el antígeno HBsAg. Se los produce mediante tecnología ADN recombinante a partir de levaduras. Se encuentra disponible de manera aislada como agente único o en combinación fija con otras vacunas.
5.2 Vacunación pasiva con inmunoglobulina contra hepatitis B
La inmunoglobulina contra hepatitis B (IgHB) se prepara a partir de plasma de individuos que tengan concentraciones elevadas de anti-HBs. La dosis estándar de IgHB es 0.06 ml/kg para todas las aplicaciones en adultos o 200 UI en lactantes. En dosis estándar brinda una protección temporaria (es decir, durante aproximadamente 3-6 meses) contra la infección por VHB. La IgHB se administra por inyección intramuscular preferentemente en los músculos deltoides o glúteos. Si se administra con la vacuna contra la hepatitis B, la vacuna IgHB debe administrarse en un sitio de inyección diferente.
5.3 Profilaxis previa a la exposición
Una estrategia integral para eliminar la trasmisión del VHB debe comenzar con un programa de vacunación previo a la exposición. Esto debería incluir:
- Vacunación universal de todos los lactantes al nacimiento; obligatorio para los niños que nazcan de mujeres embarazadas que al ser estudiadas en búsqueda de antígeno de superficie de hepatitis B arrojan resultados positivos.
- Inmunoprofilaxis post exposición para los niños nacidos de madres con estado HBsAg desconocido.
- Puesta al día de la vacunación de todos los niños y adolescentes que no hayan sido vacunados previamente.
- Vacunación de adultos no vacunados expuestos a riesgos de infección VHB (sin embargo, los individuos de “alto riesgo” frecuentemente no tienen acceso a atención médica o a dependencias sanitarias que brinden información; de ahí la necesidad de vacunación universal de los lactantes).
- Vacunación de quienes estén en riesgo de infección más severa—es decir, pacientes con enfermedad hepática crónica.
5.4 Cronogramas de vacunación
La combinación de la prevalencia, la vía de trasmisión y los factores virales tiene implicancias para la estrategia de vacunación—vacunación de grupos de riesgo, vacunación de los lactantes, o vacunación de adolescentes.
La vacuna se administra por inyección intramuscular en el músculo deltoides (no en el glúteo) en adultos, o en la cara anterolateral del muslo en los recién nacidos.
- Los estudios sugieren que la vacunación universal al nacimiento tiene buena relación costo-beneficios en los países con prevalencia de elevada a moderada.
- Europa y América del Norte tienen tasas muy bajas de incidencia y han implementado, ya sea la vacunación de rutina de los lactantes, o la vacunación de los recién nacidos cuyas madres tengan pruebas positivas para el antígeno de superficie de hepatitis B (HBsAg).
- En algunos países se recomienda la vacunación de rutina de adolescentes a los 10 años de edad y la puesta al día de la vacunación de los adultos de riesgo (es difícil identificar y/o acceder a los individuos “de riesgo”), pero esto tiene poco efecto sobre la tasa de infección crónica.
Recomendaciones de vacunación:
- La vacunación primaria, que consiste en tres o más dosis intramusculares de la vacuna contra hepatitis B administradas en los meses 0, 1, y 6, da lugar a una respuesta de anticuerpos positiva en 30–55% de los adultos ≤ 40 años después de la primera dosis, 75% después de segunda dosis, y > 90% después de la tercera dosis. Estas tasas de respuesta disminuyen cuando la vacuna se administra a individuos de mayor edad (por ejemplo, < 90% en personas > 40 años de edad, 75% en quienes tienen 60 años o más).
- Otros cronogramas de vacunación innovadores (por ejemplo, a los 0, 1, y 4 meses o 0, 2, y 4 meses o 0, 1, y 2 meses) alcanzan tasas específicas para la dosis y tasas finales de protección similares a las obtenidas con el esquema de 0, 1 y 6 meses, y tal vez sea más práctico para recién nacidos.
- Los esquemas acelerados de vacunación para la profilaxis posterior a la exposición en adultos a menudo garantizan el cumplimiento con la administración de todas las dosis de vacunas.
- Los bebés nacidos de madres HBsAg positivas deberían recibir la primera dosis de la vacuna dentro de las primeras 12 horas de vida.
- Se sabe que hay factores del huésped (por ejemplo, tabaquismo, obesidad, cirrosis, factores genéticos, inmunosupresión, insuficiencia renal, etc.) que provocan una disminución de la respuesta a la vacuna.
- Los individuos que no presentan una respuesta anti-HBs (≥ 10 mUI/ml) ante el esquema de vacunación primario deberían recibir una vacunación repetida de tres dosis (en los meses 0, 1 y 2). Esto da lugar a niveles de anticuerpos protectores en 44–100% de los individuos. En los individuos que no desarrollan niveles protectores de anti-HBs después de la revacunación se puede considerar la repetición de la vacunación (a los meses 0, 1, y 2, con un refuerzo a los 6 meses) con el doble de la posología estándar de la vacuna.
- Para las personas ≥ 18 años de edad que no viven en un área donde la hepatitis A sea endémica, se cuenta con una vacuna combinada contra hepatitis A y hepatitis B (Twinrix).
5.5 Profilaxis después de la exposición
Si se puede realizar de manera oportuna, se debe considerar la profilaxis después de la exposición para los individuos que hayan tenido una exposición reciente (ya sea parenteral o sexual) a sangre u otros líquidos corporales.
- Antes de administrar la vacuna se debe evaluar el estado HBsAg de la fuente de infección y el estado anti-HBs de la persona expuesta.
- En los países con alto nivel de endemicidad de VHB, también se debe verificar el HBsAg en los individuos expuestos.
- Los individuos sin vacunación previa también deberían recibir tanto la IgHB como la vacuna contra hepatitis B en cuanto ocurra la exposición (preferentemente dentro de las 24 h). La vacuna contra hepatitis B administrada simultáneamente con IgHB debe inyectarse en un lugar diferente.
- La administración completa de la serie de la vacuna contra hepatitis B es también a los 0, 1, y 6 meses o 0, 1, y 2 meses.
Los individuos expuestos que estén en proceso de vacunación (pero que no hayan completado toda la serie) deberían recibir la dosis apropiada de IgHB y se les debe aconsejar que completen la serie de vacunación contra hepatitis B.
Quienes respondan a la vacuna pueden mantener niveles anti-HBs protectores durante períodos de tiempo de duración variable. Los individuos que responden a la vacunación contra hepatitis B están protegidos durante por lo menos 20 años (tal vez de por vida), aún si los vacunados no tienen anti-HBs detectable en el momento de una exposición reciente. La infección aguda asintomática de hepatitis B puede ocurrir en los respondedores a la vacuna al bajar los niveles anti-HBs, pero habitualmente es autolimitada. Se ha constatado infección oculta por hepatitis B en algunos pacientes vacunados, pero su importancia clínica todavía no queda clara [54].
Por ende, las personas inmunocompetentes que se sabe que han respondido a la vacunación contra hepatitis B con concentraciones anti-HBs de ≥ 10 mUI/ml no necesitan inmunización activa o pasiva adicional después de una exposición a VHB. Además, no necesitan más pruebas periódicas para valorar las concentraciones anti- HBs. Sin embargo, si no se conoce la concentración anti-HBs previa (no se la estudia de rutina) o si es < 10 mUI/ml, entonces se debe administrar IgHB y vacuna contra hepatitis B. Si el individuo expuesto es un no respondedor conocido, entonces se pueden administrar dos dosis de IgHB con 1 mes de intervalo entre las dosis.
Las dosis de refuerzo no están recomendadas de rutina para los individuos inmunocompetentes, ya sea que hayan recibido la vacunación como lactantes, adolescentes o adultos. Del mismo modo, tampoco está recomendado realizar pruebas serológicas para valorar las concentraciones de anticuerpos en cualquier grupo etario, excepto tal vez para los individuos con alto riesgo de infección, como los contactos domésticos de personas infectadas o trabajadores de la salud — por ejemplo se debe administrar una dosis de refuerzo cuando el nivel de anti-HBs es < 10 mUI/ml. Es prudente recomendar dosis de refuerzo a individuos con un riesgo claro actual de infección por VHB (por ejemplo, cuando la pareja sexual sea HBsAg positiva, o al personal de la salud).
5.6 Embarazo y vacunación contra hepatitis B
La administración de la vacuna contra hepatitis B a mujeres embarazadas no entraña riesgos teratogénicos o de otro tipo al feto. No existen contraindicaciones para la vacunación de hepatitis B o la administración de IgHB a mujeres embarazadas o que estén amamantando.
6. Apéndice
6.1 Abreviaturas
| AASLD |
Asociación Americana para el Estudio de Enfermedades Hepáticas |
| AFP |
Alfa fetoproteína |
| ALT |
Alanino aminotransferasa |
| APASL |
Asociación Asia–Pacífico para el Estudio del Hígado |
| AST |
Aspartato aminotransferasa |
| BCP |
Promotor core basal |
| CBC |
Hemograma completo |
| CHC |
Carcinoma hepatocelular |
| CI |
Intervalo(s) de confianza |
| CS |
Corticoides sistémicos |
| EASL |
Asociación Europea para el Estudio del Hígado |
| ECA |
Ensayo controlado aleatorizado |
| FDA |
Administración de Alimentos y Medicamentos (Estados Unidos) |
| HBC |
Hepatitis B crónica |
| HBc |
Hepatitis B core (antígeno) |
| HBeAg |
Antígeno extracelular contra hepatitis B |
| HBsAg |
Antígeno de superficie de hepatitis B |
| IFN |
Interferón |
| IgG |
Inmunoglobulina G |
| IgHB |
Inmunoglobulina contra hepatitis B |
| IgM |
Inmunoglobulina M |
| INR |
Razón normalizada internacional |
| LID |
Límite inferior de detección |
| LSN |
Límite superior de lo normal |
| NA |
Análogo de nucleósido |
| NAFLD |
Enfermedad hepática grasa no alcohólica |
| NASH |
Esteatohepatitis no alcohólica |
| NICE |
Instituto Nacional para la Atención y Excelencia en la Salud |
| NSAID |
Agentes antiinflamatorios no esteroideos |
| OMS |
Organización Mundial de la Salud |
| PCR |
Reacción en cadena de la polimerasa |
| PEG-IFN |
Peginterferón |
| RR |
Riesgo relativo |
| TMH |
Trasmisión de madre a hijo |
| UI/ml |
Unidades internacionales por mililitro (el estándar de la OMS para las concentraciones del ADN del VHB) |
| VHB |
Virus de hepatitis B |
| VHC |
Virus de hepatitis C |
| VHD |
Virus de hepatitis D |
| VIH |
Virus de inmunodeficiencia humana |
| WGO |
Organización Mundial de Gastroenterología |
Para consultar alguna definición de los términos utilizados frecuentemente, referirse a la página 533 de la guía APASL de 2012 [4].
6.2 Referencias
- Lok ASF, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology 2009;50:661–2.
- European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection. J Hepatol 2012;57:167–85.
- National Institute for Health and Care Excellence (NICE). Hepatitis B (chronic): diagnosis and management of chronic hepatitis B in children, young people and adults [Internet]. London: NICE; 2013. Available from: http://www.nice.org.uk/guidance/cg165/resources/guidance-hepatitis-b-chronic-pdf
- Liaw YF, Kao JH, Piratvisuth T, Chan HLY, Chien RN, Liu CJ, et al. Asian–Pacific consensus statement on the management of chronic hepatitis B: a 2012 update. Hepatol Int 2012;6:531–61.
- World Health Organization. Global Alert and Response (GAR): Hepatitis [Internet]. Geneva: World Health Organization [cited 2015 Mar 31]. Available from: http://www.who.int/csr/disease/hepatitis/en/.
- Ott JJ, Stevens GA, Groeger J, Wiersma ST. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity. Vaccine 2012;30:2212–9.
- Hepatitis B Foundation. Hepatitis B Foundation [Internet]. Doylestown, PA. Available from: http://www.hepb.org/.
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;380:2095–128.
- Hollinger F, Liang T. Hepatitis B virus. In: Knipe DM, Howley PM, editors. Fields’ virology. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2001. p. 2971–3036.
- Sunbul M. Hepatitis B virus genotypes: global distribution and clinical importance. World J Gastroenterol 2014;20:5427.
- Shi W, Zhang Z, Ling C, Zheng W, Zhu C, Carr MJ, et al. Hepatitis B virus subgenotyping: history, effects of recombination, misclassifications, and corrections. Infect Genet Evol 2013;16:355–61.
- Chulanov V, Neverov A, Karandashova I, Dolgin V, Mikhailovskaya G, Lebedeva E, et al. Molecular epidemiology of HBV in Russia [abstract C.222]. Abstracts of the 14th International Symposium on Viral Hepatitis and Liver Disease. China, Shanghai, 2012.
- Deterding K, Constantinescu I, Nedelcu FD, Gervain J, Nemecek V, Srtunecky O, et al. Prevalence of HBV genotypes in Central and Eastern Europe. J Med Virol 2008;80:1707–11.
- Devesa M, Loureiro CL, Rivas Y, Monsalve F, Cardona N, Duarte MC, et al. Subgenotype diversity of hepatitis B virus American genotype F in Amerindians from Venezuela and the general population of Colombia. J Med Virol 2008;80:20–6.
- Blitz L, Pujol FH, Swenson PD, Porto L, Atencio R, Araujo M, et al. Antigenic diversity of hepatitis B virus strains of genotype F in Amerindians and other population groups from Venezuela. J Clin Microbiol 1998;36:648–51.
- Cardona NE, Loureiro CL, Garzaro DJ, Duarte MC, García DM, Pacheco MC, et al. Unusual presentation of hepatitis B serological markers in an Amerindian community of Venezuela with a majority of occult cases. Virol J 2011;8:527.
- Pujol FH, Navas MC, Hainaut P, Chemin I. Worldwide genetic diversity of HBV genotypes and risk of hepatocellular carcinoma. Cancer Lett 2009;286:80–8.
- Kramvis A, Kew M, François G. Hepatitis B virus genotypes. Vaccine 2005;23:2409–23.
- Kimbi GC, Kramvis A, Kew MC. Distinctive sequence characteristics of subgenotype A1 isolates of hepatitis B virus from South Africa. J Gen Virol 2004;85:1211–20.
- Kramvis A, Kew MC. Epidemiology of hepatitis B virus in Africa, its genotypes and clinical associations of genotypes. Hepatol Res 2007;37(s1):S9–S19.
- Yousif M, Mudawi H, Bakhiet S, Glebe D, Kramvis A. Molecular characterization of hepatitis B virus in liver disease patients and asymptomatic carriers of the virus in Sudan. BMC Infect Dis 2013;13:328.
- Devesa M, Pujol FH. Hepatitis B virus genetic diversity in Latin America. Virus Res 2007;127:177–84.
- Ahmed CS, Wang Z, Bin Z, Chen J, Kamal M, Hou J. Hepatitis B virus genotypes, subgenotypes, precore, and basal core promoter mutations in the two largest provinces of Pakistan. J Gastroenterol Hepatol 2009;24:569–73.
- De Franchis R, Hadengue A, Lau G, Lavanchy D, Lok A, McIntyre N, et al. EASL International Consensus Conference on Hepatitis B. 13–14 September, 2002 Geneva, Switzerland. Consensus statement (long version). J Hepatol 2003;39 Suppl 1:S3–25.
- 2McMahon BJ. Epidemiology and natural history of hepatitis B. Semin Liver Dis 2005;25 Suppl 1:3–8.
- World Health Organization. Hepatitis B. WHO fact sheet no. 204 [Internet]. Geneva: World Health Organization; 2015. Available from: http://www.who.int/mediacentre/factsheets/fs204/en/.
- Santantonio T, Fasano M. Current concepts on management of chronic hepatitis B. In: Serviddio G, editor. Practical management of chronic viral hepatitis [Internet]. InTech; 2013 [cited 2015 Mar 31]. Available from: http://www.intechopen.com/books/practical-management-of-chronic-viral-hepatitis/current-concepts-on-management-of-chronic-hepatitis-b.
- Hui CK, Leung N, Yuen ST, Zhang HY, Leung KW, Lu L, et al. Natural history and disease progression in Chinese chronic hepatitis B patients in immune-tolerant phase. Hepatology 2007;46:395–401.
- Brunetto MR, Oliveri F, Colombatto P, Moriconi F, Ciccorossi P, Coco B, et al. Hepatitis B surface antigen serum levels help to distinguish active from inactive hepatitis B virus genotype D carriers. Gastroenterology 2010;139:483–90.
- Raimondo G, Allain JP, Brunetto MR, Buendia MA, Chen DS, Colombo M, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol 2008;49:652–7.
- Zerbini A, Pilli M, Boni C, Fisicaro P, Penna A, Di Vincenzo P, et al. The characteristics of the cell-mediated immune response identify different profiles of occult hepatitis B virus infection. Gastroenterology 2008;134:1470–81.
- Peng CY, Chien RN, Liaw YF. Hepatitis B virus-related decompensated liver cirrhosis: benefits of antiviral therapy. J Hepatol 2012;57:442–50.
- Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors. J Hepatol 2008;48:335–52.
- Lee IC, Lin CH, Huang YH, Huo TI, Su CW, Hou MC, et al. IL28B polymorphism correlates with active hepatitis in patients with HBeAg-negative chronic hepatitis B. PloS One 2013;8:e58071.
- Kim TW, Kim MN, Kwon JW, Kim KM, Kim SH, Kim W, et al. Risk of hepatitis B virus reactivation in patients with asthma or chronic obstructive pulmonary disease treated with corticosteroids. Respirology 2010;15:1092–7.
- Huang YH, Hsiao LT, Hong YC, Chiou TJ, Yu YB, Gau JP, et al. Randomized controlled trial of entecavir prophylaxis for rituximab-associated hepatitis B virus reactivation in patients with lymphoma and resolved hepatitis B. J Clin Oncol 2013;31:2765–72.
- Singal AG, Conjeevaram HS, Volk ML, Fu S, Fontana RJ, Askari F, et al. Effectiveness of hepatocellular carcinoma surveillance in patients with cirrhosis. Cancer Epidemiol Biomark Prev 2012;21:793–9.
- Liaw YF, Leung N, Kao JH, Piratvisuth T, Gane E, Han KH, et al. Asian–Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int 2008;2:263–83.
- Lok ASF, McMahon BJ. Chronic hepatitis B. Hepatology 2007;45:507–39.
- Hepatitis B Foundation. HBF drug watch: compounds in development for chronic hepatitis B. Updated December 15, 2014 [Internet]. Available from: http://www.hepb.org/professionals/hbf_drug_watch.htm
- World Health Organization. Global policy report on the prevention and control of viral hepatitis in WHO member states [Internet]. Geneva: World Health Organization; 2013. Available from: http://www.who.int/hiv/pub/hepatitis/global_report/en/
- Sonneveld MJ, Hansen BE, Piratvisuth T, Jia JD, Zeuzem S, Gane E, et al. Response-guided peginterferon therapy in hepatitis B e antigen-positive chronic hepatitis B using serum hepatitis B surface antigen levels. Hepatology 2013;58:872–80.
- Lo AOS, Wong VWS, Wong GLH, Chan HLY, Dan YY. Cost effectiveness of response-guided therapy with peginterferon in the treatment of chronic hepatitis B. Clin Gastroenterol Hepatol 2015;13:377–85.
- Sonneveld MJ, Rijckborst V, Boucher CAB, Hansen BE, Janssen HLA. Prediction of sustained response to peginterferon alfa-2b for hepatitis B e antigen-positive chronic hepatitis B using on-treatment hepatitis B surface antigen decline. Hepatology 2010;52:1251–7.
- Spradling PR, Richardson JT, Buchacz K, Moorman AC, Brooks JT, HIV Outpatient Study (HOPS) Investigators. Prevalence of chronic hepatitis B virus infection among patients in the HIV Outpatient Study, 1996–2007. J Viral Hepat 2010;17:879–86.
- Thio CL, Seaberg EC, Skolasky R, Phair J, Visscher B, Muñoz A, et al. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet 2002;360:1921–6.
- Borgia G, Carleo MA, Gaeta GB, Gentile I. Hepatitis B in pregnancy. World J Gastroenterol 2012;18:4677–83.
- Terrault NA, Jacobson IM. Treating chronic hepatitis B infection in patients who are pregnant or are undergoing immunosuppressive chemotherapy. Semin Liver Dis 2007;27 Suppl 1:18–24.
- Chotiyaputta W, Lok AS. Role of antiviral therapy in the prevention of perinatal transmission of hepatitis B virus infection. J Viral Hepat 2009;16:91–3.
- Lee C, Gong Y, Brok J, Boxall EH, Gluud C. Effect of hepatitis B immunisation in newborn infants of mothers positive for hepatitis B surface antigen: systematic review and meta-analysis. BMJ 2006;332:328–36.
- Han L, Zhang HW, Xie JX, Zhang Q, Wang HY, Cao GW. A meta-analysis of lamivudine for interruption of mother-to-child transmission of hepatitis B virus. World J Gastroenterol 2011;17:4321–33.
- Deng M, Zhou X, Gao S, Yang SG, Wang B, Chen HZ, et al. The effects of telbivudine in late pregnancy to prevent intrauterine transmission of the hepatitis B virus: a systematic review and meta-analysis. Virol J 2012;9:185.
- Ter Borg MJ, Leemans WF, de Man RA, Janssen HLA. Exacerbation of chronic hepatitis B infection after delivery. J Viral Hepat 2008;15:37–41.
- Lai MW, Lin TY, Tsao KC, Huang CG, Hsiao MJ, Liang KH, et al. Increased seroprevalence of HBV DNA with mutations in the s gene among individuals greater than 18 years old after complete vaccination. Gastroenterology 2012;143:400–7.


























