类圆线虫病是由广泛生长在çƒå¸¦å’Œäºšçƒå¸¦åœ°åŒºï¼ŒåŒæ—¶å˜åœ¨äºŽæ°”候温和国家(表3)的一ç§çº¿è™«-粪类圆线虫 (图 1)感染引起。
- 人类圆线虫病是由两类圆线虫引起。其ä¸ï¼Œç²ªç±»åœ†çº¿è™«æ˜¯äººç±»æœ€å¸¸è§çš„病原体,ç¦æ°ç±»åœ†çº¿è™«åœ¨éžæ´²å’Œå·´å¸ƒäºšæ–°å‡ 内零星分布。
- 感染性粪类圆线虫å¯ç›´æŽ¥åœ¨è‚ é“内ç¹æ®–并感染自身-自身感染是区分类圆线虫病和其他ç»åœŸå£¤ä¼ æ’çš„è •è™«ç—…çš„å…³é”®ç‚¹ã€‚æ„ŸæŸ“äººä½“å¯„ç”Ÿè™«ä¸»è¦åŒ…括蛔虫(人蛔虫)ã€éžè™«ï¼ˆæ¯›é¦–éžå½¢çº¿è™«ï¼‰å’Œé’©è™«ï¼ˆç¾Žæ´²é’©è™«å’ŒåäºŒæŒ‡è‚ é’©è™«ï¼‰[1]。
- 雄性æˆè™«åªå˜åœ¨äºŽåœŸå£¤ä¸ã€‚它ä¸æ˜¯ç»„ç»‡å¯„ç”Ÿè™«ï¼Œå› æ¤ï¼Œæ— 法在宿主体内找到。
- 雌性æˆè™«éžå¸¸å¾®å°ï¼Œå‡ 乎为é€æ˜Žã€‚长约2.2-2.5mm,直径约50µm, 寄生在人体å°è‚ 上皮细胞间的管é“内。
- 感染性幼虫å¯åœ¨æ±¡æŸ“的土壤ä¸ç¹æ®–并感染暴露的个体。
ç±»åœ†çº¿è™«ç—…æœ‰åˆ«äºŽå…¶ä»–åœŸå£¤ä¼ æ’çš„è •è™«æ„ŸæŸ“ï¼Œå…¶é›Œè™«å¯åœ¨äººç±»å®¿ä¸»ä½“内以å•æ€§ç”Ÿæ®–æ–¹å¼ç¹æ®–ï¼Œåœ¨è‚ é“内åµåŒ–并å‘育æˆæ†çŠ¶å¹¼è™«ã€‚
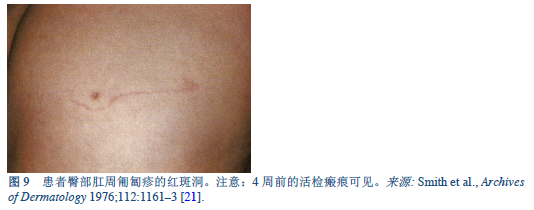
- 幼虫通常éšç²ªä¾¿æŽ’出体外,但有幼虫在体内å‘育æˆæ„ŸæŸ“性ä¸çŠ¶èš´ï¼Œé€šè¿‡ç©¿é€æœ«ç«¯è‚ é“或者肛周皮肤å†æ¬¡æ„ŸæŸ“宿主(自身感染周期)。
- ä¾æ®å®¿ä¸»çš„å…ç–«å应,å¯ä»¥é€ æˆæ’散性或者é‡åº¦æ„ŸæŸ“(表4)。


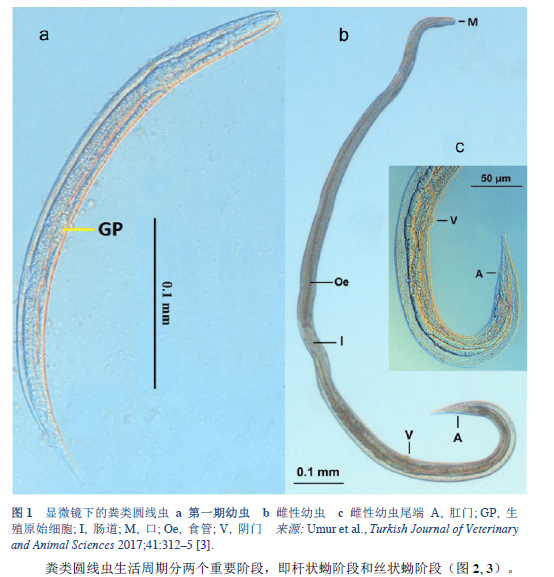
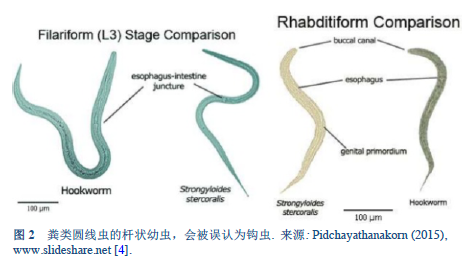
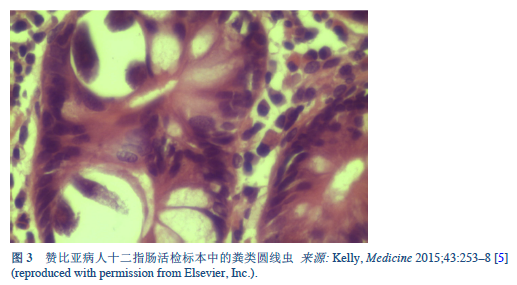
2.1 åœŸå£¤ä¼ æ’çš„è •è™«ç—…å’Œç±»åœ†çº¿è™«ç—…
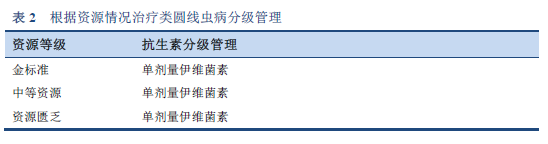
å°½ç®¡ç±»åœ†çº¿è™«ç—…å’Œå…¶å®ƒåœŸå£¤ä¼ æ’çš„è •è™«ç—…æ„ŸæŸ“é€”å¾„ç±»ä¼¼ï¼Œå®ƒéœ€è¦é™¤æ˜¾å¾®é•œå¤–其它诊æ–工具和ä¸åŒçš„治疗方法。在预防性应用伊维èŒç´ 控制盘尾ä¸è™«ç—…或淋巴ä¸è™«ç—…的地区,类圆线虫病的æµè¡ŒçŽ‡æ˜¾è‘—下é™[6–10]。世界å«ç”Ÿç»„织基本è¯ç‰©å§”员会已将伊维èŒç´ 列入其ä¸ï¼Œå’Œé˜¿è‹¯è¾¾å”‘å…±åŒç”¨äºŽæ²»ç–—类圆线虫病。大约有9亿人æ£æŽ¥å—è¿™ç§è”åˆæ²»ç–—对抗被忽视的çƒå¸¦ç—…[11]。
2.2 ç—…ç†ç”Ÿç†å¦
粪类圆线虫有其独特而å¤æ‚的生活å²ã€‚图4æ述了粪类圆线虫独特的ç¹æ®–æ–¹å¼ã€‚
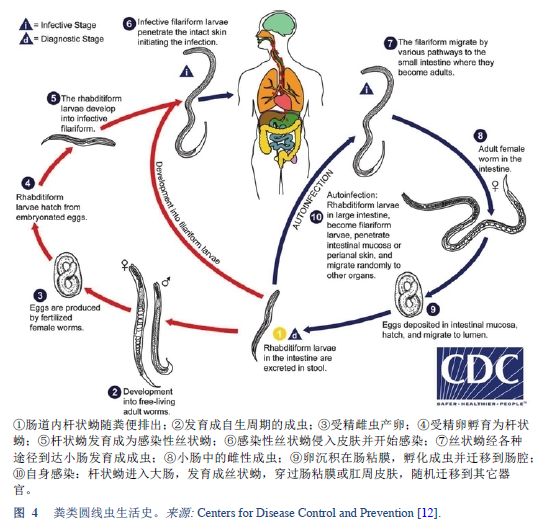
类圆线虫的生活å²è¾ƒå…¶ä»–线虫更为å¤æ‚,它å¯åœ¨è‡ªç”Ÿå‘¨æœŸä¸Žå¯„生周期之间进行转å˜ï¼Œå¹¶å…·æœ‰è‡ªèº«æ„ŸæŸ“和宿主体内自主ç¹æ®–的能力。该线虫的两ç§ç”Ÿæ´»å‘¨æœŸå¦‚下:
- 自生周期:éšç²ªä¾¿æŽ’出的æ†çŠ¶èš´å¯ç»è¿‡ä¸¤æ¬¡èœ•çš®å‘育æˆå…·æœ‰æ„ŸæŸ“性的ä¸çŠ¶èš´ (直接å‘育),或者ç»è¿‡4次蜕皮å‘育为自生周期的雌雄æˆè™«ï¼Œå¹¶äº¤é…排åµåµè‚²ä¸ºæ†çŠ¶èš´ã€‚åŽè€…å¯è¿›å…¥æ–°çš„自生周期或者å‘育æˆæ„ŸæŸ“性ä¸çŠ¶èš´ã€‚ä¸çŠ¶èš´ç»çš®è‚¤ä¾µå…¥äººä½“,并开始寄生周期。
线虫的生命周期ä¸è‡ªç”Ÿé˜¶æ®µæœ€å¤š1代[13]。这个类圆线虫病独特的特å¾å¯¹äºŽæ²»ç–—æ„ŸæŸ“è€…å’Œé¢„é˜²ä¼ æ’的环境控制具有é‡è¦çš„指示æ„义。这æ„味ç€é«˜æ•ˆçš„æ ¹é™¤æ²»ç–—æ˜¯éžå¸¸é‡è¦çš„,以清除感染者体内所有活的虫体。。
- 寄生周期:由污染土壤ç»çš®è‚¤ä¾µå…¥äººä½“çš„ä¸çŠ¶èš´ï¼Œç»é™è„‰ç³»ç»Ÿè½¬ç§»è‡³è‚ºï¼Œç©¿è¿‡è‚ºæ³¡è…”,沿支气管è¿é€è‡³å’½éƒ¨ï¼Œè¢«å’½ä¸‹å¹¶åˆ°è¾¾å°è‚ 。在å°è‚ ä¸èœ•çš®ä¸¤æ¬¡ï¼Œå‘育æˆé›Œæ€§æˆè™«ã€‚寄生在å°è‚ 上皮的雌性æˆè™«å•æ€§ç”Ÿæ®–并产åµï¼ŒåµåŒ–为æ†çŠ¶èš´ã€‚æ†çŠ¶èš´å¯éšç²ªä¾¿æŽ’出(è§ä¸Šè¿°çš„自生周期),或导致自身感染。æ†çŠ¶èš´å‘育æˆæ„ŸæŸ“性ä¸çŠ¶èš´ï¼Œå¯ç©¿è¿‡è‚ é“粘膜(体内自身感染)或者肛周皮肤(体外自身感染)引起自身感染。两ç§æ–¹å¼å‡å¯é€šè¿‡ä»¥ä¸Šæ述的途径,转è¿è‡³è‚ºã€æ”¯æ°”ç®¡æ ‘ã€å’½éƒ¨ã€å°è‚ ,å‘育为æˆè™«ï¼›ä¹Ÿå¯èƒ½æ•£æ’äºŽå…¨èº«ã€‚è¿„ä»Šå¼•èµ·äººä½“è‡ªèº«æ„ŸæŸ“çš„è •è™«ä»…è§äºŽç²ªç±»åœ†çº¿è™«ä¸Žè²å¾‹å®¾æ¯›ç»†çº¿è™«ã€‚å…¶ä¸ç²ªç±»åœ†çº¿è™«æ›´å¸¸è§å’Œæ™®é。粪类圆线虫自身感染的ç†è®ºè§£é‡Šäº†éžç–«åŒºçš„患者长期æŒç»æ„ŸæŸ“(目å‰è®°å½•ä¸ºæœ€é•¿65年)以åŠå…疫抑制患者å±åŠç”Ÿå‘½çš„é‡åº¦æ„ŸæŸ“现象的机制-åœ¨è •è™«æ„ŸæŸ“ä¸æ˜¯ä¸å¸¸è§çš„。
2.3 疾病负è·å’Œåœ°æ–¹æµè¡Œæ€§
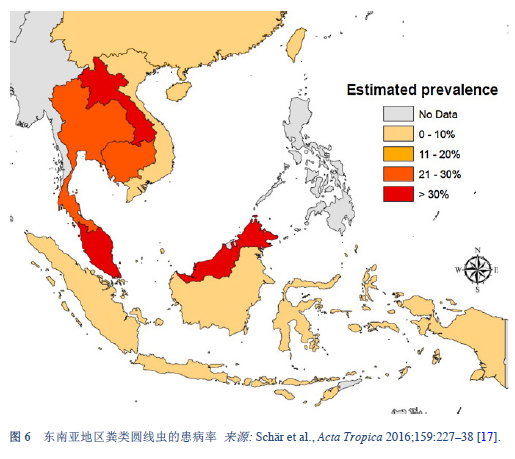
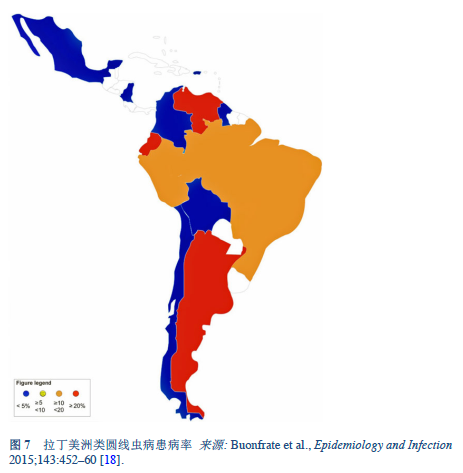
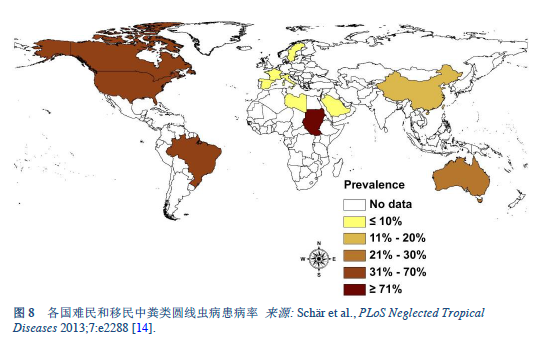
类圆线虫病主è¦æµè¡ŒäºŽçƒå¸¦å’Œäºšçƒå¸¦åœ°åŒºï¼ˆå›¾ 5–8), 它的患病率已ç»è¿œè¿œè¶…过了之å‰é¢„计的1亿人å£ï¼šç”šè‡³ä¼°è®¡å·²ç»é«˜è¾¾3.7亿人å£[2]。在东欧åŠåœ°ä¸æµ·åœ°åŒºå¹´é•¿äººç¾¤ä¸äº¦æœ‰æµè¡Œã€‚
我们对感染的患病率和疾病的临床负担知之甚少。如果它确实广泛æµè¡Œï¼Œé‚£ä¹ˆåŒ»æºæ€§çš„é‡åº¦æ„ŸæŸ“(å…疫抑制治疗)就是一项挑战。类圆线虫病的感染在æŸäº›çƒå¸¦å’Œäºšçƒå¸¦åœ°åŒºå·²è¾¾40% [14]。
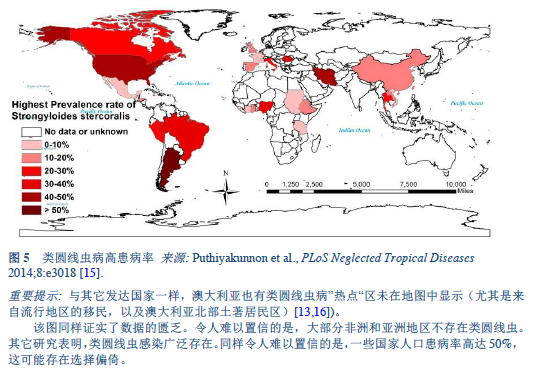
é‡è¦æ示: 与其它å‘è¾¾å›½å®¶ä¸€æ ·ï¼Œæ¾³å¤§åˆ©äºšä¹Ÿæœ‰ç±»åœ†çº¿è™«ç—…”çƒç‚¹“区未在地图ä¸æ˜¾ç¤ºï¼ˆå°¤å…¶æ˜¯æ¥è‡ªæµè¡Œåœ°åŒºçš„移民,以åŠæ¾³å¤§åˆ©äºšåŒ—部土著居民区)[13,16])。
该图åŒæ ·è¯å®žäº†æ•°æ®çš„匮ä¹ã€‚令人难以置信的是,大部分éžæ´²å’Œäºšæ´²åœ°åŒºä¸å˜åœ¨ç±»åœ†çº¿è™«ã€‚å…¶å®ƒç ”ç©¶è¡¨æ˜Žï¼Œç±»åœ†çº¿è™«æ„ŸæŸ“å¹¿æ³›å˜åœ¨ã€‚åŒæ ·ä»¤äººéš¾ä»¥ç½®ä¿¡çš„是,一些国家人å£æ‚£ç—…率高达50%,这å¯èƒ½å˜åœ¨é€‰æ‹©å倚。
移民感染å¯å‘生在任何国家,是潜在的全çƒæ€§å±å®³ã€‚该疾病å¯åœ¨ä»»ä½•è¯Šå®¤å‡ºçŽ°ã€‚
2.4 感染å±é™©å› ç´ å’Œç‰¹æ®Šäººç¾¤
在类圆线虫病æµè¡ŒåŒºï¼Œæœ€å¤§å±é™©å› ç´ æ˜¯ç¤¾ä¼šç»æµŽä¸Šçš„劣势。
- è´«ç©·ã€ä½æˆ¿èµ„æºçŸç¼ºã€å«ç”Ÿæ¡ä»¶å·®ã€å…‰è„šè¡Œèµ°ã€ç”Ÿæ´»åœ¨å¼€æ”¾æŽ’便环境ä¸
- 战俘
- 难民的地佗æ¥è‡ªç±»åœ†çº¿è™«ç—…æµè¡ŒåŒºçš„难民
- 出入疫区的旅游者
- ä¸€äº›ç ”ç©¶è¡¨æ˜Žç”·æ€§ã€é«˜é¾„ã€åŠ¨ç‰©ä¸Žäººä¹‹é—´çš„ä¼ æ’ã€çƒå¸¦å’Œäºšçƒå¸¦åœ°åŒºæ½®æ¹¿æ°”候是å±é™©å› ç´ [17]
2.5 æ’散性感染的å±é™©å› ç´ å’Œç‰¹æ®Šäººç¾¤
- å…疫抑制剂-å°¤å…¶æ˜¯ç³–çš®è´¨æ¿€ç´ ã€ä»–克莫å¸å’ŒåŒ–ç–—è¯ç‰©
- 细胞å…疫异常
- 人嗜T淋巴细胞病毒I型感染
- 肿瘤,特别是血液系统æ¶æ€§è‚¿ç˜¤ï¼ˆæ·‹å·´ç˜¤ã€ç™½è¡€ç—…)
- 器官移æ¤ï¼ˆåŒç§å¼‚体肾移æ¤å—者)
- 次è¦/å¯èƒ½çš„å±é™©å› ç´ ï¼šèƒ¶åŽŸè¡€ç®¡ç–¾ç—…ï¼Œå¸æ”¶ä¸è‰¯å’Œè¥å…»ä¸è‰¯çŠ¶æ€ï¼Œç»ˆæœ«æœŸè‚¾ç—…ï¼Œç³–å°¿ç—…ï¼Œå±€éƒ¨å®¿ä¸»å› ç´ ï¼Œæ†©å®¤å’Œç›²è¢¢ï¼ˆè‚ ç›²è¢¢ä¸æŒç»ç±»åœ†çº¿è™«æ„ŸæŸ“)
2.6 类圆线虫病和å…疫抑制患者
类圆线虫病从完全没有症状到严é‡è¡¨çŽ°ï¼Œå¯å‘展为é‡åº¦æ„ŸæŸ“综åˆå¾å’Œæ’散性疾病,与å…疫缺陷患者的高æ»äº¡çŽ‡ç›¸å…³ã€‚
在çƒå¸¦åœ°åŒºï¼Œæœ‰è®¸å¤šç±»é£Žæ¹¿æ€§å…³èŠ‚ç‚Žã€æ”¯æ°”管哮喘和肾å°çƒè‚¾ç‚Žæ‚£è€…接å—é•¿æœŸç±»å›ºé†‡æ¿€ç´ æ²»ç–—ï¼Œæ‚£è€…å¯ä»¥ç›´æŽ¥ä»Žè¯åº—è´ä¹°ç±»å›ºé†‡æ¿€ç´ 。
类圆线虫病是一ç§ä¸Žäººå—œT淋巴细胞病毒I型相关的机会性感染,而ä¸æ˜¯é‡è¦çš„艾滋病相关机会性感染[19]ã€‚è§‚å¯Ÿæ€§ç ”ç©¶è¡¨æ˜Žï¼Œæ‚£æœ‰äººç±»å…疫缺陷病毒/ 获得性å…疫缺陷综åˆå¾ï¼ˆHIV/AIDS)的患者患æ’散性类圆线虫病或者é‡åº¦æ„ŸæŸ“综åˆå¾çš„风险并ä¸å¢žåŠ [20]。
2.7 致æ»çŽ‡å’Œæ‚£ç—…率
æ€¥æ€§ç±»åœ†çº¿è™«ç—…é€šå¸¸æ— ç—‡çŠ¶å¹¶å¯æ½œä¼æ•°å年。å…疫力æ£å¸¸çš„患者如果ä¸æ²»ç–—é€šå¸¸ä¸ºæ…¢æ€§æ— ç—‡çŠ¶æ€§ç»ˆç”Ÿæ„ŸæŸ“ã€‚
慢性感染是ä¸æ˜Žç–¾ç—…的潜在é‡è¦åŽŸå› 。åŒæ ·ç”±äºŽç¼ºä¹æœ‰æ•ˆçš„诊æ–工具,方法ç¹ç且æ•æ„Ÿæ€§ä½Žï¼Œå› æ¤ï¼Œç¡®åˆ‡çš„感染患病率和å‘病率尚ä¸æ¸…楚。由于类圆线虫病被视为一ç§ç½•è§çš„ç–¾ç—…ï¼Œå› æ¤ï¼Œåœ¨è¯Šæ–或æµè¡Œç—…å¦è°ƒæŸ¥ä¸ï¼Œå°¤å…¶åœ¨å„¿ç«¥ä¸å°‘有投资。
临床上明显的类圆线虫病感染å¯å¯¼è‡´çš®è‚¤ã€èƒƒè‚ é“和肺部症状。
è¯æ®è¡¨æ˜Žï¼Œå³ä½¿æ²¡æœ‰åœ¨æµè¡ŒåŒºå±…ä½æˆ–æ—…è¡Œå²ï¼Œä¹Ÿéœ€è¦å¯¹å—œé…¸æ€§ç²’细胞增多患者进行调查[22].
è¿‘å¹´æ¥ï¼Œå·²ç»å‘展了多ç§è¯Šæ–方法,他们的使用å–决于当地实际情况和相关专业知识:åžçº¿è¯•éªŒã€åäºŒæŒ‡è‚ å¸å¼•ã€åäºŒæŒ‡è‚ æ´»æ£€ã€æ”¯æ°”管肺泡çŒæ´—(BAL)ã€å…疫诊æ–试验,以åŠç”¨ä¸åŒæ–¹æ³•é‡å¤æ£€æµ‹æ–°é²œçš„粪便。
长期以æ¥ï¼Œç²ªç±»åœ†çº¿è™«ç—…在全çƒçš„患病率被低估了。这å¯èƒ½æ˜¯ç”±äºŽä¾èµ–æµè¡Œç—…ç ”ç©¶å¸¸ç”¨å´ä¸èƒ½ç¡®è¯Šç²ªç±»åœ†çº¿è™«ç—…的粪便的直接镜检和Kato-Katz方法[23]。常用的以粪便为基础的方法具有æžä½Žçš„çµæ•åº¦ã€‚显微镜检å¯ä»¥é€šè¿‡æ£€æµ‹å¤šä»½ç²ªä¾¿æ ·æœ¬ï¼Œæ”¹è‰¯æµ“缩技术æ高检出率[24], 但çµæ•åº¦ä»è¾ƒä½Žã€‚
在低/ä¸ç‰æ”¶å…¥åŠå‘达国家,在显微镜鉴定寄生虫方é¢å—到良好è®ç»ƒçš„人员数目似乎在å‡å°‘。
- 尽管è½åŽäºŽç—…毒å¦æˆ–细èŒå¦ï¼Œåˆ†å检测的应用有望在寄生虫å¦æ–¹é¢å¢žåŠ 。
- 粪类圆线虫感染的分å诊æ–尚未显示出最佳的æ•æ„Ÿæ€§ã€‚
- 分å诊æ–ä¸å¯èƒ½å®Œå…¨å–代其他诊æ–技术。
- 血清å¦æ£€æµ‹æ˜¾ç¤ºå‡ºæœ€é«˜çš„æ•æ„Ÿæ€§ï¼Œå¯¹ç²ªç±»åœ†çº¿è™«çš„ç›æŸ¥å’Œæ²»ç–—评估具有é‡è¦æ„义[23]。
Lodhç‰[25]ç ”ç©¶è¡¨æ˜Žï¼Œç²ªç±»åœ†çº¿è™«çš„DNAå¯åœ¨å°¿é‡Œæ£€æµ‹åˆ°ã€‚一旦å¯ç”¨ä¸”如果足够æ•æ„Ÿï¼Œå°¿æ¶²æ ·æœ¬çš„检测å¯èƒ½å…·æœ‰å¸å¼•åŠ›ï¼Œå› 为它们ä¸éœ€è¦å¯†é›†çš„劳力和资æºï¼Œå¹¶ä¸”没有检测新鲜粪便的å¥åº·é£Žé™©[25]。
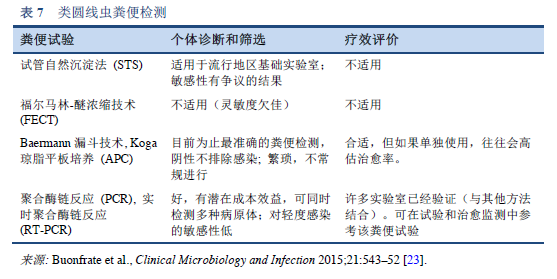
4.1 粪便检测
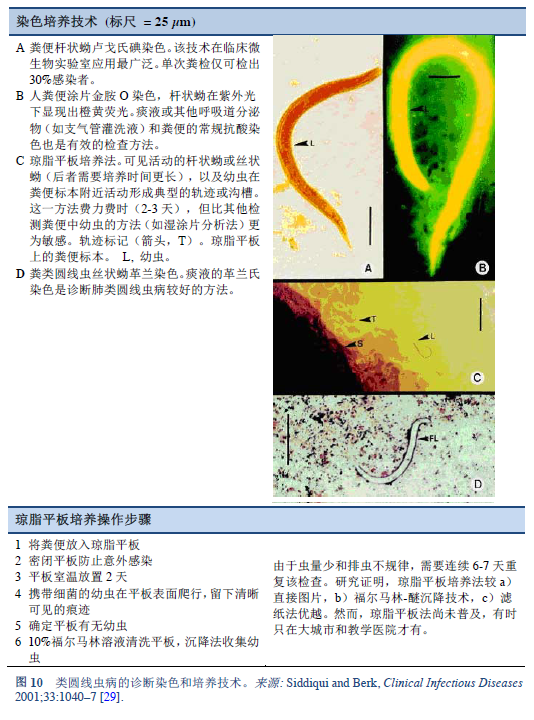
通过显微镜在粪便ã€åäºŒæŒ‡è‚ æ¶²æˆ–å¶å°”在其它组织或液体ä¸æ‰¾åˆ°å¹¼è™«å¯æ˜Žç¡®ç²ªç±»åœ†çº¿è™«çš„诊æ–(表7, 8; 图 10, 11)。然而,由于幼虫密度较低,å•æ¬¡æ£€æµ‹å¾€å¾€æ˜¯ä¸æ•æ„Ÿçš„ [26]。
用显微镜观察粪便ä¸å¹¼è™«çš„å‡ ç§æ–¹æ³•ã€‚
- 浓缩åŽè¿›è¡Œé•œæ£€
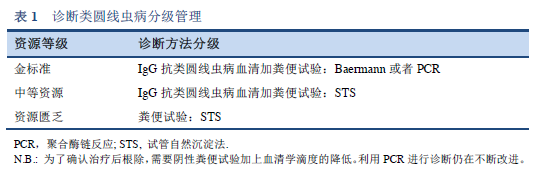
-- Baermann æ¼æ–—技术(ä»è¢«è®¤ä¸ºæ˜¯é‡‘æ ‡å‡†ï¼‰
-- ç¦å°”马林-醚浓缩技术 (FECT)
- 培养åŽé•œæ£€
-- Harada–Mori滤纸技术培养
-- Kogaç¼è„‚å¹³æ¿åŸ¹å…»
- 直接镜检
-- 利用解剖显微镜观察ç¼è„‚å¹³æ¿ä¸Šçš„幼虫
-- 粪便涂片生ç†ç›æ°´-å¢æˆˆæ°ç¢˜æŸ“色
以上方法的使用å–决于当地的实际情况和显微镜技术人员的专业水平。
Baermannæ¼æ–—技术和Kogaç¼è„‚å¹³æ¿åŸ¹å…»æ–¹æ³•æ£€æµ‹ç±»åœ†çº¿è™«æ˜¯è¯¥é¢†åŸŸæœ€å¥½çš„诊æ–方法。这些方法检测寄生虫比其它粪便检测方法具有更高的çµæ•åº¦ã€‚
- PCRæ˜¯æœ‰æ½œåŠ›çš„ï¼Œä½†æ˜¯è¿˜æ²¡æœ‰æ ‡å‡†åŒ–ï¼›äººä»¬å¯¹äºŽPCRçš„æ•æ„Ÿæ€§æœ‰æ‰€é¡¾è™‘ï¼Œå› ä¸ºå®ƒåœ¨ä¸åŒçš„ç ”ç©¶ä¸æœ‰æ‰€å·®å¼‚。
- Anamnartç‰ [27]è¿ç”¨å£æœå•å‰‚é‡400mg阿苯达唑刺激类圆线虫分泌到大便ä¸è¿›è¡Œæ£€æµ‹å¹¶å»ºè®®åº”用阿苯达唑和改良的ç¦å°”马林-é†šæµ“ç¼©æŠ€æœ¯åº”ç”¨äºŽç–‘ä¼¼æ— ç—‡çŠ¶çš„ç±»åœ†çº¿è™«ç—…æ‚£è€…ï¼ŒåŒ…æ‹¬ä¸æ˜ŽåŽŸå› 的慢性腹泻,从疫区回æ¥çš„患者和其他寄生虫检测结果阴性的患者[27]。


4.2 类圆线虫病的血清å¦è¯Šæ–
与Baermann技术和ç¼è„‚å¹³æ¿åŸ¹å…»ç›¸æ¯”,血清å¦è¯•éªŒå…·æœ‰æ›´é«˜çš„æ•æ„Ÿæ€§ï¼Œå°½ç®¡æœ‰äº›ä½œè€…担心它的特异性[20].
- 许多血清å¦è¯•éªŒä¸Žä¸è™«å¯„生虫ã€è¡€å¸è™«å’Œè›”虫交å‰å应,é™ä½Žäº†è¯•éªŒçš„特异性。
- 由于抗体å¯æŒç»ä¸€æ®µæ—¶é—´ï¼Œæ¯”较难区分活动病例和历å²ç—…例。
- 利用é‡ç»„抗原的更特异的血清å¦è¯•éªŒå·²ç»åœ¨å‘展且在特殊实验室开展。
- 血清å¦è¯•éªŒé€šå¸¸æ˜¾ç¤ºæ ¹é™¤å¯„生虫åŽ6-12月滴度明显下é™ï¼Œå› æ¤ï¼Œå¯ç”¨æ¥è¯„估治愈情况[20]。
最方便和广泛使用的血清å¦æ–¹æ³•æ˜¯é…¶è”å…ç–«å¸é™„试验(ELISA)检测针对ä¸çŠ¶å¹¼è™«ç²—æ物的å…ç–«çƒè›‹ç™½G(IgG)。ELISA比较费力,且需è¦ä¸€å®šæ°´å¹³çš„实验室基础设施实施和解读结果,这阻ç¢äº†å®ƒçš„适用性,尤其是在类圆线虫病æµè¡ŒåŒº[26]。æ¤å¤–,血清å¦åœ¨ç–«åŒºæ²»æ„ˆåŽéšè®¿ä»·å€¼æœ‰é™ï¼Œå› 为å¯èƒ½å†æ¬¡æ„ŸæŸ“。
4.3 鉴别诊æ–
类似的症状也å¯å‘生以下许多情况,包括引起急慢性腹泻和å¸æ”¶ä¸è‰¯çš„åŽŸå› ï¼Œå¼•èµ·å—œé…¸æ€§ç²’ç»†èƒžå¢žå¤šçš„åŽŸå› ï¼Œå’Œå¼•èµ·é©å…°é˜´æ€§è´¥è¡€ç—‡åŽŸå› 。以下鉴别诊æ–需è¦è€ƒè™‘:
- è‚ é“感染—阿米巴,细èŒæ€§ç»“è‚ ç‚Žï¼Œå¿—è´ºèŒï¼Œå¼§å½¢æ†èŒï¼Œè€¶å°”森èŒï¼Œéš¾è¾¨æ¢çŠ¶èŠ½å¢æ†èŒï¼›è§WGOå…¨çƒæŒ‡å—急性腹泻,表 4 [30].
- éžäººé’©è™«æ„ŸæŸ“,产生皮肤幼虫移行症-需è¦ä¸Žç²ªç±»åœ†çº¿è™«çš„肛周åŒåŒç–¹é‰´åˆ«ï¼Œå½“肛周åŒåŒç–¹æ²¡æœ‰ç»“ç—‚ã€å¿«é€Ÿè¿ç§»ã€è‚›å‘¨å—累和è¨éº»ç–¹ã€‚
- ç‚Žç—‡æ€§è‚ ç—…
- è‚ æ˜“æ¿€ç»¼åˆå¾
- 功能性腹部疾病
- è¯ç‰©-éžç”¾ä½“类消炎è¯å’Œå…¶å®ƒèƒ½å¼•èµ·å—œé…¸æ€§ç²’细胞增多的è¯ç‰©
诊æ–的关键在于将类圆线虫病作为一个å¯èƒ½çš„诊æ–并且直接或者通过血清å¦/分å试验明确寄生虫感染。
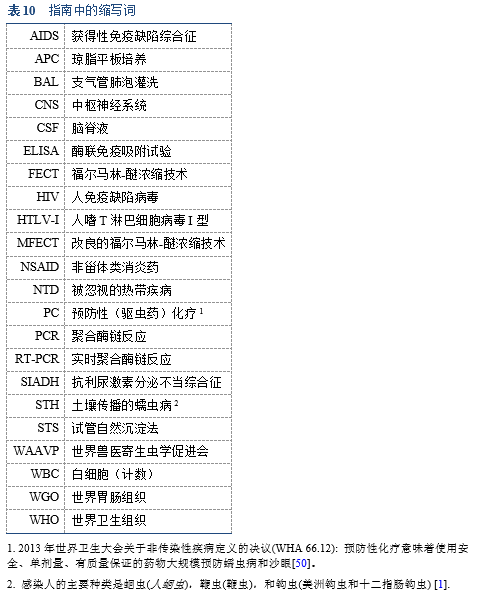
6.1 缩写
6.2 é‡‘æ ‡å‡†æŒ‡å—
6.3 å‚考文献
1. World Health Organization. Soil-transmitted helminth infections [Internet]. Geneva: World Health Organization; 2017 [accessed 2018 Mar 13]. Available from: http://www.who.int/mediacentre/factsheets/fs366/en/.
2. Bisoffi Z, Buonfrate D, Montresor A, Requena-Méndez A, Muñoz J, Krolewiecki AJ, et al. Strongyloides stercoralis: a plea for action. PLoS Negl Trop Dis 2013 May 9;7(5):e2214.
3. Umur Åž, Meral Y, BölükbaÅŸ CS, Gürler AT, Açici M. First clinical Strongyloides stercoralis case in a dog in Turkey. Turk J Vet Anim Sci 2017;41:312–5.
4. Pidchayathanakorn P. Nemathelminthes [46 slides] [Internet] 2015 [accessed 2018 Mar 13]. Available from: https://www.slideshare.net/PaemikaPidchayathana/nemathelminthes-review.
5. Kelly P. Infectious diarrhoea. Med Abingdon 2015 May;43(5):253–8.
6. Knopp S, Mohammed KA, Rollinson D, Stothard JR, Khamis IS, Utzinger J, et al. Changing patterns of soil-transmitted helminthiases in Zanzibar in the context of national helminth control programs. Am J Trop Med Hyg 2009 Dec;81(6):1071–8.
7. Anselmi M, Buonfrate D, Guevara Espinoza A, Prandi R, Marquez M, Gobbo M, et al. Mass administration of ivermectin for the elimination of onchocerciasis significantly reduced and maintained low the prevalence of Strongyloides stercoralis in Esmeraldas, Ecuador. PLoS Negl Trop Dis 2015 Nov;9(11):e0004150.
8. Barda B, Albonico M, Buonfrate D, Ame SM, Ali S, Speich B, et al. Side benefits of mass drug administration for lymphatic filariasis on Strongyloides stercoralis. Prevalence on Pemba Island, Tanzania. Am J Trop Med Hyg 2017 Sep;97(3):681–3.
9. Bisoffi Z. Human strongyloidiasis: time to act? Paper presented at the 27th European Congress of Clinical Microbiology And Infectious Diseases (ECCMID), Vienna, April 2017. Basel, Switzerland: European Society of Clinical Microbiology and Infectious Diseases; 2017. (ESCMID eLibrary). Available from: www.escmid.org/escmid_publications/escmid_elibrary/material/?mid=44339.
10. World Health Organization. What are intestinal worms (soil transmitted helminthiasis)? [Internet]. Geneva: World Health Organization; [accessed 2018 Mar 13]. Available from: http://www.who.int/intestinal_worms/disease/en/.
11. Bundy DAP, Appleby LJ, Bradley M, Croke K, Hollingsworth TD, Pullan R, et al. Mass deworming programs in middle childhood and adolescence. In: Bundy DAP, de Silva N, Horton S, Jamison DT, Patton GC, editors. Child and Adolescent Health and Development [Internet]. 3rd ed. Washington, DC: International Bank for Reconstruction and Development / World Bank Group; 2017. p. 165–82. (Disease Control Priorities; vol. 8). Available from: http://dcp-3.org/chapter/2437/deworming.
12. Centers for Disease Control and Prevention. Parasites — Strongyloides [Internet]. Atlanta, GA: Centers for Disease Control and Prevention; 2015 [accessed 2018 Mar 13]. Available from: https://www.cdc.gov/parasites/strongyloides/biology.html.
13. Ross KE, Bradbury RS, Garrard TA, O’Donahoo FJ, Shield JM, Page W, et al. The National Strongyloides Working Group in Australia 10 workshops on: commendations and recommendations. Aust N Z J Public Health 2017 Jun;41(3):221–3.
14. Schär F, Trostdorf U, Giardina F, Khieu V, Muth S, Marti H, et al. Strongyloides stercoralis: global distribution and risk factors. PLoS Negl Trop Dis 2013;7(7):e2288.
15. Puthiyakunnon S, Boddu S, Li Y, Zhou X, Wang C, Li J, et al. Strongyloidiasis — an insight into its global prevalence and management. PLoS Negl Trop Dis 2014 Aug;8(8):e3018.
16. Kearns TM, Currie BJ, Cheng AC, McCarthy J, Carapetis JR, Holt DC, et al. Strongyloides seroprevalence before and after an ivermectin mass drug administration in a remote Australian Aboriginal community. PLoS Negl Trop Dis 2017 May;11(5):e0005607.
17. Schär F, Giardina F, Khieu V, Muth S, Vounatsou P, Marti H, et al. Occurrence of and risk factors for Strongyloides stercoralis infection in South-East Asia. Acta Trop 2016 Jul;159:227–38.
18. Buonfrate D, Mena MA, Angheben A, Requena-Mendez A, Muñoz J, Gobbi F, et al. Prevalence of strongyloidiasis in Latin America: a systematic review of the literature. Epidemiol Infect 2015 Feb;143(3):452–60.
19. Crompton DWT, Engels D, Savioli L, Montresor A, Neira M, editors. Preparing to control schistosomiasis and soil-transmitted helminthiasis in the twenty-first century [special double issue of journal]. Acta Trop 2003;86(2–3):121–347.
20. Centers for Disease Control and Prevention. Parasites — Strongyloides. Resources for health professionals [Internet]. Atlanta, GA: Centers for Disease Control and Prevention; 2016 [accessed 2018 Mar 13]. Available from: https://www.cdc.gov/parasites/strongyloides/health_professionals/index.html.
21. Smith JD, Goette DK, Odom RB. Larva currens. Cutaneous strongyloidiasis. Arch Dermatol 1976 Aug;112(8):1161–3.
22. Repetto SA, Ruybal P, Solana ME, López C, Berini CA, Alba Soto CD, et al. Comparison between PCR and larvae visualization methods for diagnosis of Strongyloides stercoralis out of endemic area: A proposed algorithm. Acta Trop 2016 May;157:169–77.
23. Buonfrate D, Formenti F, Perandin F, Bisoffi Z. Novel approaches to the diagnosis of Strongyloides stercoralis infection. Clin Microbiol Infect 2015 Jun;21(6):543–52.
24. Knopp S, Mgeni AF, Khamis IS, Steinmann P, Stothard JR, Rollinson D, et al. Diagnosis of soil-transmitted helminths in the era of preventive chemotherapy: effect of multiple stool sampling and use of different diagnostic techniques. PLoS Negl Trop Dis 2008;2(11):e331.
25. Lodh N, Caro R, Sofer S, Scott A, Krolewiecki A, Shiff C. Diagnosis of Strongyloides stercoralis: detection of parasite-derived DNA in urine. Acta Trop 2016 Nov;163:9–13.
26. van Doorn HR, Koelewijn R, Hofwegen H, Gilis H, Wetsteyn JCFM, Wismans PJ, et al. Use of enzyme-linked immunosorbent assay and dipstick assay for detection of Strongyloides stercoralis infection in humans. J Clin Microbiol 2007 Feb;45(2):438–42.
27. Anamnart W, Pattanawongsa A, Intapan PM, Maleewong W. Albendazole stimulates the excretion of Strongyloides stercoralis larvae in stool specimens and enhances sensitivity for diagnosis of strongyloidiasis. J Clin Microbiol 2010 Nov;48(11):4216–20.
28. Tello R, Terashima A, Marcos LA, Machicado J, Canales M, Gotuzzo E. Highly effective and inexpensive parasitological technique for diagnosis of intestinal parasites in developing countries: spontaneous sedimentation technique in tube. Int J Infect Dis 2012 Jun;16(6):e414-416.
29. Siddiqui AA, Berk SL. Diagnosis of Strongyloides stercoralis infection. Clin Infect Dis 2001 Oct 1;33(7):1040–7.
30. World Gastroenterology Organisation. Acute diarrhea in adults and children: a global perspective [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2012 [accessed 2018 Mar 13]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/acute-diarrhea/acute-diarrhea-english.
31. Varatharajalu R, Kakuturu R. Strongyloides stercoralis: current perspectives. Rep Parasitol 2016;(5):23–33.
32. Medscape. Ivermectin (Rx). Brand and other names: Stromectol. Dosage forms & strengths. [Internet]. Medscape; [accessed 2018 Mar 13]. Available from: https://reference.medscape.com/drug/stromectol-ivermectin-342657.
33. Horton J. Albendazole: a review of anthelmintic efficacy and safety in humans. Parasitology 2000;121 Suppl:S113-132.
34. Venkatesan P. Albendazole. J Antimicrob Chemother 1998 Feb;41(2):145–7.
35. Henriquez-Camacho C, Gotuzzo E, Echevarria J, White AC, Terashima A, Samalvides F, et al. Ivermectin versus albendazole or thiabendazole for Strongyloides stercoralis infection. Cochrane Database Syst Rev 2016 Jan 18;(1):CD007745.
36. Chiodini PL, Reid AJ, Wiselka MJ, Firmin R, Foweraker J. Parenteral ivermectin in Strongyloides hyperinfection. Lancet 2000 Jan 1;355(9197):43–4.
37. Boulware DR. Strongyloides infection. BMJ Best Pract [Internet]. Available from: http://bestpractice.bmj.com/best-practice/monograph/907/treatment/step-by-step.html.
38. Albonico M, Becker SL, Odermatt P, Angheben A, Anselmi M, Amor A, et al. StrongNet: An international network to improve diagnostics and access to treatment for strongyloidiasis control. PLoS Negl Trop Dis 2016 Sep;10(9):e0004898.
39. Luvira V, Watthanakulpanich D, Pittisuttithum P. Management of Strongyloides stercoralis: a puzzling parasite. Int Health 2014 Dec;6(4):273–81.
40. Maskery B, Coleman MS, Weinberg M, Zhou W, Rotz L, Klosovsky A, et al. Economic analysis of the impact of overseas and domestic treatment and screening options for intestinal helminth infection among US-bound refugees from Asia. PLoS Negl Trop Dis 2016 Aug;10(8):e0004910.
41. Nelson GS. [Review of D.I. Grove, A history of human helminthology (1990).]. J Helminthol 1991;65(2):120.
42. Ross KE, O’Donahoo FJ, Garrard TA, Taylor MJ. Simple solutions to Strongyloides stercoralis infection. BMJ Clin Res Ed 2013 Oct 22;347:f6294.
43. European Medicines Agency Committee for Medicinal Products for Veterinary Use (CVMP). Reflection paper on anthelmintic resistance [Internet]. London: European Medicines Agency; 2017 [accessed 2018 Mar 13]. Available from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_001563.jsp&mid=WC0b01ac058002ddc2.
44. Wood IB, Amaral NK, Bairden K, Duncan JL, Kassai T, Malone JB, et al. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) second edition of guidelines for evaluating the efficacy of anthelmintics in ruminants (bovine, ovine, caprine). Vet Parasitol 1995 Jun;58(3):181–213.
45. Coles GC, Bauer C, Borgsteede FH, Geerts S, Klei TR, Taylor MA, et al. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet Parasitol 1992 Sep;44(1–2):35–44.
46. Forrer A, Khieu V, Schindler C, Schär F, Marti H, Char MC, et al. Ivermectin treatment and sanitation effectively reduce Strongyloides stercoralis infection risk in rural communities in Cambodia. PLoS Negl Trop Dis 2016 Aug;10(8):e0004909.
47. Khieu V, Schär F, Forrer A, Hattendorf J, Marti H, Duong S, et al. High prevalence and spatial distribution of Strongyloides stercoralis in rural Cambodia. PLoS Negl Trop Dis 2014 Jun;8(6):e2854.
48. Croker C, She R. Increase in reports of Strongyloides infection — Los Angeles County, 2013–2014. MMWR Morb Mortal Wkly Rep 2015 Aug 28;64(33):922–3.
49. Keiser PB, Nutman TB. Strongyloides stercoralis in the immunocompromised population. Clin Microbiol Rev 2004 Jan;17(1):208–17.
50. World Health Organization. World Health Assembly adopts resolution on neglected tropical diseases [Internet]. Geneva: World Health Organization; 2013 [accessed 2018 Mar 13]. Available from: http://www.who.int/neglected_diseases/WHA_66_seventh_day_resolution_adopted/en/.